НАЦІОНАЛЬНА АКАДЕМІЯ НАУК УКРАЇНИ
ІНСТИТУТ ПРОБЛЕМ КРІОБІОЛОГІЇ І КРІОМЕДИЦИНИ
Кондаков Ігор Ігоревич
УДК: 615.361.013.85.014.41: 616.13 – 004.6
АНТИАТЕРОГЕННА ДІЯ КРІОКОНСЕРВОВАНОЇ ПЛАЦЕНТИ ПРИ ЕКСПЕРИМЕНТАЛЬНОМУ АТЕРОСКЛЕРОЗІ
14.01.35 – кріомедицина
АВТОРЕФЕРАТ
дисертації на здобуття наукового ступеня
кандидата медичних наук
Харків – 2008
Дисертацією є рукопис.
Робота виконана в Інституті проблем кріобіології і кріомедицини НАН України
Науковий керівник: доктор медичних наук, професор
Юрченко Тетяна Миколаївна, Інститут проблем кріобіології і кріомедицини НАН України, завідувач відділу кріоморфології
Офіційні опоненти: доктор біологічних наук, професор
Петренко Олександр Юрійович, Інститут проблем кріобіології і кріомедицини НАН України, завідувач відділу кріобіохімії, м. Харків
доктор медичних наук, професор
Шепітько Володимир Іванович, Вищій державний навчальний заклад України «Українська медична стоматологічна академія», завідувач кафедри гістології, цитології та ембріології, м. Полтава
Захист відбудеться 22.04. 2008 р. о 13-30 годині на засіданні спеціалізованої вченої ради Д 64.242.01 при Інституті проблем кріобіології і кріомедицини НАН України, 61015, м. Харків 15, вул. Переяславська, 23.
З дисертацією можна ознайомитися у бібліотеці ІПКіК НАН України за адресою: 61015, м. Харків 15, вул. Переяславська, 23.
Автореферат розісланий 21.03. 2008 р.
Вчений секретар спеціалізованої вченої ради,
член-кореспондент НАН України
доктор медичних наук, професор Гольцев А.М.
ЗАГАЛЬНА ХАРАКТЕРИСТИКА РОБОТИ
Актуальність теми. Кріомедицина відноситься до галузей науки, які інтенсивно розвиваються. Це пов'язано з досягненнями кріобіології, які дозволили здійснити оборотну зупинку метаболізму в клітинах і тканинах за рахунок застосування технологічних процесів з використанням низьких температур (Грищенко В.І., 2003, 2004). У світі ведуться активні розробки способів низькотемпературного консервування біологічних об'єктів – (клітин і тканин) для їх практичного застосування, зокрема, в репаративній медицині (Farrant J., Walter C., 1977; Mazur P., 2003; Литовченко В.О., Мірошниченко О.В., 2004)
Плацентарна тканина серед інших кріоконсервованних біооб'єктів займає особливе місце. У теперішній час продовжуються дослідження властивостей кріоконсервованої плаценти, які були розпочаті з застосування її в ліофілізованному виді (Филатов В.П., 1933, Филатов С.В., 1977).
Низькі температури дозволили здійснити тривале зберігання фрагментів плаценти без значної втрати біологічних властивостей, на відміну від стерилізації при високих температурах та забезпечити ретельну перевірку біологічного матеріалу, який був призначений для застосування в клінічній практиці.
Плацента є високоактивною «залозою» внутрішньої секреції з високим вмістом біологічно активних речовин і ростових факторів. Крім того, плацента виконує імунні функції за рахунок репродуктивних імуномодуляторів таких, як хоріонічний гонадотропін, хоріонічний адренокортикотропний гормон, прозапальні та протизапальні цитокіни. Плацента містить також велику кількість статевих гормонів: естрадіол, прогестерон та тестостерон. В тканині плаценти відбуваєтся синтез білків, наприклад, трансформуючий фактор росту, який сприяє процесам репарації та неоваскуляризації.
Тканина плаценти після введення в організм реципієнта здатна якийсь час здійснювати функцію "депо" різних біологічно активних речовин і впливати на патологічні процеси. В ІПКіК НАН України (Грищенко В.І., Прокопюк О.С., 1999) був розроблений метод кріоконсервування фрагментів тканини плаценти та отримані експериментальні й клінічні дані щодо ефективності їх застосування в терапії цукрового діабету, клімактеричного синдрому, генералізованого пародонтиту (Грищенко В.В., 2003, Грищенко В.І., Бобирьова Л. Є., 2003).
Існує думка, що введення кріоконсерввованих фрагментів плаценти може викликати регрес атеросклеротичного процесу (Степанов А. В, Строна В.І., 1997; Курильская Т.Е., 1999, Шепітько К.В., Гаєвський С.О., 2001).
Практика боротьби з атеросклерозом має більш ніж двовікову історію, однак профілактика й лікування цього захворювання залишаються й дотепер малоефективними. В розвинених країнах показники захворюваності, інвалідності і смертності внаслідок атеросклерозу та його ускладнень, незважаючи на бурхливий розвиток медицини, досить високі, а в Україні вони посідають перше місце та в 2-4 рази вищі, ніж у країнах ЄС і світу (більш 68% від показника загальної смертності) (Лутай М.І., Дорогой А.П., 2002). На цей час основним методом боротьби з кардіоваскулярними проявами атеросклерозу є ліпід-корегуюча терапія, вона сприяє нормалізації рівня холестерину та його атерогенних фракцій у крові хворого. Незважаючи на успішні результати терапії коронарного атеросклерозу, клітинні й молекулярні механізми антиатерогенних ефектів уведення фетальних тканин дотепер залишаються актуальними.
Зв’язок роботи з науковими програмами, планами, темами. Робота виконана відповідно до плану НДР ІПКіК НАН України у відділі кріоморфології за темами: «Дослідити структурно-метаболічний і функціональний стан клітин фетоплацентарного комплексу після кріоконсервування і гіпотермічного зберігання» № 2.2.6.02 № ДР 0101U003484 та «Вивчити механізм регенераційних процесів шляхом дослідження структурних і деяких метаболічних показників організму експериментальних тварин після трансплантації плаценти в умовах атеросклерозу» № 2.26.31 № ДР 0106U002170.
Мета і задачі дослідження. Мета даного дослідження – реалізація антиатерогенної дії алогенної кріоконсервованої плаценти на основні ланки атерогенезу в кролів з моделлю експериментальною атеросклерозу.
Відповідно до поставленої мети передбачалося:
Дослідити вплив введення АКП на показники ліпідного обміну у експериментальних тварин з регресом моделі експериментального атеросклерозу.
Визначити зміни рівня естрадіолу у сироватці крові тварин з регресом моделі експериментального атеросклерозу, та визначити взаємозв’язок цих показників з показниками ліпідного обміну.
Провести порівняльне планіметричне дослідження розповсюдженості осередків ліпоїдозу аорти у експериментальних тварин після введення АКП та з регресом експериментального атеросклерозу.
Вивчити вплив введення АКП на структурно - функціональний стан ендотелію аорти у експериментальних тварин з регресом експериментального атеросклерозу.
Дослідити вплив введення АКП на систему мононуклеарних фагоцитів у експериментальних тварин з регресом експериментального атеросклерозу, та визначити взаємозв’язок цих показників з показниками ліпідного обміну.
Оцінити морфологічний стан тканини міокарду після введення АКП на тлі регресу експериментального атеросклерозу.
Об’єкт дослідження: антиатерогенні ефекти дії алогенної кріоконсервованої плаценти при використанні у кролів із спонтанним регресом експериментального атеросклерозу.
Предмет дослідження: кроляча плацента, аорти, фрагменти аорт, шматочки міокарду, сироватка крові та форменні елементи крові експериментальних тварин.
Методи дослідження: Для вирішеня поставлених задач були використані кріобіологічні, біохімічні, планіметричні, гістологічні, цитологічні, гістохімічні, електронно-мікроскопічні, морфометрічні та статистичні методи.
Наукова новизна одержаних результатів. Вперше вивчені й встановлені морфологічні та біохімічні прояви антиатерогенних, вазотрофічних ангіопротекторних ефектів після введення алогенної кріоконсервованої плаценти (АКП) у кролів з експериментальною моделлю атеросклерозу.
Показано, що після введення кріоконсервованої плаценти зменьшується площа атеросклеротичних уражень аорти, це повязано з інтенсивним ростом vasa vasorum та їх прорастанням у внутрішню третину середнього шару стінки аорти.
Встановлено, що використання кріоконсервованої плаценти прискорює нормалізацію ліпідного спектру сироватки крові, активізує виведення лейкоцитами атерогенних фракцій ліпопротеїдів з осередків уражень.
Доведено, що введення кріоконсервованої плаценти призводить до зниження вмісту загального холестерину (ЗХС), ліпопротеїдів низької щільності (ЛПНЩ), що викликає, у свою чергу, зменшення коефіцієнта атерогенності (КА) та сприяє прискоренному регресу експериментального атеросклерозу.
Показано, що при моделюванні атеросклерозу знижується рівень естрадіолу, а використання кріоконсервованої плаценти забезпечує його вірогідне збільшення.
Практичне значення отриманих результатів. Після введення АКП кролям з експериментальною моделлю атеросклерозу отримано дані про антиатерогенні, вазотрофічні та ангіопротекторні ефекти. Це дозволило рекомендувати випробування застосування кріоконсервованої плаценти при лікуванні хворих на атеросклероз для стабілізації й зворотного розвитку первинного й вторинного ліпоїдозу в артеріях на тлі гіполіпідемічної терапії.
Особистий внесок здобувача. Автором дисертації самостійно проведено аналітичний огляд літератури за темою дисертації, отримано результати експериментальних досліджень, проведено їх аналіз та статистичну обробку. Разом з науковим керівником проф. Юрченко Т.М. дисертантом були обговорені та узагальнені результати досліджень, а також сформульовані остаточні висновки. В опублікованих спільно зі співавторами працях особистий внесок здобувача полягає:
- в роботах [3,8] самостійно сформована модель експериментального атеросклерозу, отримана алогенна плацента, проведено її кріоконсервування, та введення експериментальним тваринам, самостійно отримані дані, проведена їх статистична обробка.
Апробація результатів дисертації. Матеріали дисертаційної роботи доповідались та обговорювались на конференції «Нейроендокринні і імунні механізми регуляції гомеостазу в нормі та патології» (м. Запоріжжя, 2005 р), ІІ Міжнародному симпозиумі «Биоэтика - путь к мировым стандартам» (м. Харків, 2005)., ІІІ Всеросійському симпозиумі «Актуальные вопросы тканевой и клеточной трансплантологии» (Москва, 2007).
Публікації. За матеріалами дисертації опубліковано 8 робіт, з яких: 5 наукових статей у спеціалізованих фахових виданнях, 3 тези доповідей на наукових конференціях.
Обсяг і структура дисертації. Дисертаційну роботу викладено на 124 сторінках друкованого тексту, з яких 110 сторінок складає основний зміст.д.исертація складається зі вступу, огляду літератури, опису матеріалів і методів дослідження, результатів власних досліджень, обговорення отриманих результатів, висновків і переліку використаної літератури (148 першоджерел, розміщено на 14 сторінках). Робота ілюстрована 12 таблицями, 42 малюнками, з них 37 - мікрофотографії.
ОСНОВНИЙ ЗМІСТ РОБОТИ
Матеріали й методи дослідження.
Матеріалом дослідження були 28 кролів самців породи "шиншила", вагою 3500 - 4200 г., віком 12 місяців. Тварини перебували на холестериновій дієті (Аничков Н.Н., 1913) протягом 180 діб. Експериментальних тварин розподілили на групи: І – контроль (5 тварин), ІІ - модель атеросклерозу (23 тварини) які утримували в стандартних умовах віварію. Після досягнення піка моделі (6 місяців годування холестерином) 23 тварини ІІ групи були розділені на підгрупи: 1 - спонтанний регрес експериментального атеросклерозу (10 тварин); 2 - введення АКП на тлі регресу спонтанного атеросклерозу (10 тварин); 3 - пік моделі (3 тварини).
В експерименті використовували протягом 6 місяців холестерин виробництва С. – Петербург, Росія, у дозі 200 мг/кг маси тіла per os за схемою: 5 днів - годування холестерином, 2 дні – відпочинок.
Після припинення навантаження холестерином спонтанний регрес, а також ефекти введення АКП на тлі регресу атеросклерозу, досліджували протягом 6 тижнів. На 6-му місяці експерименту тваринам 2-ї підгрупи введено АКП.
Плаценту для подальшого використання одержували у двох безпородних кролиць при доношеній вагітності після 4 тижнів гестації.
Для кріоконсервування із плацентарної тканини вирізали фрагменти розміром 0,8х0,8 см., вагою 550-600 мг. Перед проведенням циклу кріоконсервування фрагменти занурювали в 10% розчин ДМСО на 20 хвилин, далі їх переносили в поліамідний контейнер і заморожували за 2-етапною програмою відповідно до методичних рекомендацій (Грищенко В.І., Прокопюк О.С., 1999). Відігрівання зразків здійснювали на водяній бані при температурі 40°С.
На попередньо обробленій ділянці спини під інфільтраційною анестезією 0,5% розчину новокаїну робили розріз довжиною 3 см. та формували підшкірний карман, в який поміщали фрагменти плаценти. На шкіру накладали 2 шви та обробляли розчином брильянтового зеленого.
Через 6 тижнів після введення АКП, тварин 1-3 підгруп піддавали евтаназії відповідно до документів: Директиви 86/609 ЕЕС і угодою Ради Європи ЕТ 123. Всі експерименти проводили згідно з "Загальними етичними принципами експериментів над тваринами", схваленими Першим національним конгресом з біоетики (20 вересня 2001 р. Київ, Україна) та "Правилами використання лабораторних експериментальних тварин" (1984, додаток 4).
Для проведення планіметричного, гістологічного, гістохімічного та цитологічного досліджень були виділені аорти, фрагменти аорти, шматочки міокарду та приготовлені цитологічні препарати крові експериментальних тварин.
Біохімічні методи контролю за станом ліпідного обміну та рівнем естрадіолу в сироватці крові експериментальних тварин. Для контролю за розвитком моделі атеросклерозу показники ліпідного обміну досліджували через кожні 30 діб протягом 6 місяців у І та ІІ групах. Визначали показники рівня ЗХС, тригліцеридів (ТГ) і ХС ліпопротеїдів високої щільності (ЛПВЩ). Для дослідження використовуали реактиви фірми "Lachema": для визначення рівня ЗХС - CHOL 150, бета-ліпопротеїнів - BLP 200, і ТГ - TG 50. Рівень ЛПНЩ і ліпопротеїдів дуже низької щільності (ЛПДНЩ) визначали за формулами:
ЛПНЩ = ЗХС - (ЛПВЩ + (ТГ/2,18));
ЛПДНЩ = ТГ/2,18.
Коефіцієнт атерогенности (КА) визначали за формулою:
КА = (ЗХС - ЛПВЩ) / ЛПВЩ (Климов А.Н., Никульчева Н.Г., 1999).
Показники ліпідного обміну на піку розвитку експериментального атеросклерозу при його регресі, а також після введення АКП на тлі регресу реєстрували щотижня протягом 3-х тижнів.
Рівень естрадіолу у сироватці крові тварин досліджували прямим твердофазним імуноферментним методом з використанням реактивів фірми DRG (Estradiol Elisa Kit). Показники рівню естрадіолу в сироватці крові визначали у тварин всіх груп та підгруп.
Статистична обробка отриманих результатів проводилася за допомогою програми Statgraph 2.0
Планіметрична оцінка частоти й поширеності осередків ліпоїдозу в інтимі аорти. Аорти виділяли від дуги до біфуркації на стегнові артерії, фіксували в нейтральному 10% розчині формаліну, після чого для проведення планіметрії забарвлювали за методом (Непряхин Г.Г., 1979). Площу осередків ліпоїдозу визначали за допомогою морфометричної програми Bіovіsіon 3.0. Фотозйомку аорт проводили цифровим фотоапаратом Olympus C 180.
Морфологічні та гістохімічні методи дослідження морфофункціонального стану міокарду, ендотелію аорти та лейкоцитів периферічної крові. Для гістохімічного дослідження шматочки аорти та міокарду заливали в парафін, гістологічні зрізи тканин забарлювали гематоксилін-еозином, пікрофуксином за методами: Ван-Гізон, Харта і Вейгерта (Пирс Э., 1962, Лилли Р., 1969).
Для морфологічного дослідження ендотелію шматочки аорти піддавали перфузії розчином глюкозо-формаліну, імпрегнували азотнокислим сріблом, проявляли в стандартному фотопроявнику й дофіксовували в 10% розчині формаліну протягом 12 годин (Кондаков І.К., 2000). Імпрегновані сріблом препарати аорти досліджували методами світлової, растрової й трансмісійної електронної мікроскопії. Враховували площу ендотеліоцитів і кількість міжендотеліальних дефектів з розрахунку на 100 клітин. Площу ендотеліоцитів визначали за допомогою морфометричної програми Bіovіsіon 3.0.
Для вивчення популяційного складу лейкоцитів крові кролів і визначення кількості «ліпіднавантажених» лейкоцитів кров забирали щотижня, готували цитологічні препарати: мазки крові висушували на повітрі, фіксували в парах формаліну і забарвлювали азур-еозином (за методом Романовського), а також суданом чорним Б (за методом Ліллі-Бартнера (Лилли Р., 1969)). Популяційний склад лейкоцитів крові кролів вивчали за допомогою класифікатора (Никитин В.Н., 1949). Розподіл лейкоцитів на популяції проводили, враховуючи площу оптичного перетину лейкоцитів та їх морфологічні особливості. «Ліпіднавантажені» лейкоцити підраховували в 50 полях зору на кожному мазку, при збільшенні 400. Площу оптичного перетину досліджуваних лейкоцитів визначали за допомогою морфометричної програми Bіovіsіon 3.0., фотореєстрацію проводили цифровим фотоапаратом Olympus C 180.
Електронно-мікроскопічні методи оцінки стану аорти кролів. Фіксовані в 2,5% розчині глютарового альдегіду шматочки артерій використовували для електронно-мікроскопічного вивчення ультраструктурних особливостей люмінальної поверхні судин методом скануючої електронної мікроскопії (СЕМ). Шматочки тканини аорти розміром 0,4х0,4 см зневоднювали в батареї спиртів висхідної концентрації і напиляли у вакуумі сріблом, золото-паладієм і досліджували в СЕМ РЕМА-202 (м. Суми). Для вивчення особливостей мікроархітектоніки внутрішньої еластичної мембрани (ВЕМ) аорти шматочки судин піддавали лужній дисоціації за методикою (Song S. H., 1983, 1984), промивали у фосфатно-сольовому буфері (ФСБ) і підготовляли до дослідження в СЕМ за наведеною методикою. Для дослідження в трансмісійному електронному мікроскопі (ТЕМ) зразки тканин дофіксовували в 1% розчині чотирьохосмію, відмивали у ФСБ, зневоднювали в спирті, ацетоні й заливали в епон-аралдіт (Fluka, Швейцарія). Ультратонкі зрізи контрастували уранілацетатом, цитратом свинцю й досліджували в ТЭМ JEOL-100.
Отримані результати обробляли статистистичним методом Вілкоксона-Уітні-Манна та каноничної корреляції за допомогою пакету компютерних програм «Statgraph 2.0. », ”Microsoft Exel”. Рівень вірогідності складав 0,05 та 0,01.
Використані в дисертаційній роботі матеріали і методи були розглянуті та узгоджені з комісією з біоетики ІПКі К НАН України.
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯДинаміка показників ліпідного обміну в крові кролів при моделюванні експериментального атеросклерозу. За результатами проведеного біохімічного дослідження встановлено, що годування тварин протягом шести місяців холестерином привело до помірної гіперхолестеринемії з переважним зростанням атерогенних фракцій і зниженням рівня антиатерогенних ліпопротеїдів. Одержані результати при створенні моделі експериментального атеросклерозу в кролів співпадали з данними літератури (Аничков Н.Н., 1913, Климов А.Н., 1999).
Результати порівняльного аналізу біохімічних даних показали, що відміна атерогенної дієти (АТД) приводило до 4-кратного зниження рівня ЗХС вже на першому тижні до 3,79±35 ммоль/л (табл.1). Зниження рівня ЗХС супроводжувалося зниженням концентрації ЛПНЩ до значень 2,67±0,25 ммоль/л. При падінні рівня ЗХС і ЛПНЩ збільшувалося концентрація ЛПВЩ до 0,35±0,03 ммоль/л і невірогідно зростали рівні ТГ і ЛПДНЩ у сироватці крові. На другому тижні зниження рівнів ЗХС і ЛПНЩ було вірогідним і становило 2,07±0,2 і 0,76±0,07 ммоль/л відповідно. При цьому рівні ТГ і ЛПДНЩ збільшувалися майже в 2 рази в порівнянні з першим тижнем. Рівень ЛПВЩ знижувався на 2-й тиждень і становив 0,16±0,01 ммоль/л, що впливало на КА (11,94±1,02).
До кінця 3-го тижня регресу показники рівня ЗХС незначно збільшилися (2,63±0,24 ммоль/л) відносно попереднього строку, при цьому відзначався феномен збільшення концентрації ЛПНЩ у порівнянні з 2-м тижнем експерименту (табл.1). Рівні ТГ і ЛПДНЩ також знизились майже в 2 рази й становили відповідно 1,49±0,11 і 0,68±0,05 ммоль/л.
У порівнянні з 2-м тижнем рівень ЛПВЩ підвищився у 2 рази, (0,32±0,02 ммоль/л) і майже досягав значень, які були установлені у інтактних тварин.
Дослідження показників ліпідного обміну після введення АКП виявило різке 5-кратне зниження рівня ЗХС вже на 1-му тижні у порівнянні з таким на піку атеросклероза. Рівень атерогенних ліпопротеїдів знижувався до 0,42±0,04 ммоль/л, що в 30 разів нижче, ніж на піку розвитку процесу. Значення ТГ і ЛПДНЩ були вищими, ніж при спонтанному регресі та склали 3,55±0,34 і 1,63±0,16 ммоль/л відповідно, тобто вищі в 2 рази у порівнянні з групою контролю (табл.1). Рівень антиатерогенних ліпопротеїдів на 1-му тижні знижувався й становив 0,28±0,02 ммоль/л. На 2-му тижні деяке зниження рівня ЗХС супроводжувалося зменшенням концентрації ТГ і ЛПДНЩ в 2 рази та приводило до 3-кратного зростання концентрації ЛПНЩ. До кінця 3-го тижня на тлі подальшого зниження ЗХС рівень ЛПВЩ досягав значень, встановлених у контрольних тварин. Вміст ТГ, ЛПДНЩ, ЛПНЩ знижувався, забезпечуючи КА 3,83±041, це значення було навіть нижчим, ніж у групі контрольних тварин.
Надалі до виведення тварин з експерименту параметри ліпідного обміну вірогідно не змінювалися й не перевищували показників контрольної групи.
Дослідження показників рівня естрадіолу у сироватці крові показали, що в нормі рівень естрадіолу становить 42,4±5,92 пг/мл, годування кролів холестерином протягом 180 діб призводить до зниження цього показника майже удвічи 21,86±6,48 пг/мл (табл.2). Після відміни холестеринової дієти вже на 1-му тижні регресу рівень естрадіолу знизився до 9,65±0,75 пг/мл. Поступове невірогідне зменшення рівня естрадіолу продовжувалось до кінця 3-го тижня.
Таблиця 1.
Динаміка показників ліпідного обміну в сироватці крові
експериментальних тварин у нормі, на піку розвитку моделі, при
регресі атеросклерозу та введенні АКП (ммоль/л)
| Группи тварин | ЗХС | ЛПВЩ | ТГ | ЛПДНЩ | ЛПНЩ | КА | |
| Інтактні тварини | 2,87±0, 19 | 0,33±0,03 | 1,70±0,16 | 0,78±0,07 | 1,82±0,18 | 8,07±0,81 | |
| Пік моделі | 12,76±1,22*# | 0,25±0,02# | 1,45±0,10 | 0,66±0,05 | 11,86±1,21*# | 47,64±4,16*# | |
| 1 тижд. | регрес | 3,79±0,35* | 0,35±0,03* | 1,84±0,18 | 0,84±0,07 | 2,67±0,25*# | 10,23±1,12* |
| 2 тижд. | регрес | 2,07±0, 20* | 0,16±0,01*# | 2,88±0, 19*# | 1,32±0,09*# | 0,76±0,07*# | 11,94±1,02# |
| 3 тижд. | регрес | 2,63±0,24* | 0,32±0,02* | 1,49±0,11* | 0,68±0,05* | 1,62±0,26* | 7,29±0,96* |
| 1 тижд. | АКП | 2,48±0,23* | 0,36±0,03 | 3,55±0,34*# | 1,63±0,16*# | 0,42±0,04*# | 6,15±0,60*# |
| 2 тижд. | АКП | 2,42±0,14# | 0,28±0,02* | 1,73±0,16* | 0,79±0,07* | 1,35±0,12* | 8,16±0,89 |
| 3 тижд. | АКП | 1,45±0,04* # | 0,36±0,01* | 0,72±0,11*# | 0,33±0,05*# | 0,76±0,04* # | 3,83±0,41* # |
Примітка: * - розходження показників ліпідного обміну вірогідні відповідно до попередніх в ході експерименту, р< 0,05; # - розходження показників ліпідного обміну вірогідні відповідно до групи контролю, р< 0,05.
У групі тварин після введення АКП також спостерігалось зниження рівня естрадіолу відносно показників на піку моделі (13,93±3,74 пг/мл), але рівень естрадіолу був вірогідно вищий, ніж у підгрупі з регресом атеросклерозу, в аналогічні терміни спостереження.
Надалі спостерігалося поступове невірогідне зменшення рівня естрадіолу, яке продовжувалось до кінця 3-го тижня. При порівняльному аналізі показників рівня естрадіолу у наведених підгрупах встановлено, що його рівень протягом 3-х тижнів був вірогідно вище у 2-й підгрупі тварин.
Таблиця 2.
Динаміка показників рівня естрадіолу в сироватці крові
експериментальних тварин, пг/мл
| Групи тварин | Тижні експерименту | ||
| 1 тиждень | 2 тиждень | 3 тиждень | |
| Контроль | 42,4±5,92 | ||
| Пік моделі | 21,86±6,48 | ||
| Спонтанний регрес | 9,65±0,75 | 8,85±1,47 | 8,63±0,24 |
| Введення АКП | 13,93±3,74* | 14,8±2,36* | 14,65±2,2* |
Примітка: * - розходження показників вірогідні відповідно до підгрупи зі спонтанним регресом, р< 0,05.
Кореляційний аналіз між показниками ліпідного обміну та рівнєм естрадіолу в сироватці крові виявив прямий вірогідний зв’язок між показниками ЗХС та ЛПНЩ у двох досліджуваних підгрупах (табл.3).
Таблиця 3.
Коефіцієнт кореляції між показниками ліпідного обміну та
показниками рівня естрадіолу в сироватці крові експериментальних
тварин
| Підгрупи тварин | Показники ліпідного обміну | |
| ЗХС | ЛПНЩ | |
| Регрес моделі | r = 0,996 p = 0,003 | r = 0,995 p = 0,007 |
| Введення АКП | r = 0,99 p = 0,01 | r = 0,998 p = 0,001 |
Таким чином, порівняльний аналіз стану ліпідного обміну при спонтанному регресі атеросклерозу і при такому з введенням АКП, встановив істотні вірогідні розходження у темпі та якості змін ліпідного спектра.
Отримані дані свідчать про те, що введення АКП на тлі регресу стимулює нормалізацію показників ліпідного обміну у експериментальних тварин, і, можливо, сприяє регресу атеросклеротичного процесу.
Таким чином, введення АКП на тлі регресу впливає на рівень естрадіолу в сироватці крові експериментальних тварин, за рахунок дії естрадіолу та можливо, посилює захват ЛПНЩ гепатоцитами через рецептор-обумовлений механізм.
Частота й поширеність осередків ліпоїдозу в інтимі аорти кролів в експерименті.
При дослідженні аорт інтактних тварин осередки ліпоїдозу не спостерігались.
Аналіз поширеності осередків ліпоїдозу на піку розвитку атеросклерозу показав, що середній відсоток площі поразки грудного відділу аорти склав 46,51±13,85%. Морфометрично поширеність осередків ліпоїдозу у тварин з регресом (6 тижнів) становила 7,06±4,38%, що було вірогідно нижче, ніж у тварин на піку моделі (р<0,05). Після введення АКП поширеність осередків становила 0,89±0,37%, що було вірогідно нижче, ніж у тварин на піку моделі й при спонтанному регресі (р<0,05).
У тварин після введення АКП у ділянках типового розташування ліпідних утворень виявлялися чашеподібні вдавлювання. Ділянки суданофілії виявлялися навколо чашеподібних вдавлювань. Мікроскопічний аналіз чашеподібних вдавлень показав, що їх локалізація відповідала розташуванню атеросклеротичних бляшок. Стінка аорти в цих ділянках стоншена, на краях - потовщена й трохи піднята над люмінальною поверхнею у вигляді суданофільного валика.
Результати візуально-планіметричного дослідження показали, що частота й поширеність осередків ліпоїдозу залишалися вірогідно вищими в групі тварин зі спонтанним регресом атеросклерозу, ніж у підгрупі введення АКП.
Характеристика осередків ліпоїдозу аорти при моделюванні експериментального атеросклерозу, при його спонтанному регресі й на тлі введення АКП. При моделюванні атеросклерозу на люмінальній поверхні аорти виявлено 2 види осередків ліпоїдозу: ліпідні смужки та бляшки.
При регресі атеросклерозу неоінтимальні ділянки зустрічалися винятково в місцях гемодинамічної травматизації. Середня третина медії аорти петрифікована, осередки кальцинозу були або кільцеподібної форми, охоплюючи периметр судини, або у формі напівмісяця. У ділянках медії аорти з петрифікатами відзначали масивну круглоклітинну інфільтрацію з боку інтими та адвентиції.
У місцях чашеподібних вдавлювань, виявлених у стінці аорти на тлі введення АКП, гістологічно визначалося стоншення медії аорти в центрі та валикоподібні стовщення стінки по краях. Верхівки валикоподібних стовщень, розташованих проти току крові, були утворені скупченнями пінистих клітин і макрофагів, які були розташовані перпендикулярно внутрішній еластичній мембрані. При детальному аналізі судинної мережі, розташованої в субендотеліальному просторі, доведено, що вона являє собою систему vasa vasorum, утворену моношаром ендотелію, та безпосередньо примикає до гладком’язових клітин.
Таким чином, у середній третині медії аорти, де на піку холестеринової моделі виявлялися ділянки дистрофії та некрозу, розташовувалися ділянки кальцинозу. Реакція судинної стінки на петрифікацію полягає в гіперплазії модифікованих гладком’язових клітин середньої оболонки, які лізують петріфикат і транспортують продукти лізису за системою vasa vasorum у венозні й лімфатичні колектори адвентиції аорти. Введення АКП перешкоджає петрифікації стінки аорти. Наші дослідження доводять, що цей ефект досягається прискореним зворотним розвитком атеросклеротичних уражень за рахунок участі клітинних елементів крові та стимуляції неоангіогенезу. Після введення АКП у середній оболонці аорти бурхливо розвивається мережа vasa vasorum, яка досягає внутрішньої еластичної мембрани й поширюється в субендотеліальний простір. Такий потужний судинний дренаж, досягаючи основи бляшки, призводить до швидкої резорбції атероматозного ядра та утворення описаних чашеподібних вдавлювань. На наш погляд, прискорений регрес атеросклерозу аорти у кролів можна пояснити тим, що введення АКП стимулює ангіогенез і сприяє прискореному регресу за рахунок посилення трофіки в місцях атеросклеротичних уражень.
Експериментальна гіперхолестеринемія й лейкоцитарний кліренс ліпідів при введенні АКП. Згідно з даними деяких авторів, зворотний транспорт надлишку холестерину з інтими артерій може здійснюватися шляхом ретроендоцитозу ендотеліальними клітинами, а також за рахунок лейкоцитарного кліренсу ліпідів з осередків атеросклеротичних уражень (Gerrity R. G., 1981; Климов А.Н. 1986). У тварин контрольної групи кількість «ліпіднавантажених» лейкоцитів крові не перевищувала 12%.
Результати порівняльного аналізу динаміки процентної кількості «ліпіднавантажених» лейкоцитів в ході експерименту подані на рис.1.
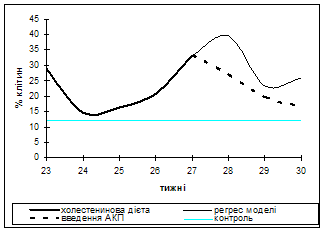 |
При моделюванні атеросклерозу процентне число ліпіднавантажених лейкоцитів до 23 тижня становило 28% від загального числа лейкоцитів, до 24 тижня їх кількість знижувалась до 14%, потім поступово зростало й на піку моделі становила близько 35%. Протягом наступного тижня відзначалося зростання їхнього числа до 40%.
Рис.1. Лейкоцитограма крові кролів на піку розвитку експериментального атеро-склерозу, його регресу та після введення АКП
Що стосується введення АКП на тлі регресу, то процентна кількість «ліпіднавантажених» лейкоцитів після введення знижувалося на першому тижні до 24%, на 2-му тижні становила 16% і на 3-му - 9%. По цитологічним і морфометричним показникам ці клітинні елементи відповідали моноцитам і сегментоядерним лейкоцитам.
З огляду на різну динаміку зміни процентного числа «ліпіднавантажених» лейкоцитів у крові в ході експерименту, нами проаналізований ступінь можливих взаємозв'язків між числом «ліпіднавантажених» клітин і показниками ліпідного обміну при спонтанному регресі й такому при введенні АКП (табл.4).
При цьому (див. табл.4) найбільш вірогідні та значні взаємозв'язки існували: з ТГ, ЛПДНЩ, ЛПВЩ.
Наявність ліпідних включень у цитоплазмі лейкоцитів свідчить про існування механізму кліренсу ліпідів із крові. При введенні кріоконсервованої плаценти високий кореляційний взаємозв'язок між кількістю «ліпіднавантажених» лейкоцитів і ТГ, ЛПВЩ, ЛПДНЩ свідчить про участь лейкоцитів у прискореній утилізації атерогенних фракцій холестерину із крові.
Порівняльна морфологічна оцінка ангіотрофичних ефектів кріоконсервованої плаценти. Дані морфологічного дослідження показали, що у кролів 3-ї підгрупи 2-ї групи відзначалося стовщення інтими в магістральних судинах коронарних артерій, що приводило до редукції кровотоку, дистрофії кардіоміоцитів і розвитку осередкового кардіосклерозу.
Таблиця 4
| Коефіцієнт кореляції між показниками ліпідного обміну й процентною кількістю «ліпіднавантажених» лейкоцитів у крові | |||||
| Показники ліпідного обміну | |||||
| Групи тварин | ЗХС | ЛПНЩ | ЛПДНЩ | ТГ | ЛПВЩ |
| Регрес моделі | r = 0,48 p = 0,58 | r = 0,41 p = 0,59 | r = 0,11 p = 0,6 | r = 0,1 p = 0,89 | r = 0,63 p = 0,37 |
| Введення АКП | r = 0,01 p = 0,98 | r = 0,08 p = 0,91 | r = 0,98 p = 0,01 | r = 0,98 p = 0,01 | r = 0,98 p = 0,02 |
У кролів 1 підгрупи через 6 тижнів не спостерігалося регресу атеросклеротичних змін в артеріях і збільшення щільності розподілу інтрамуральних судин. Введення АКП приводило до регресу атеросклеротичних уражень у магістральних судинах коронарних артерій і до прискореного ангіогенезу інтрамуральних судин міокарда, що підтверджується вірогідним збільшенням їх щільності на одиницю площі серцевого м'яза (табл.5).
Отже, отримані дані вказують на те, що введення АКП сприяє прискореному зворотному розвитку експериментального атеросклерозу й неоваскуляризації міокарда.
Таблиця 5.
Щільність розподілу інтрамуральних судин у міокарді в ході
експерименту (1/мм2).
| Контроль | Пік моделі | Регрес | Введення АКП |
| 4,5±0,5 | 2,5±1,5* | 2,36±0,36* | 5,0±1,0** |
Примітка: * - вірогідно в порівнянні з контролем (р<0,05);
** - вірогідно в порівнянні з групою регресу
Світлооптична й ультраструктурна характеристика ендотелію в нормі, при моделюванні атеросклерозу, його спонтанному регресі й після введення АКП. Як відомо, однією з основних причин виникнення й розвитку атеросклерозу є порушення проникності ендотелію.
Порушення ендотеліального транспорту може проявлятися в посиленні трансендотеліального транспорту ЛПНЩ у субендотеліальний простір у складі облямованих і необлямованих везикул (Van Hinsbergh V. W., 1983, Ryan U. S., 1986), а також через дефекти в міжендотеліальних контактах (Zand T., 1981). Порівняльний аналіз препаратів ендотелію аорти контрольних тварин показав, що моношар складається з витягнутих уздовж аорти клітин з вузькими міжендотеліальними межам, по ходу яких зустрічаються дрібні "ґудзикові" утворення й великі кільцеподібні структури, - "стигмати" і "кратери". За метричними параметрами площа стигмати не перевищує 6 мкм2 і відповідає наскрізному дефекту міжендотеліальних контактів. Електронно-мікроскопічний аналіз підтвердив, що стигмата являє собою мінімальну розбіжність цих контактів. По ходу міжендотеліальних кордонів зустрічаються кратери – великі (10 - 16 мкм2), округлої форми аргірофільні утворення, які іноді набувають вигляду кільцеподібних структур, а при дослідженні в РЕМ встановлено, що це кратероподібні об'єкти кільцеподібної форми з тонкими аргірофільними кордонами.
Як показали результати морфологічного дослідження ендотелію аорти з регресом атеросклерозу (6 тижнів), моношар ендотеліальних клітин не порушений. Ендотеліоцити представлені вузькими клітинами з тонкими міжендотеліальними кордонами, які орієнтовані уздовж вісі судини. По ходу міжендотеліальних кордонів зустрічаються переважно стигмати, а кратери розташовуються окремими групами в кількості 2-4 в полі зору.
Аналіз стану проникності ендотелію в той же строк, який був проведений на підставі підрахунку кількості міжклітинних дефектів, виявив 2,5-кратне вірогідне зниження кількості стигмат і майже 5-кратне зниження кількості кратерів у порівнянні з піком експериментальної моделі атеросклерозу (Табл.6).
Разом з тим, введення АКП не приводило до ще більшого вірогідного зменшення кількості кратерів.
Генез наскрізних міжклітинних дефектів ендотелію у виді стигмат і кратерів залишається мало вивченим. Існує думка, що утворення мінімальних міжендотеліальних дефектів у виді стигмат може бути пов'язане з токсичною дією надлишку холестерину в крові (Климов А.Н., 1999).
Таблиця 6.
Особливості частоти міжклітинних дефектів у моношарі ендотелію
аорти кролика на піку, при регресі атеросклерозу і після введення АКП
| Модель атеросклерозу | Регрес атеросклерозу | Введення АКП | |||
| Стигмати | Кратери | Стигмати | Кратери | Стигмати | Кратери |
| 63,0±5,79 | 19,5±1,03 | 25,50±1,50* | 4,50±0,29* | 12,50±3,28* ** | 5,75±0,63* |
Примітка. Розрахунок міжклітинних дефектів ендотелію робили на 100 клітин.
* - вірогідно в порівнянні з моделлю атеросклерозу (р<0,01);
** - вірогідно в порівнянні зі спонтанним регресом моделі атеросклерозу (р<0,05).
Максимальну розбіжність міжендотеліальних контактів у вигляді кратерів більшість авторів пояснює як наслідок зворотного транспорту макрофагів і лейкоцитів із субендотеліального простору у кровоток (Нагорнев В.А., 1981).
Популяційний склад ендотелію аорти у нормі, на тлі регресу атеросклерозу і після введення АКП. Порівняльний аналіз морфологічних змін ендотелію аорти кролика в нормі й при експериментальному атеросклерозі показує, що найбільш інформативними морфологічними маркерами морфофункціонального стану ендотелію можуть бути кількість стигмат, кратерів і площа ендотеліальних клітин. Перші два параметри (стигмати й кратери) вказують на ступінь проникності ендотелію в моношарі. Площа ендотеліоцитів, можливо, є інтегральним показником змін функціональної та проліферативної активності клітин, яка відбувається під впливом атерогенних стимулів.
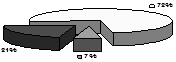
Дані морфометричного дослідження показали, що ендотелій у моношарі аорти є гетерогенним як у нормі, так і на піку розвитку атеросклерозу. За даними літератури гетерогенність ендотеліальних клітин у моношарі обумовлена певною проліферативною потенцією клітин, яка забезпечує гомеостаз двовимірної тканини. Ендотеліальні клітини з великою площею утворюють проліферативній пул готових до розділу ендотеліоцитів. Малі ендотеліальні клітини є клітинами-нащадками великих ендотеліоцитів, які поділились (Маресин В.М., 1982) (рис.2 а).
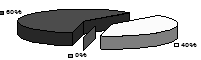
Як видно із представленої діаграми, ендотелій складається з дуже малих ендотеліоцитів, середніх і гігантських ендотеліальных клітин. Однак, площа ендотеліоцитів на піку експериментального атеросклерозу вірогідно більше (р<0,05), чим у контрольних тварин (рис.2 б).
Збільшення площі ендотеліоцитів у тварин з експериментальним атеросклерозом може бути обумовлена посиленням проліферативної активності ендотеліальних клітин у відповідь на аліментарну гиперхолістеринемію, при якій площа клітин, що діляться, значно зростає.
 |  | ||
 |
абв
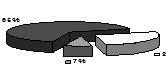
Рис.2. Розподіл ендотеліоцитів у моношарі аорти кролика залежно від їхнього логарифма площі розраховане на 100 клітин: а - контрольної групи, б - при регресі атеросклерозу, в - після введення АКП.
Як видно з рис.2 в, введення АКП на тлі регресу атеросклерозу приводило до збільшення кількості ендотеліоцитів з малою площею поверхні, що характерно для тварин контрольної групи. Це пояснюється відновленням проліферативної активності ендотеліоцитів у відповідь на введення АКП.
Проведений порівняльний аналіз морфології ендотеліальних клітин аорти, морфометричних особливостей площі ендотеліоцитів, а також ступеня його проникності, яка розрахована кількістю міжендотеліальних дефектів, показує, що при введенні АКП досліджувані показники наближаються до показників групи контрольних тварин. Отримані дані вказують на виражені ангіопротекторні та ангіотрофічні ефекти АКП.
ВИСНОВКИ
Актуальною проблемою сучасної медицини є терапія атеросклерозу. В Україні показники захворюваності, інвалідності і смертності внаслідок атеросклерозу та його ускладнень досить високі, вони посідають перше місце та в 2-4 рази вищі, ніж у країнах ЄС і світу (більше 68% від показника загальної смертності). У дисертаційній роботі виявлені антиатерогенні ефекти дії алогенної кріоконсервованої плаценти; досліджені та експериментально обґрунтовані можливі механізми дії алогенної кріоконсервованої плаценти на основні ланки атерогенезу в кролів з моделлю експериментальною атеросклерозу.
Введення фрагментів алогенної кріоконсервованої плаценти приводило до швидкої (протягом одного тижня) нормалізації ліпідного спектра сироватки крові кролів ЗХС від 12,76±1,22 до 2,48±0,23 ммоль/л, і ЛПНЩ від до 0,42±0,04 ммоль/л в той час, як при процесі регресу експериментального атеросклерозу ці показники були ЗХС - 3,79±0,35 ммоль/л та 2,67±0,25 ммоль/л відповідно. Це вказує на те, що АКП має значну гіполіпідемічну дію.
Введення фрагментів алогенної кріоконсервованої плаценти приводило до швидкого (протягом одного тижня) та стабільного (протягом 3 – х тижнів) збільшення рівня естрадіолу сироватки крові кролів 13,93±3,74 пг/л у порівнянні з показниками при регресі атеросклерозу які становили - 9,65±0,75 пг/л. Високий коефіцієнт кореляції між рівнем естрадіолу та такими показниками ліпідного обміну як ЗХС і ЛПНЩ (r=0,99; р=0,01) у тварин з введенням АКП вказує на посиленну елімінацію ЛПНЩ гепатоцитами через рецептор-обумовлений механізм.
Використання фрагментів алогенної кріоконсервованої плаценти приводило до зменшення площі осередків ліпоїдозу аорти (строк спостереження 6 тижнів) з 46,51±13,85% до 0,89±0,37%, що було вірогідно нижче, ніж у тварин з регресом (7,06±4,38%; р<0,05).
Введення фрагментів АКП супроводжувалось відновленням структурно-функціональної цілісності ендотелію. Проявом відновлення було зменшення кількості міжендотеліальних дефектів (стигмат і кратерів) з 63,0±5,79 і 19,5±1,03 до 12,50±3,28 і 5,75±0,63, в той час, як при регресі атеросклерозу ці показники були 25,50±1,50 і 4,50±0,29 відповідно. Введення АКП призводило до нормалізації популяційного складу ендотелію (появлення ендотеліоцитів з малою площею) на відміну від підгрупи з регресом атеросклерозу. Отримані дані вказують на виражені ангіопротекторні та ангіотрофічні ефекти АКП.
Проведені дослідження свідчать, що введення фрагментів алогенної кріоконсервованої плаценти стимулювало систему мононуклеарних фагоцитів, ознакою чого було вірогідне зменшення кількості «ліпіднавантажених» лейкоцитів з 35% до 9% протягом 3 тижнів, при регресі атеросклерозу у ті ж терміни цей показник був 26%.
Використання фрагментів алогенної кріоконсервованої плаценти через 6 тижнів приводило до збільшення кількості інтрамуральних судин у міокарді з 2,5±1,5 до 5,0±1,0 на мм2, на відміну від тварин з регресом атеросклерозу, у яких ці показники змінювались з 2,5±1,5 до 2,36±0,36. Це вказує на ангіотрофічні ефекти АКП.
ПЕРЕЛІК РОБІТ, ОПУБЛІКОВАНИХ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
1. Кондаков И.И. Антиатерогенные эффекты криоконсервированного препарата фетоплацентарного комплекса при экспериментальном атеросклерозе // Проблеми криобиологии. - 2005. - Т.15, №3. - С.435 - 439.
2. Кондаков И.И. Проницаемость эндотелия и предикторы нарушения эндотелиальной функции // Кровообіг та гемостаз. - 2005. -№3-4. -С.94-97.
3. Кондаков И.И., Юрченко Т.Н., Жуликова Е.П. Экспериментальная гиперхолестеринемия и липидкорригирующие эффекты при введении криоконсервированной плаценты // Світ медицини та біології. – 2007 - № 1 – С.46-50.
4. Кондаков И.И. Антиатерогенные эффекты фетоплацентарного комплекса в обратном развитии экспериментального атеросклероза // Запорожский медицинский журнал. - 2005. - №3. - С.122-123.
5. Кондаков И.И. Использование показателей лейкоцитарного клиренса липидов для контроля над адекватностью холестериновой модели атеросклероза у кроликов // Тезисы 2 междунар. симпозиума «Биоэтика - путь к мировым стандартам». - 2005. -С.31.
6. Кондаков И.И. Экспериментальный атеросклероз и лейкоцитарный клиренс липидов при аллогенной трансплантации криоконсервированной плаценты // Проблеми криобиологии. - 2006. - Т.16, №4. - С.448.
7. Кондаков И.И. Сравнительная морфологическая оценка ангиотрофических эффектов криоконсервированной плаценты при экспериментальном атеросклерозе // «Щорічні терпапевтичні читання: роль медичної науки в рішенні проблем внутрішніх хвороб»: матеріали науков-практичної конференції, 28 березня 2007 р. – Харків., 2007 – С.76.
8. Юрченко Т.Н., Кондаков И.И. Антиатерогенные эффекты действия криоконсервированной плаценты // Материалы 3 Всероссийского симпозиума «Актуальные вопросы тканевой и клеточной трансплантологии», 25-26 апреля 2007 г. – Москва, ЦИТО – С.48-49.
АНОТАЦІЇ
Кондаков І.І. Антиатерогенна дія кріоконсервованої плаценти при експериментальному атеросклерозі. – Рукопис.
Дисертація на здобуття наукового ступеня кандидата медичних наук за спеціальністю 14.01.35 – кріомедицина. Інститут проблем кріобіології і кріомедицини НАН Украини, Харків 2008.
Дисертаційна робота присвячена вивченню антиатерогенних ефектів кріоконсервованої плаценти при експериментальному атеросклерозі.
Показано, що введення алогенної кріоконсервованої плаценти кроликам з експериментальним атеросклерозом на першому тижні призводило до нормалізації ліпідного обміну, вірогідного підвищення рівня естрадиолу в сироватці крові. На 3-й тиждень після введення АКП кількість «ліпіднавантажених» лейкоцитів у периферичній крові наближувалась до контрольних показників, вірогідно знижувалась площа ураження аорти без стадії атерокальцинозу. Через 6 тижнів, введення АКП викликало неоваскуляризацію міокарда й видновлювало структурно-функціональну цілісність судинного ендотелію аорти.
Ключові слова: алогенна кріоконсервована плацента, атеросклероз, ліпідний обмін, ендотелій, лейкоцити.
Кондаков И.И. Антиатерогенное действие криоконсервированной плаценты при експериментальном атеросклерозе. – Рукопись.
Диссертация на соискание ученой степени кандидата медицинских наук по специальности 14.01.35 – криомедицина. Институт проблем криобиологии и криомедицины НАН Украины, Харьков 2008.
Диссертационная работа посвящена изучению антиатерогенных эффектов аллогенной криоконсервированной плаценты (АКП) при экспериментальном атеросклерозе. Проводилось сравнение морфологических и функциональных показателей при регрессе атеросклероза и после введения АКП на его фоне.
Показано, что кормление єкспериментальных животных холестерином в течение 6 месяцев приводило к увеличению атерогенных фракций липопротеидов сыворотки крови и 2-кратному снижению уровня эстрадиола. На пике модели атеросклероза площадь поражения грудного отдела аорты составляла 46,51±13,85%, происходило увеличение количества межэндотелиальных дефектов эндотелия аорты, нарушение его популяционного состава и увеличение количества липидсодержащих лейкоцитов периферической крови до 40% (у интактных животных 12%).
Установлено, что отмена кормления холестерином вызвала регресс экспериментального атеросклероза, который проявлялся в нормализации уровня атерогенных фракций липопротеидов через 2 недели, на фоне дальнейшего снижения уровня эстрадиола. Площадь поражения грудного отдела аорты к 6 неделе регресса уменьшалась до 7,06±4,38% по сравнению с пиком модели, а также уменьшалось количество межэндотелиальных дефектов (стигмат и кратеров), но без нормализации популяционного состава эндотелия. Количество липидсодержащих лейкоцитов к 3-й неделе регресса снижалось вдвое (20%) относительно пика модели. В очагах атеросклеротических поражений аорты возникал некроз медии с характерным последующим кальцинозом.
Введение АКП кроликам с регрессом атеросклероза через неделю приводило к нормализации липидного обмена, достоверному повышению уровня эстрадиола в сыворотке крови. К 3-й неделе после введения количество липидсодержащих лейкоцитов в периферической крови приближалось к контрольным значениям (9%), достоверно уменьшалась по сравнению с регрессом площадь поражения аорты (0,89%). Образование мощной сети vasa vasorum в местах регрессирующих бляшек предотвращало стадию кальциноза медии. Через 6 недель наблюдалась неоваскуляризация миокарда и восстановление структурно-функциональной целостности эндотелия аорты.
Таким образом, введение АКП оказывает ярковыраженный: гиполипидемический, вазотрофический и вазопротекторный эффекты.
Ключевые слова: аллогенная криоконсервированная плацента, атеросклероз, липидный обмен, эндотелий, лейкоциты.
Kondakov I.I. Anti-atherogenic effect of cryopreserved placenta at experimental atherosclerosis. – Manuscript
Thesis for obtaining scientific degree of the candidate of medical sciences (PhD equivalent) on specialty – 14.01.35. – Cryomedicine. - Institute for Problems of Cryobiology and Cryomedicine of the National Academy of Sciences of Ukraine, Kharkov, 2008.
The thesis covers studying anti-atherogenic effects of cryopreserved placenta at experimental atherosclerosis.
It has been shown that introduction of allogenic cryopreserved placenta to the rabbits with experimental atherosclerosis during the first week resulted in the normalization of lipid exchange, statistically significant rise in the level of estradiol in blood serum. To the 3rd week after introduction of anti-atherogenic cryopreserved placenta (ACP) the number of “lipid-loaded” leukocytes in peripheral blood approached to the control values, statistically and significantly reduced the area of aorta damage with no stage of atherocalcinosis. In 6 weeks it caused neovascularization of myocardium and recovered structural and functional integrity of aorta vascular endothelium.
Key words: allogenic cryopreserved placenta, atherosclerosis, lipid exchange, endothelium, leukocytes.
0 комментариев