НАЦІОНАЛЬНА АКАДЕМІЯ НАУК УКРАЇНИ
ІНСТИТУТ БІОЛОГІЇ КЛІТИНИ
КІТ ЮРІЙ ЯРОСЛАВОВИЧ
УДК 577.112.7: 576.32/36
АНТИТІЛА МОЛОКА І СИРОВАТКИ КРОВІ ЛЮДИНИ: ХАРАКТЕРИСТИКА КАТАЛІТИЧНОЇ АКТИВНОСТІ ТА ВПЛИВ НА РІСТ І ВИЖИВАННЯ КЛІТИН
03.00.11 – цитологія, клітинна біологія, гістологія
АВТОРЕФЕРАТ
дисертації на здобуття наукового ступеня
доктора біологічних наук
Львів – 2008
Дисертацією є рукопис
Роботу виконано в Інституті біології клітини НАН України та у Новосибірському інституті біоорганічної хімії СВ РАН.
Науковий консультант: член-кореспондент НАН України
доктор біологічних наук, професор,
Стойка Ростислав Степанович,
Інститут біології клітини НАН України,
завідувач відділу регуляції
проліферації клітин та апоптозу.
Офіційні опоненти: доктор біологічних наук, професор,
Сибірна Наталія Олександрівна,
Львівський національний університет
імені Івана Франка,
завідувач кафедри біохімії;
доктор біологічних наук,
Скок Марина Володимирівна,
Інститут біохімії ім. О.В. Палладіна НАН України,
головний науковий співробітник
відділу молекулярної мунології;
доктор біологічних наук,
Заставна Данута Володимирівна,
Інститут спадкової патології АМН України,
завідувач відділу діагностики спадкової патології.
Захист відбудеться «11» червня 2008 р. о «1400» годині на засіданні спеціалізованої вченої ради Д 35.246.01 в Інституті біології клітини НАН України (79005, м. Львів, вул. Драгоманова, 14/16).
З дисертацією можна ознайомитись у бібліотеці Інституту біології клітини НАН України за адресою: 79005, м. Львів, вул. Драгоманова, 14/16.
Автореферат розісланий «8» травня 2008 р.
Вчений секретар
спеціалізованої вченої ради,
кандидат біологічних наук В.М. Убийвовк
ЗАГАЛЬНА ХАРАКТЕРИСТИКА РОБОТИ
Актуальність теми. Імунна система ссавців не тільки забезпечує захист організму від шкідливих чинників оточуючого середовища, але й бере участь у регуляції багатьох біологічно важливих функцій, які підтримують гомеостаз організму. Гуморальна імунна система функціонує через продукцію мільйонів варіантів молекул антитіл (АТ), направлених як проти чужорідних антигенів, так і проти антигенів власного організму (аутологічних антигенів). Аутологічні антитіла (ауто-АТ) із спорідненістю до різноманітних біомолекул (білків, нуклеїнових кислот, полісахаридів, ліпідів) було виявлено як у хворих на аутоімунні захворювання, так і в клінічно здорових людей. В останніх описано дві різновидності ауто-АТ: поліреактивні ауто-АТ (Avrameas et al., 1995) та анти-ідіотипові ауто-АТ (Jerne et al., 1985). Поліреактивні ауто-АТ (полі-АТ) сироватки крові людини, головним чином, представлені IgM або імуноглобулінами інших ізотипів, що секретуються особливою популяцією В-лімфоцитів, на поверхні яких присутній білок CD5 (CD5+-B-лімфоцити). Полі-АТ є продуктами недиференційованих генів імуноглобулінів і характеризуються низькою афінністю та поліспецифічністю (спорідненістю до структурно-відмінних антигенів). Поліспецифічність цих ауто-АТ визначає їх подвійну фізіологічну роль в організмі ссавців. З одного боку, полі-АТ забезпечують первинну імунну відповідь організму на дію чужорідних антигенів, а з іншого боку, через спорідненість до аутологічних антигенів ці антитіла можуть бути задіяні у регуляцію гомеостазу.
Другою різновидністю ауто-АТ, які продукуються в нормі, є антиідіотипові АТ (аі-АТ). В основі продукції аі-АТ лежить здатність імунної системи ссавців сприймати варіабельні ділянки власних антитіл (ідіотипи) як чужорідні антигени і продукувати вторинні антитіла (аі-АТ), специфічні до цих фрагментів антитіл. Через рецептор–опосередковану взаємодію із імунокомпетентними клітинами аі-АТ беруть участь у клональній селекції лімфоцитів в організмі ссавців. Згідно з цим механізмом, співвідношення між первинними антитілами і аі-АТ регулює імунну відповідь організму на чужорідні антигени. Характерною ознакою аі-АТ є їхня висока специфічність до антигенних детермінант антитіл.
На відміну від ауто-АТ клінічно здорових людей, ауто-АТ, виявлені в організмі хворих на аутоімунні захворювання, володіють високою специфічністю і високою спорідненістю до аутоантигенів. При цьому антигенна специфічність ауто-АТ безпосередньо пов’язана з типом захворювання та особливістю його перебігу. Через взаємодію із аутоантигенами ауто-АТ, безпосередньо або опосередковано, можуть брати участь у розвитку аутоімунних захворювань, що дозволяє вважати їх молекулярними маркерами, придатними для діагностики аутоімунних захворювань та прогнозування особливостей їхнього перебігу у пацієнтів.
Імунний статус організму вагітних жінок і породіль має ряд суттєвих відмінностей від нормального стану. З одного боку, це пов’язано зі змінами в організмі вагітної жінки, скерованими на забезпечення імунної толерантності щодо клітин організму плоду, а з другого боку, це пов’язано із особливістю функціонування гуморального імунітету у породіль, який направлений на забезпечення імунного захисту новонароджених та на розвиток їхньої власної імунної системи.
Відомо, що зміни у гормональному та імунному статусі жінок, пов’язані з вагітністю, пологами та лактацією, можуть призводити до розвитку аутоімунних захворювань (Сervera et al., 2002; Molokhia et al., 2008). Внаслідок порушення аутоімунної толерантності в організмі жінки з’являються високоспецифічні ауто-АТ та абзими, характерні для хворих на аутоімунні захворювання (Buneva et al., 2003).
Таким чином, дослідження антигенної специфічності та функціональної активності ауто-АТ, які продукуються в нормі, при аутоімунних захворюваннях, а також при вагітності і лактації, є актуальними, оскільки вони дозволяють виявити молекулярні механізми, залучені у розвиток аутоімунних процесів в організмі людини.
Компоненти молозива та молока жінок діють не лише як фактори трофічного забезпечення дитини, але й як чинники регуляції розвитку дитячого організму. Ключову роль у такій регуляції виконують білки молока, які можуть впливати на проліферацію, диференціацію та апоптоз клітин різних типів. Цитокіни, зокрема інтерферон і деякі фактори росту, у невеликій кількості присутні у молоці і сироватці крові (Канышкова та ін., 2003). Інші білки, які задіяні у регуляції клітинної активності, зустрічаються, переважно, у жіночому молоці. До цих білків, наприклад, належить альфа-лактальбумін, олігомерні форми якого здатні індукувати апоптоз пухлинних клітин у присутності іонів кальцію (Hakansson et al., 1995), та лактоферин, який, залежно від наявності іонів заліза, здатний регулювати проліферацію, диференціацію чи апоптоз різного типу клітин (Legrand et al., 2008).
Оскільки лактація є частиною репродуктивного циклу жінки, функціональна активність імуноглобулінів молозива та молока може відображати індивідуальні особливості стану її гуморального імунітету. У жіночому молоці виявлено полі-АТ (Vassilev et al., 1996) та високоспецифічні ауто-АТ, характерні для хворих на аутоімунні захворювання (Brenner et al., 1992; Askanase et al., 2002). Останні можуть бути задіяні у розвитку аутоімунних процесів у дитини.
Важливою функціональною особливістю ауто-АТ, виявлених в нормі та при патології, є їхня здатність каталізувати хімічні реакції. Каталітично активні ауто-АТ отримали назву абзимів. Абзими, подібно до ауто-АТ, виявлених в організмі ссавців, можна розділити щонайменше на два типи – абзими, які є продуктами недиференційованих генів імуноглобулінів (Paul et al., 2005), та абзими, які утворюються внаслідок молекулярної мімікрії антигенів. Останні відносяться до аі-АТ, які продукуються за умов, коли антигенними детермінантами виступають поліпептидні ділянки, які формують каталітичні центри ензимів (Gabibov et al., 2006). Функції абзимів в організмі людини вивчені недостатньо. Аналіз літературних даних вказує на те, що перший тип абзимів може брати участь у знешкодженні вірусних та бактеріальних антигенів в організмі клінічно здорових людей, а другий тип абзимів може бути задіяний у розвитку аутоімунних захворювань.
У молозиві та молоці клінічно здорових породіль присутні обидва типи абзимів. Перший тип (абзими із фосфотрансферазною активністю) було виявлено тільки у молоці жінок (Kit et al., 1991, 1995; Gorbunov et al., 2000, 2005; Karataeva et al., 2005), тоді як другий тип (абзими із гідролізуючою активністю) присутні як у молоці клінічно здорових породіль, так і у сироватці крові хворих на аутоімунні захворювання (Nevinsky et al., 2002, 2003). Оскільки функція цих абзимів в організмі залишається не з’ясованою, дослідження їх біологічної активності є важливим для розуміння особливостей функціонування гуморального імунітету у жінок під час вагітності і лактації.
Усе вищесказане свідчить про актуальність дослідження антигенної специфічності і каталітичної активності антитіл, а також вивчення впливу цих антитіл на ріст і виживання клітин.
Зв’язок роботи з науковими програмами і планами. Роботу було розпочато відповідно до планів науково-дослідних робіт лабораторії радіохімії Новосибірського інституту біоорганічної хімії Сибірського відділення Російської Академії Наук у межах напрямку “Биокатализ, структура и функция гена” упродовж 1994-1999 рр. Пізніше її було продовжено у відділі регуляції проліферації клітин та апоптозу Інституту біології клітини Національної Академії Наук України в межах теми «Дослідження процесів, що відбуваються під час апоптозу, індукованого антинеопластичними препаратами з різним механізмом дії» упродовж 2006-2008 років (номер державної реєстрації № 0106U002599). Частково роботу було також підтримано грантом Російського Фонду Фундаментальних Досліджень за темою: “Роль фосфорилирования лактальбумина человеческого молока в образовании его мультимерных форм, обладающих способностью индуцировать апоптоз раковых, эмбриональных и лимфоидных клеток”, проект 97-04-49931 (1997-1999 рр) та грантом підтримки спільних проектів вчених Національної Академії наук України і Сибірського відділення Російської Академії наук за темою “Біологічно активні сполуки молока і їх фізіологічні функції”, проект № 9 (2006-2008 рр), які були надані здобувачу.
Мета і завдання дослідженя. Метою роботи було дослідити взаємозв’язок між антигенною специфічністю та особливостями каталітичної активності ауто-АТ клінічно здорових людей та хворих на аутоімунні захворювання, а також вивчити їхній вплив на ріст і виживання клітин ссавців in vitro.
Для досягнення цієї мети було проведено дослідження у 3-х основних напрямках:
Порівняти антигенну специфічність та каталітичну активність ауто-АТ, виділених із сироватки крові здорових донорів та хворих на системний червоний вовчак і розсіяний склероз, із ауто-АТ, виділеними із молозива та молока клінічно здорових жінок.
Проаналізувати спорідненість синтетичних та природних чинників, здатних утворювати комплекси із ауто-АТ сироватки крові і молока людини, та дослідити їхній вплив на каталітичну активність абзимів.
Отримати очищені препарати антитіл із різною антигенною специфічністю із сироватки крові та молока людини і дослідити їхній вплив на ріст та виживання клітин in vitro.
У межах цих напрямків дослідження у роботі вирішували наступні завдання:
Дослідити вплив препаратів імуноглобулінів, отриманих із сироватки крові здорових донорів, хворих на розсіяний склероз і молозива породіль, на ріст і виживання клітин in vitro.
Розробити методи очистки ауто-АТ та абзимів із сироватки крові та молока людини.
Визначити антиген-зв’язувальні, каталітичні та регуляторні центри ауто-АТ та абзимів із використанням афінної модифікації молекул АТ реакційно здатними аналогами нуклеотидів та олігонуклеотидів.
Вивчити закономірності регуляції каталітичної активності абзимів сироватки крові та молока людини:
а) за допомогою різних речовин біологічного походження (нуклеотиди, ДНК, РНК, полісахариди, конкурентні інгібітори протеїназ);
б) за допомогою синтетичних речовин (модифіковані аналоги нуклеотидів та олігонуклеотидів, хімічні модифікатори амінокислотних залишків білків).
Встановити закономірності впливу ауто-АТ та абзимів, виділених із сироватки крові клінічно здорових людей та молока породіль, на ріст та виживання ракових і трансформованих клітин in vitro.
Об’єкт дослідження – аутологічні антитіла сироватки крові і молока людини.
Предмет дослідження – виявлення і очистка аутологічних антитіл різної антигенної специфічності із сироватки крові і молока людини та дослідження їхньої функціональної активності, зокрема, впливу на ріст і виживання клітин.
Методи дослідження. У роботі використано методи препаративної та аналітичної біохімії білків і нуклеїнових кислот (осадження білків сульфатом амонію, діаліз, іонообмінна хроматографія, електрофорез у поліакриламідному та агарозному гелі, ізоелектричне фокусування білків, високоефективна рідинна хроматографія). Проведено комп’ютерний аналіз рівня гомології між первинними структурами протеїнкіназ та білків надродини імуноглобулінів. Застосовано методи дослідження цитотоксичної дії чинників на клітини ссавців in vitro (визначення кількості живих і мертвих клітин у культурі, виявлення апоптозу електрофоретичним аналізом нуклеосомної фрагментації ДНК та електрофорезом індивідуальних клітин у гелі агарози (метод ДНК-комет)). Крім того, застосовано імунологічні методи (імуноензимний і цитохімічний аналіз антигенної специфічності антитіл молока людини), а також методи статистичної обробки результатів дослідження.
Наукова новизна одержаних результатів. На основі розробленої схеми очистки антитіл із заданою антигенною специфічністю із сироватки крові хворих на аутоімунні захворювання (системний червоний вовчак (СЧВ), розсіяний склероз) та молока клінічно здорових жінок уперше очищено каталітично активні антитіла (абзими) класу IgG та IgA зі спорідненістю до АТР (анти-АТР АТ), дволанцюгової ДНК (анти-ДНК АТ) і гістону Н1 (антигістонові АТ). Встановлено, що анти-АТР АТ сироватки крові хворих на системний червоний вовчак і молока клінічно здорових жінок володіють фосфотрансферазною (протеїнкіназною і ліпідкіназною) активністю, анти-ДНК АТ молока людини володіють РНК-азною, ДНК-азною та протеїнкіназною активністю, тоді як антигістоновим АТ сироватки крові хворих на розсіяний склероз і молозива породіль властива протеазна активність щодо деяких лужних білків.
Вперше виявлено чинники, які впливають на каталітичну активність абзимів. Показано, що дезоксирибоолігонуклеотиди стимулюють протеїнкіназну активність sIgA-абзимів молока людини, тоді як нуклеотидтрифосфати інгібують їхню нуклеазну активність.
Виявлено, що імуноглобуліни сироватки крові та молока клінічно здорових людей індукують загибель клітин лейкемії шляхом апоптозу. Разом із тим, у сироватці крові окремих хворих на розсіяний склероз присутні імуноглобуліни, здатні індукувати проліферацію лейкемічних клітин людини.
Теоретичне значення одержаних результатів. Вперше обґрунтовано механізм промітогенної дії IgG-абзимів на клітини ссавців, а також механізм каталізу антитілами фосфотрансферазної реакції. Запропоновано модель внутрішньоклітинної нейтралізації вірусів у епітеліальних клітинах за участю sIgA-абзимів.
Практичне значення отриманих результатів. У роботі проведено аналіз антигенної специфічності, каталітичної та цитотоксичної активності імуноглобулінів, отриманих із молозива клінічно здорових породіль. На основі отриманих результатів зроблено висновок про те, що функціональні властивості імуноглобулінів молозива залежать від індивідуальних особливостей стану гуморального імунітету у породіль. Ці властивості важливо врахувати під час комплексного визначення показників ранніх аутоімунних порушень у жінок, пов’язаних із їхньою вагітністю та пологами.
Особистий внесок здобувача. Авторові належить формулювання теми й мети досліджень, вибір об’єктів, а також вибір і розробка методів дослідження, постановка експериментів. Експериментальні визначення, обробка даних, їхній теоретичний аналіз виконані автором самостійно, або за його безпосередньою участю. Автором проведено аналіз даних літератури за темою роботи, сформульовано та обґрунтовано висновки та узагальнення.
Науковим консультантом здійснювалося загальне керівництво проведенням досліджень та обговорення отриманих результатів у період роботи дисертанта в Інституті біології клітини НАН України.
Апробація одержаних результатів. Основні результати дисертації обговорювались на ІІ міжнародній конференції “Catalytic Antibodies and Antibody Engineering” (Шантілі, Франція, 1996); X міжнародному імунологічному конгресі (Нью-Делі, Індія, 1998); Кістоунському симпозіумі з молекулярної і клітинної біології (Брекенрідж, США, 1999); III Парнасівській конференції “Mechanisms of cellular signal transduction and communication” (Львів, 2000); Міжнародній конференції “RNA as Terapeutic and Genomic Target” (Новосибірськ, Росія, 2001); конференції НАТО “Frontiers in autoimmunity: fundamental aspects and clinical perspectives” (Кеслей, Угорщина, 2002); Установчому з’їзді українського товариства клітинної біології (Львів, 2004); V Парнасівській конференції (Київ, 2005); XI Українському біохімічному з’їзді (Харків, 2006); ІІІ Міжнародній конференції “Фундаментальные науки – медицине” (Новосибірськ, Росія, 2007); ІІ з’їзді українського товариства клітинної біології (Київ, 2007).
Публікації. За темою дисертації опубліковано 38 наукових робіт, із них 25 статей у фахових вітчизняних і міжнародних журналах, 1 огляд та тези 12 доповідей на наукових конференціях.
Зміст та обсяг роботи. Дисертація включає вступ, огляд літератури, матеріали і методи, результати власних досліджень, що складаються із 9 розділів, аналіз та узагальнення результатів досліджень, висновки, список використаної літератури, який нараховує 300 найменувань. Текст дисертації викладено на 290 сторінках машинописного тексту і проілюстровано 118 рисунками і 5 таблицями.
ОСНОВНИЙ ЗМІСТ РОБОТИМатеріали і методи дослідженя. Отримання електрофоретично гомогенних препаратів антитіл є однією із найбільш важливих умов дослідження їхньої функціональної активності. У першу чергу, це стосується каталітично активних антитіл, які володіють аналогічною із ензимами каталітичною активністю. Виділення та очистка абзимів є досить складним завданням. Це зумовлено сукупністю факторів. Відомо, що сумарні препарати імуноглобулінів є поліклональними, складаються із різноманітних за ізотипом антитіл, які мають спорідненість до великої кількості різноманітних антигенів, серед яких є й ензими. Останні можуть знаходитися у комплексі із антитілами, що може бути причиною артефактів при дослідженні їхньої каталітичної активності. Тому на перших стадіях очистки ауто-АТ необхідно відділити антитіла від різноманітних антигенів, у першу чергу від білків. Наступним кроком повинно бути виділення фракції антитіл, яка володіє спорідненістю до антигену – потенційного субстрату каталітичної реакції.
На рис.1 наведено узагальнену схему очистки ауто-АТ із сироватки крові та молока людини, яка дозволяє отримати препарати антитіл із заданою антигенною специфічністю, збагачені каталітично активними антитілами.
На першій стадії очистки імуноглобуліни осаджували 50% сульфатом амонію. Це дозволяє відділити фракцію імуноглобулінів від основної маси білків сироватки крові чи молока. Наступна стадія включає афінну хроматографію на колонці, яка містить протеїн A - або протеїн G - агарозу (або сефарозу). Для видалення домішок колонки промивали розчинами із підвищеною концентрацією NaCl (0,3–0,5 М) у присутності неіонних детергентів (NP-40, тритон Х-100). Елюцію імуноглобулінів із колонки проводили буфером із низьким значенням рН (1 M оцтова кислота або 0,1 М гліцин-HCl, рН 2,6). Використання цих сорбентів дозволяє уже на перших стадіях очистки отримати препарати, які на 90-95% складаються із імуноглобулінів. Для подальшої очистки антитіл або їхнього розділення на субкласи (наприклад, sIgA та IgG молозива) використовували іонообмінну хроматографію або напівпрепаративну гель-фільтрацію (Невинский та ін., 2000). Препарати антитіл, очищені таким методом, є електрофоретично гомогенними (рис.1А, Б) і придатні для виділення антитіл зі спорідненістю до певних антигенів чи субстратів каталітичної реакції.
Отримані препарати імуноглобулінів у подальшому слугували для виділення моноспецифічних поліклональних антитіл із сироватки крові і молока людини афінною хроматографією на колонках, які містять сорбенти із ковалентно зв’язаними лігандами. Сорбентами слугували: АТР-сефароза, ДНК-целюлоза, гістон Н1-сефароза. Залежно від спорідненості до сорбентів, антитіла елюювали градієнтом концентрації 0–1 М NaCl (анти-АТР IgG сироватки крові хворих на системний червоний вовчак), 3,5 M MgCl2 (анти-АТР sIgA молозива породіль), 50 мМ NaOH (анти-ДНК sIgA молозива породіль), 0,1 М гліцин-HCl, рН 2,6 (антигістонові АТ субкласів IgG та sIgA сироватки крові хворих на розсіяний склероз і молозива породіль).
Визначення протеїнкіназної активності. Для аналізу протеїнкіназної активності АТ і rsCD4 донором фосфату був [g-32P] ATP (5000 Ki/ммоль, “Изотоп”, Російська Федерація). Реакційне середовище містило 0,3 – 3 мкг білка,20 мМ трис-HCl, рН 7,4, 5-10 мМ MgCl2, 25 мкКі [g-32P] ATP. У деяких випадках, у реакційне середовище додатково додавали АТР, казеїн коров’ячого або людського молока. Реакцію фосфорилювання проводили впродовж 30 хв при 37 °С і зупиняли додаванням денатуруючого розчину (65 мМ трис-HCl, рН 6,8, 1% Ds-Na, 2% 2-меркаптоетанол, 10% гліцерин) або 10% ТХО. Білки розділяли електрофорезом у 12% ПААГ, або у градієнті 6-16,5% ПААГ у присутності 0,1% DS-Na. Гелі фарбували Coomassie R-250, висушували і піддавали авторадіографії протягом 20 год.
Визначення ліпідкіназної активності. Для аналізу використовували препарати IgG і sIgA різного ступеня очистки. Реакцію фосфорилювання проводили у середовищі, яке містило 20 мM трис-HCl, pH 7,5, 3 мМ MgCl2 і 20 мкКі [g-32P] ATP.32Р-мічені ліпіди екстрагували розчином хлороформ: метанол (2: 1) і розділяли на пластині Kieselgel 60 у системі хлороформ: метанол: 7М NH40H (60: 35: 5). Пластину висушивали і піддавали авторадіографії.
Визначення нуклеазної активності. Нуклеазну активність імуноглобулінів визначали згідно раніше описаної методики (Shuster et al., 1992). Як субстрат використовували надспіралізовану та лінійну форми плазмідної ДНК, тотальну РНК E. coli або рибосомну РНК клітин аденокарциноми людини лінії A549. Для аналізу зразки, які містили 1-5 мкг білка, інкубували із 3-5 мкг нуклеїнових кислот у 20 мМ трис-HCl, 75 мМ NaCl, 10 мМ MgCl2 протягом 1 год при 37 °С. Ефекторами реакції слугували 0,1-3 мМ АТР або 1 мМ GTP, СТР, TTP, dATP, dGTP, dCTP, dTTP. Продукти реакції розділяли електрофорезом у 1% агарозі у трис-борат-ЕДТА буфері, рН 8,3 у присутності 0,001% бромистого етидію. Гель фотографували при ультрафіолетовому освітленні.
Визначення протеазної активності. Для аналізу протеазної активності АТ субстратами слугували гістони тимусу теляти і цитохром С („Fermentas”, Литовська Республіка). Реакцію гідролізу проводили у буфері, який містив 20 мМ трис-HCl, pH 7,5 у присутності 3 мг/мл білка і 0,05 – 0,3 мг/мл АТ упродовж 1-3 год при 37 °С. Реакцію зупиняли додаванням у реакційне середовище 4-кратного денатуруючого буферу (0,2 М трис-HCl, рН 6,8, 4% Ds-Na, 8% 2-меркаптоетанол, 40% гліцерин) і білки розділяли електрофорезом у 12% ПААГ у присутності 0,1% Ds-Na. Гелі фарбували Coomassie G-250.
Аналіз каталітичної активності АТ після розділення гель-фільтрацією за умов дисоціації імунних комплексів (рН-шок). Препарати АТ піддавали гель-фільтрації на колонці розміром 180 x 5 мм, яка містила Toyopearl TSK HW-55 („Toyo Soda”, Японія). Білки препаратів АТ попередньо осаджували 50% сульфатом амонію й осад розчиняли в 0,1 М гліцин-HCl, рН 2,6 або 50 мМ NaOH. Елюцію білків проводили цими ж розчинами. Хроматографічні фракції (300 мкл) збирали, нейтралізували і діалізували проти буферу, що містив 20 мМ трис-HCl, pH 7,5, 0,1 М NaCl протягом 18 год. Вміст білків аналізували електрофорезом у градієнті ПААГ (7 – 18,5%) у присутності 0,1% Ds-Na. Для аналізу каталітичної активності від хроматографічних фракцій відбирали аліквоти (30 мкл), додавали 6 мкг субстрату (плазмідна ДНК, гістон Н1) й інкубували 2 год при 37 °С. Продукти реакції розділяли електрофорезом залежно від природи субстрату.
Афінна модифікація білків реакційно здатними аналогами АТР і олігонуклеотидів. Для виявлення АТР - і ДНК-зв’язувальних ділянок на молекулах білків використовували реакційно здатні похідні АТР(ClR-Р-ppA) і [g-32P] ATP(ClR-32Р-ppA), а також 32Р-мічений 14-мірний дезоксириботимідилат (ClRCH2NHp(T) 14), які були синтезовані к. б. н. Якубовим Л.А. (Інститут хімічної біології і фундаментальної медицини, Новосибірськ, Російська Федерація). Реакційною групою слугувала алкілуюча сполука 4- [(N-2-хлоретил-N-метил) аміно] бензиламін, приєднана до 5'-кінцевої фосфатної групи олігонуклеотиду або g-фосфату [g-32P] ATP (рис.2).
Афінну модифікацію білків (sIgA, rsCD4) проводили у забуференому фізіологічному розчині (ЗФР: 0,14 М NaCl, 10 мМ NaН2РО4, рН 7,5) у присутності 10 мкМ алкілуючого реагенту протягом 45 хв при 37 °С. Конкурентами у реакції слугували: ДНК тимусу теляти, сумарна РНК E. coli і гепарин у концентрації 1 мг/мл або 30 мкМ d(T) 14. Після завершення інкубації до реакційного середовища додавали денатуруючий буфер (2% Ds-Na, 50 мМ трис-НCl, рН 6,8, 4% 2-меркаптоетанол, 20% гліцерин) і білки розділяли електрофорезом у 10% ПААГ у присутності 0,1% Ds-Na. Гелі висушували і проводили їхню авторадіографію.
Імуноензимний аналіз (ІЕА). ІЕА проводили згідно описаної нижче методики. Для сорбції антигенів у лунки 96-лункового планшету для імунологічних аналізів вносили 30 мкл розчину, який містив 2 мкг гістонів або дволанцюгову ДНК у 0,1 М K2CO3/KHCO3, pH 8,6, й інкубували протягом 18 год при 4 °С. Лунки промивали (3 рази) 200 мкл буферу А (1% БСА у ЗФР), додавали 15 мкг антитіл у 200 мкл буферу А й інкубували протягом 2 год при 37 °С. Лунки тричі промивали 200 мкл буферу А, додавали 50 мкл розчину кон’югату білок А – пероксидаза хрону ("Sigma", США) у розведенні 1: 500 й інкубували протягом 1 год при 37 °С. Лунки планшету тричі промивали 200 мкл ЗФР у присутності 0,05% Twin-20 і фарбували розчином діамінобензидин/Н2О2 протягом 30 хв при 37 °С. Реакцію зупиняли 1 М ортофосфорною кислотою. Оптичну густину розчину визначали при довжині хвилі 492 нм на спектрофотометрі NanoDrop ND 1000 („NanoDrop Technologies”, США). Рівень ауто-АТ у лунках вираховували за величиною оптичного поглинання розчину забарвлених продуктів пероксидазної реакції. Визначення проводили у трьох паралельних дослідах.
Клітини та їхнє культивування. У роботі використовували клітинні лінії, одержані з колекції Інституту експериментальної патології, онкології та радіобіології НАН України: Jurkat – лейкемічні Т-лімфоцити периферичної крові людини, Namalwa – В-лімфоцити людини (лімфома Беркіта); L1210 – лейкемічні В-лімфоцити миші, L929 – трансформовані фібробласти миші. Клітини культивували у середовищі RPMI-1640 або DMEM („Sigma”, США) у присутності 10% сироватки крові ембріонів ВРХ („Sigma”, США) і 50 мкг/мл гентаміцину.
Аналіз цитотоксичної активності препаратів антитіл. Клітини інкубували із препаратами АТ (кінцева концентрація 0,7 мг/мл) протягом 24, 48 або 72 год. Фарбування клітин проводили 0,1% водним розчином трипанового синього. Кількість незабарвлених живих і забарвлених мертвих клітин підраховували у гемоцитометричній камері під світловим мікроскопом Биолам Р (ЛОМО, Російська Федерація). Індекс життєздатності (IЖ) визначали за формулою: IЖ = O/C x 100, де О – кількість живих клітин у культурі під впливом АТ, С – кількість живих клітин у культурі у відсутності АТ.
Аналіз субклітинної локалізації антигенів ауто-АТ. Клітини відмивали ЗФР від культурального середовища, готували цитологічні мазки, фіксували їх метанолом протягом 90 сек і висушували при кімнатній температурі. Після цього мазки інкубували з препаратами Ig (розведення 1: 75) при 4 °C протягом ночі. Після інкубації мазки промивали ЗФР двічі по 10 хв та інкубували із FITC-міченими IgG кози, специфічними до Н-ланцюгів IgA людини, або кон’югованими із пероксидазою хрону IgG кролика, специфічними до Н-ланцюгів IgG людини („Sigma”, США), у розведенні 1: 50 протягом 1,5 год при 37 °С. Мазки промивали ЗФР, фарбували флуоресцентним барвником DAPI (1 мкг/мл) протягом 1 хв, знову промивали ЗФР, дистильованою водою і фотографували під мікроскопом Микмед К-2-12 („ЛОМО”, Росія) при відповідних довжинах хвилі збудження та емісії для виявлення флуоресценції. У випадку, коли для детекції використовували кон’югати АТ із пероксидазою хрону, комплекси антиген-АТ фарбували розчином діамінобензидин/Н2О2 у присутності 100 мМ NiCl2 протягом 30 хв при 37 °С і виявляли мікроскопією у видимій області спектру.
Виділення фрагментованої ДНК та її електрофорез у гелі агарози. Клітини після культивування із препаратами АТ осаджували центрифугуванням при 2000 об/хв протягом 5 хв. До осаду клітин додавали 0,5 мл холодного ЗФР та фіксували, поступово додаючи до суспензії клітин 5 мл холодного розчину 70% етанолу. Клітини залишали на 12 год при - 20 °С (деякі зразки зберігали при даній температурі протягом 3-4 тижнів). Після цього клітини центрифугували при 2000 об/хв протягом 5 хв. Осад клітин (2-3 млн. клітин) ресуспендовували у 40 мкл фосфат-цитратного буферу, який містив 192 частини 0,2 М Na2HPO4 та 8 частин 0,1 М лимонної кислоти, рН 7,8, та залишали при кімнатній температурі на 30 хв. Після центрифугування при 3000 об/хв протягом 5 хв надосадову рідину переносили у свіжу пробірку типу Еппендорф та додавали 3 мкл 0,25% водного розчину NP-40 („Sigma”, США) та 2 мкл РНК-ази А (розчин 10 мг/мл у воді). Після 1-годинної інкубації при 37 °С до суспензії додавали 5 мкл протеїнази К („Merck”, Німеччина) (розчин 1 мг/мл у воді) та інкубували 1 год при 37 °С. Після інкубації до препарату ДНК додавали 12 мкл буферу, який містив 0,25% бромфенолового синього, 50 мМ трис-HCl, рН 7,5, 50% гліцерину і розділяли в 1% гелі агарози у присутності 0,005% етидію броміду при напрузі 4 В/см протягом 2 год. Фрагменти ДНК виявляли при ультрафіолетовому освітленні і фотографували цифровою камерою Nikon Coolpix 4200.
Мікроелектрофорез ДНК окремих клітин у гелі агарози (метод ДНК-комет). Аналіз здійснювали, як описано (Камінський та ін., 2005). Для формування гелю, предметні скельця покривали плівкою агарози шляхом нанесення 2 мл 1% тугоплавкої агарози („Serva”, Німеччина) і висушування у термостаті при 37 °С.40 мкл суспензії клітин вносили у пробірку типу Еппендорф і поміщали у водяну баню при 40 °С, змішували із 120 мкл розчину легкоплавкої агарози („Serva”, Німеччина) (кінцева концентрація агарози становила 0,75%), швидко наносили на теплі предметні скельця 150 мкл такої суміші і покривали теплим покривним скельцем. Після застигання агарози обережно знімали покривне скельце і вносили у лізувальний буфер (2% лаурил саркозинат, 0,5 М ЕДТА, рН 7,5, 0,3 мг/мл протеїнази К). Гелі інкубували при 4о С упродовж 1 год, а потім 20 год при 37 °С. Гелі витримували тричі по 20 хв у буфері ТБЕ (90 мМ трис, 90 мМ борної кислоти та 2 мМ ЕДТА, рН 8,5), після чого вносили в електрофоретичну камеру і заливали цим же буфером (2-3 мм буферу над скельцем). Електрофорез здійснювали при напрузі 0,6 В/см протягом 25 хв, причому електричне поле скеровували поперек предметного скельця. Після лужного електрофорезу препарати нейтралізували у 0,4 М трис-HCl, рН 7,5. Гелі висушували і фарбували водним розчином етидію броміду у концентрації 2 мкг/мл.
Комп’ютерний аналіз рівня гомології послідовностей амінокислот імуноглобулінів і рецептора СD4 та протеїнкіназ. Амінокислотну послідовність рецептора СD4 та Fc-фрагментів імуноглобулінів було отримано із бази даних Swiss-Prot. Для аналізу рівня гомології використовували банк генів протеїнкіназ KinBase та програми порівняння Kinom Blast Server (www. kinase. com). Аналіз доменної організації рецептора СD4 проводили, використовуючи базу даних SMART (smart. embl-heidelberg. de) та Pfam (pfam. wustl. edu). Пошук функціональних мотивів молекули СD4 здійснювали, застосовуючи базу даних Scansite та програму порівняння Motif Scan (scansite. mit. edu).
Статистична обробка отриманих результатів досліджень. Усі досліди повторювали 3-5 разів. У роботі наведено середні значення величин і стандартні похибки (M±m). Статистичний аналіз проводили, користуючись критерієм Ст’юдента (t). Вірогідними вважали дані у випадку, коли р≤0,05. Побудову графіків та статистичну обробку даних здійснювали за допомогою комп’ютерних програм Origin 4.0 та Excel 97.
РЕЗУЛЬТАТИ ДОСЛІДЖЕНЬ ТА ЇХ ОБГОВОРЕННЯВплив препаратів антитіл сироватки крові та молока людини на ріст і виживання Т-клітин лінії Jurkat. Аналіз впливу препаратів сумарних імуноглобулінів (Ig), отриманих із сироватки крові 22 хворих на розсіяний склероз (РС), і 25 зразків молозива клінічно здорових породіль, отриманих осадженням 50% cульфатом амонію, показав, що залежно від донорів, ці препарати можуть як пригнічувати, так і стимулювати ріст Т-клітин лінії Jurkat in vitro (рис.3). На відміну від Ig хворих на розсіяний склероз, препарати Ig, отримані із сироватки крові здорових донорів, у більшості випадків пригнічували ріст клітин in vitro. Рівень гальмування приросту Т-клітин лінії Jurkat під дією Ig здорових донорів був близьким до рівня гальмування приросту цих клітин під впливом Ig хворих на розсіяний склероз. При цьому жоден із 25 препаратів Ig здорових донорів не володів промітогенною активністю щодо Т-клітин лінії Jurkat. Співвідношення кількості живих і мертвих клітин у цьому досліді вказує на те, що деякі препарати Ig молозива породіль володіють цитотоксичною активністю щодо Т - клітин лінії Jurkat.
Гель-електрофорезом індивідуальних клітин (аналіз ДНК-комет), а також електрофоретичним аналізом міжнуклеосомної фрагментації ядерної ДНК встановлено, що загибель Т-клітин лінії Jurkat під впливом цитотоксичних препаратів Ig молозива породіль відбувається шляхом апоптозу (рис.4).
Наступне дослідження показало, що подібно до Ig молозива породіль, окремі препарати Ig, очищені із сироватки крові хворих на розсіяний склероз і здорових донорів, також індукують апоптоз цих Т-клітин.
Отримані результати вказують на особливості впливу препаратів імуноглобулінів на ріст і виживання Т-клітин лінії Jurkat, що може відображати індивідуальний стан гуморального імунітету донорів. Відмінності у дії препаратів Ig щодо клітин можуть бути пов’язані із присутністю в їхньому складі ауто-АТ певної антигенної специфічності і каталітичної активності. Особливої уваги заслуговує той факт, що досліджені препарати сумарних АТ сироватки крові хворих на розсіяний склероз і АТ молозива пророділь володіли як цитотоксичною, так і промітогенною активністю щодо Т-клітин лінії Jurkat. Ці дані вказують на те, що у молозиві людини можуть бути присутні ауто-АТ, які за своєю антигенною специфічністю і біологічною активністю подібні до ауто-АТ сироватки крові хворих на аутоімунні захворювання.
Ауто-АТ молозива клінічно здорових породіль. Характерною ознакою аутоімунних порушень в організмі людини є поява високоспецифічних ауто-АТ до ядерних антигенів – дволанцюгової ДНК та гістонів. За допомогою ІЕА було проаналізовано 25 препаратів Ig молозива породіль на наявність у них анти-ДНК АТ та анти-гістонових АТ. Як позитивний контроль застосовували препарати IgG сироватки крові хворих на розсіяний склероз, а як негативний – препарати IgG сироватки крові здорових донорів. Встановлено, що вміст анти-ДНК АТ в усіх препаратах Ig молозива породіль, окрім препарату Ig № 4, суттєво не відрізнявся від вмісту анти-ДНК АТ у препаратах IgG, виділених із сироватки крові здорових донорів (рис.5). Вміст анти-ДНК АТ у препараті № 4 був достовірно вищим, ніж в інших препаратах АТ, хоча у цілому, він був нижчим, ніж у препаратах IgG, виділених із сироватки крові хворих на розсіяний склероз.
Анти-гістонові АТ було виявлено у складі 12-ти препаратів Ig молозива породіль (Рис.5). При цьому у 6-ти препаратах їхній рівень був близьким або перевищував рівень анти-гістонових АТ, виявлених у препаратах IgG сироватки крові хворих на розсіяний склероз. Найвищим вмістом анти-гістонових АТ характеризувався препарат № 4, де рівень анти-гістонових АТ у 2,5 рази перевищував їхній рівень у препаратах IgG сироватки крові хворих на розсіяний склероз.
Додатковим підтвердженням наявності ауто-АТ у молозиві породіль можуть слугувати дані аналізу субклітинної локалізації антигенів секреторних імуноглобулінів А (sIgA) у фіксованих препаратах клітин. За допомогою FITC-мічених АТ, специфічних до IgA людини, було виявлено, що препарати сумарних імуноглобулінів молока містять sIgA-антитіла зі спорідненістю до антигенів Т-клітин лінії Jurkat. На Рис.6 представлено узагальнені результати
аналізу, які вказують, що за спорідненістю до антигенів клітин і місцем їхньої локалізації sIgA-антитіла можна розділити на три типи: ауто-АТ із високою спорідненістю до ядерних антигенів (ряд 1), ауто-АТ із низькою спорідненістю до антигенів клітин (ряд 2) і ауто-АТ із високою спорідненістю до компонентів цитоплазми і плазматичної мембрани цих клітин (ряд 3).
У цілому, аналіз отриманих даних свідчить про те, що у молозиві клінічно здорових породіль, як і у сироватці крові хворих на деякі аутоімунні захворювання, можуть бути присутні ауто-АТ. Це дозволяє припустити, що у молозиві жінок-породіль, подібно до сироватки крові хворих на аутоімунні захворювання, можуть бути присутні ауто-АТ із цитотоксичною і промітогенною активністю щодо клітин ссавців. Для перевірки цього припущення із молозива породіль виділяли анти-ДНК sIgA і досліджували їхні функціональні властивості.
Характеристика функціональної активності анти-ДНК АТ молока породіль. Анти-ДНК sIgA виділяли хроматографією на ДНК-целюлозі (рис.7А) з електрофоретично гомогенних препаратів sIgA, очищених із молока клінічно здорових породіль афінною та іонобмінною хроматографіями, як вказано на схемі, представленій на рис.1. Наявність sIgA у фракції білків, очищених на
ДНК-целюлозі було підтверджено Ds-Na-eлектрофорезом у градієнті ПААГ і імуноблотингом із використанням специфічних антитіл до IgA людини (рис.7Б).
Нуклеазна активність анти-ДНК sIgA молока людини. Характерною ознакою анти-ДНК АТ сироватки крові хворих на СЧВ (Shuster et al., 1990) і розсіяний склероз (Nevinsky et al., 2002) є їхня гідролізуюча активність щодо плазмідної ДНК. Під час аналізу нуклеазної активності анти-ДНК sIgA субстратами реакції слугували: рибосомна РНК клітин аденокарциноми лінії L929, надспіралізована і лінійна форми ДНК плазміди. Виявлено, що анти-ДНК sIgA, очищені із жіночого молозива, подібно до анти-ДНК АТ сироватки крові хворих на аутоімунні захворювання, володіють РНКазною, топоізомеразною та ендонуклеазною активністю (рис.8). Нуклеазна активність анти-ДНК sIgA, отриманих із молока жінок у такий же спосіб, була незалежно від нас виявлена іншими дослідниками (Nevinsky, 2000).
На наступному етапі дослідження проведено пошук чинників, які можуть впливати на нуклеазну активність анти-ДНК sIgA. Встановлено, що 10 мкМ АТР суттєво інгібує гідроліз рРНК клітин аденокарциноми людини А549 і одноланцюгове розщеплення надспіралізованої форми ДНК плазміди. dATP у такій же концентрації не виявляв помітного впливу на РНКазну і топоізомеразну активність sIgA-абзимів. Іншу картину спостерігали при дослідженні впливу рибонуклеотидтрифосфатів (NTP) і дезоксирибонуклеотидтрифосфатів (dNTP) на ендонуклеазну активність анти-ДНК sIgA. На відміну від РНКазної і топоізомеразної активності, ендонуклеазна активність анти-ДНК sIgA-абзимів, крім АТР, повністю інгібувалася і dATP. При цьому GTP, CTP, TTP також суттєво інгібували реакцію гідролізу лінійної форми плазмідної ДНК. Часткове інгібування ендонуклеазної активності анти-ДНК sIgA молока людини спостерігалося у присутності dGTP, хоча dCTP dTTP не впливали на швидкість розщеплення ДНК плазміди.
Вибірковість дії нуклеотидтрифосфатів на РНКазну, топоізомеразну й ендонуклеазну активність sIgA-абзимів вказує на те, що в основу регуляції їхньої активності можуть бути задіяні, щонайменше, два незалежних механізми. За першим механізмом, регуляція нуклеазної активності може відбуватися шляхом фосфорилювання поліпептидів sIgA за участю sIgA-абзимів, які володіють протеїнкіназною активністю (Kit et al., 1991, 1995). Можливо, що фосфорилювання певних ділянок цих антитіл призводить до втрати їхньої спорідненості до нуклеїнових кислот, зокрема до рРНК. За другим механізмом, інгібування ендонуклеазної активності ДНК-гідролізуючих sIgA може відбуватися через зміну конформації каталітичного центру абзимів при зв’язуванні АТР і dATP із певними ділянками поліпептидів цих антитіл, задіяних в алостеричній регуляції їхньої нуклеазної активності.
Про можливе існування цих ділянок у sIgA-абзимів свідчать результати аналізу спорідненості щодо олігонуклеотидів і АТР електрофоретично гомогенних препаратів sIgA, отриманих із молока людини послідовними хроматографіями на протеїн А-сефарозі і ДЕАЕ-фрактогелі (рис.9). Очищені у такий спосіб sIgA слугували основою для подальшої очистки АТ, які володіють фосфотрансферазною і нуклеазною активністю.
За допомогою афінної модифікації sIgA-антитіл 32Р-міченими алкілуючими похідними олігонуклеотидів і АТР у присутності конкурентів (dT14 і АТР) встановлено, що секреторний компонент sIgA виявляє спорідненість до дезоксирибоолігонуклеотидів (рис.9, доріжки 3, 4), тоді як важкі і легкі ланцюги цих антитіл, головним чином, зв’язуються із АТР (рис.9, доріжки 5, 6).
На основі цього аналізу було зроблено припущення про те, що подібно до інгібувальної дії АТР на нуклеазну активність sIgA-абзимів, олігонуклеотиди можуть бути залучені до регуляції протеїнкіназної активності sIgA-абзимів молозива породіль. Підтвердженням цього припущення слугувало дослідження впливу олігонуклеотидів на протеїнкіназну активністю анти-ДНК sIgA молозива породіль.
Протеїнкіназна активність анти-ДНК sIgA молока людини. При інкубації sIgA, очищених на ДНК-целюлозі, із [g-32P] ATP було виявлено включення радіоактивного фосфату у поліпептиди цих імуноглобулінів (рис.10А, доріжка 1), що свідчить про можливу протеїнкіназну активність анти-ДНК sIgA-антитіл. Незначний рівень протеїнкіназої активності цих АТ спостерігали, коли субстратом фосфорилювання слугував казеїн молока людини (рис.10Б, доріжка 6). Отримані результати показали, що подібно до sIgA-антитіл, очищених із молока людини хроматографією на АТР-сефарозі (Kit et al., 1996), анти-ДНК sIgA також можуть володіти протеїнкіназною активністю. У присутності мікромолярних кількостей дезоксирибоолігонуклеотиду d(A) 12 спостерігається значне зростання фосфорилювання важких ланцюгів sIgA (рис.10А, доріжки 5–8) і казеїну (рис.10Б, доріжки 1–5). При цьому рибоолігонуклеотид r(A) 12 помітно не впливав на протеїнкіназну активність цих антитіл (рис.10Б, доріжки 7–11). Таким чином, нами було з’ясовано, що sIgA, очищені із молока людини афінною хроматографією на ДНК-целюлозі, крім нуклеотид-залежної нуклеазної активності, також володіють олігонуклеотид-залежною протеїнкіназною активністю.
Цитотоксична активність анти-ДНК sIgA молока людини клітин ссавців in vitro. Важливою властивістю анти-ДНК АТ, виділених із сироватки крові хворих на СЧВ і розсіяний склероз, є їхня здатність індукувати загибель клітин шляхом апоптозу (Kozyr et al., 2000; Nevinsky et al., 2002). Подібну цитотоксичну активність також було виявлено в анти-ДНК IgG, очищених із молока клінічно здорових жінок (Nevinsky et al., 2002).
Аналіз спорідненості FITC-мічених sIgA, очищених на ДНК-целюлозі, виявив їхню здатність зв’язуватися із фіксованими Т-клітинами лінії Jurkat (рис.11). Розподіл флуоресцентної мітки показав, що мішенню дії анти-ДНК sIgA можуть бути структури, локалізовані на плазматичній мембрані, або в цитоплазмі цих клітин (рис.11, картинки 1, 3). Це дозволило припустити, що анти-ДНК sIgA можуть впливати на ріст і виживання клітин.
Ми вивчили дію препаратів анти-ДНК sIgA молозива породіль на життєздатність трансформованих фібробластів лінії L929 миші, клітин лейкемії людини (лінії Namalwa, Jurkat) та клітин лінії L1210 лейкемії миші. Вплив АТ на ріст і виживання клітин in vitro визначали за індексом життєздатності (ІЖ), який вираховували за формулою, наведеною у розділі “Матеріали і методи досліджень”. Аналіз отриманих даних свідчить про те, що використані нами лінії клітин суттєво відрізняються між собою за чутливістю до дії препаратів анти-ДНК sIgA (рис.12). Найбільш чутливими були фібробласти лінії L929 (ІЖ ≤ 20). Значно меншою цитотоксичною дією ці імуноглобуліни володіли щодо T-клітин ліній Jurkat (ІЖ ≥ 40) та В-клітин лінії L1210 (ІЖ ≥ 30). В-клітини лінії Namalwa були найменш чутливими до дії анти-ДНК sIgA (ІЖ ≥ 60).
На підставі отриманих даних можна зробити висновок, що препарати sIgA зі спорідненістю до ДНК тимусу теляти, які містять абзими з нуклеазною і фосфотрансферазною активністю, можуть із різною ефективністю індукувати загибель ракових та трансформованих клітин in vitro. Доведено, що цитотоксична дія анти-ДНК IgG сироватки крові хворих на системний червоний вовчак і на розсіяний склероз безпосередньо пов’язана із їхньою ДНКазною активністю АТ (Kozyr et al., 2002). Тому можна припустити, що загибель клітин під дією анти-ДНК sIgA молозива людини відбувається за подібним механізмом.
Інший механізм біологічної дії каталітично активних sIgA молока людини може бути пов'язаний із особливістю транспортування секреторних АТ в організмі людини. В основі запропонованої моделі (рис.13) лежить механізм трансцитозу sIgA-антитіл через шар епітеліальних клітин слизових оболонок до секреторних рідин (жовч, слина, молоко і т.п.). Встановлено, що в процесі трансцитозу, sIgA-антитіла можуть бути залучені до внутрішньоклітинної нейтралізації вірусів (Lamm et al., 1998; Masteski et al, 1997).
Базуючись на цих даних, можна припустити, що sIgA-абзими із нуклеазною активністю, здатні гідролізувати нуклеїнові кислоти вірусів у цитоплазмі епітеліоцитів і, таким чином, можуть бути задіяні у захисті епітеліальних клітин слизових оболонок людини від вірусних інфекцій. Наведені аргументи дозволяють припустити, що sIgA-абзими функціонують як фактори гуморального імунного захисту епітеліальних клітин від вірусних інфекцій.
Характеристика функціональної активності антигістонових антитіл сироватки крові хворих на розсіяний склероз і молока людини. Антитіла, каталітично активні щодо гідролізу гістону Н1, було вперше виявлено нами під час дослідження протеазної активності препаратів IgG сироватки крові хворих на розсіяний склероз. Основою для проведення таких досліджень слугували дані про те, що при цьому аутоімунному захворюванні у спинномозковій рідині і сироватці крові хворих можуть бути присутні абзими із гідролізуючою активністю щодо основного білка мієліну (ОБМ) [Polosukhina et al., 2005; Gabibov et al., 2006]. Важливою особливістю білків цієї родини є їхній високий позитивний заряд (рI=12-13). Це дозволило нам припустити, що у сироватці крові хворих на розсіяний склероз присутні абзими, які здатні гідролізувати, крім ОБМ, також інші позитивно заряджені білки. Для перевірки цього припущення як субстрати протеолітично активних антитіл було використано лінкерний та корові гістони хроматину тимусу теляти і лізоцим курячого яйця. Аналіз протеолітичної активності 20-ти препаратів IgG, очищених із сироватки крові хворих на розсіяний склероз хроматографією на протеїн А-сефарозі, виявив у зразках 3-х пацієнтів здатність каталізувати гідроліз гістону Н1. Аналіз 16-ти препаратів IgG сироватки крові здорових донорів не виявив у жодного з них гідролізуючої активності щодо цього білка. Дослідження протеолітичної активності 25-ти препаратів sIgA молозива породіль показало, що два з цих препаратів АТ виявляють гідролізуючу активність щодо гістону Н1.
На рис.14 наведено результати аналізу субстратної специфічності протеолітичної активності препаратів IgG сироватки крові хворих на розсіяний склероз (рис.14А) і sIgA молозива клінічно здорових породіль (рис.14Б).
Встановлено, що IgG - і sIgA-антитіла ефективно розщеплюють гістон Н1 (доріжки 2) і не гідролізують лізоцим курячого яйця (доріжки 6). У той же час препарати IgG і sIgA відрізнялися між собою за здатністю гідролізувати корові гістони тимусу теляти. Із рис.14А видно, що у присутності IgG сироватки крові хворого на розсіяний склероз відбувається суттєве зменшення кількості деяких гістонів із паралельним зростанням вмісту низькомолекулярних продуктів їхнього гідролізу (доріжка 4). Присутність sIgA молозива у реакційному середовищі не впливала на рівень цих гістонів (рис.14. Б, доріжка 4), хоча певний приріст кількості низькомолекулярних поліпептидів на електрофоретичній доріжіці 4 вказує на те, що деякі із корових гістонів також можуть руйнуватися цими антитілами.
Щоб переконатися, що протеолітична активність препаратів імуноглобулінів дійсно належить АТ, а не домішкам ензимів, які можуть знаходитися у комплексі із АТ, каталітично активні препарати IgG сироватки крові хворих на розсіяний склероз і sIgA молозива породіль піддавали гель-фільтрації за умов дисоціації імунних комплексів (рН-шок-аналізу) (рис.15а). Виявлено, що гістон Н1-гідролізуюча активність хроматографічних фракцій каталітично активних препаратів IgG (рис.15А) і sIgA (рис.15Б) відповідає фракціям, які містять поліпептиди цих імуноглобулінів. Відсутність протеолітичної активності в інших хроматографічних фракціях свідчить про те, що гідроліз гістону Н1 відбувається саме за участю IgG і sIgA, а не під дією домішків протеаз сироватки крові чи молозива породіль у препаратах цих імуноглобулінів.
Присутність значного рівня антигістонових-АТ, виявлених нами у препаратах Ig молозива породіль і сироватки крові хворих на розсіяний склероз (рис.5), дозволяє припустити, що саме цим антитілам властива протеолітична активність щодо гістону Н1.
Для перевірки цієї гіпотези із каталітично активних препаратів IgG і sIgA хроматографією на гістон Н1-сефарозі виділили антигістонові антитіла (рис.16А) і проаналізували їхню протеолітичну активність. Електрофоретичний аналіз хроматографічних фракцій (рис.16Б) показав, що у складі препаратів IgG і sIgA присутні антитіла зі спорідненістю до гістону Н1 (антигістонові-АТ), які володіють гідролізуючою активністю щодо цього білка (рис.16В).
Отже, нами вперше встановлено, що у сироватці крові хворих на розсіяний склероз і в молозиві клінічно здорових породіль містяться абзими, здатні гідролізувати гістон Н1. Показано, що IgG - і sIgA-абзими різняться між собою за чутливістю до дії інгібіторів відомих протеаз.
Вплив антигістонових АТ на ріст і виживання клітин in vitro. Оскільки анти-гістон Н1 антитіла, очищені із сироватки крові хворих на розсіяний склероз та із молока людини за антигенною специфічністю можна віднести до ауто-АТ, важливо було визначити їхній вплив на ріст і виживання клітин in vitro. Мішенями тут слугували Т-клітини лінії Jurkat. Встановлено, що анти-гістонові sIgA-антитіла молозива породіль і анти-гістонові IgG-антитіла сироватки крові хворих на розсіяний склероз відрізняються між собою за дією щодо цих клітин. Із рис.17 видно, що дія анти-гістонових sIgA-антитіл упродовж 72 год суттєво не вливає на ріст Т-клітин лінії Jurkat. У той же час, під впливом антигістонових IgG-антитіл спостерігався помітний приріст кількості цих клітин.
|
Отримані нами дані вказують на те, що анти-гістонові IgG-антитіла сироватки крові хворих на розсіяний склероз можуть володіти промітогенною активністю щодо Т-клітин лінії Jurkat. Тому було припущено, що відмінність у дії антигістонових АТ сироватки крові хворих на розсіяний склероз та антигістонових АТ молозива породіль на Т-клітини лінії Jurkat може бути пов’язана із їхньою здатністю до інтерналізації. Підставою для цього припущення слугували дані про те, що IgG-антитіла, специфічні до деяких ядерних антигенів, можуть не лише проникати у клітини ссавців, але й транспортуватися в ядро цих клітин (Ma et al., 1993; Avrameas et al., 1998).
Щоб перевірити цю гіпотезу, анти-гістонові-АТ обох ізотипів інкубували із Т-клітинами лінії Jurkat і визначали їхню субклітинну локалізацію за допомогою анти-IgG і анти-IgA антитіл, кон’югованих із пероксидазою хрону. Результати мікроскопії фіксованих препаратів клітин показали (рис.18), що після 2-годинної інкубації значна кількість анти-гістонових IgG сироватки крові хворих на розсіяний склероз потрапляє у цитоплазму клітин-мішеней
У той же час, присутність анти-гістонових sIgA-антитіл у клітинах була незначною. Здатність анти-гістонових IgG-антитіл інтерналізуватися у клітини ссавців було також підтверджено при використанні трансформованих фібробластів лінії L929 (рис. 19).
Отримані результати свідчать про те, що на відміну від анти-гістонових sIgA-антитіл молозива породіль, антигістонові IgG–антитіла сироватки крові хворих на розсіяний склероз можуть інтерналізуватися клітинами ссавців.
Зв'язок між стимулюючим ефектом анти-гістонових IgG на ріст лейкемічних лімфоцитів людини лінії Jurkat in vitro, їхньою протеолітичною активністю щодо гістону Н1 та здатністю до інтерналізації цих АТ дозволяє запропонувати гіпотезу про механізм активації проліферації клітин під дією цих антитіл. В основі цього механізму може лежати деконденсація хроматину, викликана гідролізом лінкерного гістону Н1 під впливом IgG-абзимів, які за певного функціонального стану клітин-мішеней можуть проникати в їхнє ядро.
Характеристика фосфотрансферазної активності АТ молозива породіль і сироватки крові хворих на СЧВ. Фосфорилювання білків і ліпідів є ключовими реакціями, задіяними у регуляції життєдіяльності клітин. Раніше нами було встановлено, що sIgA молока жінок володіють спорідненістю до АТР і казеїнкіназною активністю (Kit et al., 1995). У наступних дослідженнях ми показали, що sIgA молока жінок також можуть володіти ліпідкіназною активністю. Ліпідкіназну активність антитіл було виявлено при аналізі продуктів фосфорилювання хроматографічних фракцій, отриманих гель-фільтрацією препаратів sIgA, очищених із молока жінок послідовними хроматографіями на протеїн А-агарозі і ДЕАЕ-фрактогелі (рис.7А).
Для дисоціації можливих імунних комплексів у препаратах sIgA гель-фільтрацію проводили у присутності 50 мМ NaOH (рис. 20А). Хроматографічний пік було розділено на 2 фракції і після нейтралізації рН було проаналізовано їхню протеїнкіназну активність. У sIgA–антитіл фракції 2 виявлено фосфорилювання секреторного компоненту (SC) і важких ланцюгів (Н) ![]() цих імуноглобулінів (рис. 20В, доріжка 2). На відміну від фракції 2, у sIgA фракції 1, при низькому рівні фосфорилювання поліпептидів імуноглобулінів, спостерігали також утворення низькомолекулярного 32P-міченого продукту (рис. 20В, доріжка 1), який не фарбувався Coomassie (рис. 20Б, доріжка 1).
цих імуноглобулінів (рис. 20В, доріжка 2). На відміну від фракції 2, у sIgA фракції 1, при низькому рівні фосфорилювання поліпептидів імуноглобулінів, спостерігали також утворення низькомолекулярного 32P-міченого продукту (рис. 20В, доріжка 1), який не фарбувався Coomassie (рис. 20Б, доріжка 1).
На підставі даних було зроблено припущення, що виявлені нами фосфорильовані продукти належать до фосфоліпідів. Це припущення було підтверджене після екстракції цих продуктів розчином хлороформ-метанол (2: 1) і їхнім розділенням ТШХ у буферній системі, яку використовують для аналізу фосфоліпідів (рис. 20Г). Отже, sIgA-антитіла молока породіль можуть володіти як протеїнкіназною, так і ліпідкіназною активністю. При цьому ліпіди знаходяться у комплексі із імуноглобулінами і не дисоціюють при високих значеннях рН. На основі комбінованого аналізу цих сполук із застосуванням методів ензиматичної та хімічної деградації було зроблено висновок (Gorbunov et al., 2000, 2005), що субстратами каталізу sIgA-абзимів молока є 2 гліколіпіди, до складу яких входить один залишок сіалової кислоти та 4–5 залишків жирних кислот.
Результати наших досліджень показали, що ліпідкіназна активність властива також IgG-антитілам сироватки крові хворих на СЧВ (рис.21).
При електрофоретичному аналізі продуктів фосфорилювання препаратів IgG, очищених із сироватки крові хворих на СЧВ хроматографією на протеїн А-сефарозі (рис.21Б, доріжка 1), як і у випадку sIgA-антитіл молока людини, спостерігали утворення низькомолекулярних 32Р-мічених сполук небілкової природи (рис.21В, доріжка 1), які також екстрагувалися із реакційного середовища розчином хлороформ-метанол (2: 1) і розділялися ТШХ на три фракції (рис.21Г, доріжка 1). Радіоактивно мічені продукти ліпідної природи було також виявлено при фосфорилюванні препаратів IgG (рис.21Г, доріжка 2), очищених на колонці із АТР-сефарозою (рис.21А). При цьому фосфорилювання ліпідів не спостерігалося у випадку, коли із [g-32P] ATP інкубували IgG, які не володіли спорідненістю до АТР (рис.21В, доріжка 2).
Отримані дані дозволяють припустити, що у сироватці крові хворих на СЧВ, подібно як у молоці людини, можуть бути присутні IgG-абзими, які володіють фосфотрансферазною активністю. Ми також припустили, що ліпіди можуть впливати на протеїнкіназну активність IgG-антитіл. Для перевірки цього припущення IgG піддавали гель-фільтрації у буферній системі, яка містила 5% діоксану (рис.22). При інкубації IgG, очищених у такий спосіб від ліпідів, із [g-32P] ATP було виявлено включення 32Р у важкі (Н) і легкі (L) ланцюги IgG. При цьому рівень фосфорилювання їхніх поліпептидів значно зростав у випадку, коли до реакційної суміші додавали 1 мкМ нерадіоактивного АТР.
Нами також проаналізовано, як впливає видалення ліпідів на рівень фосфорилювання АТ, очищених із молозива породіль і сироватки крові хворих на склеродермію. Встановлено, що руйнування комплексів ліпід-АТ гель-фільтрацією у присутності іонного розчинника діоксана стимулює фосфорилювання, не тільки IgG сироватки крові хворих на СЧВ, але й sIgA-антитіл молозива породіль і IgG-антитіл сироватки крові хворих на склеродермію. Очищені у такий спосіб від ліпідів препарати IgG здорових донорів не виявляли протеїнкіназної активності.
Отже у молоці клінічно здорових жінок і у сироватці крові хворих на СЧВ присутні абзими із фосфотрансферазною активністю. Характерною ознакою цих каталітично активних антитіл є їхня спорідненість до АТР і ліпідів. Висока спорідненість АТ до ліпідів дозволяє класифікувати виявлені абзими як антифосфоліпідні IgG. Підтвердженням цього можуть слугувати дані про те, що АТ із спорідненістю до фосфоліпідів можуть перехресно реагувати із АТР (Wasef et al., 1993; Chapman et al., 2005). Можна припустити, що за рахунок конкуренції цих сполук за антиген-зв’язувальні ділянки молекул АТ відбувається перенос макроергічного гамма-фосфату молекули АТР на акцепторні групи ліпідів, і, можливо, білків. Крім того, не виключено, що фосфотрансферазна активність властива деяким ізотипам імуноглобулінів сироватки крові. На це вказують дані про те, що афінно-очищені IgA сироватки крові клінічно здорових донорів можуть фосфорилювати казеїн у присутності [g-32P] ATP. Для виявлення ділянок АТ, які залучені у фосфотрансферазну реакцію, ми використали комп’ютерний аналіз рівня гомології первинних структур білків імуноглобулінової надродини і відомих протеїнкіназ. За допомогою цього підходу було встановлено, що Fc-фрагменти імуноглобулінів містять послідовності, гомологічні до деяких протеїнкіназ. Отримані результати слугували поштовхом для дослідження протеїнкіназної активності рецептора Т-гелперних клітин СD4.
Протеїнкіназна активність rsCD4. Рецептор СD4 – це глікопротеїн, який розташований на зовнішній поверхні плазматичної мембрани Т-гелперів, задіяний в активації внутрішньоклітинних процесів у цих клітинах, і, крім того, спільно із рецептором (TCR) /CD3 бере участь у різних міжклітинних взаємодіях [Gay et al., 1987; Doyle and Strominger, 1987]. За своєю будовою рецептор СD4 належить до надродини імуноглобулінових білків і тому деякі властивості цього білка можуть бути спільними з ознаками ауто-АТ та абзимів (рис.23А).
Спочатку нами було проведено пошук амінокислотних послідовностей СD4 із найвищим рівнем гомології щодо відомих протеїнкіназ. Для такого аналізу використано банк генів протеїнкіназ KinBase та програму порівняння Kinom Blast Server (www. kinase. com). Встановлено, що найвищим рівнем гомології до протеїнкіназ володіє послідовність довжиною 100 амінокислотних залишків, яка входить до структури двох імуноглобулінових доменів позаклітинної ділянки рецептора СD4. Отримані дані дозволили припустити, що позаклітинний фрагмент СD4 володіє протеїнкіназною активністю. Для перевірки цієї гіпотези було використано рекомбінантний розчинний рецептор rsCD4 (“Genentech”, США), послідовність якого гомологічна позаклітинному фрагменту СD4 (рис.23А). Аналіз протеїнкіназної активності rsCD4 показав (рис.23Б), що у присутності [g-32P] ATP відбувається фосфорилювання рецептора (доріжка 1). Фосфорилювання rsCD4 не відбувалося, коли білок попередньо прогрівали при 65 0С (доріжка 2) або коли до реакційної суміші додавали 3 мМ АТР (доріжка 3). Інкубація rsCD4 із [-32P] ATP також не призводила до його фосфорилювання (доріжка 4). Отримані дані вказують на те, що рецептор rsCD4 володіє протеїнкіназною активністю. Додатковим аргументом на користь цього можуть слугувати дані фосфорилювання казеїну коров’ячого молока у присутності rsCD4 та [g-32P] ATP (рис.23Б, доріжки 5, 6). Наступними дослідами було показано, що подібно до класичних протеїнкіназ, для фосфорилювання рецептора rsCD4 необхідною є наявність двовалентних катіонів. Їхній вплив на протеїнкіназну активність rsCD4 у порядку зростання виглядає наступним чином: Ca2+ > Zn2+> Mn2+> Ni2+> Mg2+ > Cu2+ >Co2+. Реакція фосфорилювання також інгібувалась діетилпірокарбонатом, що вказує на участь у каталізі залишків гістидину. Визначення амінокислотної специфічності фосфорилювання показало, що фосфорилювання казеїну за участю rsCD4 відбувається за залишками серину.
Встановлено, що інкубація rsCD4 із плазмою крові людини призводить до фосфорилювання двох білків із мол. масою 62 і 12 кДа. Це вказує на те, що у плазмі крові можуть бути присутні ендогенні субстрати протеїнкіназної активності цього рецептора.
Отже нами встановлено, що рекомбінантний аналог білка, який належить до надродини імуноглобулінів, а саме рецептора Т-гелперних клітин СD4 володіє протеїнкіназною активністю.
Біологічна роль протеїнкіназної активності рецептора СD4 залишається невідомою. Оскільки у протеїнкіназній активності задіяний позаклітинний фрагмент рецептора, за місцем локалізації ензиму в клітині СD4 можна віднести до ектопротеїнкіназ плазматичної мембрани лімфоїдних клітин. Очевидно, протеїнкіназна активність рецептора CD4 може бути направлена як на регуляцію біологічної активності Т-гелперних лімфоцитів, так і на регуляцію взаємодії білків плазми крові і лімфи із Т-лімфоцитами і лімфоїдними клітини, які також продукують цей рецептор. Той факт, що присутність АТР є необхідною умовою активації Т-лімфоцитів (Filippini et al., 1990; Redegelt et al., 1991), може також слугувати на користь цього припущення.
ВИСНОВКИ
У дисертаційній роботі вперше проведено комплексне дослідження з метою виявлення, очистки та функціональної характеристики аутологічних антитіл сироватки крові та молока людини у нормі та при деяких аутоімунних захворюваннях. Отримані дані свідчать про те, що у сироватці крові і молоці людини присутні аутологічні антитіла із антигенною специфічністю щодо клітин ссавців, здатні каталізувати деякі біохімічні реакції. Встановлено, що ці антитіла впливають на ріст і виживання клітин in vitro, причому деякі з них можуть зв’язуватися з клітинами та інтерналізуватися ними. У молозиві деяких клінічно здорових жінок-породіль присутні аутоантитіла, які за антигенною специфічністю, каталітичною активністю і за впливом на клітини ссавців подібні до аутоантитіл сироватки крові хворих на розсіяний склероз і системний червоний вовчак. Це робить їх привабливими для подальшого дослідження з огляду на можливість їхнього використання як діагностичних та прогностичних маркерів аутоімунних порушень у породіль.
1. Імуноглобуліни сироватки крові хворих на розсіяний склероз і молозива здорових жінок-породіль здатні індукувати апоптоз T-клітин лінії Jurkat або стимулювати проліферацію цих клітин in vitro. Значну цитотоксичну активність імуноглобулінів виявлено у 36% обстежених хворих на розсіяний склероз і 44% клінічно здорових породіль, тоді як промітогенну активність антитіл виявлено у 13,6% хворих на розсіяний склероз і 8% здорових породіль.
2. У молозиві 8% обстежених жінок-породіль встановлено підвищений рівень антитіл, які володіють спорідненістю до дволанцюгової ДНК (анти-ДНК АТ), а у 48% породіль, виявлено антитіла зі спорідненістю до гістонів ссавців (анти-гістонові АТ).
3. Розроблено комплексний підхід для виділення та аналізу антигенної специфічності та каталітичної активності аутологічних антитіл сироватки крові і молока людини. Він полягає у використанні афінної та іонообмінної хроматографії, а також гель-фільтрації за умов дисоціації імунних комплексів, і дозволяє отримати високоочищені препарати аутоантитіл певної каталітичної активності.
4. Анти-ДНК sIgA молока людини володіють рибонуклеазою активністю щодо рибосомної РНК, топоізомеразною та ендонуклеазною активністю щодо надспіралізованої і лінійної форм ДНК плазміди, а також протеїнкіназною активністю щодо власних поліпептидів і казеїну молока людини. АТР і dАТР інгібують нуклеазну активність цих sIgA-абзимів, а синтетичні дезоксирибоолігонуклеотиди стимулють протеїнкіназну активність цих антитіл.
5. Анти-ДНК sIgA молозива породіль із різною ефективністю індукують загибель імунокомпетентних клітин (лінії Namalwa, Jurkat і L1210), а також трансформованих фібробластів миші (лінія L929). За чутливістю до цитотоксичної дії цих антитіл, досліджувані лінії клітин розподіляються наступним чином: L929 > Jurkat > L1210 > Namalwa.
6. У молоці клінічно здорових жінок-породіль і сироватці крові хворих на системний червоний вовчак уперше виявлено антитіла класів sIgA і IgG, які володіють ліпідкіназною і протеїнкіназною активністю. Ліпіди співвиділяються з цими антитілами під час їхньої очистки на протеїн А-сефарозі, ДЕАЕ-фрактогелі, АТР-сефарозі і фосфорилюються у складі імунних комплексів у присутності [g-32P] ATP. Гель-фільтрація даних антитіл у буфері, який містить 5% діоксан, призводить до дисоціації імунних комплексів і стимуляції протеїнкіназної активності антитіл.
7. У молоці клінічно здорових жінок-породіль і у сироватці крові хворих на розсіяний склероз вперше виявлено анти-гістонові sIgA - і IgG-антитіла, які каталізують гідроліз гістону Н1. Анти-гістонові антитіла обох ізотипів гідролізують корові гістони із значно нижчою ефективністю, ніж лінкерний гістон Н1, і не гідролізують альбумін сироватки крові бика і лізоцим курячого яйця.
8. Анти-гістонові IgG-антитіла сироватки крові хворих на розсіяний склероз стимулюють проліферацію Т-лімфоцитів лінії Jurkat. Приріст кількості цих клітин порівняно з контролем складав 37% при дії 70 мкг/мл антитіл упродовж 72 год. У той же час, анти-гістонові sIgA-антитіла молозива породіль не впливають на проліферацію Т-клітин лінії Jurkat.
9. Анти-гістонові IgG сироватки крові хворих на розсіяний склероз зв’язуються з Т-клітинами ліній Jurkat і L929, які здатні їх інтерналізувати. Взаємодія цих аутоантитіл із Т-клітинами лінії Jurkat упродовж 2 год або з клітинами лінії L929 упродовж 6 і 24 год призводить до значного їх накопичення у цитоплазмі клітин-мішеней. За таких умов анти-гістонові sIgA-антитіл молозива жінок-породіль не інтерналізуються клітинами вказаних ліній.
ПЕРЕЛІК НАУКОВИХ ПРАЦЬ, ОПУБЛІКОВАНИХ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
1. Кит Ю.Я. Фосфорилирование рецептора rsCD4 в присутствии клеток и плазмы крови человека / Ю.Я. Кит, В.А. Якубов, В.А. Рихтер, В.В. Власов // Доклады Академии Наук. - 1995. - Т.340, № 3. - С.412-415. (Автором визначено завдання досліджень, проведено фосфорилювання rsCD4 за участю протеїнкіназ і підготовлено статтю до друку)
2. Kit Y. Y. Phosphorylation of different human milk proteins by human catalytic secretory immunoglobylin A / Y. Y. Kit, D. V. Semenov, G. A. Nevinsky // Biochem. Mol. Biol. Int. - 1996. - V.36, No 3. - P.521-527. (Автором проведено виділення й аналіз протеїнкіназної активності sIgA-абзимів).
3. Кит Ю.Я. В препаратах человеческого α-лактальбумина, индуцирующих апоптоз трансформированных клеток, присутствуют рибоолигонуклеотиды / Ю.Я. Кит, Е.В. Кулигина., И.В. Романникова, Д.В. Семенов, В.А. Рихтер, В.В. Власов // Доклады Академии Наук. - 1998. - Т.360, № 3. - С.406-408. (Автором визначено завдання досліджень, проведено аналіз досліджень і підготовлено статтю до друку).
4. Кит Ю.Я. Фосфорилирование липидов, прочно связанных с иммуноглобулином А, в препаратах антител из молока человека, обладающих протеинкиназной активностью / Ю.Я. Кит, М.В. Шипицин, Д.В. Семенов, В.А. Рихтер, Г.А. Невинский // Биохимия. - 1998. - Т.63, № 6. - С.852-858. (Автором визначено завдання досліджень, проведено аналіз ліпідкіназної активності sIgA молозива породіль).
5. Yakubov L. A. The extracellular domain of CD4 receptor possesses a protein kinase activity / L. A. Yakubov, Y. Y. Kit, V. A. Richter, A. Y. Andreeva, V. N. Karamyshev, C. A. Stein, V. V. Vlassov // FEBS Lett. - 1998. - V.431, No 1. - P.45-48. (Автором визначено завдання досліджень, проведено аналіз протеїнкіназної активності rsCD4).
6. Семенов Д.В. Иммуноглобулин G молока человека гидролизует нуклеотиды / Д.В. Семенов, Т.Г. Канышкова, Ю.Я. Кит, Д.Ю. Хлиманков, А.М. Акимжанов, Д.А. Горбунов, В.Н. Бунева, Г.А. Невинский // Биохимия. - 1998. - Т.63, № 8. - С.1097-1106. (За участю автора сплановано мету досліджень і проаналізовано отримані результати).
7. Nevinsky G. A. Secretory Immunoglobulin A from human milk catalyzes milk protein рhosphorylation / G. A. Nevinsky, Y. Ya. Kit, D. V. Semenov, D. Y. Khlimankov, V. N. Buneva // Appl. Biochem. Biotechnol. - 1998. - V.75, No 1. - P.77-91. (За участю автора сплановано завдання досліджень, проведено аналіз субстратної специфічності протеїнкіназної активності sIgA-абзимів).
8. Кит Ю.Я. Секреторные иммуноглобулины А молока человека обладают сродством к олигонуклеотидам и нуклеиновым кислотам / Ю.Я. Кит, Д.В. Семенов, Т.Г. Канышкова, Е.В. Кулигина, И.В. Романникова, О.В. Морозова, В.А. Рихтер // Биохимия. - 1999. - Т.64, № 1. - С.52-59. (Автором сформульовано завдання досліджень, проведено виділення АТ, підготовлено статтю до друку).
9. Кит Ю.Я. Эндогенные олигонуклеотиды молока человека и их возможная биологическая активность / Ю.Я. Кит, Е. В Кулигина, А.М. Онищенко, Л.В. Юрченко, И.В. Романникова, В.А. Рихтер, В.В. Власов // Биохимия. - 1999. - Т.64, № 8. - С.59-64. (Автором визначено завдання досліджень, проведено аналіз протеїнкіназної активності білків молозива породіль, підготовлено статтю до друку).
10. Кулигина Е.В. Олигонуклеотиды и олигонуклеотидсвязывающие белки спинномозговой жидкости человека / Е.В. Кулигина, А.Ю. Андреева, А.С. Могельницкий, Ю.Я. Кит, Л.А. Якубов, В.А. Рихтер, В.В. Власов // Доклады Академии Наук. - 1999. - Т.364, № 6. - С.832-834. (Автором розроблено схему виділення олігонуклеотидів із спинномозкової рідини людини, проведено аналіз олігонуклеотид-звязувальних білків, підготовлено статтю до друку).
11. Кит Ю.Я. Влияние нуклеиновых кислот и полисахаридов на фосфотрансферазную активность препаратов sIgA, выделенных из молока человека / Ю.Я. Кит, Д.В. Семенов, Е.В. Кулигина., В.А. Рихтер // Биохимия. - 2000. - Т.65, № 1. - С.59-64. (Автором визначено завдання досліджень, проаналізовано вплив чинникив на фосфотрансферазну активності sIgA молозива породіль, підготовлено статтю до друку).
12. Kit Y. Y. Human anti-DNA secretory immunglobulins A possess endonuclease activity and they are able to cause the destruction of nuclear chromatin in vitro / Y. Y. Kit, E. E. Mitrofanova, O. E. Shestova, E. V. Kuligina, I. V. Romannikova, V. A. Richter // Укр. біохім. журн. - 2000. - Т.72, № 3. - С.73-76. (Автором сформульовано завдання досліджень, очищені анти-ДНК sIgA і досліджено іх ДНКазну активність, підготовлено статтю до друку).
13. Gorbunov D. V. Phosphorylation of Minor Lipids of Human Milk Tightly Bound to Secretory Immunoglobulin A / D. V. Gorbunov, D. V. Semenov, M. V. Shipitsin, Yu. Yu. Kit, T. G. Kanyshkova, V. N. Buneva, G. A. Nevinsky // Rus. J. Immunol. - 2000. - V.5, No 3. - С.267-278. (За участю автора сформульована мета роботи і проведено аналіз результатів досліджень).
14. Kit Y. Oligodeoxyadenylate stimulates the protein kinase activity of anti-DNA sIgA from human milk / Y. Kit, E. Kuligina, D. Semenov, V. Richter // Acta Biochim. Pol. - 2002. - V.5, No 1. - С.291-294. (Автором сформульована мета роботи, проведено дослідження впливу олігонуклеотидів на протеїнкіназну активність sIgA-абзимів, підготовлено статтю до друку).
15. Філяк Є.З. Дослідження впливу оксиду азоту на нуклеазну активність імуноглобулінів крові здорових людей / Є.З. Філяк, В.М. Коробов, Ю.Я. Кіт // Біологія тварин. - 2002. - Т.4, № 1-2. - С.157-162. (Автором визначено завдання досліджень, проаналізовано отримані дані і підготовлено статтю до друку).
16. Кит Ю.Я. Фосфотрансферазная активность препаратов IgG из сыворотки крови больных системной красной волчанкой / Ю.Я. Кит, В.А. Ковалева, В.А. Рихтер // Біополімери і клітина. - 2003. - Т. 19, № 2. - С.185-189. (Автором отримані IgG із спорідненістю до АТР і досліджено іх фосфотрансферазну активність, підготовлено статю до друку).
17. Кит Ю.Я. Взаимодействие олигонуклеотидов и АТР с препаратами sIgA, обладающими протеинкиназной активностью / Ю.Я. Кит, В.А. Якубов, Е.В. Кулигина, В.А. Рихтер // Укр. біохім. журн. - 2003. - Т.75, № 2. - С.63-66. (Автором отримано препарати sIgA і досліджена їх спорідненість до олігонуклеотидів і АТР, підготовлена стаття до друку).
18. Кіт Ю.Я. Метод визначення протеїнкіназної активності в поліакриламідному гелі з використанням системи двомірного розділення білків / Ю.Я. Кіт, В.А. Ковальова, Я.П. Бобак, Л.Б. Дробот // Укр. біохім. журн. - 2002. - Т.74, № 4. - С.129-132. (Автором розроблено метод визначення протеїнкіназної активності білків у сиворотці крові і лізатах клітин після їхнього розділення ізоелектричним фокусуванням, підготовлено статтю до друку).
19. Кит Ю.Я. Протеинкиназная активность иммуноглобулинов плазмы крови человека / Ю.Я. Кит, А.А. Ким, Н.Р. Гут, В.А. Рихтер // Укр. біохім. журн. - 2005. - Т.77, № 3. - С.49-55. (Автором досліджено протеїнкіназну активність різних ізотипів імуноглобулінів сироватки крові людини).
20. Кіт Ю.Я. Виділення з молока людини секреторних імуноглобулінів класу А з різною спорідненістю до ДНК та дослідження їх ДНК-гідролізуючої активності / Ю.Я. Кiт, Р.С. Стойка // Імунологія та алергологія. - 2005. - № 1. - С.53-55. (Автором сплановано завдання досліджень, проведено аналіз спорідненості sIgA молозива породіль до ДНК і полісахаридів, підготовлено статтю до друку).
21. Kit Yu. Ya. Comparative analysis of the similarity between primary sequenses of receptor CD4 and protein kinases / Yu. Ya. Kit // Ukrainica Bioorganica Acta. - 2005. - No 1. - P. 20-24. (Автором проведено аналіз рівня гомології між амінокислотними послідовностями рецептора CD4 і протеїнкіназ).
22. Старикович М.А., Цитотоксическая активность иммуноглобулинов плазмы крови клинически здоровых людей и больных рассеянным склерозом / М.А. Старикович, Ю.Я. Кит, М.Я. Хавунка, Т.И. Негрич, Р.С. Стойка // Цитокины и воспаление. - 2006. - Т.5, № 4. - С.26-31. (За участю автора сплановано завдання дослідження, проведена очистка антитіл, підготовлено статтю до друку).
23. Кіт Ю.Я. Каталітично активні антитіла (абзими) молока людини / Ю.Я. Кіт, Р.С. Стойка // Укр. біохім. журн. - 2007. - Т.79, № 2. - С.5-16. (Автором проведено збір та аналіз літератури, підготовлено статтю до друку).
24. Kit Yu. Ya. Secretory IgAs from human milk with affinity to mammalian DNA are capable of hydrolyzing ribosomal RNA / Yu. Ya. Kit, E. V. Kuligina, V. A. Richter. Укр. біохім. журн. - 2007. - Т.79, № 3. - С.8-13. (Автором проведено дослідження впливу нуклеотидів на нуклеазну активність анти-ДНК sIgA).
25. Козак М.Р. Зниження життєздатності клітин селезінки та цитотоксичної активності імуноглобулінів сироватки крові мишей за умов тривалого згодовування їм мозку великої рогатої худоби / М.Р. Козак, Д.Д. Остапів, Ю.Я. Кіт, В.В. Влізло, Р.С. Стойка // Експ. клін. фізіол. і біохім. - 2007. - № 1. - С.11-15. (За участю автора визначено мету дослідження, проаналізовано отримані результати).
26. Козак М.Р. Індукція апоптозу та некрозу лейкемічних клітин очищеними препаратами IgG сироватки крові мишей, яким тривалий час згодовували мозок великої рогатої худоби / М.Р. Козак, В.В. Влізло, Ю.Я. Кіт, Р.С. Стойка // Біополімери і клітина. - 2008. - Т.24, № 1. - С.1-5. (За участю автора встановлено завдання досліджень, проаналізовано отримані дані, підготовлено статтю до друку).
27. Kit Yu. Oligodeoxynucleotides stimulate protein kinase activivity of the anti-DNA sIgA from human milk / Kit Yu., D. Semenov, E. Kuligina, V. Richter // Mechanisms of cellular signal transduction and communication: 3rd Parnas Conf., October 14 – 18, 2000.: Abstract Book. - Lviv, 2000. - P.101.
28. Kuligina E. Oligonucleotides and oligonucletotide-binding proteins of human extracellular fluids / E. Kuligina, Y. Kit, I. Romannikova, D. Semenov, V Richter // RNA as Terapeutic and Genomic Target: Internat. Conf., 30th August – 2nd September 2001.: Abstract Book. - Nоvosibirsk, 2001. - P.17.
29. Kit Yu. Study of phosphotranspherase activity of IgG fraction possessing affinity to ATP from blood serum of humans with lupus erytromatosis / Yu. Kit, V. Kovaleva, L. Drobot // Frontiers in autoimmunity: fundamental aspects and clinical perspectives: Internat. Conf., September 8 – 18, 2002.: Abstract Book. - Keszthly, (Hungary), 2002. - P.39.
30. Kit Yu. Ya. Comparattive analysis of primary sequence similarity between receptor CD4 and protein kinases / Yu. Ya. Kit // Установчий з’їзд Українського товариства клітинної біології, 25-28 квіт. 2004 р.: тези доп. - Львів, 2004. - C.34.
31. Kit Yu. Ya. ATP inhibits endonuclease activity of anti-DNA sIgA from human milk / Yu. Ya. Kit, M. O. Starykovych, V. A. Richter, R. S. Stoika // Molecular mechanisms of cellular signaling: 5th Parnas Conf., April 26-29 2005.: Український біохімічний журнал. - 2005. - T.77, № 2 (спец. вип) - С.186-187.
32. Starykovych M. O. Cytotoxic activity of immunoglobulins isolated from blood serum of multiple sclerosis / M. O. Starykovych, M. A. Khavunka, T.I. Nehrych, Yu. Ya. Kit, R. S. Stoika // Molecular mechanisms of cellular signaling: 5th Parnas Conf., April 26-29 2005.: Український біохімічний журнал. - 2005. - T.77, № 2 (спец. вип) - C.238-239.
33. Кіт Ю.Я. Каталітично активні антитіла (абзими) молока людини і деякі механізми регуляції їх активності / Ю.Я. Кіт, Р. С Стойка // IX Український біохімічний з'їзд, 24-27 жовт. 2006 р.: тези доп. - Х., 2006 - Т.1. - С. 20.
34. Кіт Ю.Я. Цитотоксична активність sIgA-абзимів молока людини / Ю.Я. Кіт, М.О. Старикович // IX Український біохімічний з'їзд, 24-27 жовт. 2006 р.: тези доп. - Х., 2006 - Т.1. - С.45.
35. Kit Yu. Ya. Colostrum antibodies as potential markers of autoimmune disoders in parturient women / Yu. Ya. Kit, M. O. Starykovych, R. O. Bilyy, N. R. Skorohyd, V. A. Richter,. L. B. Yanyv, R. S. Stoika // Basic Science for Medicine: 3rd Internat. Conf., September 2 – 8, 2007. - Novosibirsk, 2007. - С.129.
36. Кіт Ю.Я. Функціональна активність автологічних антитіл в нормі та при деяких автоімунних захворюваннях / Ю.Я. Кіт // ІІ з’їзд Українського товариства клітинної біології, 23 – 26 жовт. 2007 р.: тези доп. - К., 2007. - С. 196.
37. Старикович М.О. // Антигенна специфічність і каталітично активність антитіл молозива породіль та їх вплив на ріст і виживання лейкемічних клітин in vitro / М.О. Старикович, Ю.Я. Кіт, Р.О. Білий, Н.Р. Скорохід, Л.Б. Гнатюк, Р.С. Стойка // ІІ з’їзд Українського товариства клітинної біології, 23 – 26 жовт. 2007 р.: тези доп. - К., 2007. - С. 208.
38. Недовіз В. Імуноглобуліни сироватки крові хворих на множинну мієлому здатні гідролізувати гістон Н1 / В. Недовіз, Ю. Кіт, Н.Р. Гут, О. Шалай, В. Логінський, Р. Стойка // ІІ з’їзд Українського товариства клітинної біології, 23 – 26 жовт. 2007 р.: тези доп. - К., 2007. - С.277.
АНОТАЦІЯ
Кіт Ю.Я. Антитіла молока і сироватки крові людини: характеристика каталітичної активності та вплив на ріст і виживання клітин. - Рукопис.
Дисертація на здобуття наукового ступеня доктора біологічних наук за спеціальністю 03.00.11 – цитологія, клітинна біологія, гістологія. – Інститут біології клітина НАН України, Львів, 2008.
Дисертація присвячена вивченню антигенної специфічності і каталітичної активності антитіл сироватки крові і молозива людини в нормі та за деяких аутоімунних захворювань, а також встановленню впливу антитіл на ріст і виживання клітин ссавців.
Встановлено, що препарати імуноглобулінів сироватки крові частини хворих на розсіяний склероз і молозива здорових жінок-породіль можуть індукувати апоптоз або стимулювати проліферацію різних клітин-мішеней in vitro.
Функціональна активність антитіл щодо клітин може бути зумовлена їхньою антигенною специфічністю і каталітичною активністю.
Із молозива породіль очищено анти-ДНК sIgA, які володіють топоізомеразною, ендонуклеазною, РНКазною і протеїнкіназною активністю. При цьому АТР, dATP інгібують нуклеазну активність анти-ДНК sIgA, а олигодезоксирибонуклеотиди стимулюють протеїнкіназну активність цих антитіл. Анти-ДНК sIgA молозива породіль із різною ефективністю індукують загибель клітин ліній Namalwa, Jurkat, L1210 і L929.
У молоці клінічно здорових жінок-породіль і у сироватці крові хворих на розсіяний склероз виявлено антигістонові sIgA - і IgG-антитіла, які каталізують гідроліз лінкерного гістону Н1. Антигістонові IgG сироватки крові хворих на розсіяний склероз можуть інтерналізуватися у клітини ліній Jurkat і L929, а також стимулювати проліферацію Т-лімфоцитів лінії Jurkat.
У молоці клінічно здорових жінок-породіль і сироватці крові хворих на системний червоний вовчак виявлено sIgA - і IgG-антитіла, які володіють ліпідкіназною і протеїнкіназною активністю. Ліпіди співвиділяються із антитілами під час їх очистки, і фосфорилюются у складі імунних комплексів у присутності [g-32P] ATP. Гель-фільтрація у буфері, який містить 5% діоксан, призводить до дисоціації комплексів ліпідів із антитілами і стимуляції протеїнкіназної активності імуноглобулінів.
Ключові слова: антитіла, каталітична активність, цитотоксичність, проліферація, молозиво, сироватка крові, розсіяний склероз.
АННОТАЦИЯ
Кит Ю.Я. Антитела молока и сыворотки крови человека: характеристика каталитической активности и влияние на рост и выживание клеток. – Рукопись.
Диссертация на соискание ученой степени доктора биологических наук по специальности 03.00.11 – цитология, клеточная биология, гистология. – Інститут биологии клетки НАН Украины, Львов, 2008.
Диссертация посвящена исследованию антигенной специфичности, каталитической активности антител сыворотки крови и молозива человека в норме и при некоторых аутоимунных заболеваниях, а также изучению влияния антител на рост и выживание клеток млекопитающих.
Установлено, что препараты иммуноглобулинов сыворотки крови некоторых больных рассеяным склерозом и молозива здоровых рожениц могут индуцировать гибель или стимулировать пролиферацию различных клеток-мишеней in vitro. Анализом нуклеосомной фрагментации ядерной ДНК и ДНК-комет индивидуальных клеток показано, что гибель клеток под действием иммуноглобулинов происходит путем апоптоза. Функциональная активность препаратов иммуноглобулинов относительно клеток млекопитающих могла быть следствием действия аутоантител определеной антигенной специфичности и каталитической активности. Иммуноферментным анализом установлено, что препараты антител двух из 25-ти обследованных рожениц содержат повышенный уровень анти-ДНК антител, а у 12-ти рожениц обнаружено повышенный уровень антигистоновых антител.
Используя афинную и ионообменную хроматографии, из сыворотки крови и молока человека очищены аутоантитела разных изотипов и проведен анализ их каталитической активности, а также влияния на рост и выживание клеток in vitro.
Установлено, что анти-ДНК sIgA молозива обладают РНКазной, ДНКазной и протеинкиназной активностью. АТР и dАТР ингибируют нуклеазную активность sIgA-абзимов, а дезоксирибоолигонуклеотиды стимулируют протеинкиназную активность этих антител.
Обнаружено, что анти-ДНК sIgA с разной эффективностью индуцируют гибель иммунокомпетентных клеток линий Namalwa, Jurkat и L1210 и фибробластов мыши линии L929.
На основании полученных результатов и анализа литературных данных предложена модель участия sIgA-абзимов во внутриклеточной нейтрализации вирусов в инфицированных эпителиоцитах слизистых оболочек.
Из молока клинически здоровых рожениц и из сыворотки крови больных рассеянным склерозом очищены антигистоновые sIgA - и IgG-антитела, обладающие способностью гидролизовать линкерный гистон Н1. Антигистоновые АТ обоих изотипов с более низкой эффективностью, чем гистон Н1, гидролизовали коровые гистоны, но были неактивны по отношению к лизоциму куриного яйца и сывороточного альбумина быка.
Установлено, что анти-гистоновые IgG сыворотки крови больных рассеянным склерозом могут стимулировать пролиферацию Т-клеток линии Jurkat. Прирост количества клеток составлял 37% при действии 70 мкг/мл антител на протяжении 72 ч. В то же время, анти-гистоновые sIgA молозива не влияли на пролиферацию Т-клеток линии Jurkat.
Обнаружено, что анти-гистоновые IgG сыворотки крови больных рассеянным склерозом могут проникать в клетки линий Jurkat и L929. Инкубация антител в течении 2 ч с клетками линии Jurkat и в течении 6 и 24 ч с клетками линии L929 приводила к значительному их накапливанию в цитоплазме клеток-мишеней. При таких же условиях инкубации не обнаружено интернализации анти-гистоновых sIgA-антител в клетки-мишени.
На основании полученных результатов предложен механизм промитогенной активности анти-гистоновых IgG-антител.
Из молока рожениц и сыворотки крови больных системной красной волчанкой очищены sIgA - и IgG-антитела со сродством к АТР-сефарозе, обладающих липидкиназной и протеинкиназной активностью. Субстраты липидкиназной активности выделяются совместно с антителами в процессе их очистки на протеин А-сефарозе, ДЕАЕ-фрактогеле, АТР-сефарозе и фосфорилируются в составе комплексов в присутствии [g-32P] ATP. Наличие 32Р-меченных липидов в препаратах антител подтверджено хлороформ-метанольной экстракцией и ТСХ. Гель-фильтрация в присутствии 5% диоксана приводит к дисоциации комплексов липидов с антителами и стимуляции фосфорилирования их полипептидов.
Установлено, что протеинкиназной активностью помимо иммуноглобулинов может обладать также другой белок этого семейства - рецептор Т-хелперных клеток CD4. Инкубация рекомбинантного рецептора rsCD4 («Genintech», США) с [g-32P] ATP в присутствии ионов Са2+ приводит к его фосфорилированию. В присутствии ионов Mg2+ rsCD4 обладает способностью к фосфорилированию казеина коровьего молока и некоторых белков плазмы крови человека.
Ключевые слова: антитела, каталитическая активность, цитотоксичность, пролиферация, молозиво, сыворотка крови, рассеянный склероз.
SUMMARY
Kit Yu. Ya. Antibodies of human milk and serum: characteristics of catalytic activity and action towards cell growth and survival. – Manuscript.
Thesis for the Doctor of Biological Sciences scientific degree in biology, speciality 03.00.11 – cytology, cell biology, histology. – Institute of Cell Biology of NAS of Ukraine, Lviv, 79005.
The Doctoral thesis is focused on the study of antigen specificity and catalytic activity of human serum and milk antibodies in healthy people and during some autoimmune pathologies, and also towards estimation of the antibodies’ influence on growth and survival of the mammalian cells.
It has been shown that different preparations of immunoglobulins, obtained from collostrum of healthy woman and blood serum of some patients with multiple sclerosis can induce cells death in vitro or, in contrary, stimulate proliferation of the studied target cells. Functional activity of antibodies against cells could be linked with their antigen specificity and catalytic activity.
Anti-DNA sIgA, isolated from human colostrum possesses topoisomerase, ribonuclease, endonuclease and proteinkinase activities. ATP and dATP inhibit nuclease activities of anti-DNA sIgA, while oligodeoxinucleotides stimulate their activity. Anti-DNA sIgA isolated from human colostrum possessed different extent of cytotoxic activity towards Namalwa, Jurkat, L1210 and L929 cell lines.
We found anti-histone sIgA - and IgG-antibodies capable of catalyzing hydrolysis of linker histone H1 in the colostrums of healthy woman and blood serum of some patients with multiple sclerosis. Anti-histone IgG from blood serum of patients with multiple sclerosis were able to internalize into Jurkat and L929 cells and also to stimulate proliferation of Jurkat human T-cell line.
We also detected sIgA - and IgG-antibodies possessing lipid kinase and protein kinase activity in the collostrum of healthy woman and blood serum of some patients with system lupus erythrematosis. Lipids were co-purified with antibodies during their purification and were phosphorylated in those complexes in the presence of [g-32P] ATP. Gel-filtration in dioxan containing buffer (5%) lead to dissociation of lipid-antibodies complexes and stimulation of protein kinase activity of immunoglobulins.
Keywords: antibodies, catalytic activity, cytotoxicity, proliferation, colostrum, blood serum, multiple sclerosis.
Похожие работы
... і декстрин. Температурний оптимум росту 30°С, оптимум рН 7 –9,5 Виробничий штам повинен володіти антагоністичною активністю по відношеню до патогенних та УПМ, які використовуються при контролі пробіотиків. 3.2 Дослідження антагоністичної активності пробіотичних штамів по відношенню до стандартних тест-штамів та клінічних ізолятів Пробіотики відіграють позитивну роль у підвищенні загальної ...
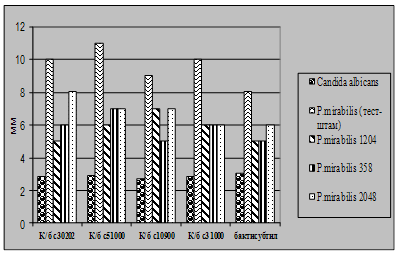
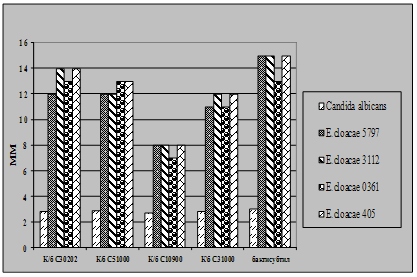
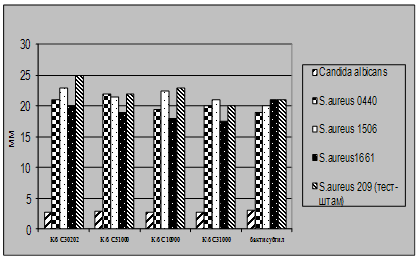
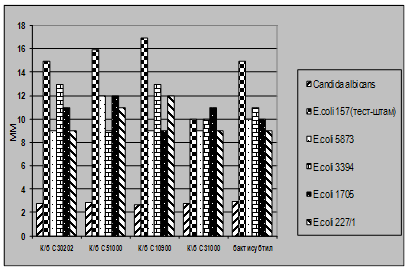
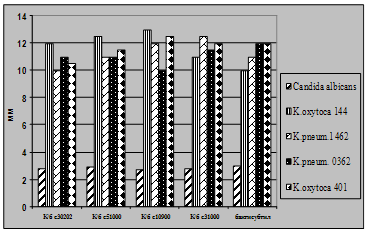
0 комментариев