Ассоциация между человеческими лейкоцитарными антигенами (HLA) и туберкулезом
Резюме
Легочный туберкулез развивается как сложная комбинация между экологическими факторами и генетической восприимчивостью. В данном исследовании ассоциация между человеческими лейкоцитарными антигенами (HLA) и туберкулезом была изучена в нескольких популяциях, но результаты оказались противоречивыми.
Предполагаемая оценка II класса HLA проводилась методом полимеразной цепной реакции (ПЦР) с помощью набора специфических праймеров и олигонуклеотидов в мексиканской популяции.
Исследование проводилось Клинической службой Туберкулеза и Отделом иммунологии, Национальном институте респираторных болезней, Мексика.
В качестве обследуемых были четыре группы пациентов: 95 здоровых; 50 неиммуносупрессированных пациентов с туберкулезом легких; 15 ВИЧ-инфицированных пациентов с туберкулезом; 37 ВИЧ-инфицированных пациентов в асимптотической стадии.
В результате исследования были получены данные: частоты аллелей DQA1*101, DQB1*501, DRB1*1501 были значительно увеличены у неиммунодепрессированных пациентов с туберкулезом легких по сравнению со здоровыми пациентами. В отличие от этого, частоты аллелей DQB1*402, DRB1*4 и DRB1*8 были значительно уменьшены у пациентов с туберкулезом. Также, значительное увеличение частоты аллеля DRB1*1101 было обнаружено у ВИЧ-положительных пациентов.
Генетическое влияние, связанное с системой HLA играет важную роль в развитии туберкулеза легких. Хотя эта восприимчивость, возможно, не играет у роли у пациентов, с серьезными нарушениями иммунной системы (такими, как ВИЧ-инфекция).
Введение
Туберкулез остается одной из важнейших мировых проблем. По приблизительным оценкам примерно треть населения заражена Mycobacterium tuberculosis. Около 8 миллионов случаев активного туберкулеза и 2,9 миллионов смертей регистрируется каждый год.
Болезнь приблизилась к эпидемическим пропорциям с ухудшением окружающей среды, социоэкономических условий, таких как перенаселение, неправильное питание и расположение сточных вод. Также, в последнее время эпидемическая картина ассоциирована с ВИЧ.
Однако, исследования, выполненные на людях и лабораторных животных, доказывают, что в дополнение к окружающей среде генетическая предрасположенность может играть роль в прогрессировании заболевания. Недавно открыто, что изменения генетической информации для ассоциированного с врожденным иммунитетом протеина I макрофага связаны с восприимчивостью к туберкулезу у жителей Западной Африки.
Главный комплекс гистосовместимости человека играет важную роль в формировании иммунного ответа. Возможная ассоциация между антигенами HLA и туберкулезом исследована на многих популяциях, но результаты оказались противоречивыми. Несоответствия могут быть связаны с методологическими проблемами, потому что исследования были сделаны главным образом серологическими методами, которые могут давать перекрестные реакции и иметь низкую специфичность. Кроме того, серологические методы дают ошибочные значения HLA класса II более чем в 25% случаев по сравнению с более точным методом ДНК-типирования. Также восприимчивость к туберкулезу находится под многофакторным генетическим контролем, включающим и контроль за системой HLA.
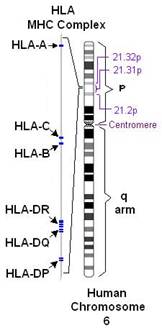
HLA регион находится на коротком плече шестой хромосомы и делится на три региона: HLA класса I, кодирующий HLA-A, -B, -C антигены; HLA класса II, кодирующий HLA-DR, DQ и DP антигены; HLA класса III, кодирующий второй и четвертый компоненты комплемента С2 и С4, фактор B, туморонекротический фактор α и β, белок теплового шока 70 и 21-гидроксилазу. Гены классов I и II кодируют поверхностные клеточные гликопротеины, функция которых презентовать антигенные пептиды для CD8+ CD4+ клеток, играющих фундаментальную роль в гомеостазе.
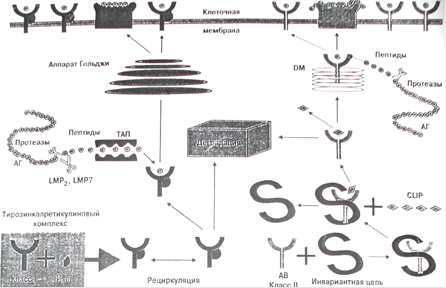
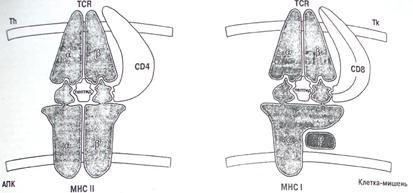
Система HLA – самая полиморфная биологическая система, и популяционные различия представлены частотами специфических аллелей и подтипов, а также их комбинацией. HLA-система рестриктирует Т-клетки и тесно связана с генами иммунного ответа и супрессии. Ответ антиген-специфических Т-клеток связан с презентацией процессированного пептида в ассоциации с поверхностными гликопротеинами МНС класса I и II. В частности, белки, кодированные генами МНС класса II, функционируют как рестриктирующий элемент, который опосредует узнавание антигена регуляторными Т-клетками, и тесно связаны с иммунным распознаванием и ответом.
Цель данного исследования – сравнить частоту генов HLA класса II у взрослых с туберкулезом легких и здоровых людей метом полимеразной цепной реакции. Также были исследованы ВИЧ-положительные пациенты с туберкулезом или без него.
Материалы и методы. Исследование популяции
В исследование были включены пятьдесят случайно отобранных неиммунодепрессированных пациентов с туберкулезом легких. Пациенты, не связанные родственными связями, являлись коренными жителями Мехико, были госпитализированы в Национальный институт респираторных болезней во время исследования. Во всех случаях диагноз туберкулеза был поставлен на основе световой микроскопии, с помощью которой обнаруживалось присутствие кислотоустойчивых бацилл в мокроте, а также культуральным высевом M. tuberculosis.
Чтобы признать пациентов неиммунодепрессированными, они были оценены по следующим критериям: отсутствие ВИЧ-инфекции; нормальное количество лимфоцитов и Т-клеток в периферической крови; подтвержденный легочной туберкулез. Пациенты с диабетом, силикозом, циррозом печени или другими системными заболеваниями, а также пациенты, злоупотребляющие алкоголем, не были включены в исследование. Пациенты со СПИДом исследовались независимо.
В качестве контроля исследовались 95 не связанных родством здоровых пациентов, отобранные по этническим и социоэкономическим особенностям; 37 ВИЧ-инфицированных пациентов без туберкулеза и других инфекций (2-я стадия ВИЧ-инфекции по классификации Центра по контролю и предотвращению инфекций CDC). Дополнительно исследовались 15 ВИЧ-инфицированных пациентов с туберкулезом (4-я стадия ВИЧ-инфекции по CDC) и 20 здоровых не ВИЧ-инфицированных гомосексуальных пациентов. Диагноз ВИЧ ставился по методу ИФА и подтверждался с помощью метода иммуноблотинга. Пациенты и контроль родились в Мексике и имеют три поколения предков, коренных жителей Мексики. Исследование было одобрено Научным и Этическим комитетом, было получено согласие всех обследуемых.
Проект исследования
Геномная ДНК из цельной крови, содержащей этилендиаминтетраацетат была извлечена с помощью стандартных методик. ДНК амплификация и специфическая идентификация аллелей HLA-DQ осуществлялись с помощью метода ПЦР с набором специфических праймеров (Bio-Sinthesis; Dallas, TX). Идентификация HLA-DRB1 проводилась с помощью специфических последовательностей олигонуклеотидов методом обратной гибридизации dot blot (Amplicor kit; Hoffman La Roche; Базель, Швейцария). DR1, DR2, DR4, DRB1-DR52, DRB3 и DRB5 амплификация проводилась методом ПЦР с использованием Taq-полимеразы (Promega; Madison, WI). Праймеры, используемые для амплификации: DRBAMP-B для региона 3’ из экзона 2, и DRBAMP-1, DRBAMP-2, DRBAMP-3 DRBAMP-4, DRBAMP-5 и DRBAMP-52 для региона 5’ из экзона 2. Они были синтезированы на автоматическом синтезаторе (DNA-SM; Beckman; Пало-Альто, Калифорния).
Статистический анализ
После того, как были определены частоты фенотипов для каждых аллелей в исследуемой и контрольной популяциях, различия были установлены и подтверждены с помощью критерия χ2. Риск развития туберкулеза был проверен с помощью компьютерной программы (STATA и Windows 95; Microsoft; Редмонд, WA).
Результаты
Исследование включало 50 неиммунодепрессированных пациентов (средний возраст 39,1±13,0 лет). В контроль были включены 95 здоровых человек (35,4±10,1 лет); 37 ВИЧ-инфицированных пациентов, не зараженных туберкулезом и не имеющих новообразований; 15 иммунодепрессированных пациентов (ВИЧ-инфицированных) с туберкулезом (31,1±5,7 лет); 20 здоровых не ВИЧ-инфицированных гомосексуалистов (26,3±8,5 лет). Поздняя группа контроля не имела существенных отличий в фенотипе HLA с группой несвязанных здоровых людей.
С помощью метода ПЦР и гибридизации были показаны различия между частотами аллелей неиммунодепрессированных пациентов с активным туберкулезом и пациентами из других групп. Различия частот в каждой группе показаны в таблице 1. Среди 50 неиммунодепрессированных пациентов с туберкулезом было 30 пациентов с аллелем DQA1*0101, 22 с аллелем DQB1*0501 и 24 с аллелем DRB1*1501 (по сравнению с контрольной группой из 95 человек: 20, 12 и 9 человек соответственно).
ВИЧ-инфицированные пациенты показали высокие частоты аллеля DRB1*1101.
С другой стороны три аллеля ассоциированы с протекцией против туберкулеза: DQB1*0402, DRB1*4 и DRB1*8 (таблица 1).
Обсуждение результатов
Молекулярное типирование оказалось полезным для определения ассоциации между системой HLA и туберкулезом. Этот метод оказался более удобным, чем серологический. В данном исследовании метод ПЦР в сочетании со специфическими олигонуклеотидными пробами показали ассоциацию между генами DQA1*0101, DQB1*0501, DRB1*1501 и восприимчивостью к туберкулезу. Эти маркеры восприимчивости определялись независимо друг от друга, поэтому речь не идет о гаплотипе. Интересно, что ВИЧ-инфицированные пациенты с туберкулезом не имели данных генов. Предполагается, что приобретение серьезного иммунодепрессивного статуса предрасполагает к развитию туберкулеза, независимо от генетической составляющей. Однако размер этой группы был слишком мал, чтобы делать какие-либо заключения, и необходимы дальнейшие исследования больших групп ВИЧ-инфицированных пациентов с туберкулезом. Вдобавок частоты некоторых аллелей HLA DR и DQ локусов у здорового контроля были значительно увеличены по сравнению с частотами HLA у пациентов с туберкулезом, что можно связать с тем, что эти аллели могут вносить вклад в устойчивость к данному инфекционному заболеванию.
Недавние исследования пациентов с туберкулезом из Индии показали ассоциацию с геном HLA DRB1*2, но большая часть данных аллелей DRB1*1501 и DRB1*1502 была одновременно и у пациентов и у контроля. Распределение генов HLA DQ в данном исследовании изучено не было. Позднее была найдена ассоциация между HLA DQB1*503 и клиническим туберкулезом у пациентов из Камбоджи. В этом исследовании было также отмечено небольшое увеличение частоты встречаемости аллеля HLA-DRB1*2.
HLA-DQ молекулы уникальны среди II класса молекул МНС, потому что обе α- и β-цепочки очень полиморфны; более того, многие вариабельные аминокислотные остатки расположены в α-спиральной части антиген-связывающего кармана. С помощью ПЦР анализа было выявлено два гена DQ аллеля, связанных с туберкулезом.
Также риском к развитию легочных и экстрапульмонарных заболеваний являются воздействия окружающей среды и первоначальный результат воздействия микобактерий на организм. Хотя факторы, которые влияют на развитие болезни и ее клиническое проявление, еще недостаточно изучены. В частности, при воздействии микобактерий на организм не всегда происходит заражение; а среди зараженных прогрессирование в активное заболевание, причины болезни и ее длительность сильно варьируют. Наиболее вероятно, действует сложный комплекс генетических и экологических факторов. Хорошо известно, что плохие окружающие условия и некоторые идентифицированные факторы риска: диабет, силикоз, ВИЧ, злоупотребление алкоголем и другие, - все они играют роль в предрасположенности к туберкулезу. В данном исследовании семейный статус и правильное питание, известные кофакторы в развитии туберкулеза, были одинаковыми в контрольной группе и группе пациентов с туберкулезом; пациенты с некоторыми из вышеупомянутых нарушений были исключены из группы больных с туберкулезом, а ВИЧ-инфицированные пациенты с туберкулезом анализировались отдельно.
Генетические факторы хозяина могут оказывать влияние и на восприимчивость к инфекционному агенту, и на патогенез заболевания, хотя получить свидетельство генетической предрасположенности к туберкулезу довольно сложно. Недавно были получены данные, что вариации в протеине I человеческих макрофагов, который ассоциирован с врожденным иммунитетом, связаны с измененной чувствительностью к мокрото-положительным туберкулезом у населения Западной Африки.
Результаты исследований, как и данные Goldfeld и др., показывают, что некоторые аллели системы HLA II класса, особенно локуса DQ1, могут принимать участие в возрастании чувствительности и в восприимчивости к туберкулезу. HLA-рестриктированная презентация процессированных антигенов альвеолярными макрофагами может быть изменена у пациентов, экспрессирующих данные специфические аллели HLA.
Также было обнаружено возрастание частоты DRB1*1101 аллеля у ВИЧ-инфицированных пациентов. При использовании стандартного метода микроцитотоксичности на мононуклеарных клетках несколько лет назад была получена высокая частота встречаемости гена HLA-DR5 у ВИЧ-инфицированных пациентов. Однако неясно, предрасполагал ли ген HLA-DR5 к развитию ВИЧ-инфекции или к некоторым последующим осложнениям, таким как постоянная генерализованная лимфоаденопатия или саркома Капоши. После того, как было доказано, что частота DRB1*1101 была значительно увеличена на II стадии ВИЧ-инфекции по CDC, результаты исследования доказывали: генетическая восприимчивость, связанная с этим маркером, предрасполагает пациентов к ВИЧ-инфекции, а не к вышеописанным осложнениям. В доказательство данной точки зрения было исследовано 20 мужчин-гомосексуалистов без ВИЧ-инфекции по HLA II класса. Частота аллеля HLA DRB1*1101 в этой группе не отличается от контрольной группы. Однако эти данные нужно использовать осторожно, так как несмотря на многие исследования относительно типа HLA и иммунного ответа на ВИЧ-I, вопрос о том, влияет ли HLA на восприимчивость к данной вирусной инфекции остается нерешенным.
Проведенные исследования доказывают, что три аллеля HLA вовлечены в восприимчивость к туберкулезу в мексиканской популяции.
Механизмы, лежащие в основе неустойчивости или восприимчивости к инфекционным заболеваниям, связанные с HLA II класса, а также различия между DR и DQ локусами до сих пор до конца не изучены. Хотя результаты исследования подтверждают, что генетическое влияние системы HLA может играть роль в развитии туберкулеза, но эта предполагаемая чувствительность не играет роли у пациентов с серьезными нарушениями иммунитета, как во время ВИЧ-инфекции. Также было предположено, что ген DR5 может быть ассоциирован с развитием ВИЧ-инфекции.
Таблица 1. Частоты генов HLA в четырех группах пациентов
| Allele Specificity | Healthy Subject | PTB Patients, % | HIV-Positive Patients, % | AIDS Patients with PTB, % |
| DR1 | 10.52 | 20.00 | 5.40 | 6.66 |
| DR3 | 12.63 | 20.00 | 16.21 | 13.33 |
| DR4 | 46.31 | 12.00 | 13.51 | 33.33 |
| DR7 | 22.10 | 18.00 | 16.21 | 33.33 |
| DR8 | 33.68 | 4.00 | 18.91 | 6.66 |
| DR9 | 1.05 | 8.00 | 5.40 | 6.66 |
| DR10 | 1.05 | 4.00 | 0.00 | 6.66 |
| DR11 | ||||
| (DRB1*1101) | 11.57 | 24.00 | 45.94! | 33.33 |
| (DRB1*1102) | 3.15 | 4.00 | 2.70 | 6.66 |
| (DRB1*1103) | 1.05 | 2.00 | 0.00 | 0.00 |
| (DRB1*1104) | 3.15 | 0.00 | 2.70 | 0.00 |
| DR12 | ||||
| (DRB1*1201) | 2.10 | 16.00 | 8.10 | 0.00 |
| (DRB1*1202) | 0.00 | 2.00 | 5.40 | 0.00 |
| (DRB1*1203) | 0.00 | 0.00 | 2.70 | 0.00 |
| DR13 | ||||
| {DRB1*1301) | 4.21 | 2.00 | 2.70 | 0.00 |
| (DRB1*1302) | 4.21 | 4.00 | 0.00 | 0.00 |
| (DRB1*1305) | 2.10 | 0.00 | 0.00 | 0.00 |
| DR14 | 22.10 | 2.00 | 0.00 | 0.00 |
| DR15 | ||||
| (DRB1*1501) | 9.47 | 48.00! | 24.32 | 33.33 |
| (DRB 1*1502) | 3.15 | 0.00 | 0.00 | 6.66 |
| (DRB1*1503) | 1.05 | 0.00 | 2.70 | 0.00 |
| DR16 | ||||
| (DRB1*1601) | 2.10 | 6.00 | 27.02 | 6.66 |
| (DRB1*1602) | 3.15 | 4.00 | 0.00 | 6.66 |
| DQA | ||||
| (DQA1*0101) | 22.10 | 62.00! | 40.54 | 35.71 |
| (DQA1*0102) | 17.89 | 10.00 | 13.51 | 28.71 |
| (DQAl*020l) | 22.10 | 12.00 | 18.91 | 14.28 |
| (DQA1*0301) | 48.42 | 30.00 | 13.51 | 35.71 |
| (DQA1*0401) | 32.63 | 12.00 | 18.91 | 7.14 |
| (DQA1*0501) | 46.31 | 34.00 | 35.13 | 28.57 |
| (DQA1*0502) | 4,21 | 0.00 | 0.00 | 0.00 |
| DQB | ||||
| (DQBl*0201) | 33.68 | 26.00 | 16.21 | 35.71 |
| (DQB1*0301) | 35.78 | 24.00 | 13.51 | 28.57 |
| (DQB1*0302) | 43.15 | 32.00 | 32.48 | 35.71 |
| (DQB1*0304) | 1.05 | 0.00 | 0.00 | 0.00 |
| (DQB1*0402) | 33.68 | 6.00 | 8.10 | 0.00 |
| (DQB1*0501) | 12.68 | 44.00! | 21.62 | 31.71 |
| (DQB1*0502) | 5.26 | 6.00 | 5.40 | 7.14 |
| (DQB1*0503) | 9.47 | 4.00 | 5.40 | 14.28 |
| (DQB1*0504) | 1.05 | 0.00 | 0.00 | 0.00 |
| (DQB1*0602) | 15.78 | 14.00 | 8.10 | 0.00 |
| (DQB1*0603) | 5.26 | 0.00 | 10.21 | 7.14 |
| (DQB1*0604) | 2.10 | 8.00 | 8.10 | 7.14 |
| (DQB1*0609) | 1.05 | 0.00 | 0.00 | 0.00 |
Похожие работы
... их гаплотических сочетаний у больных туберкулезом представителей русской этнической группы Челябинской области При сравнительном анализе особенностей распределения специфичностей генов HLA II класса у больных туберкулезом и здоровых представителей русской этнической группы Челябинской области были установлены следующие факты: у больных туберкулезом и здоровых пациентов были выявлены различия в ...
... о связи между частотой аллелей генов-кандидатов ТБ и особенностями распространения этого инфекционного заболевания. Выводы Выявлены особенности в распределении частот аллелей, изученных генов–кандидатов подвержености к туберкулезу, у русских жителей г. Томска по сравнению с другими популяциями мира. При сравнении с тувинцами показаны отличия в распределении генотипов и частот аллелей по всем ...
... фиброза и деформации лёгочной ткани. Фиброзно-кавернозный туберкулёз значительно хуже подвергается заживлению, чем кавернозный. Цирротический туберкулёз. Цирротический туберкулез лёгких характеризуется развитием в лёгочной ткани грубого, деформирующего орган склероза (цирроза), бронхоэктатических, посткавернозных типа кист полостей, эмзифематонных булл или каверн без признаков прогрессирования. ...
... наиболее характерно отражают манифестную форму ВИЧ-инфекции, представить в едином целом схему фаз течения болезни, классифицировать состояния, наблюдаемые наиболее закономерно Разновидности ВИЧ Для вируса иммунодефицита человека характерна высокая частота генетических изменений, возникающих в процессе самовоспроизведения. Частота возникновения ошибок у ВИЧ составляет 10-3 — 10-4 ошибок / ( ...
0 комментариев