КАФЕДРА ОРГАНИЗАЦИИ И ЭКОНОМИКИ ФАРМАЦИИ
Тема:
"Особеность обеспечения ацетилсалициловой кислотой населения и заведений здравохранения в Украине"
Львов 2008
Политика фармацевтических фирм по распределению продукции
Развитие каналов распределения
В прошлом каналы распределения состояли из независимых компаний, каждая из которых преследовала свои собственные цели [1]. Такой канал распределения называется конвенционным, в котором компании стремились оптимизировать политику закупок и сбыта за счет компаний верхних и нижних уровней канала.
На смену конвенционным каналам распределения пришли вертикальные маркетинговые системы, в которых деятельностью канала управляет или значительно влияет на нее один из участников канала распределения – производитель, посредник или розничный торговец. Вертикальная маркетинговая система – это такая организация каналов распределения, в которой все участники координируют свои действия с целью оптимизации процесса распределения.
Вертикальные маркетинговые системы обладают рядом преимуществ перед конвенционными каналами распределения:
![]() Снижение расходов канала вследствие исключения дублирования функций;
Снижение расходов канала вследствие исключения дублирования функций;
![]() Минимизация количества конфликтов между каналами распределения;
Минимизация количества конфликтов между каналами распределения;
![]() Максимальное использование опыта и компетентности членов канала распределения.
Максимальное использование опыта и компетентности членов канала распределения.
Вертикальные маркетинговые системы
Вертикальные маркетинговые системы различаются по уровню организации.
Корпоративная вертикальная маркетинговая система – участки канала распределения принадлежат одной организации. Таким образом, производственные и распределительные функции контролируются одной компанией.
Административная вертикальная маркетинговая система представляет собой менее формализованную организацию, в которой каждый участник канала распределения обладает достаточной силой, чтобы влиять на других участников канала. Наиболее влиятельная компания в административной вертикальной маркетинговой системе называется «капитаном канала» и выполняет функции обеспечения выгодных условий работы для всей системы.
Договорная вертикальная маркетинговая система представляет собой промежуточное звено между корпоративной и административной системами. Участники канала распределения связаны между собой договорными отношениями, которые определяют их взаимные обязательства.
В фармацевтическом секторе США очень много примеров вертикальных интегрированных систем между производителями и компаниями по управлению лечением заболеваний (disease state management), которые занимаются распределением лекарственных препаратов.
Составные части процесса рекламы
Реклама как процесс состоит из четырех составных [2]:
1. Рекламодатели (заказчики рекламы)
2. Рекламные агентства
3. Средства рекламы (рекламный пакет)
4. Потребители (рекламная целевая аудитория) товаров и услуг
Рекламодатель (заказчик рекламы) – фирма или лицо, которая делает заказ на рекламу. Рекламодатель оплачивает все рекламные услуги сам.
Рекламное агентство – организация, которая выполняет весь комплекс или отдельные виды рекламных услуг. Рекламное агентство может быть специализированным по отраслям промышленности либо по типам средств рекламы.
Рекламное агентство может работать как в рамках определенной территории, так и в международном масштабе.
Средства рекламы (рекламный пакет) – включает весь комплекс рекламных услуг, которые предоставляет данное агентство (от разработки стратегии рекламной кампании до анализа ее эффективности).
Потребители (рекламная целевая аудитория) – все те потенциальные объекты рекламы, на которые она направлена.
Носители рекламы – средства массовой информации.
Классификация рекламы как системы изображена на рисунке 2.
Рекламное планирование
Планирование рекламной кампании состоит из нескольких этапов:
![]() Определение и изучение целевой аудитории (или целевого рынка);
Определение и изучение целевой аудитории (или целевого рынка);
![]() Постановка целей рекламы;
Постановка целей рекламы;
![]() Определение рекламного бюджета;
Определение рекламного бюджета;
![]() Разработка плана использования средств рекламы;
Разработка плана использования средств рекламы;
![]() Создание рекламного обращения;
Создание рекламного обращения;
![]() Оценка эффективности рекламы.
Оценка эффективности рекламы.
Определение и изучение целевой аудитории (или целевого рынка)
Для рекламы, как и для любого маркетингового планирования, важно определение основных целевых сегментов потенциального рынка. Содержание рекламы, способ ее подачи, время показа и выбор средства рекламы определяется особенностями целевого сегмента (для ОТС – препаратов – конечный потребитель или фармацевт; для рецептурных возмещаемых препаратов – врачи, учреждения здравоохранения, страховые компании, правительственные организации).
Планирование рекламы начинается с анализа рынка.
Рынок разбивается на группы потребителей, обладающих сходными потребностями, в соответствии с которыми и разрабатываются специфические типы рекламы.
Оценка потенциалов различных сегментов. После сегментирования компания останавливается на одном или нескольких целевых сегментах. Выбор определяется привлекательностью сегмента: размером, темпами роста, прибыльностью, – а также тем, в каком из сегментов компания получит наибольшее конкурентное преимущество.
Анализ потребностей и поведения потребителей. Эффективное рекламное обращение должно соответствовать культурному уровню целевой аудитории, заинтересовывать покупателей и убедить, что предлагаемый товар удовлетворит их потребности. Часто компании прибегают к услугам рекламного агентства, которое разработает рекламное обращение и выберет средства рекламы, так как агентство изучает потребности целевой аудитории.
Цели и задачи рекламы
Задача рекламы – увеличить прибыль компании путем увеличения объема сбыта товара или повышения цен.
Чаще всего компания дает рекламу с целью увеличения объемов сбыта. Однако это не всегда удается, так как:
![]() Очень сложно выделить воздействие рекламы из комплекса факторов, влияющих на объем реализации товара;
Очень сложно выделить воздействие рекламы из комплекса факторов, влияющих на объем реализации товара;
![]() Для большинства потребителей покупка является итоговым результатом долгого процесса принятия решения.
Для большинства потребителей покупка является итоговым результатом долгого процесса принятия решения.
В связи с этими факторами влияние текущей рекламы на объем сбыта проявляется не сразу, а только через определенный промежуток времени. Исключением может быть только показатель объема реализации в краткосрочном периоде, который является хорошим показателем эффективности рекламы. В этом случае реклама становится единственным решающим фактором изменения объемов реализации. Долгосрочные эффекты при этом незначительны.
Реклама играет одну из главных ролей при повышении цен на товар (поддерживает марочную премию к цене, подчеркивая ценность ведущих марок для потребителей) и, вследствие этого, в увеличении прибыли компании. Отделить влияние рекламы на величину премии от воздействия других факторов очень сложно. Эффект запаздывания, описанный ранее, еще более затрудняет оценку. Вследствие этого задачи рекламы определяются исходя из непосредственных целей компании с использованием критериев SMART (конкретные, измеримые, достижимые, релевантные и определенные во времени).
Создание рекламного обращения
После определения целевых сегментов и постановки задач рекламы компании разрабатывают обращение, которое позволяет достичь поставленных целей.
Обращение должно соответствовать следующим критериям:
![]() Привлекать внимание потребителей;
Привлекать внимание потребителей;
![]() Вызывать необходимый тип поведенческой реакции потребителя;
Вызывать необходимый тип поведенческой реакции потребителя;
![]() Быть понятным и убедительным.
Быть понятным и убедительным.
Рекламное агентство, как правило, занимается разработкой рекламного обращения: содержанием, структурой, форматом и источником. Призыв используется в рекламном объявлении и должен мотивировать действия потребителей. Существует несколько видов обращений в рекламе фармацевтической продукции. Они могут быть как рациональными, так и эмоциональными.
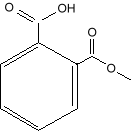
Химическая формула и название
Acetylsalicylic acid Chemical Formula: C6H4(OCOCH3) CO2H.
Код, название групы и подгрупы за уровнями согласно АТЦ классификация
| МНН | Код | Уровни |
| |||
| Первый | Второй | Третий | Четвертый | Пятый | ||
| Ацетилсалициловая кислота Acetylsalicylic Acid | N02B A01 | N‑Средства Влияющие на нервную систему | N02 Анальгетики | N02B Прочие анальгетики и антипиретики | N02B A Салициловая кислота и ее производни | N02B A01 Кислота ацетил-салициловая |
Характеристика ассортимента
Готовые лекарственные средства (Компендиум, Лекарственные препараты, в двух томах, Морион 2006).
| № | Торговые название | Форма выпуска | Производитеь | Регистрационный номер | Срок действия регистрации |
| 1 | Acidum acetylsalicylicum | Табл. 500 мг контур. Безъячейк. Уп., №10 | Агрофарм | №UA/3721/01/01 | От 27.09.2005 До 27.09.2010 |
| 2 | Acidum acetylsalicylicum | Табл. 0,5г контурн. Безъячейк. Уп., №10 Табл. 0,5 контурн. Ячейк. Уп., №10 | Борисовский ЗМП | №UA/5739/01/01 | От 22.01.2007 До 22.01.2012 |
| 3 | Acetylsalicylic Acid | Табл. 0.5г контурн. Безячейк. Уп., №10 | Галичфарм | №П. 01.03/05684 | От 09.01.2003 до 09.01.2008 |
| 4 | Acidum acetylsalicylicum | Табл. 0,5г, №10 | Лубныфарм | №UA/5708/01/01 | От 22.01.2007 До 22.01.2012 |
| 5 | Acidum acetylsalicylicum | Табл. 0,5г стрип, №10 | Луганский ХФЗ | №UA/5709/01/01 | От 22.01.2007 До 22.01.2012 |
| 6 | Acidum acetylsalicylicum | Табл. 0,5г контурн. Ячейк. Уп., №10 Табл. 0,5г контурн. Безъячейк. Уп., №10 | Монфарм | №UA/6272/01/01 | От 19.04.2007 До 19.04.2012 |
| 7 | Acidum acetylsalicylicum | Табл. Контурн. Ячейк. Уп., №10 | Стома | №UA/0789/01/01 | От 05.04.2004 до 05.04.2009 |
| 8 | Acidum acetylsalicylicum – Darnitsa | Табл. 0.25 г. контурн. Ячейк. Уп., №10 | Дарница | №UA/2992/01/01 | От 07.04.2005 До 07.04.2010 |
| Табл. 0.5г контурн. Ячейк. Уп., №10 | №UA/2992/01/02 | От 07.04.2005 До 07.04.2010 |
Лекарственные средства индивидуального изготовления
| № п/п | Состав | Источник информации |
| 1. | Rp: Acidi acetylsalicylici 0,3 Da tales doses №20 Signa. По 1 порошку 3 раза в день | Тихонов А.И., Ярных Т.Г. Технология лекарств |
| 2. | Аспирин Кардио Ацетилсалициловая кислота 0.33 г | www.karapuz.kz |
| 3. | Упсарин Упса Состав: Ацетилсалициловая кислота 500 мг Вспомагательные вещества необходимое количество | www.karapuz.kz |
Анализ информации о регистрации, перерегистрации ЛС по данным Государственного фармакологического центра МОЗ за два последних года
| № п/п | Название ЛС | Форма выпуска | Производитель, страна | Регистрационная процедура | Дата и № приказа МОЗ | |
| 1 | Упсарин упса с витамин С | Таблетки шипучи №10, №12 Х 2 в тубики | Франция, Бристол-Маиерс Сквибб | Перерегистрация в связи с окончания термином действий регистраций удостоверения | 22.01.2008 №022 | |
| 2 | Упсавит витамин С | Таблетки шипучий по 1г №10 у тубики | Франция, Бристол-Маиерс Сквибб | Перерегистрация в связи с окончания термином действий регистраций удостоверения | 22.01.2008 №022 | |
| 3 | Аспирин® | Таблетки по 500 мг №10, №20, №100 | Байер АГ, Нимечина: Биттерфлейд ГмбХ, Нимечина | Внесенные изменения до регистрационны материалы; измененич в инструкций для медицинского применения; регистрация допълнение упаковки | 22.01.2008 №022 | |
| 4 | Аспирин® С | Таблетки шипучий №10, №20 | Байер АГ, Нимечина: Биттерфлейд ГмбХ, Нимечина | Внесенные изменения до регистрационны материалы; измененич в инструкций для медицинского применения; регистрация допълнение упаковки | 22.01.2008 №022 |
| 5 | Аспирин Кардио | Таблетки, откриты кишково растворимая оболочка по 100 мг, №20 | Байер АГ, Биттерфлейд ГмбХ, Нимечина. Кимика Фармасютика Байер Ц.А. Испания | Перерегистрация в связи с окончания термином действий регистраций удостоверения; изменение имя и местонахождения производителя | 07.03.2008 №119 |
| 6 | Аспирин кардио | Таблетки, открыты кишково растворимая оболочка По 300 мг, №20 | Байер АГ, Биттерфлейд ГмбХ, Нимечина. Кимика Фармасютика Байер Ц.А. Испания | Перерегистрация в связи с окончания термином действий регистраций удостоверения; изменение имя и местонахождения производителя | 07.03.2008 №119 |
| 7 | Ацетил салициловая кислота | Таблетки по 0.5 г №10 | ВАТ «Лубнифарм» Украйна | Внесенных изменений до регистрационны материалы: уточнения в АНД ‘’количественные назначения’’ | 07.03.2008 №121 |
| 8 | Аспирин® | Таблетки по 500 мг, №10, №20, №100 | Байер АГ, Нимечина: Биттерфлейд ГмбХ, Нимечина | Внесенных изменений до регистрационны материалы: изменения процедури испробоват готовые лекарственны средствь | 18.03.2008 г. №139 |
| 9 | Ацетилсалициловая кислота | Таблетки по 0.5 г, №10 | ВАТ «Лубнифарм» Украйна | Внесенных изменений до регистрационны материалы: Уточнения графичного изображения упаковки | 18.03.2008 г. №139 |
| 10 | Ацетилсалициловая кислота | Таблетки по 0.5 г, №10, №10х2 в блистер | АТ «Галичфарм», Украйна Г. Львов ВАТ ‘’ Киевмедпрепарат’’, Украйна г. Киев | Внесенных изменений до регистрационны материалы: смяна произворителя активной субстанций: введения допулнительного производителя: измена спецификации и процедура испробувания препарата; измена в листовка препарата, инструкций для медицинского применения и маркоровки внесени в интересах охрани здоровя отдельно за результатами послерегистрационного огляда; изменение состава препарата (вспомагательних веществ); регистрация дополнительной опаковки | 21.08.2008 №485 |
| 11 | Ацетилсалициловая кислота | Таблетки по 0.5г, №10 | ВАТ «Лубнифарм» Украйна | Перерегистрацияв связи с окон чание термином действие регистрационного удостоверение; уточнения опаковки | 5.3.2007 №103 |
| 12 | Ацетилсалициловая кислота | Таблетки по 0.5г, №10 в стрипах | ВАТ «Луганский химико-фармацевтичниы завод'' Украйна г. Луганск | Перерегистрацияв связи с окон чание термином действие регистрационного удостоверение; уточнения опаковки | 5.3.2007 №103 |
| 13 | Ацетилсалициловая кислота | Таблетки по 0.5г, №10 у контурих безчарункових або чарункових упаковках | ТЕМИС ЛАБОРАТОРИС Пвт Лтд Индия | Внесенных изменений до регистрационны материалы: измена цветовая гама первичная упаковка вилучення р. «Маркування» | 5.3.2007 №103 |
| 14 | Аспирин® 1000 | Таблетки шипучие по 500 мг №2Х6 №2Х12 | Байер АГ, Нимечина: Биттерфлейд ГмбХ, Нимечина | Внесенных изменений до регистрационны материалы: изменение графичного изображения упаковки | 19.04.2007 №195 |
| 15 | Ацетилсалициловая кислота | Таблетки 0.5г, у контурих с оболочки или без оболочки | ВАТ ‘’Монофарм’’ Украйна черкаськая област г. Манастирище | Перерегистрацияв связи с окон чание термином действие регистрационного удостоверение; регистрация дата упаковки | 19.04.2007 №195 |
| 16 | Аспирин® | таблетки по 500 мг №10, №20, №100 | ЗАТ ‘’Технолог’’ Украйна | Внесенных изменений до регистрационны материалы: изменение графичного изображения упаковки (для №10 и №10х2) | 06.08.2007 №454 |
| 17 | Аспирин® С | Таблетки шипучие №10, №12 | Байер АГ, Нимечина: Биттерфлейд ГмбХ, Нимечина | Внесенных изменений до регистрационны материалы: изменение графичного изображения упаковки (для №10) | 06.08.2007 №454 |
| 18 | Аспирин Кардио | Таблетки открытая оболочка кишково растворим по 100 мг, 300 мг №20 | Байер АГ, Биттерфлейд ГмбХ, Нимечина. Кимика Фармасютика Байер Ц.А. Испания | Внесенных изменений до регистрационны материалы: измяна в инструкций медицинского применения | 17.09.2007 №557 |
| 19 | Аспирин® С | Таблетки шипучие №10 (2х5), №20 (2х10) | Байер АГ, Нимечина: Биттерфлейд ГмбХ, Нимечина | Внесенных изменений до регистрационны материалы: измяна процедура испробувание готовы лекарственны продукт | 25.10.2007 №656 |
| 20 | Ацетилсалициловая кислота | Таблетки 0.5г, №10 | АТ «Галичфарм» Украйна г. Львов | Перерегистрацияв связи с окон чание термином действие регистрационного удостоверение | 27.12.2007 №858 |
Анализ предложений исследуемых ЛС на фармацевтическом рынке
| № п/п | Торговое название | Форма выпуска | Производитель | Поставщик | Стоимость поставщика | |||
| I кв. | II кв. | III кв. | IV кв. | |||||
| 7/2008 с 1 по 3 априля | Ацетилсалициловая кислота | Таблетки 0.5г №10 | Дарниця | Атрур | 0.31 | 0.34 | 0.30 | 0.31 |
| 7/2008 с 1 по 3 априля | Ацетилсалициловая кислота | Таблетки 0.5г №10 | Борщаг ХФЗ | ВВС | 0.36 | 0.27 | 0.34 | 0.30 коп |
| 7/2008 с 21 по 23 апиля | Ацетилсалициловая кислота | 7/2008 с 21 по 23 апиля | Борщаг ХФЗ | ВВС | 0.36 | 0.27 | 0.34 | |
| 7/2008 с 21 по 23 апиля | Ацетилсалициловая кислота | Таблетки 0.5г №10 | Луганский ХФЗ | ВВС | 0.30 | 0.30 | ||
| 7/2008 с 21 по 23 апиля | Ацетилсалициловая кислота | Таблетки 0.5г №10 | Дарниця | Артур К, Мед сервис | 0.31 | 0.44 | ||
| 10/2008 с 24 по 26 мая | Ацетилсалициловая кислота | Таблетки 0.5г №10 | Дарниця | Артур К | 0.31 | 0.44 | ||
| 10/2008 с 24 по 26 мая | Ацетилсалициловая кислота | Таблетки 0.5г №10 | Борщаг ХФЗ | Галичфарм | 0,36 | 0.27 | 0.34 | 0.30 0.30 |
| 11/2008 с 9 по 11 | Ацетилсалициловая кислота | Таблетки 0.5г №10 | Дарниця | Артур К | 0.31 0.34 | 0.44 0.30 | 0.36 | 0.27 |
| 11/2008 с 23 по 26 юня | Ацетилсалициловая кислота | Таблетки 0.5г №10 | Дарниця | Медфармсервис | 0.49 0.34 | 0.36 0.30 | 0.36 | 0.27 |
| 12/2008 с 12 по 15 сентебря | Ацетилсалициловая кислота | Таблетки 0.5г №10 | Дарниця | Артур К | 0.31 | 0.59 | 0.27 | 0.34 |
Организация входного контроля качества лекарственных средств
| Для оптовой реализации | Для розничной реализации |
| 1. Каждый субъект хозяйственной деятельности, который занимается оптовой торговлей лекарственными средствами, должен обеспечить проведение входного контроля качества лекарственных средств и иметь уполномоченное лицо. Порядок назначения, сфера компетенции, требования к уполномоченному лицу изложенные в подпункте 2. Главной обязанностью уполномоченного лица является: Проверка 3. лекарственных средств, которые поступают к субъекта, и сопроводительных документов – накладной (с обязательным указанием наименования, дозирования, врачебной формы, номера серия, количества, названия производителя); сертификатов качества, которые выданы производителями; сведений о государственной регистрации врачебного средству. 4. Оформление вывода входного контроля качества лекарственных средств. 5. Ведение реестра лекарственных средств, которые поступили к субъекта хозяйственной деятельности (дополнение 1), чтобы иметь возможность отследить источник получения каждой некачественной или фальсифицированной партия лекарственных средств. 6. Ведение реестра лекарственных средств, которые реализуются субъектом хозяйственной деятельности (дополнение 2), чтобы иметь возможность отзывать обнаруженную партию фальсифицированных или некачественную лекарственных средств. 7. Проверка наличия на составе некачественных и фальсифицированной серии лекарственных средств согласно информации территориальной инспекции. 8. Предоставление территориальной инспекции сведений о обнаружены некачественные и фальсифицированы лекарственные средства или о которых есть подозрение относительно их качества. Остановка торговли и помещение в карантин таких лекарственных средств. 9. Порядок проведения входного контроля качества врачебных средств, которые поступают к субъекту оптовой торговли: 10. Закупать и получать лекарственные средства след только у субъектов, которые имеют действующую лицензию на право оптовой торговли или производство лекарственных средств. Копия такой лицензии должна сохраняться у уполномоченного лица. 11. Полученная партия лекарственных средств должна пройти входной контроль уполномоченным лицом. До получения письменного выводу уполномоченного лица торговля полученными врачебными средствами запрещается. 12. Уполномоченное лицо проверяет соответствие полученных лекарственных средств сопроводительным документам относительно количества дозирования, номеров серии, сроков пригодности, регистрационного статуса, наименования, врачебной формы, производителя. Каждая серия лекарственных средств должна сопровождаться сертификатом качества выданным производителем. Лекарственные средства, указанные в п. 4.8 этой Инструкция, должны дополнительно сопровождаться выводом относительно качества, выданным лабораторией, подчиненной или уполномоченной Государственной инспекцией. 13. Групповая тара, внешняя (вторичная) и внутренняя (первичная) упаковка, маркировки, листок-вкладка, внешний вид без раскрытия упаковка проверяется на целостность, однородность наличие повреждений, качество паковочных материалов. При потребности лекарственные средства проверяются с раскрытием упаковки относительно размеров, формы, цвета, однородности, количества единицы, в упаковке, наличию загрязнений. 14. При позитивном результате входного контроля уполномоченное лицо передает на реализацию партии врачебных средств. 15. При негативном результате уполномоченное лицо составляет акт об обнаруженных дефектах, который является основанием для возвращения серии поставщику. Копия акта подается в территориальную инспекцию, которая после проведения дополнительной проверки и выборочного анализа принимает меру относительно информирования других субъектов об обнаруженных некачественные или фальсифицированные лекарственные средства и контролирует действия поставщика относительно уничтожения, утилизации или возвращения (в разе некачественных лекарственных средств) производителю. 16. В случае возникновения сомнения относительно качества уполномоченная лицо отбирает образцы сомнительных лекарственных средств и направляет их в территориальную инспекцию для прохождения лабораторных исследований. На время проведения таких исследований, к окончательному решению вопрос об их качестве, партии сомнительных лекарственных средств находятся в карантине изолировано от других лекарственных средств из обозначениям «Торговля запрещена к отдельному распоряжению». 17. Субъект хозяйственной деятельности разрабатывает внутренний порядок обращения лекарственных средств с определением мероприятий при выявлении фальсифицированных и некачественных лекарственных средств. | 1. Входной контроль качества лекарственных средств в аптеке осуществляет лицо, назначенное приказом руководителя субъекту ответственная за качество лекарственных средств, которые поступают в аптеку (уполномоченное лицо). Уполномоченное лицо должно иметь визжу или среднее фармацевтическое образование. Ее фамилия, контактный телефон и форму связи (телефон, факс, электронная почта) следуют сообщить территориальной инспекции. К компетенции уполномоченного лица принадлежит подготовка и оформление вывода относительно результатов входного контроля качества серии лекарственных средств с отметкой о передачу их к реализации. 2. Главной обязанностью уполномоченного лица является: 3. Проверка лекарственных средств, которые поступают в аптеку и сопроводительных документов – накладной (с обязательным указанием наименования, дозирования, врачебной формы, номера серии количества, названия производителя), сертификатов качества производителей, данных о регистрационном статусе лекарственного средства. 4. Оформление вывода входного контроля качества лекарственных средств. 5. Ведение реестра лекарственных средств, которые поступили к субъекта хозяйственной деятельности (дополнение 1). 6. Проверка наличия в аптеке некачественных и фальсифицированной серии лекарственных средств согласно информации территориальной инспекции. 7. Предоставление территориальной инспекции сообщений о обнаружены некачественные и фальсифицированы лекарственные средства или о которых есть подозрение относительно их качества. Остановка торговли такими врачебными средствами. 8. Согласование внутреннего порядка обращения врачебных средств. 9. контролю качества врачебных средств, которые поступают в аптеку: 10. Закупать и получать лекарственные средства след только у субъектов, которые имеют действующую лицензию на право оптовой торговли. Копия такой лицензии добавляется к соглашениям о снабжении и сохраняются у заведующего аптеки или уполномоченного лица со всем комплектом документов. 11. Получены аптекой лекарственные средства должны пройти визуальный контроль уполномоченным лицом. До получения письменного выводу уполномоченного лица торговля полученными врачебными средствами запрещается. 12. Уполномоченное лицо проверяет соответствие полученных лекарственных средств сопроводительным документам относительно количества дозирования, номеров серии, сроков пригодности, регистрационного статуса, наименования, врачебной формы, производителя. Каждая серия лекарственных средств должна сопровождаться сертификатом качества что кажется производителем, заверенным печатью последнего поставщика. Лекарственные средства, указанные в п. 4.8 этой Инструкции должны дополнительно сопровождаться выводом относительно качества, что выданный лабораторией, подчиненной или уполномоченной Государственной инспекцией. 13. Групповая тара, внешняя (вторичная) и внутренняя (первичная) упаковка, маркировки, листок-вкладка, внешний вид без раскрытия упаковка проверяется на целостность, однородность наличие повреждений, качество паковочных материалов. При потребности если возникло подозрение относительно качества, лекарственные средства проверяются из раскрытием упаковки относительно размеров, формы, цвета однородность, количества единицы в упаковке, наличии загрязнений. 14. При позитивном результате входного контроля уполномоченное лицо передает полученную серию лекарственных средств в реализацию. 15. При негативном результате уполномоченное лицо составляет акт об обнаруженных дефектах, который является основанием для возвращения партии поставщику. Копия акта подается в территориальную инспекцию, которая после проведения дополнительной проверки и выборочного лабораторного анализу принимает меру относительно информирования другой аптеки об обнаруженных некачественные или фальсифицированные лекарственные средства и контролирует действия поставщика относительно их уничтожения, утилизации или возвращения (в разе некачественной серии) производителю. 16. В случае возникновения сомнения относительно качества врачебных средств при выполнении визуального контроля уполномоченное лицо отбирает образцы сомнительных лекарственных средств и направляет их в территориальную инспекцию для прохождения лабораторных исследований. На время проведения таких исследований, к окончательному решению вопроса об их качестве, серия сомнительных лекарственных средств находится в карантине, изолировано от других лекарственных средств, из обозначениям «Торговля запрещена к отдельному распоряжению». |
Анализ предписанний Государственной Инспекции по контролю качества ЛЗ МОЗ Украины
| Месяц, год | К-во предписаний | Лекарственное средство, причина изъятия из оборота |
| 26.02.2007 | Таблетки по 0.5г контурн. безчарункв. упаков. №10 | Ацетил салициловая кислота: производитель Дарниця Незареєстрований. Вжити заходів щодо вилучення з обігу і вміщення в карантин або повернення постачальнику. |
| 24.11.2005 | Таблетки по 0.5г №10 серия №620205 | Производитель Беларус РУП Борисовський завод медичних препаратів На підставі встановлення факту невідповідності вимогам аналітичної нормативної документації до реєстраційного посвідчення П. 07.01/03352 препарату за показником «Кількісний вміст» (занижений). Вжити заходів щодо вилучення з обігу і вміщення в карантин до окремого розпорядження Державної інспекції. |
| 01.12.2002 | Таблетки №10 серия №3676 | Ацетилсалициловая кислота: Борщаг ХФЗ Причина: 1.’’Количетсвенное определени’’е-заниженные показатели еделени’’е-заниженные показатели |
Особенности организаций хранения лекарственных средтсв
| Название субстанции | Условия хранения за | ||||||
| Токсикологическими группами | Физическими и физико-химическими свойствами и требуют защиты от | ||||||
| Не сильно действие Общее – неядовитое в-во | света | действия влажности | испарения | повыш. t0 | пониж. t0 | от действия газов | |
| Ацетилсалициловая кислота | Твердое | + | - | - | - | - | - |
Наличие исследуемых лекарственных средств в Перечнях
| Перечень / группа ЛС | Номер и дата нормативного документа | Отметка о наличии |
| Национальный | Приказ 29.03.2006 г. №400 | + |
| Бюджетный | Приказ 27.02.2006 г. №86 | + |
| Регулирующий | Приказ 03.12.2001 г. №480/294 | + |
| Ассортиментный | Приказ 25.11.2004 г. №569 | + |
| Безрецептурный | Приказ 27.12.2006 г. №897 | + |
| Наркотические | Постановление от 06.05.2000 г. №770 | - |
| Психотропниые | Постановление от 06.05.2000 г. №770 | - |
| Прекурсоры | Постановление от 06.05.2000 г. №770 | - |
| Ядовитые | Приказ от 19.07.2005 г. №646 | - |
| Сильнодействующие | Приказ от 19.07.2005 г. №646 | - |
Ценообразование
Анализ ценовых предложений на ЛС в аптеке региона за 3-11 мес. 2008 г.
| Название ЛС, форма выпуска | Месяц | Аптеки региона / розничная стоимость, грн. | ||||||||
| Виталис | Доброго дня | Эделвейс | Аптечний киоск | Фармакон | Аптека ЛМНУ | Арс биос | Фарма | D.S. | ||
| Упсарин упса | Октябрь | 1.00 грн. | 0.90 ггрн. | 0.95 грн. | 0.90 грн. | 0.85 грн. | 0.90 грн. | 0.95 грн. | 0.90 грн. | 0.95 грн. |
| Упсарин упса | Ноябрь | 1.00 грн. | 0.95 грн. | 0.95 грн. | 0.95 грн. | 0.95 грн. | 0.90 грн. | 0.95 грн. | 0.95 грн. | 0.95 грн. |
| Упсарин упса | Декабрь | 1.00 грн. | 1.00 грн. | 0.95 грн. | 0.95 грн. | 1.00 грн. | 0.95 грн. | 1.00 грн. | 0.95 грн. | 0.95 грн. |
Выписывание рецептов и отпуск ЛС из аптеки
| Лекарственное средство | Форма рецептурного бланка | Дополнительные реквизиты | Срок | Норма отпуска за одним рецептом | Отношение к ПКО | |
| Действия рецепта | Хранения рецепта в аптеке | |||||
| Ацетилсалициловая кислота | Ф‑1 | - | 1 месяц (с дня выпуски) | Без сохранение | - | - |
Алгоритм фармацевтической опеки при отпуске из аптеки исследуемых ЛС
Ацетилсалициловая кислота – имеет известное противовоспалительное, анальгетическое и жаропонижающее действие. В настоящее время широко применяется в качестве антиагреганта. Ацетилсалициловая кислота необратимо ингибирует циклооксигеназу, и таким образом нарушает образование из арахидоновой кислоты циклических ендопероксидов, предшественников тромбоксана А2, при этом уменшается не только синтез тромбоксана А2 в тромбоцитах, но и синтез простациклина в эндотелиальных клетках сосудов. Однако путем подбора соответствующих доз и режима дозирования можно добиться преимущественного действия ацетилсалициловой кислоты на синтез тромбоксана А2. Это связано с существенными различиями между тромбоцитами и эндотелиальными клетками.
Тромбоциты – безъядерные клетки – не имеют системы ресинтеза белка и, следовательно, не способны синтезироват циклооксигеназу. Поэтому при необратимом ингибировании циклооксигеназы нарушение синтеза тромбоксана А2 сохраняетса на протяжении всей жизни тромбоцита – в течение 7–10 дней. Однако вследствие образования новых тромбоцитов антиагрегантное действие ацетилсалициловой кислоты продолжается меньший период времени и для достижения стабильного эффекта препарата его рекомендуют назначать 1 раз в сутки.
В клетках эндотеля происходит ресинтез циклооксигеназы, вследствие чего ее активность восстанавливается уже через несколько часов после необратимого ингибирования ацетилсалициловой кислотой. Поэтому при назначении препарата 1 раз в сутки не произходит существенного снижения синтеза простациклина.
Кроме того, ацетилсалициловая кислота приблизительно на 30% подвергается пресистемному метаболизму в печени, вследствие чего ее концентрация в системного кровотоке ниже, чем в портальной крови. В результате на тромбоциты, циркулирующие в портальном кровотоке, ацетилсалициловая кислота действует в более высоких концентрациях, чем на эндотелиалные клетки системных сосудов. Поэтому для подавления синтеза тромбоксана А2 в тромбоцитах необходимым меньшие дозы ацетилсалициловой кислоты, чем для подавления синтеза простациклина в клетках эндотелия. При увеличении дозы ацетилсалициловой кислоты ее угнетающее действие на синтез простациклина становится более выражинным, что может привести к уменьшению антиагрегантного эффекта препарата. В связи с указанными особенностями ацетилсалициловую кислотув качестве антиагреганта рекомендуют назначать в небольших дозах (обычно 100 мг) 1 раз в сутки.
Как антиагрегант ацетилсалициловая кислота используется для профилактики инфаркта миокарда, при нестабильной стенокардии, для профилактики ишемического инсульта и тромбозов периферических сосудов, при аортокоронарном шунтировании и коронарной ангиопластике.
Ацетилсалициловую кислоту назначают внутрь в дозах 75-325 мг 1 раз в сутки на протяжении длительного времени. В настоящее время в распоряжении вречей имеются препараты ацетилсалициловой кислоты, предназначенные для продилактики тромбозов, которые содержат 50-325 мг действующего вещества – Аспирин кардио, Буферин, Новандол, Тромбо АСС и др.
Основные побочные эффекты ацетилсалициловой кислоты связаны с угнетением циклооксигеназы. При этом нарушается образование простагландинов Е2 и I2 (простациклина), которые оказывают гастропротекторное действие. В результате даже при непродолжительном применении ацетилсалициловая кислота может вызвать повреждение эпителия желудка и дванадцетоперсной кишки (ульцерогенны эффект). При применении ацетилсалициловой кислоты возможны желудочно-кишечные кровотечения и другие геморрагические осложнения. Избирательное ингибирование циклооксигеназы приводит к активации липоксигеназного пути превращения арахидоновой кислоты и образованию лейкотриенов, обладающих бронхоконстрикторными свойствами. У больных бронхиальной астмой ацетилсалициловая кислота может провоцировать начало приступа (аспириновая астма). Возможные аллергические реакции.
Експрес-анализ лекарственных средств индивидуального изготовления
| Пропись | Методика количественного анализа, навеска, количество титр. р-ра | Расчет количества действующих веществ |
| Ацетилсалициловая кислота | К 0,005г препарата прибавляют 3 капли реактива Марки и слегка нагревают; появляется розовое окрашивание (образование ауринового красителя) | 0.005 г. Ацетилсалициловая кислота 3г реактива Марки |
| Ацетилсалициловая кислота | 0.005 г. препарата кипятят с 1–2 мл воды, охлаждают, прибавляют 1–2 капли раствора хлорида оксидного железа; появляетса фиолетовое окрашивание. | 0.005 г. Ацетилсалициловая кислота 1–2 мл воды 1–2 капли раствора хлорида оксидного железа |
Показатели, которые используются при начислении содержаний из заработной платы
| Показатели | Значение показателя в текущем году, грн. | ||||
| с 1 января | с 1 апреля | с 1 июля | с 1 октября | с 1 декабря | |
| Минимальная заработная плата | 515 грн | 525 грн | 545 грн | 605 грн | |
| Прожиточный минимум для трудоспособныь лиц | 633 грн | 647 грн | 649 грн | 669 грн | 669 грн |
| Прожиточный минимум для детей до 6 лет | 526 грн | 538 грн | 540 грн | 557 грн | 557 грн |
| Прожиточный минимум для детей 6–18 лет | 663 грн | 668 грн | 680 грн | 701 грн | 701 грн |
| Прожиточный минимум для лиц, утративших трудоспособность | 470 грн | 481 грн | 482 грн | 458 грн | 498 грн |
| Податковая социальная льгота (ПСЛ) | С начало года 257,5 | ||||
| Максимальный доход, к которому применяется ПСЛ | С начало года 890 | ||||
| Максимальная сумма заработной платы для начисления взносов в фонды | 9495 | 9705 | 9735 | 9735 | 10305 |
Общогосударственные обязательные содержания из заработной платы наемных работников за 2008 г.
| Совокупный месячный доход | Ставки общегосударственных обязательных издержек, налога | ||||
| Взносы в Пенсионный фонд Украины | Взносы в фонд социального страхования | Налоговая социальная льгота (безналоговый доход) | Налог по доходам физических лиц | ||
| В связи с временной потерей трудоспособности | В случае безработицы | ||||
| 600 грн | 600•2%=12 грн | 600•0,5%=3 грн | 600•0,5%=3 грн | 275,5 грн | 45,97 грн |
| 7500 грн | 7500•2%=150 грн | 7500•1%=75 грн | 7500•0,5%=37,5 грн | - | 1108 грн |
| 1100 грн | 1100•2%=22 грн | 1100•1%=11 грн | 1100•0,5%=5,5 грн | - | 159,2 грн |
Общогосударственные обязательные начисления на фонд заработной платы в 2008 г.
| Период | Ставки общегосударственных обязательных начислений, % | |||
| Взносы в Пенсионный фонд Украины | Взносы в фонд социального страхования | |||
| В связи с временной потерей трудоспособности | В случае безработицы | От несчастного случая на производстве | ||
| 1600 грн | 1600•31,8%=508,8 грн | 1600•2,9%=46,4 грн | 1600•1,3%=20,8 грн | 1600•0,7%=11,2 грн |
Создать модель конкурентоспособной аптеки
v Место расположения аптеки – Самая главная улица, возле остановка транспорта, непосредственно до спальном районе. В Болгарский морский городом Поморие.
v Ценовая политика – составляет скитьки и акции для редовных клиентов в размер 3%.
v Характеристика ассортимента ЛС – Полны набор асортимента Лекарсвенных средств. Косметические средства парфюмерия. Исшо шприцы вата и слабительных шоколады.
v Использование принципов фармацевтической этики – Фармацевт должен быть всегда с улыбкой, любезны, приятной.
v Скорость и качество обслуживания – Должен обяснять нужное лекарственное средство в полностью и быть возможнее быстрый в обслуживания. Клиент навсегда имеет право.
v Режим работы – дни от 8:00 до 21:30, Воскресение от 10:00 до 18:00
v Внешней и внутринний интерьер аптеки – На верху возле входе будет большоя кружещаяся таблетка, будет и реклама свечещая в ночи. Должна имет кресло, быть с склянные рафты на стенке для косметики.
v Дополнительные услуги, которые предоставлются аптекой – В аптеке будут предлагаться вымеривание кровеное давление. Будет машина для воды холодна и горячая, а на входе будет и машина фля кофе.
Оценка финансового состояния аптеки по данным внешной финансовой отчетности
Анализ основных экономических показателях аптеки
| № п/п | Показатель | Значение | Темп прироста, % | Тип изменения |
| 1. | Чистый доход, тыс. грн | 825,2 | 2% | J |
| 803,7 | ||||
| 2. | Сумма торговой наценки, тыс. грн | 226,8 | 5% | J |
| 214,2 | ||||
| 3. | Уровнь торговой наценки, % | 27,4 | 3% | J |
| 26,6 | ||||
| 4. | Сумма издержек (без себестоймости товара) тыс. грн | 49,1 | -13% | L |
| 56,8 | ||||
| 5. | Уровень издержек, % | 5,9 | -16% | L |
| 7,06 | ||||
| 6. | Чистая прибыль, тыс. грн | 26,3 | 2,92% | J |
| 6,7 | ||||
| 7. | Рентабельность продажи | 0,03 | 2,75% | J |
| 0,008 | ||||
| 8. | Коэффициент оборотности товара | 2,21 | 12% | J |
| 1,96 | ||||
| 8.1 | Период одного оборота товара, дни | 162,9 | -11% | L |
| 183,7 | ||||
| 9. | Валюта баланса | 1696,6 | -2% | L |
| 1741,8 |
Рассчет интегральных показателей
| Группа показателей | Аптека | ||
| Позитивные | Без изменений | Негативные | |
| Абсолюные (показ. 1,2,4,6,9) | 1,2,6 | - | 4,9 |
| Относительные (показ. 3,5,7) | 3,7 | - | 5 |
| Оборотности товар (показ. 8,1) | 8 | - | 8.1 |
| Всего | 6 | - | 4 |
| Iep | Lg 0,7782 | - | Lg 0,6021 |
Вывод: Интегральный показатель меньше 1, следует что аптека не очень конкурентноспособная.
Используемая литература
1.www.pharma-center.kiev.ua
2.www.provisor.com.ua
3.www.apteka.ua
4.www.dtkt.com.ua
5.www.moz.gov.ua
6.www.pharm-cis.com
0 комментариев