1. Технологические свойства метанола Метанол (метиловый спирт) СН3ОН представляет бесцветную легкоподвижную жидкость с температурой кипения 64,65°С, температурой кристаллизации -97,9°С и плотностью 0,792 т/м3. Критическая температура метанола равна 239,65°С. Метанол смешивается во всех отношениях с водой, спиртами, бензолом, ацетоном и другими органическими растворителями, образуя с некоторыми из них азеотропные смеси. Не растворим в алифатических углеводородах. В водных растворах образует эвтектику, содержащую 93,3%(мол.) метанола. Хорошо растворяет многие газы, в том числе оксиды углерода, ацетилен, этилен и метан, вследствие чего используется в технике для абсорбции примесей из технологических газов. В твердом состоянии существует в двух кристаллических формах, переходящих одна в другую при -115,75°С. Пары сухого метанола образуют с воздухом взрывчатые смеси с пределами взрываемости: нижний 6,0% (об.) и верхний 34,7% (об.). Метанол токсичен, вызывает отравление через органы дыхания, кожу и при приеме внутрь, действуя на нервную и сосудистую системы. ПДК составляет 5 мг/м3. Прием внутрь 5—10 мл приводит к тяжелому отравлению, доза 30 мл и более может быть смертельной.
Применение метанола и перспективы развития производства
Метанол — сырье для многих производств органического синтеза. Основное количество его расходуется на получение формальдегида. Он служит промежуточным продуктом в синтезе сложных эфиров органических и неорганических веществ (диметилтерефталата, метилметакрилата, диметилсульфата), пентаэритрита. Его применяют в качестве метилирующего средства для получения метиламинов и диметиланилина, карбофоса, хлорофоса и других продуктов. Метанол используют также в качестве растворителя и экстрагента, в энергетических целях как компонент моторных топлив и для синтеза метил-трет-бу-тилового эфира — высокооктановой добавки к топливу. В последнее время наметились новые перспективные направления использования метанола, такие как производство уксусной кислоты, очистка сточных вод, производство синтетического протеина, конверсия в углеводороды с целью получения топлива. В табл. 1 представлена структура потребления метанола по основным направлениям.
Структура потребления метанола, %
Таблица 1.
| Область применения | Беларусь и Россия | Западная Европа |
| Производство формальдегида | 34,6 | 42,4 |
| Производство СК | 12,6 | - |
| Производство диметилтерефталата | 1,8 | 4,3 |
| Производство уксусной кислоты | 2,0 | 6,0 |
| Компонент моторного топлива | 1,0 | 6,3 |
| Процессы метилирования | 4,7 | 10,7 |
| Прочие направления использования | 43,3 | 30,3 |
2. Сырьевые источники получения метанола
Структура сырья в производстве метанола, %.
Таблица 2.
| Сырье | В мире | Беларусь и Россия |
| Природный газ | 73,8 | 70,7 |
| Нефть и нефтепродукты | 24,4 | 4,0 |
| Отходы других производств | - | 17,4 |
| Каменный уголь | 1,8 | 7,9 |
При современной тенденции роста цен на нефть и нефтепродукты перспективы имеет переработка каменного угля.
Так, например, по технологической схеме «Мобиль» осуществляется следующий цикл:
уголь → газификация → метанол → синтетический бензин.
Процесс протекает в две стадии: дегидратация метанола до диметилового эфира и, далее, до алкена:
2СН3ОН → СН3ОСН3 + Н2О → СН2=СН2 + 2Н2О
и последующие превращения алкенов в парафины, циклопарафины и ароматические углеводороды. В качестве катализаторов используются синтетические цеолиты [2].
3. Многочисленные технологические схемы производства метанола включают три обязательных стадии:
—очистка синтез-газа от сернистых соединений, карбонилов железа и частиц компрессорного масла,
—собственно синтез,
—очистка и ректификация,метанола-сырца,
В остальном технологические схемы различаются аппаратурным оформлением и параметрами процесса. Все они могут быть разделены на три группы.
1. Синтез при высоком давлении проводится на цинк-хромовых катализаторах при температуре 370—420°С и давлении 20—35 МПа. В настоящее время этот процесс устарел и вытесняется синтезом при низком давлении.
2. Синтез при низком давлении проводится на цинк-медь-алюминиевых или цинк-медь-хромовых катализаторах при температуре 250—300°С и давлении 5—10 МПа. Использование в этом методе низкотемпературных катализаторов, активных при более низких давлениях, позволяет снизить энергозатраты на сжатие газа и уменьшить степень рециркуляции непрореагировавшего сырья, то есть увеличить степень его конверсии. Однако, в этом методе требуется особо тонкая очистка исходного газа от соединений, отравляющих катализатор.
3. Синтез в трехфазной системе «газ—жидкость—твердый катализатор», проводимый в суспензии из тонкодисперсного катализатора и инертной жидкости, через которую барботируется синтез-газ. Этот процесс отличается от первых двух, которые проводятся в двухфазной системе «газ - твердый катализатор». В трехфазной системе может бытъ обеспечено более благоприятное состояние равновесия системы, что позволяет повысить равновесную концентрацию метанола в реакционной смеси до 15% вместо 5% при использовании двухфазных систем, доведя степень конверсии оксида углерода (II) до 35% вместо 15% и еще более уменьшить рециркуляцию газа и энергозатраты.
Возросшая потребность в метаноле вызвала разработку новых перспективных методов его производства. Помимо описанного выше трехфазного синтеза к ним относятся:
· синтез метанола прямым окислением метана воздухом на цинк-никель-кадмиевом катализаторе, позволяющий использовать в качестве сырья природный газ непосредственно из скважин;
· совместное производство из синтез-газа метанола и спиртов С2—С4 в виде так называемой «спиртовой композиции», используемой как добавка к моторному топливу;
· совместное производство метанола и аммиака на основе конвертированного газа по малоотходным энерготехнологическим схемам, обеспечивающим рациональное и комплексное использование сырья.
Несмотря на то, что доля метанола используемого на производство моторного топлива в настоящее время еще невелика (см. табл. 2), использование его для топливно-энергетических целей стало весьма перспективным. Это обусловлено возможностью получения метанола из любого углеродсодержащего сырья и неограниченными запасами его, что позволяет использовать метанол в качестве полупродукта в производстве синтетического моторного топлива.
4. Реакция синтеза метанола из синтез-газа представляет гетерогенно-каталитическую обратимую экзотермическую реакцию, протекающую по уравнению:
![]() , где ΔН1=90,7 кДж (а)
, где ΔН1=90,7 кДж (а)
Тепловой эффект реации возрастает с повышением температуры и давления и для условий синтеза составляет 110,8 кДж.
Параллельно основной протекают и побочные реакции:
![]() , где ΔН2=209 кДж (б)
, где ΔН2=209 кДж (б)
![]() , где ΔН3=252 кДж (в)
, где ΔН3=252 кДж (в)
![]() , где ΔН4=8,4 кДж (г)
, где ΔН4=8,4 кДж (г)
а также продукционная реакция образования метанола из содержащегося в синтез-газе диоксида углерода:
![]() , где ΔН5=49,5 кДж (д)
, где ΔН5=49,5 кДж (д)
Кроме этого, образовавшийся метанол может подвергаться вторичным превращениям по реакциям:
![]()
![]()
![]()
Реакции (а—д) протекают с выделением тепла и уменьшением объема, но различаются величиной теплового эффекта и степенью контракции. Поэтому, хотя для всех этих реакций степень превращения возрастает с увеличением давления и понижением температуры, в наибольшей степени повышение давления влияет на равновесие основной реакции синтеза (а), для которой степень контракции максимальна и составляет 3:1. В то же время, понижение температуры ниже некоторого предела нецелесообразно, так как при низких температурах скорость процесса синтеза настолько мала, что не существует катализатора, который в этих условиях мог бы существенно ускорить достижение высокой степени превращения сырья.
Вследствие противоречивого влияния температуры на скорость процесса и равновесную степень превращения выход метанола за один проход реакционной смеси через реактор не превышает 20%, что делает необходимой организацию циркуляционной технологической схемы синтеза.
Температура процесса зависит главным образом от активности применяемого катализатора и варьируется в пределах от 250 до 420°С. В соответствии с температурным режимом работы катализаторы синтеза метанола подразделяются на высокотемпературные и низкотемпературные. Высокотемпературные катализаторы, получаемые методом соосаждения оксидов цинка и хрома, например, катализатор СМС-4 состава 2,5 ZnOZnCr2O4, термостойки, мало чувствительны к каталитическим ядам, причем отравляются обратимо, имеют высокую селективность, но активны только при высоких температурах (370—420°С) и давлениях (20—35 МПа). Низкотемпературные катализаторы, например, цинк-медь-алюминиевый состава ZnOCuOAl2O3 или цинк-медь-хромовый состава ZnО-СиО-Сг2О3, менее термостойки, необратимо отравляются каталитическими ядами, но проявляют высокую активность при относительно низких температурах (250—300°С) и давлениях (5—10 МПа), что более экономично.
Оба типа катализаторов проявляют свою активность и селективность в узком интервале температур 20—30°С. Исходя из температурного режима работы катализаторов выбирается давление синтеза, которое тем больше, чем выше температура синтеза.
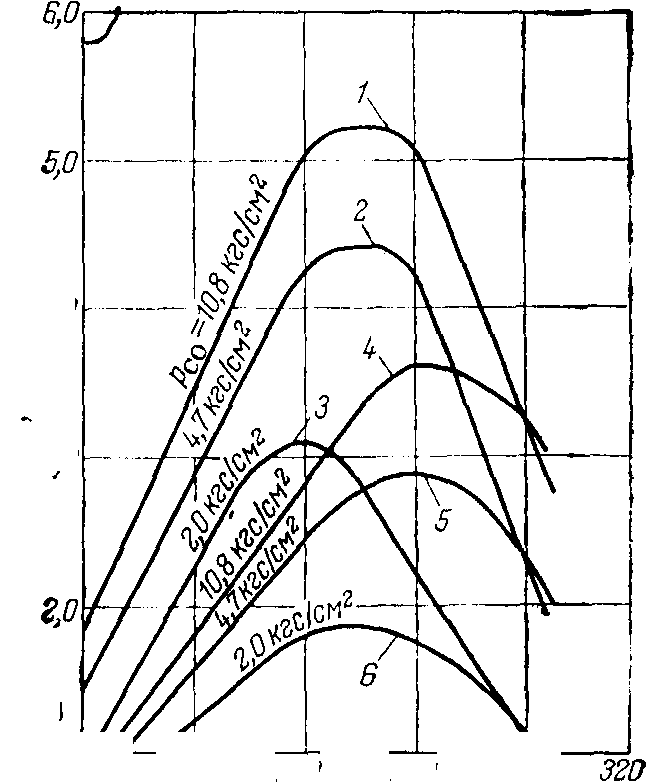
Состав исходной газовой смеси оказывает существенное влияние как на степень превращения оксидов углерода, так и на равновесную концентрацию метанола в продуктах синтеза. С увеличением объемного отношения Н2:СО в синтез-газе степень превращения оксидов углерода возрастает, причем оксида углерода (IV) более интенсивно [рис. 12.2, 2]. Из рисунка также сле дует, что оптимальный состав газовой смеси отвечает отношению Н2:СО=5:1. Равновесная концентрация метанола в продуктах реакции проходит через максимум, который отвечает стехиометрическому отношению Н2:СО в исходной газовой смеси [рис. 12.3, 2].
Скорость образования метанола является функцией многих переменных:
![]()
где: к — константа скорости реакции синтеза метанола;
Ск — концентрация компонентов исходной газовой смеси,
τ — время контакта,
Т — температура,
Р — давление.
Образующиеся при синтезе побочные продукты оказывают существенное влияние на стадию хемосорбции и на кинетику образования метанола в целом. Поэтому, для реакции синтеза метанола предложено большое количество различных кинетических уравнений, выведенных на основе выдвинутых их авторами предположений о механизме реакции. Независимо от этого, время контактирования для реальных условий процесса синтеза может быть рассчитано по формуле [2]:
![]() (1)
(1)
где: Р — давление, 1 МПа; Т — температура, К;
W — объемная скорость газа при нормальных условиях, с-1.
Согласно [рис. 17.3., 1] оптимальными параметрами процесса являются объемная скорость газа – 40 000 ч-1; температура 370 – 380 оС при давлении 30 МПа. При этих значениях производительность катализатора составляет около 3,15 кг/(м3·ч). Концентрация метанола – 40 % (рис. 17.2 [1]). Степень превращения СО за один проход – 15%. Согласно [1] максимальная производительность наблюдается при молярном отношении Н2:СО=4:1, на практике поддерживают отношение 2,15 – 2,25.
5. Технологический процесс получения метанола из оксида углерода и водорода включает ряд операций, обязательных для любой технологической схемы синтеза. Газ предварительно очищается от карбонила железа, сернистых соединений, подогревается до температуры начала реакции и поступает в реактор синтеза метанола. По выходе из зоны катализа из газов выделяется образовавшийся метанол, что достигается охлаждением смеси, которая затем сжимается до давления синтеза и возвращается в процесс.
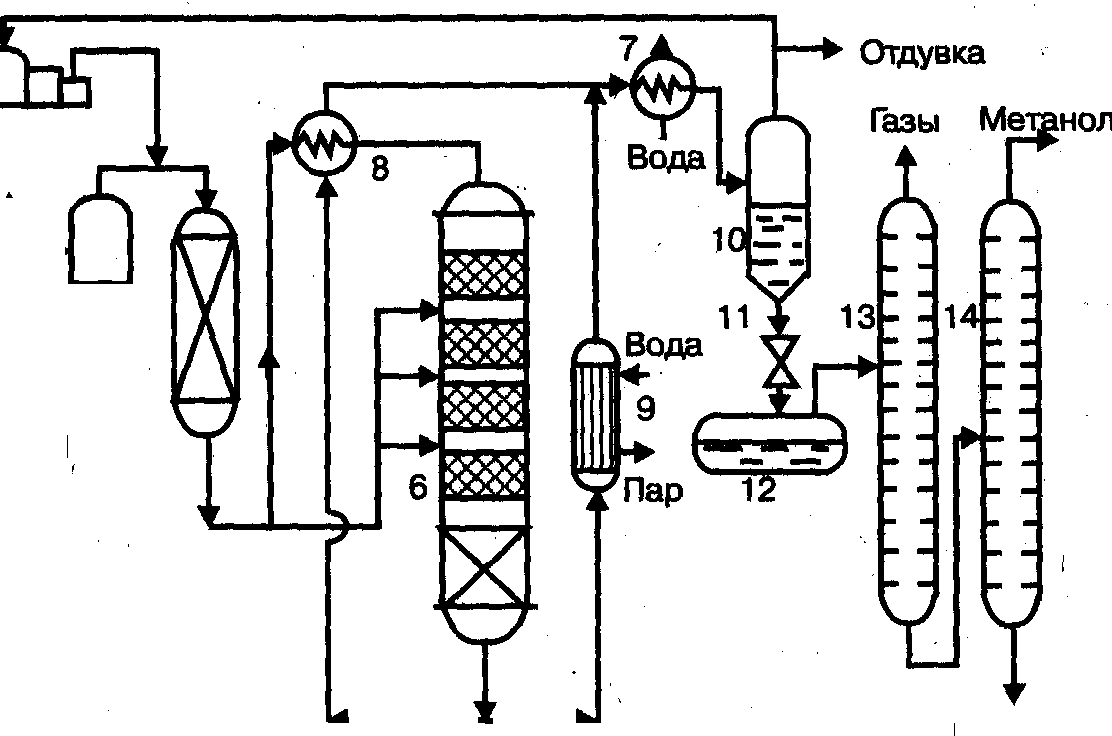
Технологические схемы различаются аппаратурным оформлением главным образом стадии синтеза, включающей основной аппарат колонну синтеза и теплообменник. На рис. 1 представлена схема агрегата синтеза высокого давления с так называемой совмещенной насадкой колонны.
Сжатый до 32 МПа синтез-газ проходит очистку в масляном фильтре 1 и в угольном фильтре 2, после чего смешивается с циркуляционным газом. Смешанный газ, пройдя кольцевой зазор между катализаторной коробкой и корпусом колонны 3, поступает в межтрубное пространство теплообменника, расположенного в нижней части колонны (рис. 2). В теплообменнике газ нагревается до 330—340 °С и по центральной трубе, в которой размещен электроподогреватель, поступает в верхнюю часть колонны и проходит последовательно пять слоев катализатора. После каждого слоя катализатора, кроме последнего, в колонну вводят определенное количество холодного циркуляционного газа для поддержания необходимой температуры. После пятого слоя катализатора газ направляется в теплообменник, где охлаждается с 300—385 до 130 °С, а затем в холодильник-конденсатор типа «труба в трубе» 4 (рис. 1). Здесь газ охлаждается до 30— 35 °С и продукты синтеза конденсируются. Метанол-сырец отделяют в сепараторе 5, направляют в сборник 7 и выводят на ректификацию. Газ проходит второй сепаратор 5 для выделения капель метанола, компримируется до давления синтеза турбоциркуляционным компрессором 6 и возвращается на синтез. Продувочные газы выводят перед компрессором и вместе с танковыми газами используют в качестве топлива.
Размещение теплообменника внутри корпуса колонны значительно снижает теплопотери в окружающую среду, что улучшает условия автотермичной работы агрегата, исключает наличие горячих трубопроводов, т.е. делает эксплуатацию более безопасной и снижает общие капиталовложения. Кроме того, за счет сокращения длины трубопроводов снижается сопротивление системы, что позволяет использовать турбоциркуляционные компрессоры вместо поршневых.
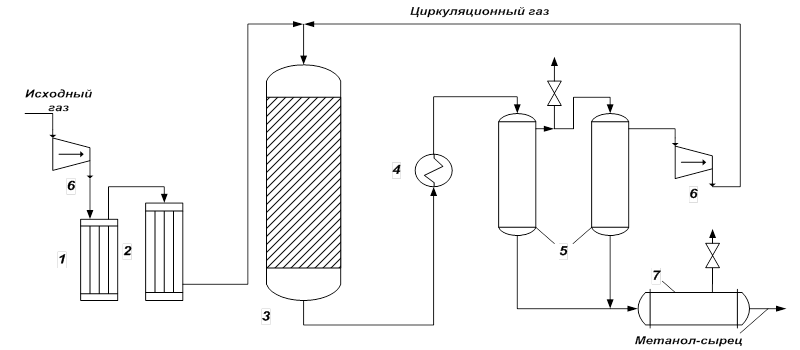
Рис. 1. Схема синтеза метанола.
1 – масляный фильтр; 2 – угольный фильтр; 3 – колонна синтеза; 4 – холодильник-конденсатор; 5 – сепараторы; 6 – компрессоры;
7 – сборник.
Основным аппаратом производства метилового спирта из окиси углерода и водорода является колонна синтеза. Колонны обычно изготавливают из высоколегированной стали, хорошо сопротивляющейся коррозионному действию Н2 и СО, или из низколегированных конструкционных сталей с футеровкой стенок медью или ее сплавами. Производительность колонны синтеза метанола в большой степени зависит от конструкции насадки. В промышленности применяются колонны с насадками разнообразных конструкций.
На рис. 2 схематически изображена колонна синтеза с полочной насадкой (внутренний диаметр колонны 800 мм, высота 12 м, толщина стенок корпуса 90 мм). В верхней части колонны размещается катализаторная коробка 1 с полками 3 для катализатора и электроподогревателем для подогрева газа в пусковой период, в нижней части колонны имеется теплообменник 4. Основной поток синтез-газа вводится сверху и проходит вниз по кольцевому пространству между корпусом колонны и корпусом катализаторной коробки. Далее газ поступает в межтрубное пространство теплообменника 4 и подогревается за счет тепла продуктов реакции, проходящих по трубкам. В межтрубном пространстве теплообменника имеются перегородки, направляющие часть газового потока поперек труб, благодаря чему значительно увеличивается коэффициент теплоотдачи.
Из теплообменники 4 газ через центральную трубу 2 поступает в катализаторное пространство, где протекает реакция образования метилового спирта. Продукты реакции проходят по трубкам теплообменники, охлаждаясь поступающим свежим газом, и через тройник в нижней крышке выводятся из колонны синтеза. Для предотвращения перегрева катализаторной массы в колонну подают холодный («байпасный») газ. Для этого на каждую полку аппарата подведены трубки, изогнутые но окружности и имеющие мелкие отверстия, через которые холодный газ поступает в контактную массу. Количество поступающего холодного газа регулируется клапанами, установленными на подводящих трубках.
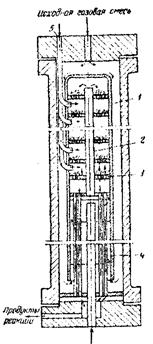
Рис. 2. Колонна синтеза метилового спирта:
1 – корпус катализаторной коробки;
2 – труб для электроподогревателя;
3 – полки катализатора;
4 – теплообменник;
5 – трубки подвода байпасного газа.
6. Расчет материального баланса и основных технологических показателей процесса получения метанола.
Данные для расчета:
Основная реакция:
![]() (1)
(1)
Побочные реакции:
![]() (2)
(2)
![]() (3)
(3)
![]() (4)
(4)
![]() (5)
(5)
![]() (6)
(6)
![]() (7)
(7)
Рабочий объем катализатора – 24 м3.
Расход оксида углерода и метанола на побочные продукты с учетом рецикла, %(масс.):
СО СН3ОН
Реакция 2 – 3,8 реакция 6 – 1,9
Реакция 3 – 4,1 реакция 7 – 0,5
Реакция 4 – 2,5
Реакция 5 – 0,7
Итого: 11,1 2,4
Температура – 655 К – 382 оС.
Давление – 38,8 МПа.
Объемная скорость газа – 22,2·103![]() .
.
Мольное соотношение Н2 : СО – 7,5.
База для расчета – 1 час работы установки.
1) Объем синтез-газа подаваемого в реактор за 1 час (учетом рецикла)
расход при нормальных условиях
V0=22,2·103·24=532,8·103 нм3/ч;
при условиях реактора (по формуле Менделеева-Клайперона)
![]() .
.
2) Массы водорода и оксида углерода, подаваемые в реактор
количество кмоль синтез-газа:
532,8∙103·1000/(22,4∙1000)=23785,7 кмоль/ч;
количество моль водорода:
![]() ;
;
количество кмоль СО
23786-20988=2798 кмоль/ч.
![]() ,
, ![]() ;
;
![]() ,
, ![]() .
.
3) Расход оксида углерода
на целевую реакцию:
78344·(100 - 11,1)/100=69648 кг/час;
на побочные:
78344-69648=8696 кг/час.
4) Масса образующегося метанола
масса водорода на целевую реакцию
![]()
![]() ;
;
Масса метанола
69648+9950=79598 кг/ч.
5) Расход метанола на побочные реакции
на реакцию (6)
79598·1,9/100=1512 кг/ч;
на реакцию (7)
79598·0,5/100=398 кг/ч.
Часовая производительность установки на 100% метанол:
79598-1512-398=77688 кг/ч.
6)Балансовый расчет по реакциям
реакция (2)
СО: 78344·3,8/100=2977 кг/ч;
Н2: ![]()
![]() ;
;
СН4: ![]()
![]() ;
;![]()
Н2О: ![]()
![]() ;
;
реакция(3)
СО: 78344·4,1/100=3212 кг/ч;
Н2: ![]()
![]() ;
;
СН4: ![]()
![]() ;
;
СО2: ![]()
![]() ;
;
реакция(4)
СО: 78344·2,5/100=1959 кг/ч;
С: ![]()
![]() ;
;
СО2: ![]()
![]() ;
;
реакция(5)
СО: 78344·0,7/100=548 кг/ч;
Н2: ![]()
![]() ;
;
НСНО:![]()
![]() ;
;
реакция(6)
СН3ОН: 1512 кг/ч;
(СН3)2О: ![]()
![]() ;
;
Н2О: ![]()
![]() ;
;
реакция(7)
СН3ОН: 398 кг/ч
Н2: ![]()
![]() ;
;
СН4: ![]()
![]() ;
;
Н2О: ![]()
![]() ;
;
Масса непрореагировавшего водорода
41976-9950-638-229-39-25=31095 кг/ч.
Всего образовалось:
∑СН4 = 1701+918+199=2818 кг/ч;
∑Н2О = 1914+425+224=2563 кг/ч;
∑СО2 = 2524+1539=4063 кг/ч.
Основные технологические показатели процесса:
Конверсию исходного сырья рассчитываем как отношение количества израсходованного сырья (СО+Н2) – (Gн - Gк), где Gк – количество непрореагировавшего водорода, к общему количеству сырья в начале процесса Gн:
![]()
Селективность нахожу как отношение готового продукта Gп к прореагировавшему сырью Gc (на 100 % метанол)
![]()
Выход целевого продукта.
Если количество целевого (товарного) продукта Gп, то выход продукта Р в расчете на сырье Gз составит
![]()
Интенсивность работы катализатора рассчитываем как отношение производительности установки по метанолу на объем катализатора:
![]()
где П=79598 кг/ч – количество метанола, полученного в результате реакции (1).
7) Материальный баланс процесса
Таблица 3.
Материальный баланс реактора
| № п/п | Приход | кг/ч | № п/п | Расход | кг/ч |
| 1 | СО | 78344 | 1 | СН3ОН | 77688 |
| 2 | Н2 (с учетом рецикла) | 41976 | 2 | Н2О | 2563 |
| 3 | СО2 | 4063 | |||
| 4 | СН4 | 2818 | |||
| 5 | С | 419 | |||
| 6 | НСНО | 587 | |||
| 7 | (СН3)2О | 1087 | |||
| 8 | Н2 (на рецикл) | 31095 | |||
| ИТОГО: | 120320 | ИТОГО: | 120320 |
РАБОТА НАД ОШИБКАМИ
Селективность нахожу как отношение готового продукта Gп к прореагировавшему сырью Gc (на 100 % метанол)
![]()
где GП=77688 кг/ч – расход метанола (по материальному балансу);
Gс – расход прореагировавшего сырья:
78344 кг/ч – расход СО, 9950 кг/ч – расход водорода на целевую реакцию (1).
Интенсивность работы катализатора рассчитываем как отношение производительности установки по метанолу на объем катализатора:
![]()
где П=77688 кг/ч – количество полученного метанола (по материальному балансу).
ЛИТЕРАТУРА
1. Кутепов А.М., Бондарева Т.И., Беренгартен М.Г. Общая химическая технология. Учебник для технических ВУЗов. – М.: «Высшая школа», 1990. – 512 с.
2. Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза: Учебник для вузов. – М. Химия, 1988. – 592 с.
3. Общая химическая технология: Учеб. для химико-техн. спец. вузов. В 2-х т./под ред. проф. И.П.Мухленова. – М.: Высш. шк., 1984. – 263 с.
4. Паушкин Я.М., Адельсон С.В., Вишнякова Т.П. Технология нефтехимического синтеза, в двух частях. Ч. I. Углеводородное сырье и продукты его окисления. М.: «Химия», 1973. – 448 с.
Похожие работы
... металлов ведет к образованию высших спиртов,(4).Также протекает реакция Будуара (6), но только до тех пор, пока не достигнута определенная температура. Влияние вида катализатора на параметры, скорость и глубину процесса Синтез метанола на цинк-хромовом катализаторе В 1923 г. фирмой BASF было предложено проводить синтез метанола на цинк-хромовом катализаторе. На этом катализаторе процесс ...
... опасность перегрева катализатора, кроме того, процесс восстановления можно вести без циркуляционных компрессоров. Пробег промышленного цинк-хромового катализатора в значительной степени определяется условиями восстановления катализатора и процесса синтеза метанола на нем. В начальной стадии развития производств метанола, когда в качестве сырья использовали водяной газ со значительным ...
... с циркуляционным газом, который поджимается до рабочего давления в компрессоре 2. Газовая смесь проходит через адсорбер. Высшие спирты Рис. 1. Технологическая схема производства метанола при низком давлении: 1 — турбокомпрессор, 2 — циркуляционный компрессор, 3, 7 —холодильники, 4 — сепаратор, 5 — адсорбер, 6 — реактор адиабатического действия, б — ...
... эту высокую стоимость. К тому же метанол сильно ядовит. Что касается дизельных двигателей, то в них можно использовать продукт разложения метанола – ДМЭ. 4. Получение диметилового эфира дегидратацией метанола Дегидратация метанола с получением диметилового эфира-исторически первый путь проведения данного синтеза. Этому процессу ещё с 1960-х годов было посвящено множество работ советских и ...
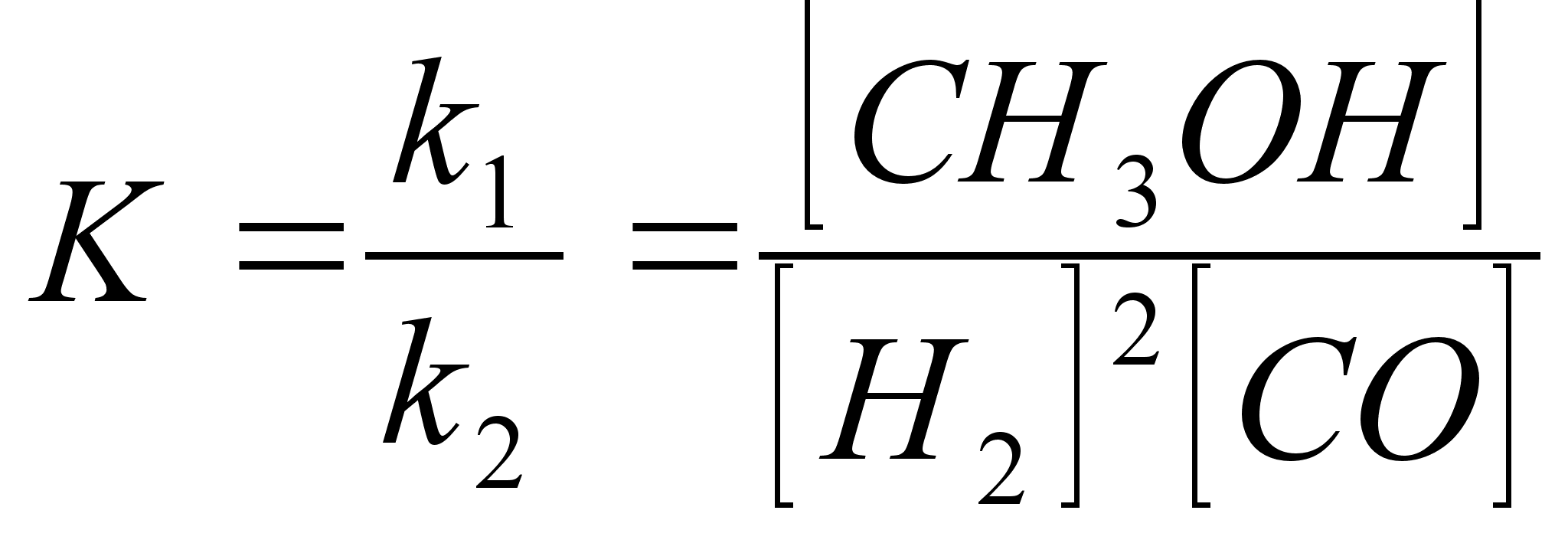
0 комментариев