ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ РОССИЙСКОЙ ФЕДЕРАЦИИ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«САМАРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
ИНЖЕНЕРНО-ТЕХНОЛОГИЧЕСКИЙ ФАКУЛЬТЕТ
Кафедра «Органической химии»
СИНТЕЗ НИТРАТА АДАМАНТАНА
Курсовая работа.
Выполнил: студент 3 - ИТ - III
Авдеев В. Ю.
____________
(подпись)
Научный руководитель
д.х.н. Моисеев И.
_______________
(подпись)
Работа защищена:
«___»____________200_г.
Оценка________________
Зав. кафедрой
д.х.н. Климочкин
(подпись)
СОДЕРЖАНИЕ:
1. Введение……………….………………………………………………..1 – 3
2. Литературный обзор..………………………………………………….4 – 9
3. Экспирементальная часть…………………………………………...10 - 11
4. Выводы…………………………………………………………………….12
5. Библиографический список………………………………………………13
Открытие. Получение.
Адамантан был открыт в 1933г. чехословацкими исследователями С. Ландой и В. Махачеком при исследовании состава нефти Годонинского месторождения. Из тонны этой нефти было выделено несколько граммов тугоплавкого, но летучего вещества, представляющего собой белый порошок. Были установлены состав и строение открытого углеводорода. Ученые дали ему название "Адамантан", которое сразу же привилось. Казалось совершенно несомненным, что адамантан, как и все насыщенные циклические углеводороды, будет устойчив к действию большинства реагентов, например окислителей. Но малая доступность нового вещества не позволила провести масштабные исследования его свойств.
В 1957 г. американский химик П. Шляйер обнаружил, что при обработке гидрированного дициклопентадиена хлоридом или бромидом алюминия с выходом 12% образуется адамантан.

А исходное соединение получается крайне просто, в две стадии, из широко распространенного химического реактива – циклопентадиена.
Через 3 года фирма "Дюпон" взяла патент на сходный процесс, в результате которого адамантан образуется уже с выходом 42%. После того, как адамантан стал доступен, начались исследования его химических свойств.
Структура.
Адамантан – трицикличесий мостиковый углеводород состава С10H16, молекула которого состоит из трех циклогексановых колец; пространственное расположение атомов углерода в молекуле адамантана то же, что и в кристаллической решетке алмаза. Согласно систематической номенклатуре, адамантан следует называть – трицикло [3.3.1.13,7] деканом.
Обычно адамантан изображают одним из следующих способов:
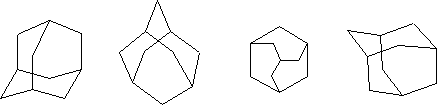
В органической химии существует небольшое число веществ, которые вызывали громадный интерес химиков всего мира. Среди подобных соединений – структуры бензола, ферроцена, карборана, фуллеренов и адамантана, есть и другие молекулярные структуры, вызывавшие и вызывающие интерес химиков-органиков. Вероятно, это во многом обусловлено необычностью структуры самих молекул, особенно высокой степенью их симметрии. Строение адамантана. Углеродный скелет молекулы адамантана подобен структурной единице алмаза.

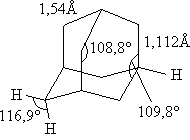
Именно поэтому название «адамантан» произошло от греческого «adamas» – алмаз. Экспериментально полученные структурные характеристики адамантана:
Подобная структура сохраняется практически у всех производных адамантана, что обусловлено высокой устойчивостью адамантанового каркаса. Адамантан – родоначальник гомологического ряда семейства углеводородов алмазоподобного строения диамантана, триамантана и т.д.:
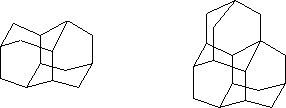
На основе химии адамантана возникла и развилась одна из областей современной органической химии – химия органических полиэдранов.
Применение.
Сейчас синтезировано более тысячи разнообразных производных адамантана, многие из которых представляют не только теоретический, но и практический интерес. Например, радикал адамантил пытаются ввести в молекулы различных лекарственных веществ, в результате чего лекарственные вещества приобретают новые свойства. К лекарствам - производным адамантана относятся:
1) Ремантадин (1-адамантил-1-этиламина гидрохлорид):
Представляет собой белый кристаллический порошок, горький на вкус. Является специфическим химиотерапевтическим препаратом, оказывающим профилактическое действие в отношении гриппозной инфекции, вызванной штаммами вируса типа А2.
2) Адапромин ( 7a 0-Пропил-1-адамантил-этиламина гидрохлорид).
По химической структуре и действию близок к Ремантадину, но эффективен в отношении вирусов гриппа А и В.
3) Мидантан (1-Аминоадамантана гидрохлорид):
Препарат был первоначально предложен в качестве противовирусного средства, эффективного в отношении вирусов гриппа типа А2. В дальнейшем была обнаружена его активность при паркинсонизме, для лечения чего он сейчас и применяется.
4) Глудантан (Глюкуронид 1-аминоадамантана):
Сходен по действию с Мидантаном, эффективен при паркинсонизме разл. этиологии, в частности при нейролептическом и посттравматическом синдроме. Введение в молекулу препарата глюкуронидного радикала несколько уменьшает его токсичность по равнению с Мидантаном и улучшает его прохождение через гематоэнцефалический барьер.
Содержащие адамантан полимеры обладают высокими т-рами стеклования и размягчения, низкой усадкой, прозрачностью и применяются в производстве оптических стекол. Высоковязкие растворы полиадамантилакрилатов - загустители смазочных масел. Алкил замещенные адамантана используются в качестве добавки к топливам для повышения октанового числа.
ОБЩАЯ ХАРАКТЕРИСТИКА НИТРАТОВ СПИРТОВ
Нитраты спиртов, или нитроэфиры, составляют основу бездымных порохов и твердых ракетных топлив, а также входят в состав многих промышленных взрывчатых веществ (динамитов, победитов, некоторых аммонитов и др.) [1]. Ассортимент используемых для вооружения и промышленных целей нитроэфиров, который долгое время ограничивался нитроглицерином и пироксилином, все время расширяется. Широкому применению нитроэфиров в технике, несмотря на их высокую чувствительность к механическим воздействиям и относительно низкую стойкость, способствует легкость получения, доступность исходных материалов и высокие взрывчатые свойства. Многие нитроэфиры способны пластифицировать высокомолекулярный нитроэфир — нитроцеллюлозу. Такая пластификация, приводящая к образованию эластичных масс с хорошими физико-механическими показателями, используется при производстве высокоэнергетического баллиститного пороха.
Некоторые нитроэфиры, например тетранитрат пентаэритрита (тэн), благодаря высокой чувствительности к детонационному импульсу и малому критическому диаметру детонации, используют для снаряжения капсюлей-детонаторов, детонирующих шнуров и детонаторов.
По свойствам нитроэфиры резко отличаются от нитросоединений и нитраминов, вследствие того, что нитрогруппа связана с углеродом через кислород —С—О—NO2. Эту группировку атомов называют нитратной, а нитроэфиры рассматривают как О-нитросоединения.
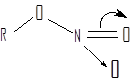 Атомы С, О и N нитратной группировки лежат в одной плоскости, и кратность связи нитрогруппы с кислородом несколько больше единицы, о чем говорит высокий барьер вращения (~ 10ккал/моль) вокруг этой связи:
Атомы С, О и N нитратной группировки лежат в одной плоскости, и кратность связи нитрогруппы с кислородом несколько больше единицы, о чем говорит высокий барьер вращения (~ 10ккал/моль) вокруг этой связи:
Спектроскопические исследования различных Нитроэфиров подтверждают симметричность структуры нитратной группировки. Длины связей и углы между ними следующие :
![]()
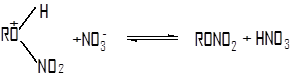
Доказательством связи нитрогруппы с кислородом является реакция восстановления нитроэфиров, приводящая к образованию исходного спирта и аммиака:
RON02![]() ROH + NH3
ROH + NH3
При восстановлении же нитросоединений образуется амин. Структура группы N02 в нитроэфирах та же, что и в нитросоединениях.
ПОЛУЧЕНИЕ
Нитроэфиры могут быть получены при взаимодействии галогеналкилов с нитратом серебра:
R3CX+AgNO3![]() R3CONO2+AgX
R3CONO2+AgX
где Х – Cl, Br, I; R – H, Alk.
Более удобным и широко распространенным способом получения нитроэфиров, особенно в заводской практике, является этерификация спиртов азотной кислотой или серно-азотной кислотной смесью.
Согласно современным взглядам, механизм этерификации спиртов азотной кислотой или серно-азотной кислотной смесью аналогичен механизму образования нитросоединений.
Ингольд этерификацию спиртов рассматривает как O-нитрование. Точнее, он считает, что происходит электрофильное замещение водорода гидроксила на нитрогруппу. Процесс идет в две стадии:
1) присоединение ![]()
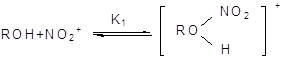
2) отрыв протона
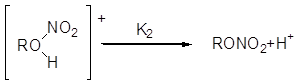
Первая стадия протекает медленно, вторая — быстро.
Образование активного этерифицирующего агента идет по схеме:
2HNO3![]()
![]()
HNO3+2H2SO4![]()
![]()
H2O+H2SO4![]()
![]()
Промежуточный комплекс может распадаться как на конечный, так и на исходный продукт, потому что константы K1 и K2 по величине довольно близки и процесс этерификации является обратимым. Чтобы реакция протекала в нужном направлении, необходим активный акцептор протонов, например ![]() или
или ![]() .
.
Спирт атакует положительно заряженный азот и образует с ним связь за счет свободной электронной пары кислорода гидроксила. Реакция будет идти тем быстрее, чем больше частичный положительный заряд на азоте. Таким зарядом обладает катион нитрония ![]() . Это делает концентрированную серно-азотную кислотную смесь более сильным этерифицирующим агентом, чем чистая азотная кислота.
. Это делает концентрированную серно-азотную кислотную смесь более сильным этерифицирующим агентом, чем чистая азотная кислота.
Теоретическое объяснение этого факта впервые было дано Сапожниковым, полагавшим, что этерифицирующим агентом в серно-азотной кислотной смеси является молекула азотной кислоты, не связанная с Н20 в гидраты благодаря наличию серной кислоты. Некоторым продолжением исследований и развитием взглядов Сапожникова является работа Еременко, который считает, что механизм О-нитрования Ингольда недостаточно полно отражает процесс и не объясняет многих его явлений.
На основании калориметрических исследований реакции О-нитрования метанола, этиленгликоля, метриола, глицерина, мезоэритрита, пентаэритрита и других спиртов было показано, что О-нитрование одной азотной кислотой прекращается, если в ней воды становится более 40%. Таким образом, даже разбавленная азотная кислота, не содержащая катион нитрония, обладает этерифицирующим
действием.
Кинетические исследования О-нитрования спиртов непрерывным автоматическим методом по выделению реакционного тепла, а также О-нитрования меченого мезоэритрита (180) азотной кислотой позволили предположить, что О-нитрующим агентом является свободная неионизированная азотная кислота. Механизм складывается из следующих реакций:
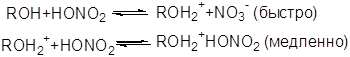
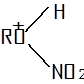
![]()
(медленно)
 (быстро)
(быстро)
![]() (быстро)
(быстро)
Реакционная способность спиртов различна, при электрофильном замещении Н на N02 она определяется электронной плотностью атома кислорода гидроксила, усиленной или ослабленной индукционным эффектом, распространяемым по цепи атомов, из которых состоит молекула.
Первичные спирты этерифицируются азотной кислотой легче, чем вторичные. Это различие используют в практике при получении неполных эфиров многоатомных спиртов. В многоатомных спиртах α-гидроксильные группы более реакционноспособны, чем β-гидроксильные группы. Поэтому для получения тринитрата глицерина используют безводные серно-азотные кислотные смеси, в то время как динитрат глицерина получают с использованием чистой азотной кислоты.
Повышение содержания азотной кислоты в отработанной кислоте увеличивает выход нитроэфира, а повышение содержания воды, наоборот, влечет за собой уменьшение выхода нитроэфира, вследствие его гидролиза.
При выборе состава кислотной смеси необходимо помнить также, что серная кислота не только ускоряет этерификацию, но при определенном избытке разлагает продукты этерификации. При этом эфиры азотной кислоты могут переходить в эфиры серной кислоты:
![]()
Для этерификации спиртов можно применять в качестве водоотнимающего средства уксусный ангидрид или его смесь с ледяной уксусной кислотой. В этом случае, по сравнению с этерификацией в присутствии серной кислоты, исключается образование сульфатов, наличие которых во взрывчатых азотнокислых эфирах нежелательно, так как они понижают стойкость нитроэфиров и затрудняют стабилизацию.
Нитроэфиры получают при определенной, обычно невысокой, температуре, поскольку повышение температуры увеличивает скорость не только этерификации, но и обратной реакции омыления, а также процессов окисления. Окислительные процессы снижают выход нитроэфиров и увеличивают опасность их производства. Повышение температуры выше определенного предела может привести к загоранию массы, вследствие прогрессивно увеличивающихся скоростей реакций этерификации и окисления. Из-за большого теплового эффекта окисления охлаждающая поверхность аппаратуры не сможет обеспечить полный отвод выделившегося тепла, температура реакционной массы будет прогрессивно расти может достичь температуры воспламенения спирта и нитрата, что повлечет за собой взрыв.
Повышение температуры при этерификации особенно опасно для некоторых эфиров азотной кислоты, обладающих низкой стойкостью в неочищенном состоянии. Оно может вызвать саморазложение полученного продукта, которое часто ускоряется окислами азота. Саморазложение нитроэфиров, как правило, остановить охлаждением не удается, и оно оканчивается загоранием или даже взрывом.
ХИМИЧЕСКИЕ СВОЙСТВА.
1) Гидролиз
Характерным свойством нитроэфиров является их способность к гидролизу как в щелочной, так и в кислой среде:
RONO2+H2O![]() ROH+HNO3
ROH+HNO3
Гидролиз сопровождается образованием, наряду с основными продуктами (спирт и кислота), ряда побочных продуктов: альдегидов кетонов карбоновых кислот, ненасыщенных соединении, азотной кислоты и т.
2) Восстановление
Восстановление нитроэфиров приводит, как правило, к образованию исходного спирта и аммиака. В некоторых случаях, в зависимости от природы восстанавливающего агента, продуктами реакции могут быть N2, NO, а также вместо спирта эфир той кислоты, в которой проводили восстановление.
3) Переэтирификация
Специфичной для нитроэфиров является реакция переэтерификации. В частности, взаимодействие их с серной кислотой приводит к замене нитрогруппы сульфогруппой:
RONO2+H2SO4![]() ROSO3H+HNO3
ROSO3H+HNO3
При нагревании нитроэфиров в уксусной кислоте, содержащей серную кислоту, кроме переэтерификации может протекать реакция, приводящая к образованию альдегидов.
4) Нитрование
Благодаря подвижности нитрогруппы, нитроэфиры способны нитровать различные органические соединения в кислой и щелочной средах Например, пиррол и индол легко нитруются этилнитратом:
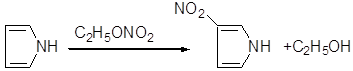
5) Интересным свойством нитроэфиров является их способность катализировать реакции полимеризации.
Например, нитроглицерин инициирует полимеризацию стирола и метилметакрилата.
ФИЗИЧЕСКИЕ СВОЙСТВА И ПРИМЕНЕНИЕ
Низкая энергия связи О—N02 в нитроэфирах (35—41 ккал/моль) по сравнению с энергиями связей С—N02 в нитроуглеводородах (52—57 ккал/моль) и N—N02 в нитраминах (41—47 ккал/моль) объясняет их низкую термическую стойкость. Температура вспышки нитроэфиров лежит в пределах 195—215 °С. Термический распад взрывчатых веществ этого класса характеризуется резким автокаталитическим ускорением и часто заканчивается взрывом. Особенно низкой стойкостью отличаются влажные продукты, плохо отмытые от кислоты. Этерификация спирта и выделение продукта реакции являются опасными операциями из-за нестойкости «кислых» нитроэфиров. В этих условиях начавшееся по тем или иным причинам разложение реакционной смеси быстро ускоряется и заканчивается вспышкой или взрывом. Нитроэфиры являются более мощными взрывчатыми веществами, чем соответствующие нитросоединения, благодаря лучшему кислородному балансу.
Все нитроэфиры токсичны. Попадание в организм приводит к расширению сосудов, головной боли, а при больших концентрациях к смерти. В небольших количествах некоторые нитроэфиры (нитроглицерин, тэн и др.) используются в медицинской практике как сосудорасширяющие средства.
ПОЛУЧЕНИЕ НИТРАТА АДАМАНТАНА.
Химические свойства адамантана впервые были представлены реакциями с бромом, серной кислотой в статьях Ланды, Штеттера, Гелука и Шлатманна.
Реакции адамантана с бромом и серной кислотой отнесены к ионным реакциям, протекающим через стадию образования адамантильного катиона. Однако сведения о действии азотной кислоты на адамантан в ранних исследованиях отсутствуют если не считать работы Смита по нитрованию адамантана смесью азотной и уксусной кислот при 140 °С с образованием моно- и динитроадамантанов.

Первое сообщение о синтезе нитратов взаимодействием адамантана с азотной кислотой относится к 1975 году. Так, реакция адамантана с избытком 96-98 %-й азотной кислоты приводит к 1-нитроксиадамантану в качестве основного продукта реакции и 1,3-динитроксиадамантану.
Несколько позднее авторы предложили для синтеза нитрата 2 использовать смесь азотной и уксусной кислот. Адамантан со смесью азотной и уксусной кислот взаимодействует с меньшей скоростью, чем с азотной кислотой, и максимальный выход нитрата 2 80% (мольное соотношение азотной и уксусной кислот 3:1, количество смеси 24 моль) достигается за 3 ч. Единственным побочным продуктом реакции является адамантанол-1.
Изучение поведения адамантана в азотной кислоте и ее смеси с уксусной кислотой [9] позволило предложить механизм образования 1-нитроксиадамантана, включающий стадию генерации адамантильного катиона.
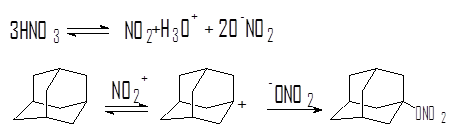
Метод получения нитрата адамантана как перспективного вещества для синтеза функциональных производных адамантана защищен авторским свидетельством.
Однако синтезировать тринитрокси- и тетранитроксипро-изводные непосредственно из адамантана не удалось. Соответствующие нитраты были получены нитрованием спиртов смесью азотной кислоты с уксусным ангидридом. В табл. 1 приведен ряд нитратов полученных этим способом.
Таблица 1
Нитраты адамантана
| Нитрат | Т. пл., °С | Выход, % |
| 1-AdONO2 | 104-105 | 97.0 |
| 1,3-Ad(ONO2)2 | 113-114 | 97.1 |
| 1,3,5-Ad(ONO2)3 | 88 | 70.4 |
| 1,3.5,7-Ad(ONO2)4 | 139-140 | 95.2 |
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ.
1. Уравнение реакции
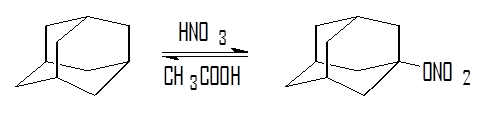
2. Свойства приготовляемого вещества по литературным данным:
Mr 198, Tпл. 1040С Свойства исходных веществ применяемых при синтезе:
| Название | Формула | Mr | Tпл.,0С | Ткип., 0С | Плотность | Примечание |
| Адамантан | С10H16 | 136 | 209 - 212 | х.ч. | ||
| Азотная кислота | HNO3 | 63 | -20 | 121.6 | 1.5 | 98-100% |
| Уксусная кислота | CH3COOH | 60 | 16.64 | 117.8 | 1.1403 |
3. Расчет количества веществ, необходимых для синтеза:
Теоретический расчет
(Ad) 136 – 63 (HNO3)
(Ad) 50 – 23 (HNO3)
(Ad) 136 – 60 (CH3COOH)
(Ad) 50 – 22 (CH3COOH)
Практический расчет
(Ad) 13.6г. – 78г. (HNO3)
(Ad) 50г. – 286г. (НNO3)
(Ad) 13.6г. – 26г. (CH3COOH)
(Ad) 50г. – 96г. (CH3COOH)
4. Таблица количества веществ, необходимых для синтеза:
| Количество веществ по руководству | Количество веществ в пересчете на заданное количество(практический расчет) | Количество веществ по уравнению реакции(теоретический расчет) | Избыток (недостаток) | Примечание | |||||||
| г | мл | моль | г | мл | в пересч. хч. г. | моль | г | моль | г | % | |
| 78 | 52 | 1.2 | 286 | 191 | 280 | 1.3 | 23 | 0.365 | +257 | 91 | 98 – 100% |
| 26.2 | 23 | 0.4 | 96 | 84.5 | 96 | 1.6 | 22 | 0.365 | +74 | 77 | |
| 13.6 | - | 0.1 | 50 | - | 50 | 0.365 | 50 | 0.365 | 0 | 0 | х.ч. |
Реактивы: адамантан 50 г.
азотная кислота 191 мл.
уксусная кислота 84.5 мл
5. Теоретический выход приготовляемого вещества по взятому в недостатке реактиву, участвующему в реакции, равен 72 г
6. Описание хода синтеза
В трехгорлую колбу с механической мешалкой и термометром через воронку вливают 84.5 мл. ледяной уксусной кислоты. Общий объем азотной кислоты делят примерно пополам. Первую порцию азотной кислоты (95 мл.) приливают к уксусной кислоте при этом выдерживаем температуру в пределах 15 – 200С, используя лед, который добавляется в «ванночку» по мере необходимости. Приготовив таким образом смесь кислот, прибавляют небольшими порциями адамантан 50 г. Реакционную смесь выдерживают в течении трех чесов при температуре 15 – 200С. Полученную массу выливают на лед. Выпавший осадок промывают водой и отфильтровывают, сушат.
7. Выход чистого продукта: 48 г. (65% от теоритического количества)
ВЫВОДЫ
1. Рассмотрен литературный материал по нитратам адамантанового и алифатического рядов.
2. Проанализированы и выбрана оптимальная методика проведения синтеза нитрата адамантана.
3. Проведен синтез нитрата адамантана.
Библиографический список.
1. Е. Ю. Орлова. Химия и технология бризантных взрывчатых веществ. Л., «Химия», 1973.
2. R. Boschan, R. Merrow, R. Dolah The Chemistry of nitrate esters. Chemical Reviews., №44, 485 (1955)
3. Раймонд Форд и Пауль Шлейер «Адамантан: значение алмазной структуры». Chemical Reviews №3, 277-300 (1964)
4. Е. О. Жилкина, Ю. Н. Климочкин, М. В. Леонова, И. К. Моисеев «Синтез и свойства нитратов адамантана». Панорама современной химии России. Успехи химии адамантана. Сб. обзорных статей. – М.: Химия, 2007. - 320 с.
5. Средства Интернета:
http://www.krugosvet.ru/articles/124/1012428/1012428a1.htm
http://www.chemport.ru/chemical_encyclopedia_article_18.html
http://www.xumuk.ru/encyklopedia/22.html
http://www.chem.msu.su/rus/teaching/oil/spezprakt-adam.html
0 комментариев