Определение и классификация
СОЛИ - это электролиты, при диссоциации которых образуются катионы (положительно заряженные ионы) металлов и анионы, отрицательно заряженные ионы кислотных остатков:
Na2SO4 2Na+ = SO42-
NH4Cl NH4+ + Cl-
KH2PO4 K+ + H2PO4-
Электролиты - жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток.
Диссоциация - полный или частичный распад молекул растворенного вещества на ионы в результате взаимодействия с растворителем.
Катионы - положительно заряженные ионы.
Анионы - отрицательно заряженные ионы.
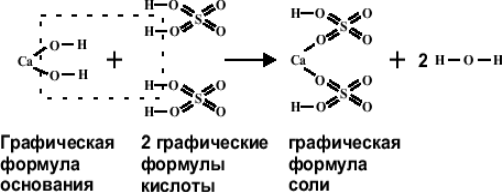
Любую соль можно рассматривать как продукт взаимодействия основания и кислоты, т.е. реакции нейтрализации.
Продуктами полного замещения атомов воды на атомы металлов являются средние соли, например. Na2SO4.Диссоциацию средней соли можно записать так: Na2SO4 2Na+ = SO42-
Если кислота или кислотный оксид взяты в избытке, то при упаривании будут выпадать кристаллы кислой соли: KOH + H2SO4 = KHSO4 + H2O Диссоциацию кислой соли можно записать так: KH2PO4 K+ + H2PO4- Анион кислой соли подвергается вторичной диссоциации, как слабый электролит: HSO4- H+ + SO42-. Кислые соли образуются многоосновными кислотами. Одноосновные кислоты кислых солей не образуют.
Основные соли можно представить как продукт неполного замещения гидроксогрупп основания на кислотные остатки: Mg(OH)2 + HCl = MgOHCl + H2O Диссоциацию основной соли можно выразить уравнением: MgOHCl MgOH+ + Cl- Катион основной соли в незначительной степени подвергается дальнейшей диссоциации: MgOH+ Mg2+ + OH- Основные соли образуются многокислотными основаниями. Однокислотные основания основных солей не образуют. Существуют также двойные и комплексные соли.
Получение
Соли образуются в результате реакций:
1). Основания с кислотой (реакция нейтрализации):
3KOH + H3PO4 =K3PO4 +3H2O
2KOH + H3PO4 =K2HPO4 +2H2O
KOH + H3PO4 =KH2PO4 +H2O
Mg(OH)2 + 2HCl = MgCl2 + 2H2O
Mg(OH)2 + HCl = MgOHCl + H2O
2). Кислоты с основным или амфотерным оксидами:
CuO + H2SO4= CuSO4 + H2O
3). Кислоты с солью:
MgCO3 + 2HCl = MgCl2 + H2O + CO2↑
4). Растворов двух солей
3CaCl2 + 2Na3PO4 = Ca3(PO4)2↓ + 6NaCl
5). Щелочи с кислотным оксидом
6KOH + P2O5 = 2K3PO4 +3H2O
4KOH + P2O5 = 2K2HPO4 + H2O
H2O + 2KOH + P2O5 = 2KH2PO4
6). Щелочи с солью:
Ba(OH)2 + Na2SO4 = 2NaOH + BaSO4↓
7). Основного оксида с кислотным оксидом:
MgO + SO3 = MgSO4
CaO + SiO2 = CaSiO3
8). Металла с неметаллом:
2Na + Cl2 = 2NaCl
9). Металла с кислотой:
Zn + 2HCl = ZnCl2 + H2
10). Металла с солью менее активного металла:
Fe + CuSO4 = FeSO4 + Cu
Существуют и другие способы получения солей.
Химические свойства солей
1). Более активный металл вытесняет из соли менее активный (кроме металлов до магния):
Fe + CuSO4 = FeSO4 + Cu
2). Растворимые соли реагируют со щелочами, если выделяется осадок или газ:
FeCl2 + 2NaOH = 2NaCl + Fe(OH)2↓
Ba(HCO3)2 + Ba(OH)2 = 2BaCO3↓ + 2H2O
3). Две растворимые соли реагируют между собой, если выделяется осадок:
CaCl2 + Na2SiO3 = CaSiO3↓ + 2NaCl
4). Более сильная и менее летучая кислота вытесняет из соли более слабую и более летучую, если выделяется осадок или газ:
AgNO3 + HCl = AgCl↓ + HNO3
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑
5). Многие соли устойчивы при нагревании. Однако соли аммония, некоторые соли малоактивных металлов и слабых кислот при нагревании разлагаются:
CaCO3 = CaO + CO2↑
NH4Cl = NH3↑ + HCl
Ca(HCO3)2 = CaCO3 + CO2↑+ H2O
(CuOH)2CO3 = 2CuO + CO2↑ + H2O
Гидролиз солей
Опыт показывает, что растворы солей могут иметь нейтральную, кислую или щелочную реакцию среды. Объяснение этому факту следует искать во взаимодействии солей с водой.
Взаимодействие ионов соли с водой, приводящее к образованию слабого электролита, называется гидролизом соли.
Любую соль можно рассматривать как продукт взаимодействия кислоты и основания.
![]() Сильные: 1. Щелочи
Сильные: 1. Щелочи
2. Кислоты: HCL, HBr, HJ, HNO3, H2SO4
![]() Электролиты
Электролиты
Слабые: 1. Нерастворимые основания и NH4OH
2. Кислоты: HF, H2CO3, H2SO3, H2SiO3, H3PO4, H2S.
Так, хлорид натрия NaCl образован сильным основанием NaOH и сильной кислотой HCl, хлорид аммония NH4Cl - слабым основанием NH4OH и сильной кислотой HCl, K2CO3 -сильным основанием KOH и слабой кислотой H2CO3, Al2S3 - слабым основанием Al(OH)3 и слабой кислотой H2S.
Таким образом, существует четыре варианта гидролиза солей.
1). Соли образованные сильным основанием и сильной кислотой (например Na2SO4, KBr, BaCl2):
Na2SO4 2Na+ = SO42-
Na+ + HOH →
SO42- + HOH→
Гидролиз не идет, среда остается нейтральной.
2). Соли, образованные сильным основанием и слабой кислотой (например, Na2CO3, Ca3(PO4)2, K2S): реакция раствора соли щелочная, в результате реакции гидролиза образуется слабый электролит - кислота.
KSiO3 2K+ + SiO32-
I. SiO32- + HOH HSiO3- + OH- - краткое ионное уравнение
SiO32- + HOH + 2K+ HSiO3- + OH-+ 2K+ - полное ионное уравнение
K2SiO3 + H2O KHSiO3 + KOH - молекулярное уравнение
II. HSiO3- + HOH H2SiO3 + OH-
HSiO3- + HOH + K+ H2SiO3 + OH- + K+
KHSiO3 + H2O H2SiO3 + KOH
Гидролиз идет не до конца, среда щелочная. Гидролиз практически ограничивается первой ступенью, т. к. ионы HSiO3- диссоциируют гораздо труднее, чем молекулы H2SiO3 ; тем более, что образование молекул H2SiO3 в щелочной среде мало вероятно.
3). Соли, образованные слабым основанием и сильной кислотой (например, FeSO4, CuCl2, AlCl3):
FeCl3 Fe3+ + 3Cl-
I. Fe3+ + HOH FeOH2+ + H+
Fe3+ + HOH + 3Cl- FeOH2+ + H+ + 3Cl-
FeCl3 + H2O FeOHCl2 + HCl
II. FeOH2+ + HOH Fe(OH)2+ + H+
FeOH2+ + HOH + 2Cl- Fe(OH)2+ + H+ + 3Cl-
FeOHCl2 + H2O Fe(OH)2Cl + HCl
III. Fe(OH)2 + + HOH Fe(OH)3↓ + H+
Fe(OH)2 + + HOH + Cl- Fe(OH)3↓ + H+ + 3Cl-
Fe(OH)2Cl + H2O Fe(OH)3↓ + HCl
Гидролиз идет не до конца, среда кислая. В обычных условиях гидролиз практически ограничивается первой стадией, т. к. в кислой среде образование осадка Fe(OH)3↓ маловероятно.
4). Соли, образованные слабым основанием и слабой кислотой (например, Al2S3, Cr2S3 , CH3 COONH4):
а). Растворимые соли:
CH3COONH4 + H2O CH3COOH + NH4OH
CH3COO- + NH4+H2O CH3COOH + NH4OH
Реакция среды в этом случае зависит от сравнительной силы основания и кислоты. Другими словами, водные растворы таких солей могут иметь нейтральную, кислую или щелочную реакцию среды. Все зависит от констант диссоциации образующихся кислот и оснований. Если константа диссоциации основания < константы диссоциации кислоты, то среда кислая, если константа диссоциации основания > константы диссоциации кислоты, то среда щелочная
В случае гидролиза CH3COONH4:
K дисс.(NH4OH) = 6,3 • 10-5 > K дисс.(CH3COOH) = 1,8 • 10-5 , значит реакция среды будет слабощелочной.
б). Неустойчивые и разлагающиеся водой соли:
Al2S3 + 6H2O 2Al(OH)3↓ + 3H2S↑
Продукты гидролиза уходят из сферы реакции, гидролиз необратимый:
2AlCl3 + 3NaCl + 6H2O = 2Al(OH)3↓ + 3H2S↑ + 6NaCl
Поэтому сульфид алюминия не может существовать в виде водных растворов, может быть получен только "сухим способом", например 2Al + 3S == Al2S3
Качественные реакции на катионы
| Катион | Воздействие или реактив | Наблюдаемая реакция |
| Li | Пламя | Красное окрашивание |
| Na | Пламя | Желтое окрашивание |
| K | Пламя | Фиолетовое окрашивание |
| Ca | 1). Пламя 2). CO3 | 1). Кирпично-красное окрашивание 2). Ca + CO3 = CaCO3↓ |
| Ba | 1). Пламя 2). SO4 | 1).Желто-зеленое окрашивание 2). Белый (мелкокристаллический) осадок SO4 +Ba = BaSO4↓ |
| Cu | 1). Пламя 2). Вода 3). Щелочь | 1). Зеленое окрашивание 2). Гидратированные ионы Cu имеют голубую окраску 3). Синий осадок Cu + 2OH = Cu(OH)2↓ |
| Ag | Cl | Белый (творожистый) осадок Cl + Ag = AgCl↓ |
| Al | Щелочь OH (амфотерные свойства гидроксида) | Желеобразный осадок белого цвета, растворяющийся в избытке щелочи Al + 3OH = Al(OH)3↓ |
| NH4 | Щелочь OH | Выделение газа с резким запахом NH4 + OH = NH3↑+ H2O |
| Fe | 1). Щелочь OH 2).Красная кровяная соль K3[Fe(CN)6] | 1). Зеленоватый осадок, буреет на воздухе Fe + 2OH = Fe(OH)2↓ 2). Синий осадок (турнбулева синь) 3Fe+2[Fe(CN)6]= Fe3[Fe(CN)6]2↓ |
| Fe | 1). Щелочь OH 2).Роданид аммония NH4SCN 3).Желтая кровяная соль K4[Fe (CN)6] | 1). Бурый осадок Fe + 3OH = Fe(OH)3↓ 2). Кроваво-красный осадок Fe + 3SCN = Fe(SCN)3↓ 3). Темно-синий осадок "Берлинская лазурь" 4Fe+3[Fe(CN)6]= Fe4[Fe(CN)6]3↓ |
Качественные реакции на анионы
| Анион | Реактив | Результат реакции |
| SO4 | Соли бария Ba | Белый осадок SO4 +Ba = BaSO4↓ |
| NO3 | H2SO4 (конц.) и Cu | Выделение бурого газа Cu+NO3+2H=Cu+NO2↑+H2O |
| PO4 | Нитрат серебра Ag | Ярко-желтый осадок PO4 + 3Ag = AgPO4↓ |
| CrO4 | Соли бария Ba | Желтый осадок Ba + CrO4 = BaCrO4↓ |
| S | Соли свинца Pb | Черный осадок Pb + S = PbS↓ |
| CO3 | Растворы кислот H Ca(OH)2 | Выделение газа без запаха, вызывающее помутнение известковой воды CO3 + 2H = H2O + CO2↑ CO2+ Ca+OH= CaCO3↓+H2O |
| Cl | Нитрат серебра Ag | Белый (творожистый) осадок Cl + Ag = AgCl↓ |
| Br | Нитрат серебра Ag | Желтоватый осадок Br + Ag = AgBr↓ |
| I | Нитрат серебра Ag | Желтый осадок J + Ag = AgJ↓ |
Список использованной литературы
Ковалевская Н.Б. Химия . 8 класс (в таблицах). М., 1997.
Ковалевская Н.Б. Химия . 9 класс (в таблицах). М., 1996.
Гузей Л.С., Сорокин В.В. Основные классы неорганических соединений. М., 1992.
Кузьменко Н.Е., Еремин В.В., Попков В.А. Краткий курс химии. М.,2000.
Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии, I том. М., 1997
Хомченко Г.П., Химия для поступающх в вузы. М., 1985.
Большая Энциклопедия Кирилла и Мефодия. М., 2000.
Похожие работы
... + H BaO + H0 = Ba(OH) Вывод: все основания реагируют с кислотами, образуя соль и воду. Например: NaOH + HNO = NaNO + HO Cu(OH) + 2HCl = CuCl + 2HO 4. Амфотерные оксиды и гидроксиды Основания реагируют с кислотами и наоборот. Всегда получается соль и вода. Ca(OH) + 2HCl = CaCl + 2HO HCO + 2NaOH = NaCO + 2HO Есть такие хим. элементы, которые образуют оксиды и гидроксиды, обладающие двойственными ...
... показывает, что соленакопление не является каким-то исключением, а представляет собой закономерное явление в современном и древнем галогенезе. [5] Наиболее известные месторождения солей. Калуш-Галынское месторождение калийных солей. Соленосные отложения миоцена и приуроченные к ним линзы калийных слей Кулуш-Голынского месторождения являются образованиями внутренней зоны Предкарпатского ...
... вполне оправданы. Добавление соли при приготовлении пищи и в готовые блюда необходимо, с натуральными продуктами ее поступает недостаточно. Для нормального человека в обычных, неэкстремальных условиях, предлагается примерно такой расход соли: 10 г в виде натуральных продуктов и 5 г на досаливание пищи при кулинарной обработке и подсаливание во время еды. Содержание соли в продуктах сильно ...
... атомом донорно-акцепторной связью. Диссоциация: При диссоциации отщепляются сложные ионы, которые затем подвергаются вторичной диссоциации. K4[Fe(CN)6] « 4K+ + [ Fe(CN)6]4-[ Fe(CN)6] 4- « Fe2+ + 6 CN- Получение солей 1. Реакция нейтрализации Растворы кислоты и основания смешивают в нужном мольном соотношении. После выпаривания воды получают кристаллическую соль. Например: H2SO4 ...
0 комментариев