Энергетика химических реакций
I. Химическая термодинамика – это раздел физической химии, которая изучает превращения различных видов энергии при химических реакциях, процессах растворения, кристаллизации. Химическая термодинамика исследует возможности и границы самопроизвольного протекания физических процессов. Объектом изучения в термодинамике является термодинамическая система, под которой понимают условно выделенную из пространства совокупность тел, между которыми возможен масса- и теплообмен.
Системы, которые могут обмениваться с окружающей средой и энергией и веществом называются открытыми. Системы, которые обмениваются только энергией, называются закрытыми.
Если между средой и системой отсутствует и тепло- и массообмен – это изолированная система.
Различают также гомогенные системы, состоящие из одной фазы и гетерогенные, состоящие из нескольких фаз. Реакции, которые протекают на границе раздела фаз – гетерогенные.
Совокупность свойств системы называется состоянием системы. Одна и та же система может находиться в различных состояниях. Каждое состояние характеризуется определённым набором значений термодинамических параметров.
Параметры, описывающие состояние системы, называются параметрами состояния.
Они делятся на интенсивные и экстенсивные. Интенсивные не зависят от размера системы, а зависят от температуры и давления, экстенсивные зависят от массы и объёма. Изменение одного из параметров приводит к изменению состояния в целом.
Состояние системы называется равновесным, если параметры системы во времени самопроизвольно не изменяются. Неравновесная система – параметры во времени изменяются.
Состояние системы и происходящие в ней изменения определяются так же с помощью функций состояния. Функции состояния – внутренняя энергия, энтропия, изобарный, изотермический потенциал.
Переход системы из 1-го состояния во 2-ое называется процессом.
1. ![]() – изотермический процесс
– изотермический процесс
2. ![]() – изохорный процесс
– изохорный процесс
3. ![]() – изобарный процесс
– изобарный процесс
Основной функцией состояния системы является её полная энергия, которая является суммой 3-х состояний: ![]() кинетическая энергия движущейся системы, потенциальная энергия обусловленная воздействием на систему внешних силовых полей, внутренняя энергия.
кинетическая энергия движущейся системы, потенциальная энергия обусловленная воздействием на систему внешних силовых полей, внутренняя энергия.
При термодинамическом описании системы ![]() ,
, ![]() ;
; ![]() и включает в себя энергию всех форм движения молекул, атомов, электронов; энергию межмолекулярного взаимодействия; внутреннюю атомную и внутреннюю ядерную энергию.
и включает в себя энергию всех форм движения молекул, атомов, электронов; энергию межмолекулярного взаимодействия; внутреннюю атомную и внутреннюю ядерную энергию.
Экспериментально внутреннюю энергию ![]() определить нельзя, можно определить лишь её изменение
определить нельзя, можно определить лишь её изменение ![]() :
: ![]() .
.
II. Если система обменивается с внешней средой тепловой энергией ![]() и механической энергией (работой)
и механической энергией (работой) ![]() и переходит из 1-го состояния во 2-ое, то согласно 1-му началу термодинамики – количество энергии, которое выделяется или поглощается системой в виде теплоты
и переходит из 1-го состояния во 2-ое, то согласно 1-му началу термодинамики – количество энергии, которое выделяется или поглощается системой в виде теплоты ![]() и работы
и работы ![]() , равно изменению полной энергии системы
, равно изменению полной энергии системы ![]() , т.е. при переходе из 1-го состояния во 2-ое:
, т.е. при переходе из 1-го состояния во 2-ое: ![]() .
.
Для изохорного процесса (при ![]() ) тепловой эффект реакции при температуре T соответствует изменению внутренней энергии системы в ходе реакции:
) тепловой эффект реакции при температуре T соответствует изменению внутренней энергии системы в ходе реакции: ![]() .
.
Для изобарного процесса (![]() ):
):
![]() , следовательно
, следовательно
![]() или
или ![]() , откуда получаем
, откуда получаем
![]() .
.
Функция ![]() обозначается через
обозначается через ![]() и называется энтальпия.
и называется энтальпия.
Энтальпия – есть функция состояния системы, имеет размерность энергии.
![]()
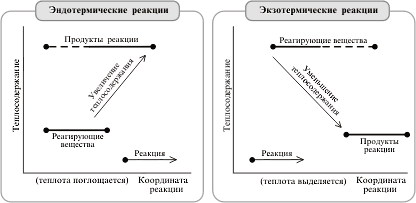
III. Сущность химических реакций сводится к разрыву связей в исходных веществах и образованию связей в продуктах реакции. Т.к. образование связей протекает с выделением энергии, а разрыв с поглощением энергии, то химические реакции сопровождаются энергетическими эффектами. Раздел термодинамики, который изучает тепловые эффекты химических реакций, называется термохимией.
Энергия, которая выделяется и поглощается, называется тепловым эффектом химической реакции.
Если прочность связей в продуктах реакции больше чем в реагентах, то выделяется энергия в виде теплоты ![]() .
.
Процессы, протекающие с выделением теплоты называются экзотермическими, а с поглощением – эндотермическими.
Тепловой эффект эндотермической реакции считают положительным «+» (поглощение тепла), а экзотермической – отрицательным «−» (выделение тепла).
Тепловой эффект в изобарных условиях определяется изменением энтальпии ![]() , в изохорных условиях – изменением внутренней энергии
, в изохорных условиях – изменением внутренней энергии ![]() , т.е. для экзо-
, т.е. для экзо- ![]() ,
, ![]() , для эндо-
, для эндо- ![]() , для
, для ![]() .
.
Величины ![]() и
и ![]() сильно различаются только для систем, в которых вещества в газообразном состоянии.
сильно различаются только для систем, в которых вещества в газообразном состоянии.
Для систем, в которых вещества находятся в конденсированном состоянии изменение объёма в ходе реакции мало, т.е. ![]() , тогда
, тогда ![]() ;
; ![]() .
.
При термомеханическом описании реакции опускают ![]() ,
, ![]() , говорят только об изменении энтальпии
, говорят только об изменении энтальпии ![]() :
:
Закон Гесса: тепловой эффект химической реакции протекающий или при ![]() или при
или при ![]() не зависит от числа промежуточных стадий, а определяется лишь конечным и начальным состоянием системы.
не зависит от числа промежуточных стадий, а определяется лишь конечным и начальным состоянием системы.
![]()
![]()
![]()
![]()
![]()

![]()
![]()
![]()
![]()
![]()
![]()
Тепловой эффект реакции зависит от природы регентов и продуктов реакции, их агрегатного состояния, условия проведения реакции, а также от количества, участвовавшего в реакции.
Поэтому тепловой эффект принято относить к 1-му моль вещества и определять его в стандартных условиях: ![]() ,
, ![]() ,
, ![]() .
.
При термохимических расчётах важными являются ![]() (
(![]() ) – это тепловой эффект реакций образования вещества из простых веществ. По величинам и знакам энтальпии можно судить об устойчивости соединения относительно его распада на простые вещества.
) – это тепловой эффект реакций образования вещества из простых веществ. По величинам и знакам энтальпии можно судить об устойчивости соединения относительно его распада на простые вещества.
Если ![]() , то соединение более устойчиво, чем простые вещества, из которых оно образовано. Стандартный тепловой эффект химической реакции равен сумме стандартных энтальпий образования продуктов реакций за вычетом суммы стандартных энтальпий образования реагентов с учётом стехиометрических коэффициентов:
, то соединение более устойчиво, чем простые вещества, из которых оно образовано. Стандартный тепловой эффект химической реакции равен сумме стандартных энтальпий образования продуктов реакций за вычетом суммы стандартных энтальпий образования реагентов с учётом стехиометрических коэффициентов: ![]()
![]()
![]() =[Дж/моль]
=[Дж/моль]
![]() – эндотермический процесс,
– эндотермический процесс, ![]() – экзотермический процесс
– экзотермический процесс
![]() – для простых веществ
– для простых веществ
С термохимическими уравнениями можно проводить любые математические действия.
3) ![]()
1) ![]()
![]()
2) ![]()
![]()
![]()
![]()
![]() – по закону Гесса
– по закону Гесса
Тепловой эффект изменяется с изменением температуры в соответствии с законом Кирхгофа: 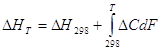 ,
,
где ![]() – разность между ∑ теплоёмкостей продуктов реакций за вычетом реагентов.
– разность между ∑ теплоёмкостей продуктов реакций за вычетом реагентов.
Теплоёмкость ![]() , которая необходима для нагревания определённого количества вещества на 1К, если относится к 1 молю – молярная, к 1 кг – удельная.
, которая необходима для нагревания определённого количества вещества на 1К, если относится к 1 молю – молярная, к 1 кг – удельная.
при ![]()
![]() при
при ![]()
![]()
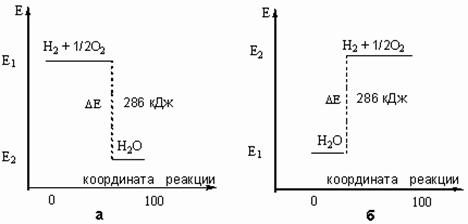
IV. Реакцию, идущую саму по себе (без помощи извне) называют самопроизвольной.
Некоторые самопроизвольные реакции являются эндотермическими.
![]()
![]()
![]()
![]()
![]() Ne Ar
Ne Ar
Два газа разделены перегородкой, если ее убрать начнется самопроизвольный процесс взаимодиффузии. Система, состоящая из различных молекул, в разных сосудах более упорядочена, чем смесь разных молекул в одном сосуде, т.е. все самопроизвольные изменения заключаются в переходе из упорядоченного состояния частиц в менее упорядоченное. Степень беспорядка или неупорядоченность в системе характеризуется состоянием системы называемом энтропией.
Энтропия – функция меры беспорядка ![]() , она связана с термодинамической вероятностью реализации данного состояния вещества:
, она связана с термодинамической вероятностью реализации данного состояния вещества:
![]() , где
, где
![]() – постоянная Больцмана,
– постоянная Больцмана,
![]() – термодинамическая вероятность, т.е. число возможных микросостояний, соответствующих данному макросостоянию вещества.
– термодинамическая вероятность, т.е. число возможных микросостояний, соответствующих данному макросостоянию вещества.
![]() – стандартная энтропия,
– стандартная энтропия, ![]() – её изменение.
– её изменение.
В изолированных системах изменение энтропии служит критерием определяющим направление процесса.
2-ое начало термодинамики: В изолированных системах самопроизвольно протекают те процессы и реакции, в ходе которых энтропия ![]() возрастает.
возрастает.
Процессы, для которых ![]() – расширение газов, фазовые превращения (их же в газ), процессы растворения, плавление, кипение, диссоциация соединений, нагревание.
– расширение газов, фазовые превращения (их же в газ), процессы растворения, плавление, кипение, диссоциация соединений, нагревание.
Процессы, для которых ![]() – сжатие газов, конденсация, кристаллизация, охлаждение.
– сжатие газов, конденсация, кристаллизация, охлаждение.
Если в ходе реакции объём возрастает, то ![]() .
.
![]()
![]() возрастает
возрастает ![]()
В ряде однотипных соединений ![]() возрастает по мере усложнения атомов, входящих в состав соединений:
возрастает по мере усложнения атомов, входящих в состав соединений: ![]() ; по мере усложнения состава молекулы:
; по мере усложнения состава молекулы: ![]() .
.
![]()
![]()
![]() , т.е. усложняется состав
, т.е. усложняется состав
В отличие от энтальпии ![]() и внутренней энергии
и внутренней энергии ![]() для чистых веществ можно определить абсолютное значение энтропии
для чистых веществ можно определить абсолютное значение энтропии ![]() .
.
Энтропия, определяемая в стандартных условиях (![]() ,
, ![]() ) называется стандартной
) называется стандартной ![]() .
.
![]() – для простых веществ.
– для простых веществ.
Изменение энтропии ![]() в ходе химической реакции определяется как
в ходе химической реакции определяется как ![]() продуктов реакции за вычетом
продуктов реакции за вычетом ![]() исходных реагентов с учётом стехиометрических коэффициентов:
исходных реагентов с учётом стехиометрических коэффициентов: ![]()
![]() .
.
Изменение энтропии ![]() в ходе реакции образования соединений из простых веществ называют энтропией образования
в ходе реакции образования соединений из простых веществ называют энтропией образования ![]() .
.
![]()
![]()
![]()
![]()
![]()
V. Только для изолированной системы, у которой нет обмена энергией с окружающей средой, энтропия является единственным фактором, определяющим возможность протекания процессов. На практике обычно системы закрытые, в которых изменяется внутренняя энергия и совершается работа против внешних сил. Для таких систем критерием направления протекания процесса является не только стремление системы перейти в состояние с наибольшей термодинамической вероятностью, но и стремление системы перейти в состояние с наименьшей энергией, т.е. выделить теплоту в окружающую среду. Стремление среды к увеличению энтропии называется энтропийным фактором. Стремление системы получить внутреннюю энергию называется энтальпийным фактором.
Суммарный эффект этих двух противоположно действующих факторов в условиях при ![]() находит отражение в изменении энергии Гиббса
находит отражение в изменении энергии Гиббса ![]() (изобарно-изотермический потенциал):
(изобарно-изотермический потенциал): ![]() и в условиях
и в условиях ![]() находит отражение в изменении энергии Гельмгольца
находит отражение в изменении энергии Гельмгольца ![]() (изохорно-изотермический потенциал):
(изохорно-изотермический потенциал): ![]() .
.
Поскольку ![]() , то
, то ![]() .
.
![]() и
и ![]() являются функциями состояния системы.
являются функциями состояния системы.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Для процессов в конденсированных средах в ходе реакции ![]() , тогда
, тогда ![]() .
.
![]() образования 1-го моль соединения из простых веществ, называется
образования 1-го моль соединения из простых веществ, называется ![]() , стандартная
, стандартная ![]() .
.
Изменение энергии Гиббса ![]() в ходе химической реакции равно сумме энергий Гиббса продуктов реакции за вычетом суммы энергий Гиббса реагентов с учётом стехиометрических коэффициентов:
в ходе химической реакции равно сумме энергий Гиббса продуктов реакции за вычетом суммы энергий Гиббса реагентов с учётом стехиометрических коэффициентов: ![]()
![]() .
.
![]() – для простых веществ
– для простых веществ
Величина и знак ![]() определяют возможность самопроизвольного протекания процесса.
определяют возможность самопроизвольного протекания процесса.
Самопроизвольно в направлении образования продуктов реакции протекают только те реакции, в ходе которых происходит уменьшение ![]() . Реакция идёт в направлении пока
. Реакция идёт в направлении пока ![]() (система равновесия).
(система равновесия).
Если ![]() , то в данных условиях реакция самопроизвольно протекать не будет.
, то в данных условиях реакция самопроизвольно протекать не будет.
|
|
|
| Вывод |
| − | + | − | Протекает самопроизвольно при любой T |
| − | − | − + | Протекает при низких T |
| + | + | + − | Протекает при высоких T |
| + | − | + | Не протекает (протекает в обратном направлении) |
В открытых системах изменение внутренней энергии ![]() происходит не только в результате получения или отдачи теплоты и совершения работы, но и за счёт изменения масс, входящих в систему компонентов. Все свойства открытых систем и ΔG будут зависеть от количества каждого компонента:
происходит не только в результате получения или отдачи теплоты и совершения работы, но и за счёт изменения масс, входящих в систему компонентов. Все свойства открытых систем и ΔG будут зависеть от количества каждого компонента:
![]() ,
,
где![]() – химический потенциал, энергия Гиббса отнесённая к 1-му молю вещества,
– химический потенциал, энергия Гиббса отнесённая к 1-му молю вещества, ![]() – изменённое количество вещества системы
– изменённое количество вещества системы
Если в системе ![]() – компонентов, то
– компонентов, то ![]() :
:
![]() – самопроизвольное протекание процессов в открытой системе
– самопроизвольное протекание процессов в открытой системе
![]() – состояние равновесия
– состояние равновесия
![]() – процессы не протекают
– процессы не протекают
Химический потенциал – функция состояния. В условиях ![]() определяется изменением энергии Гиббса
определяется изменением энергии Гиббса ![]() :
: ![]() .
.
![]()
![]()
![]()
![]()
![]()
![]()
Вопросы для самоконтроля
1. Термодинамические системы: открытые, закрытые, изолированные; гомогенные, гетерогенные.
2. Параметры системы.
3. Функции состояния системы: внутренняя энергия, энтальпия, энтропия, химический потенциал, изобарно- и изохорно-изотермический потенциал.
4. Изобарные, изохорные, изотермические процессы.
5. Первое (закон сохранения энергии) и второе начало термодинамики.
6. Тепловой эффект реакции. Стандартная теплота образования вещества.
Похожие работы
... (излучаемая) энергия – отрицательна.) Энергетический эффект реакции, протекающей при постоянном давлении, отличается от энергетического эффекта реакции, протекающей при постоянном объеме, на величину pDV. Для химического процесса, протекающего изобарически, DV представляет собой разность между суммой объемов исходных веществ и продуктов реакции. Так, для реакции, записанной в общем виде: , ...
... условия сдвига равновесия вправо .... Глава 2. Прикладные аспекты преподавания темы «Закономерности течения химических реакций» Прикладные аспекты преподавания темы «Закономерности течения химических реакций» на мой взгляд удобнее всего рассматривать на уроках, которые следуют сразу за рассмотрением скорости реакции и химического равновесия, - это производство серной кислоты. 2.1 ...
... Просвещение, 1976. 35. Третьяков Ю.Д., Зайцев О.С. Программное пособие по общей и неорганической химии. М.: Юнити, 2005. 36. Фаязов Д.Ф. Формирование умений учащихся пользоваться химическим языком // Химия в школе. 1983. № 2. 37. Фигуровский Н.А. Открытие элементов и происхождение их названий. М.: Наука, 1970. 38. Цветков Л.А. Преподавание органической химии в средней ...
... в уравнениях реакций и не забывать о том, что складываемые, вычитаемые или сокращаемые моли вещества должны находиться в одинаковом агрегатном состоянии. 2. Применение теплового эффекта на практике Тепловые эффекты химических реакций нужны для многих технических расчетов. Например, рассмотрим мощную российскую ракету "Энергия", способную выводить на орбиту космические корабли и другие полезные ...








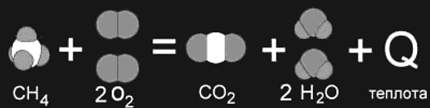
0 комментариев