Рассмотрим подробнее применение закона действия масс для реакций на поверхности. Для описания скорости элементарной стадии используют закон действия поверхностей. Если процесс определяется скоростью реакции двух поверхностных интермедиатов (Аадс + Вадс →, ZA + ZB →, 2ZA →) скорость такой стадии, например,
![]() (27)
(27)
запишем через концентрации поверхностных веществ ![]() и
и ![]() (моль/м2)
(моль/м2)
![]() моль·м–2·сек–1 (28)
моль·м–2·сек–1 (28)
Удельная скорость стадии (на 1 г катализатора)
![]() моль·г–1·сек–1 (29)
моль·г–1·сек–1 (29)
где S – удельная поверхность, м2/г.
Выразим величины ![]() и
и ![]() через относительные концентрации, доли занятой поверхности
через относительные концентрации, доли занятой поверхности
![]()
![]()
где ![]() – максимальная концентрация поверхностных центров, занимаемых молекулами А, В или С. Тогда
– максимальная концентрация поверхностных центров, занимаемых молекулами А, В или С. Тогда
![]() (30)
(30)
Зная насыпную плотность катализатора (G, г/л), можно пересчитать скорость в молях на 1л катализатора в сек. В жидкофазных процессах с твёрдым катализатором обычно используют значения скорости на 1л раствора. Тогда G есть количество грамм тв. катализатора в 1л раствора
R = WG = kΘAΘB, моль·л–1·сек–1, (31)
где ![]() .
.
Для однородной поверхности скорость реакции легко записать, выразив ΘA и ΘB через концентрации или парциальные давления реагентов А и В. В случае квазиравновесного приближения
![]() (32)
(32)
(изотерма Лэнгмюра). Тогда, для стадии (27) получим
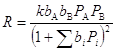 (33)
(33)
Такой тип уравнений называют уравнениями (или моделью) Лэнгмюра – Хиншельвуда и часто используют для описания кинетики гетерогенного катализа при решении прикладных задач. Кинетику реакций на неоднородных поверхностях рассмотрим в следующем разделе.
Методы вывода кинетических уравнений
Для вывода кинетических уравнений для скоростей по маршрутам и скоростей по веществам можно использовать три метода для стационарных и квазистационарных процессов:
Метод Боденштейна;
Условие стационарности стадий Хориути-Темкина;
Методы теории графов (для линейных механизмов).
Метод Боденштейна ![]() удобно использовать, когда мало интермедиатов и много маршрутов. Решив систему уравнений относительно Xi для тех интермедиатов, которые необходимы для определения RP в соответствии с уравнением (19), получим выражение для RP стационарного или квазистационарного процесса. Зная RP, найдем выражение для RN.
удобно использовать, когда мало интермедиатов и много маршрутов. Решив систему уравнений относительно Xi для тех интермедиатов, которые необходимы для определения RP в соответствии с уравнением (19), получим выражение для RP стационарного или квазистационарного процесса. Зная RP, найдем выражение для RN.
Условие стационарности стадий (19) дает нам систему уравнений с S неизвестными (P + NI). Метод удобно использовать, когда много интермедиатов и мало маршрутов (например, P = 1).
Пример 5. Запишем систему ![]() для примера 3 и NI = 2:
для примера 3 и NI = 2:
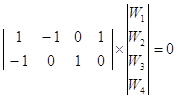
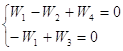
Используем веса стадий для значений Wj и доли поверхности для поверхностных концентраций, обозначив ![]() и
и ![]() .
.
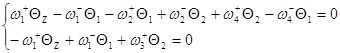
Заменим ![]() и сгруппируем неизвестные:
и сгруппируем неизвестные:
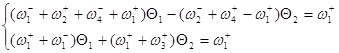
Используя метод определителей Крамера, получим ![]() и
и ![]() .
.
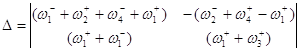
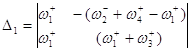
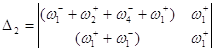
![]()
![]()
![]()
![]() (34)
(34)
Уравнение (34) является искомым уравнением скорости реакции по первому маршруту для стехиометрического базиса маршрутов (![]() ,
,![]() ) с учетом материального баланса по катализатору.
) с учетом материального баланса по катализатору.
Пример 6.
Для примера 4 запишем систему ![]() :
:
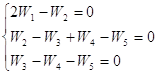
При сложении трех уравнений получим:
W1 = W5 W1 = k5[H·][C2H5·] (35)
Поскольку W3 и W4 >> W5 (условие длинных цепей)
W3 = W4+ ![]() (36)
(36)
Решая систему (25) и (26) относительно [Н·] и [С2Н5·], получим
![]() (37)
(37)
Применение условия стационарности стадий (уравнение 19) для вывода кинетических уравнений рассмотрим на примере одномаршрутного механизма гетерогенной каталитической реакции.
Пример 7.
(1) ![]()
(2) ![]()
(3) ![]()
Согласно (19):
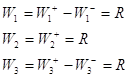
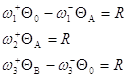
Имеем три уравнения и уравнение материального баланса ![]() , т.е. три уравнения с тремя неизвестными QA, QB и R. Заменив Q0 через 1, QA, QB, можно методом Крамера найти R.
, т.е. три уравнения с тремя неизвестными QA, QB и R. Заменив Q0 через 1, QA, QB, можно методом Крамера найти R.
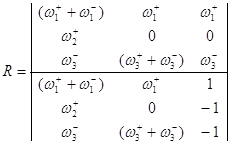
![]() (38)
(38)
Преобразуем уравнение (38):
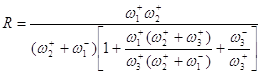 (39)
(39)
Первый сомножитель в знаменателе – следствие квазистационарности процесса, второй сомножитель есть закомплексованность катализатора (следствие учета материального баланса по катализатору). Если стадия (2) является лимитирующей стадией, то ![]() и
и ![]() . Тогда,
. Тогда,
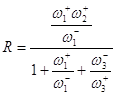 (40)
(40)
![]()
![]()
![]() (41)
(41)
В условиях квазиравновесия стадий (1) и (3) уравнение (41) можно получить, используя уравнение изотермы Ленгмюра:
![]()
и уравнение для скорости лимитирующей стадии ![]() .
.
Для одномаршрутных линейных механизмов удобно использовать уравнение Темкина, если скорость реакции записывать через свободную концентрацию активного центра ([М] или Q0):
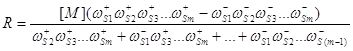 (42)
(42)
Для рассмотренного выше примера 7:
![]() (43)
(43)
Найдя из уравнения (43) Q0, из скоростей второй стадии QА и QВ из скорости стадии (3), можно также получить уравнение (38):
![]() ,
, ![]() и
и ![]()
Сложив Qi, получим ![]() , найдем R.
, найдем R.
Применение теории графов в химической кинетике
А.А. Баландин, по-видимому, впервые указал на возможность использования графов при изучении механизмов сложных реакций. Он же впервые применил к механизмам реакции элементы топологии и предложил первую классификацию механизмов на топологической основе. Затем Христиансен применил графы для классификации механизмов, а Кинг и Альтман дали графическую интерпретацию метода Крамера решения систем линейных алгебраических уравнений и использовали ее для вывода кинетических уравнений ферментативных процессов.
Начало активному использованию графов в химической и ферментативной кинетике положила работа М.И. Темкина по планарным циклическим графам. Был предложен метод вывода кинетических уравнений на кинетических графах Темкина (алгоритм Волькенштейна и Гольдштейна).
Линейные механизмы и графы
К линейным механизмам, как мы уже отмечали, относятся механизмы, все стадии которых в левой и правой частях уравнений стадий содержат не более, чем по одному интермедиату. Скорости таких стадий или не зависят, или линейно зависят от концентрации интермедиатов. Линейные механизмы естественным образом описываются кинетическими графами (КГ) Темкина. Вершины таких графов ставятся в соответствие интермедиатам, а ребра, связывающие вершины, – стадиям. Например, двухмаршрутный механизм каталитической реакции (М – катализатор)
(1) ![]()
(2) ![]() (44)
(44)
(3) ![]()
может быть представлен КГ1, в котором ориентированные ребра (со стрелками) обозначают необратимые стадии, а неориентированные – обратимые стадии. Неориентированное ребро можно изображать двумя ориентированными дугами (КГ2), но для упрощения графов удобнее использовать вариант КГ1 (не забывая при выводе уравнений об обратимости стадии (ребра) 1). В случае некаталитических реакций, Темкин предложил использовать понятие нуль-вещества, т.е. гипотетического интермедиата с концентрацией, равной 1. Таким образом, циклические графы можно использовать для изображения механизмов любых сложных реакций с линейными механизмами. Например, для механизмов (2):
(1) ![]()
(2) ![]() (45)
(45)
(3) ![]()
и эквивалентного ему механизма (46)
(1) ![]()
(2) ![]() (46)
(46)
(3) ![]()
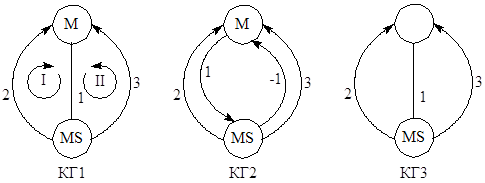
используется КГ3 с пустой нуль-вершиной, в которой помещается нуль-вещество Х0.
В механизмах каталитических и некаталитических реакций встречаются стадии образования соединений катализатора и (или) интермедиатов с реагентами, продуктами, лигандами (и др. компонентами среды), не участвующих в стехиометрии итоговых уравнений, но вносящих вклад в материальные балансы по катализатору и реагентам. Например, к механизму (44) можно добавить реакции
(4) ![]()
(5) ![]()
Такие стадии изображаются на графах висячими вершинами, поскольку соединения МР1 и МР2 не являются интермедиатами (КГ4).
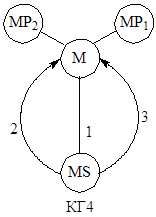
КГ линейных механизмов позволяют установить число линейно независимых маршрутов, поскольку базис маршрутов соответствует числу независимых (простых) циклов графа, определяемому цикломатическим числом графа (характеристика Эйлера) Ф:
Ф = q – r + C, (47)
где q = S – число ребер (стадий), r = I – число вершин (интермедиатов) + нуль-вещество в нуль-вершине (если оно необходимо) и С – число компонент графа, равное 1 для КГ. Уравнение (47) эквивалентно уравнению (48) теории маршрутов
![]() , (48)
, (48)
где Р – число линейно независимых маршрутов (базис маршрутов), S – число стадий и NI – число линейно независимых интермедиатов (ранг матрицы ![]() ). В случае планарных графов число простых циклов равно числу граней КГ (2 грани на КГ1).
). В случае планарных графов число простых циклов равно числу граней КГ (2 грани на КГ1).
Рассмотрим алгоритмы вывода кинетических уравнений для линейных механизмов на основании методов теории графов. Введем несколько определений.
Циклом графа называют любую последовательность ориентированных дуг (стадий), начинающуюся и заканчивающуюся в одной и той же вершине. Цикл КГ соответствует циклическому превращению интермедиатов. Величина цикла С (вес цикла) выражается произведением весов соответствующих дуг (весов элементарных реакций)
![]()
![]()
Напомним, что вес стадии равен скорости j-той стадии в одном направлении, деленной на концентрацию i-того интермедиата, участвующего в j-той стадии:
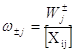
Если [Хi] = [X0] = 1, то ![]() .
.
Для КГ1 (и, соответственно, КГ2) величины циклов (веса циклов), включающих стадии 1, 2 и 1, 3,
![]()
![]()
Направление циклов на КГ выбирается в соответствии с направлением маршрутов, которое в свою очередь определяется направлением стадий и вектором стехиометрических чисел. Так, направление двух циклов двух маршрутов на КГ1 показано стрелками.
Похожие работы
... условия сдвига равновесия вправо .... Глава 2. Прикладные аспекты преподавания темы «Закономерности течения химических реакций» Прикладные аспекты преподавания темы «Закономерности течения химических реакций» на мой взгляд удобнее всего рассматривать на уроках, которые следуют сразу за рассмотрением скорости реакции и химического равновесия, - это производство серной кислоты. 2.1 ...
... для следующего механизма реакции НX + hv→Н· + X Н· + НХ→Н2 + Х Х + Х→Х2. Ответ: А.0,45·10-7 Эйнштейн·с-1 . Б. γ=1,95. В. γ = 2 Глава 3. Кинетика гетерогенных реакций 3.1 Примеры 3.1.1. Образец сплава металла А и В длиной 0,5 см и образец металла В длиной 0,5 см спаяны друг с другом. Определите время, за которое в результате диффузии А ...
... , т. е. к увеличению скорости реакции. Количественно зависимость между скоростью реакции и молярными концентрациями реагирующих веществ описывается основным законом химической кинетики — законом действующих масс. Скорость химической реакции при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ. Для мономолекулярной реакции скорость реакции ...
... или меньше. Зависимость константы скорости реакции от температуры и энергии активации описывает уравнение Аррениуса: . Здесь k0 – предэкспоненциальный множитель – постоянная величина. Одной из проблем химической кинетики является нахождение k0 и Еа по экспериментальным данным. В качестве примера рассмотрим методику нахождения значений этих величин для реакции С12Н22О11 + Н2О → ...



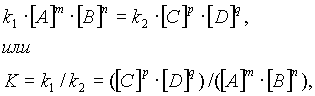
0 комментариев