Газовый состав атмосферного воздуха
Газовый состав воздуха, которым мы дышим, выглядит так: 78% составляет азот, 21 % - кислород и 1% приходится на другие газы. Но в атмосфере крупных промышленных городов это соотношение часто нарушено. Значительную долю составляют вредные примеси, обусловленные выбросами предприятий и автотранспорта. Автотранспорт привносит в атмосферу многие примеси: углеводороды неизвестного состава, бенз(а)пирен, углекислый газ, соединения серы и азота, свинец, угарный газ.
Атмосфера состоит из смеси ряда газов - воздуха, в котором взвешены коллоидные примеси - пыль, капельки, кристаллы и пр. С высотой состав атмосферного воздуха меняется мало. Однако начиная с высоты около 100 км, наряду с молекулярным кислородом и азотом появляется и атомарный в результате диссоциации молекул, и начинается гравитационное разделение газов. Выше 300 км в атмосфере преобладает атомарный кислород, выше 1000 км - гелий и затем атомарный водород. Давление и плотность атмосферы убывают с высотой; около половины всей массы атмосферы сосредоточено в нижних 5 км, 9/10 - в нижних 20 км и 99,5% - в нижних 80 км. На высотах около 750 км плотность воздуха падает до 10-10 г/м3 (тогда как у земной поверхности она порядка 103 г/м3), но и такая малая плотность еще достаточна для возникновения полярных сияний. Резкой верхней границы атмосфера не имеет; плотность составляющих ее газов
В состав атмосферного воздуха, которым дышит каждый из нас, входят несколько газов, основными из которых являются: азот(78.09%), кислород(20.95%), водород(0.01%) двуокись углерода (углекислый газ)(0.03%) и инертные газы(0.93%). Кроме того, в воздухе всегда находится некоторое кол-во водяных паров, кол-во которых всегда изменяется с переменой температуры: чем выше температура, тем содержание пара больше и наоборот. Вследствие колебания кол-ва водяных паров в воздухе процентное содержание в нем газов также непостоянно. Все газы, входящие в состав воздуха, бесцветны и не имеют запаха. Вес воздуха изменяется в зависимости не только от температуры, но и от содержания в нем водяных паров. При одинаковой температуре вес сухого воздуха больше, чем влажного, т.к. водяные пары значительно легче паров воздуха.
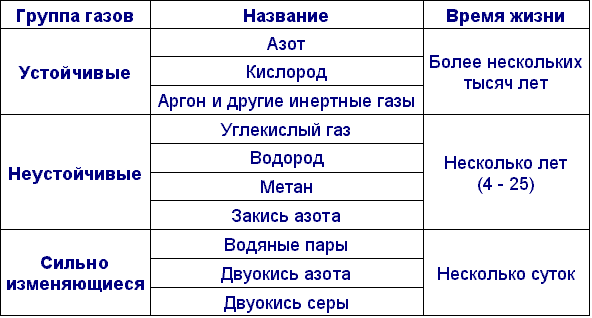
В таблице приведен газовый состав атмосферы в объемном массовом отношении, а также время жизни основных компонентов:
| Компонент | % объемные | % массовые |
| N2 | 78,09 | 75,50 |
| O2 | 20,95 | 23,15 |
| Ar | 0,933 | 1,292 |
| CO2 | 0,03 | 0,046 |
| Ne | 1,8 10-3 | 1,4 10-3 |
| He | 4,6 10-4 | 6,4 10-5 |
| CH4 | 1,52 10-4 | 8,4 10-5 |
| Kr | 1,14 10-4 | 3 10-4 |
| H2 | 5 10-5 | 8 10-5 |
| N2O | 5 10-5 | 8 10-5 |
| Xe | 8,6 10-6 | 4 10-5 |
| O3 | 3 10-7 - 3 10-6 | 5 10-7 - 5 10-6 |
| Rn | 6 10-18 | 4,5 10-17 |
Свойства газов, входящих в состав атмосферного воздуха под давлением меняются.
К примеру: кислород под давлением более 2-х атмосфер оказывает ядовитое действие на организм.
Азот под давлением свыше 5 атмосфер оказывает наркотическое действие (азотное опьянение). Быстрый подъем из глубины вызывает кессонную болезнь из-за бурного выделения пузырьков азота из крови, как бы вспенивая ее.
Повышение углекислого газа более 3% в дыхательной смеси вызывает смерть.
Каждый компонент, входящий в состав воздуха, с повышением давления до определенных границ становится ядом, способным отравить организм.
Исследования газового состава атмосферы. Атмосферная химия
Для истории бурного развития сравнительно молодой отрасли науки, именуемой атмосферной химией, более всего подходит термин “спурт” (бросок), применяемый в высокоскоростных видах спорта. Выстрелом же из стартового пистолета, пожалуй, послужили две статьи, опубликованные в начале 1970-х годов. Речь в них шла о возможном разрушении стратосферного озона оксидами азота - NO и NO2. Первая принадлежала будущему нобелевскому лауреату, а тогда сотруднику Стокгольмского университета П. Крутцену, который посчитал вероятным источником оксидов азота в стратосфере распадающуюся под действием солнечного света закись азота N2O естественного происхождения. Автор второй статьи, химик из Калифорнийского университета в Беркли Г.Джонстон предположил, что оксиды азота появляются в стратосфере в результате человеческой деятельности, а именно - при выбросах продуктов сгорания реактивных двигателей высотных самолетов.
Конечно, вышеупомянутые гипотезы возникли не на пустом месте. Соотношение по крайней мере основных компонент в атмосферном воздухе - молекул азота, кислорода, водяного пара и др. - было известно намного раньше. Уже во второй половине XIX в. в Европе производились измерения концентрации озона в приземном воздухе. В 1930-е годы английский ученый С.Чепмен открыл механизм формирования озона в чисто кислородной атмосфере, указав набор взаимодействий атомов и молекул кислорода, а также озона в отсутствие каких-либо других составляющих воздуха. Однако в конце 50-х годов измерения с помощью метеорологических ракет показали, что озона в стратосфере гораздо меньше, чем его должно быть согласно циклу реакций Чепмена. Хотя этот механизм и по сей день остается основополагающим, стало ясно, что существуют какие-то иные процессы, также активно участвующие в формировании атмосферного озона.
Нелишне упомянуть, что знания в области атмосферной химии к началу 70-х годов в основном были получены благодаря усилиям отдельных ученых, чьи исследования не были объединены какой-либо общественно значимой концепцией и носили чаще всего чисто академический характер. Иное дело - работа Джонстона: согласно его расчетам, 500 самолетов, летая по 7 ч в день, могли сократить количество стратосферного озона не меньше чем на 10%! И если бы эти оценки были справедливы, то проблема сразу становилась социально-экономической, так как в этом случае все программы развития сверхзвуковой транспортной авиации и сопутствующей инфраструктуры должны были подвергнуться существенной корректировке, а может быть, и закрытию. К тому же тогда впервые реально встал вопрос о том, что антропогенная деятельность может стать причиной не локального, но глобального катаклизма. Естественно, в сложившейся ситуации теория нуждалась в очень жесткой и в то же время оперативной проверке.
Напомним, что суть вышеупомянутой гипотезы состояла в том, что оксид азота вступает в реакцию с озоном NO + O3 ® ® NO2 + O2, затем образовавшийся в этой реакции диоксид азота реагирует с атомом кислорода NO2 + O ® NO + O2, тем самым восстанавливая присутствие NO в атмосфере, в то время как молекула озона утрачивается безвозвратно. При этом такая пара реакций, составляющая азотный каталитический цикл разрушения озона, повторяется до тех пор, пока какие-либо химические или физические процессы не приведут к удалению оксидов азота из атмосферы. Так, например, NO2 окисляется до азотной кислоты HNO3, хорошо растворимой в воде, и потому удаляется из атмосферы облаками и осадками. Азотный каталитический цикл весьма эффективен: одна молекула NO за время своего пребывания в атмосфере успевает уничтожить десятки тысяч молекул озона.
Но, как известно, беда не приходит одна. Вскоре специалисты из университетов США - Мичигана (Р.Столярски и Р.Цицероне) и Гарварда (С.Вофси и М. Макэлрой) - обнаружили, что у озона может быть еще более беспощадный враг - соединения хлора. Хлорный каталитический цикл разрушения озона (реакции Cl + O3 ® ClO + O2 и ClO + O ® Cl + O2), по их оценкам, был в несколько раз эффективнее азотного. Сдержанный оптимизм вызывало лишь то, что количество хлора естественного происхождения в атмосфере сравнительно невелико, а значит, суммарный эффект его воздействия на озон может оказаться не слишком сильным. Однако ситуация кардинально изменилась, когда в 1974 г. сотрудники Калифорнийского университета в Ирвине Ш. Роуленд и М. Молина установили, что источником хлора в стратосфере являются хлорфторуглеводородные соединения (ХФУ), массово используемые в холодильных установках, аэрозольных упаковках и т.д. Будучи негорючими, нетоксичными и химически пассивными, эти вещества медленно переносятся восходящими воздушными потоками от земной поверхности в стратосферу, где их молекулы разрушаются солнечным светом, в результате чего выделяются свободные атомы хлора. Промышленное производство ХФУ, начавшееся в 30-е годы, и их выбросы в атмосферу постоянно наращивались во все последующие годы, особенно в 70-е и 80-е. Таким образом, в течение очень короткого промежутка времени теоретики обозначили две проблемы атмосферной химии, обусловленные интенсивным антропогенным загрязнением.
Однако чтобы проверить состоятельность выдвинутых гипотез, необходимо было выполнить немало задач.
Во-первых, расширить лабораторные исследования, в ходе которых можно было бы определить или уточнить скорости протекания фотохимических реакций между различными компонентами атмосферного воздуха. Надо сказать, что существовавшие в то время весьма скудные данные об этих скоростях к тому же имели изрядную (до нескольких сот процентов) погрешность. Кроме того, условия, в которых производились измерения, как правило, мало соответствовали реалиям атмосферы, что серьезно усугубляло ошибку, поскольку интенсивность большинства реакций зависела от температуры, а иногда от давления или плотности атмосферного воздуха.
Во-вторых, усиленно изучать радиационно-оптические свойства ряда малых газов атмосферы в лабораторных условиях. Молекулы значительного числа составляющих атмосферного воздуха разрушаются ультрафиолетовым излучением Солнца (в реакциях фотолиза), среди них не только упомянутые выше ХФУ, но также молекулярный кислород, озон, оксиды азота и многие другие. Поэтому оценки параметров каждой реакции фотолиза были столь же необходимы и важны для правильного воспроизведения атмосферных химических процессов, как и скорости реакций между различными молекулами.
В-третьих, нужно было создавать математические модели, способные возможно более полно описывать взаимные химические превращения компонент атмосферного воздуха. Как уже упоминалось, продуктивность разрушения озона в каталитических циклах определяется тем, сколь долго пребывает в атмосфере катализатор (NO, Cl или какой-либо другой). Понятно, что такой катализатор, вообще-то говоря, мог вступить в реакцию с любой из десятков составляющих атмосферного воздуха, быстро разрушаясь при этом, и тогда ущерб стратосферному озону оказался бы значительно меньше, чем предполагалось. С другой стороны, когда в атмосфере ежесекундно происходит множество химических превращений, вполне вероятно выявление других механизмов, прямо или косвенно влияющих на образование и разрушение озона. Наконец, такие модели в состоянии выделить и оценить значимость отдельных реакций или их групп в формировании других газов, входящих в состав атмосферного воздуха, а также позволить вычислить концентрации газов, которые недоступны измерениям.
И наконец, предстояло организовать широкую сеть для измерений содержания в воздухе различных газов, в том числе соединений азота, хлора и др., используя с этой целью наземные станции, запуски метеозондов и метеоракет, полеты самолетов. Безусловно, создание базы данных было наиболее дорогостоящей задачей, которую и не решить в короткое время. Однако только измерения могли дать исходную точку для теоретических изысканий, будучи одновременно пробным камнем истинности высказанных гипотез.
С начала 70-х по крайней мере раз в три года выходят специальные, постоянно пополняемые сборники, содержащие сведения обо всех значимых атмосферных реакциях, включая реакции фотолиза. Причем погрешность в определении параметров реакций между газовыми компонентами воздуха сегодня составляет, как правило, 10-20%.
На вторую половину этого десятилетия приходится бурное развитие моделей, описывающих химические преобразования в атмосфере. Наибольшее их число было создано в США, но появились они и в Европе, и в СССР. Сперва это были боксовые (нульмерные), а потом и одномерные модели. Первые воспроизводили с разной степенью достоверности содержание основных атмосферных газов в заданном объеме - боксе (отсюда и их название) - в результате химических взаимодействий между ними. Поскольку постулировалось сохранение общей массы воздушной смеси, удаление какой-либо ее доли из бокса, например, ветром, не рассматривалось. Боксовые модели были удобны для выяснения роли отдельных реакций или их групп в процессах химических образований и разрушений газов атмосферы, для оценки чувствительности газового состава атмосферы к неточностям определения скоростей реакций. С их помощью исследователи могли, задав в боксе атмосферные параметры (в частности, температуру и плотность воздуха), соответствующие высоте полетов авиации, оценить в грубом приближении, как изменятся концентрации атмосферных примесей в результате выбросов продуктов сгорания двигателями самолетов. В то же время боксовые модели были непригодны для изучения проблемы хлорфторуглеводородов (ХФУ), так как не могли описать процесс их перемещения от земной поверхности в стратосферу. Вот здесь пригодились одномерные модели, которые совмещали в себе учет подробного описания химических взаимодействий в атмосфере и переноса примесей в вертикальном направлении. И хотя вертикальный перенос задавался и здесь достаточно грубо, использование одномерных моделей было заметным шагом вперед, поскольку они давали возможность как-то описать реальные явления.
Оглядываясь назад, можно сказать, что наши современные знания во многом базируются на проведенной в те годы с помощью одномерных и боксовых моделей черновой работе. Она позволила определить механизмы формирования газового состава атмосферы, оценить интенсивность химических источников и стоки отдельных газов. Важная особенность этого этапа развития атмосферной химии в том, что рождавшиеся новые идеи апробировались на моделях и широко обсуждались среди специалистов. Полученные результаты часто сравнивались с оценками других научных групп, поскольку натурных измерений было явно недостаточно, да и точность их была весьма низкой. Кроме того, для подтверждения правильности моделирования тех или иных химических взаимодействий было необходимо проводить комплексные измерения, когда одновременно определялись бы концентрации всех участвующих реагентов, что в то время, да и сейчас, было практически невозможно. (До сих пор проведено лишь несколько измерений комплекса газов с “Шаттла” в течение 2-5 сут.) Поэтому модельные исследования шли впереди экспериментальных, и теория не столько объясняла проведенные натурные наблюдения, сколько способствовала их оптимальному планированию. Например, такое соединение, как хлорный нитрат ClONO2, сначала появилось в модельных исследованиях и только потом было обнаружено в атмосфере. Даже сравнивать имевшиеся измерения с модельными оценками было трудно, поскольку одномерная модель не могла учесть горизонтальных движений воздуха, из-за чего атмосфера предполагалась горизонтально однородной, а полученные модельные результаты соответствовали некоторому среднеглобальному ее состоянию. Однако в реальности состав воздуха над индустриальными регионами Европы или США сильно отличается от его состава над Австралией или над акваторией Тихого океана. Поэтому результаты любого натурного наблюдения в значительной мере зависят от места и времени проведения измерений и, конечно, не соответствуют в точности среднеглобальному значению.
Чтобы устранить этот пробел в моделировании, в 80-е годы исследователи создают двумерные модели, в которых наряду с вертикальным переносом учитывался и перенос воздуха вдоль меридиана (вдоль круга широты атмосфера по-прежнему считалась однородной). Создание таких моделей на первых порах было сопряжено со значительными трудностями.
Во-первых, резко возрастало количество внешних модельных параметров: в каждом узле сетки необходимо было задать скорости вертикального и межширотного переноса, температуру и плотность воздуха и т.д. Многие параметры (в первую очередь, вышеупомянутые скорости) не были надежно определены в экспериментах и поэтому подбирались из качественных соображений.
Во-вторых, состояние вычислительной техники того времени заметно сдерживало полноценное развитие двумерных моделей. В отличие от экономичных одномерных и тем более боксовых двумерные модели требовали существенно больших затрат памяти и времени ЭВМ. И в результате их создатели были вынуждены значительно упрощать схемы учета химических превращений в атмосфере. Тем не менее комплекс атмосферных исследований, как модельных, так и натурных с использованием спутников, позволил нарисовать относительно стройную, хотя и далеко не полную картину состава атмосферы, а также установить основные причинно-следственные связи, вызывающие изменения содержания отдельных компонент воздуха. В частности, многочисленные исследования показали, что полеты самолетов в тропосфере не наносят сколь-нибудь существенного вреда тропосферному озону, однако их подъем в стратосферу, похоже, может иметь отрицательные последствия для озоносферы. Мнение большинства специалистов о роли ХФУ было почти единодушным: гипотеза Роуленда и Молина подтверждается, и эти вещества действительно способствуют разрушению стратосферного озона, а регулярный рост их промышленного производства - мина замедленного действия, так как распад ХФУ происходит не сразу, а спустя десятки и сотни лет, поэтому последствия загрязнения будут сказываться в атмосфере очень долго. Более того, долго сохраняясь, хлорфторуглеводороды могут достигнуть любой, самой удаленной точки атмосферы, и, следовательно, это - угроза глобального масштаба. Настало время согласованных политических решений.
В 1985 г. при участии 44 стран в Вене была разработана и принята конвенция по охране озонного слоя, стимулировавшая его всестороннее изучение. Однако вопрос, что же делать с ХФУ, все еще оставался открытым. Пустить дело на самотек по принципу “само рассосется” было нельзя, но и запретить производство этих веществ в одночасье невозможно без огромного ущерба для экономики. Казалось бы, есть простое решение: нужно заменить ХФУ другими веществами, способными выполнять те же функции (например, в холодильных агрегатах) и в то же время безвредными или хотя бы менее опасными для озона. Но воплотить в жизнь простые решения часто бывает очень непросто. Мало того что создание таких веществ и налаживание их производства требовали огромных капиталовложений и времени, необходимы были критерии оценки воздействия любого из них на атмосферу и климат.
Теоретики снова оказались в центре внимания. Д. Уэбблс из Ливерморской национальной лаборатории предложил использовать для этой цели озоноразрушающий потенциал, который показывал, насколько молекула вещества-заменителя сильнее (или слабее), чем молекула CFCl3(фреона-11), воздействует на атмосферный озон. На тот момент также хорошо было известно, что температура приземного слоя воздуха существенно зависит от концентрации некоторых газовых примесей (их назвали парниковыми), в первую очередь углекислого газа CO2, водяного пара H2O, озона и др. К этой категории отнесли и ХФУ, и многие их потенциальные заменители. Измерения показали, что в ходе индустриальной революции среднегодовая глобальная температура приземного слоя воздуха росла и продолжает расти, и это свидетельствует о значительных и не всегда желательных изменениях климата Земли. Для того чтобы поставить эту ситуацию под контроль, вместе с озоноразрушающим потенциалом вещества стали также рассматривать его потенциал глобального потепления. Этот индекс указывал, насколько сильнее или слабее изучаемое соединение воздействует на температуру воздуха, чем такое же количество углекислого газа. Проведенные расчеты показали, что ХФУ и альтернативные вещества обладали весьма высокими потенциалами глобального потепления, но из-за того, что их концентрации в атмосфере были гораздо меньше концентрации CO2, H2O или O3, их суммарный вклад в глобальное потепление оставался пренебрежимо малым. До поры до времени…
Таблицы рассчитанных значений озоноразрушающих потенциалов и потенциалов глобального потепления хлорфторуглеводородов и их возможных заменителей легли в основу международных решений о сокращении и последующем запрещении производства и использования многих ХФУ (Монреальский протокол 1987 г. и более поздние дополнения к нему). Возможно, собравшиеся в Монреале эксперты не были бы столь единодушными (в конце концов статьи Протокола основывались на не подтвержденных натурными экспериментами “измышлениях” теоретиков), но за подписание этого документа высказалось еще одно заинтересованное “лицо” - сама атмосфера.
Сообщение об обнаружении английскими учеными в конце 1985 г. “озонной дыры” над Антарктидой стало, не без участия журналистов, сенсацией года, а реакцию мировой общественности на это сообщение легче всего охарактеризовать одним коротким словом - шок. Одно дело, когда угроза разрушения озонного слоя существует лишь в отдаленной перспективе, другое - когда все мы поставлены перед свершившимся фактом. К этому не были готовы ни обыватели, ни политики, ни специалисты-теоретики.
Очень быстро выяснилось, что ни одна из существовавших тогда моделей не могла воспроизвести столь значительного сокращения содержания озона. Значит, какие-то важные природные явления либо не учитывались, либо недооценивались. Вскоре проведенные в рамках программы изучения антарктического феномена натурные исследования установили, что важную роль в формировании “озонной дыры”, наряду с обычными (газофазными) атмосферными реакциями, играют особенности переноса атмосферного воздуха в стратосфере Антарктики (ее почти полная изоляция зимой от остальной атмосферы), а также в ту пору мало изученные гетерогенные реакции (реакции на поверхности атмосферных аэрозолей - частиц пыли, сажи, льдинок, капель воды и т.д.). Только учет вышеупомянутых факторов позволил добиться удовлетворительного согласования модельных результатов с данными наблюдений. А уроки, преподанные антарктической “озонной дырой”, серьезно сказались на дальнейшем развитии атмосферной химии.
Во-первых, был дан резкий толчок к детальному изучению гетерогенных процессов, протекающих по законам, отличным от тех, которые определяют процессы газофазные. Во-вторых, пришло ясное осознание того, что в сложной системе, каковой является атмосфера, поведение ее элементов зависит от целого комплекса внутренних связей. Другими словами, содержание газов в атмосфере определяется не только интенсивностью протекания химических процессов, но и температурой воздуха, переносом воздушных масс, особенностями загрязнения аэрозолями различных частей атмосферы и пр. В свою очередь радиационные нагрев и выхолаживание, формирующие поле температуры стратосферного воздуха, зависят от концентрации и распределения в пространстве парниковых газов, а следовательно, и от атмосферных динамических процессов. Наконец, неоднородный радиационный нагрев разных поясов земного шара и частей атмосферы порождает движения атмосферного воздуха и контролирует их интенсивность. Таким образом, неучет каких-либо обратных связей в моделях может быть чреват большими ошибками в полученных результатах (хотя, заметим попутно, и чрезмерное усложнение модели без насущной необходимости столь же нецелесообразно, как стрельба из пушек по известным представителям пернатых).
Если взаимосвязь температуры воздуха и его газового состава учитывалась в двумерных моделях еще в 80-е годы, то привлечение трехмерных моделей общей циркуляции атмосферы для описания распределения атмосферных примесей стало возможным благодаря компьютерному буму только в 90-е. Первые такие модели общей циркуляции использовались для описания пространственного распределения химически пассивных веществ - трассеров. Позже из-за недостаточной оперативной памяти компьютеров химические процессы задавались только одним параметром - временем пребывания примеси в атмосфере, и лишь относительно недавно блоки химических превращений стали полноправными частями трехмерных моделей. И хотя до сих пор сохраняются трудности подробного представления атмосферных химических процессов в трехмерных моделях, сегодня они уже не кажутся непреодолимыми, и лучшие трехмерные модели включают в себя сотни химических реакций, наряду с реальным климатическим переносом воздуха в глобальной атмосфере.
В то же время широкое применение современных моделей вовсе не ставит под сомнение полезность более простых, о которых говорилось выше. Хорошо известно, чем сложнее модель, тем труднее отделить “сигнал” от “модельного шума”, анализировать полученные результаты, выделить главные причинно-следственные механизмы, оценить влияние на конечный результат тех или иных явлений (а значит, и целесообразности их учета в модели). И здесь более простые модели служат идеальным испытательным полигоном, они позволяют получить предварительные оценки, в дальнейшем используемые в трехмерных моделях, изучить новые природные явления до их включения в более сложные и т.д.
Бурный научно-технический прогресс породил еще несколько направлений исследований, так или иначе связанных с атмосферной химией.
Спутниковый мониторинг атмосферы. Когда было налажено регулярное пополнение базы данных со спутников, для большинства важнейших компонент атмосферы, охватывающих почти весь земной шар, возникла необходимость в совершенствовании методов их обработки. Здесь и фильтрование данных (разделение сигнала и ошибок измерений), и восстановление вертикальных профилей концентрации примесей по их суммарным содержаниям в столбе атмосферы, и интерполяция данных в тех областях, где прямые измерения по техническим причинам невозможны. К тому же спутниковый мониторинг дополняется проведением самолетных экспедиций, которые планируются для решения различных проблем, например, в тропической зоне Тихого океана, Северной Атлантике и даже в летней стратосфере Арктики.
Июльское распределение отношения смеси озона (млрд-1 по объему) в поясе 30-60°с.ш., рассчитанное с помощью двумерной фотохимической модели атмосферы Главной геофизической обсерватории им. А.И.Воейкова. Черными числами на рисунке показаны результаты измерений на соответствующих высотах и долготах.
Важная часть современных исследований - ассимиляция (усвоение) этих баз данных в моделях различной сложности. При этом параметры подбираются из условия наибольшей близости измеренных и модельных значений содержания примесей в точках (регионах). Таким образом производится проверка качества моделей, а также экстраполяция измеренных величин за пределы регионов и периодов проведения измерений.
Оценка концентраций короткоживущих атмосферных примесей. Атмосферные радикалы, играющие ключевую роль в атмосферной химии, такие как гидроксил OH, пергидроксил HO2, оксид азота NO, атомарный кислород в возбужденном состоянии O (1D) и др., имеют наибольшую химическую реактивность и, следовательно, очень маленькое (несколько секунд или минут) “время жизни” в атмосфере. Поэтому измерение таких радикалов чрезвычайно затруднено, а реконструкция их содержания в воздухе часто осуществляется по модельным соотношениям химических источников и стоков этих радикалов. Долгое время интенсивности источников и стоков вычислялись по модельным данным. С появлением соответствующих измерений стало возможным восстанавливать на их основе концентрации радикалов, при этом совершенствуя модели и расширяя сведения о газовом составе атмосферы.
Реконструкция газового состава атмосферы в доиндустриальный период и более ранние эпохи Земли. Благодаря измерениям в антарктических и гренландских ледовых кернах, возраст которых колеблется от сотен до сотен тысяч лет, стали известны концентрации углекислого газа, закиси азота, метана, окиси углерода, а также температура тех времен. Модельная реконструкция состояния атмосферы в те эпохи и его сопоставление с нынешним позволяют проследить эволюцию земной атмосферы и оценить степень воздействия человека на природную среду.
Оценка интенсивности источников важнейших компонент воздуха. Систематические измерения в приземном воздухе содержания газов, таких, как метан, оксид углерода, оксиды азота, стали основой для решения обратной задачи: оценки размера выбросов в атмосферу газов, имеющих наземные источники, по их известным концентрациям. К сожалению, лишь инвентаризация виновников вселенского переполоха - ХФУ - является относительно простой задачей, так как почти все эти вещества не имеют естественных источников и общее их количество, поступившее в атмосферу, ограничивается объемом их производства. Остальные газы имеют разнородные и сравнимые по мощности источники. Например, источник метана - переувлажненные территории, болота, нефтяные скважины, угольные шахты; это соединение выделяется колониями термитов и даже является продуктом жизнедеятельности крупного рогатого скота. Оксид углерода попадает в атмосферу в составе выхлопных газов, в результате сжигания топлива, а также при окислении метана и многих органических соединений. Трудно осуществить прямые измерения выбросов этих газов, но разработаны методики, позволяющие давать оценки глобальных источников газов-загрязнителей, погрешность которых в последние годы значительно сократилась, хотя и остается большой.
Общее содержание озона (в единицах Добсона; 1 ед. Добсона = 10-3 см слоя озона при 15°С на уровне моря) над Северным полушарием в марте 2000 г. (а и б) и над Южным полушарием в октябре 1998 г. (в и г). Данные получены в результате модельных расчетов (а и в) и спутниковых измерений (б и г). Для расчетов использована трехмерная модель
Прогнозирование изменений состава атмосферы и климата Земли Рассматривая тенденции - тренды содержания атмосферных газов, оценки их источников, темпы роста населения Земли, скорости увеличения производства всех видов энергии и т.д., - специальными группами экспертов создаются и постоянно корректируются сценарии вероятного загрязнения атмосферы в ближайшие 10, 30, 100 лет. Исходя из них, с помощью моделей прогнозируются возможные изменения газового состава, температуры и циркуляции атмосферы. Таким образом удается заблаговременно обнаружить неблагоприятные тенденции в состоянии атмосферы и можно попытаться их устранить. Антарктический шок 1985 г. не должен повториться.
Явление парникового эффекта атмосферы
В последние годы стало отчётливо понятно, что аналогия между обычным парником и парниковым эффектом атмосферы не вполне корректна. Ещё в конце прошлого века известный американский физик Вуд, заменив в лабораторной модели парника обычное стекло на кварцевое и не обнаружив при этом никаких изменений в функционировании парника, показал, что дело не в задержке теплового излучения почвы стеклом, пропускающим солнечную радиацию, роль стекла в данном случае состоит лишь в “отсечении” турбулентного теплообмена между поверхностью почвы и атмосферой.
Парниковый (оранжерейный) эффект атмосферы – это её свойство пропускать солнечную радиацию, но задерживать земное излучение способствуя аккумуляции тепла землёй. Земная атмосфера сравнительно хорошо пропускает коротковолновую солнечную радиацию, которая почти полностью поглощается земной поверхностью. Нагреваясь за счёт поглощения солнечной радиации, земная поверхность становится источником земного, в основном длинноволнового, излучения, часть которого уходит в космическое пространство.
Влияние увеличивающейся концентрации СО2
Учёные – исследователи продолжают спорить о составе так называемых парниковых газов. Наибольший интерес в этой связи вызывает влияние увеличивающейся концентрации углекислого газа (СО2) на парниковый эффект атмосферы. Высказывается мнение, что известная схема: “рост концентрации углекислого газа усиливает парниковый эффект, что ведёт к потеплению глобального климата” – предельно упрощена и очень далека от действительности, так как наиболее важным “парниковым газом” является вовсе не СО2, а водяной пар. При этом оговорки, что концентрация водяного пара в атмосфере определяется лишь параметрами самой климатической системы, сегодня уже не выдерживает критики, так как антропогенное воздействие на глобальный круговорот воды убедительно доказано.
В качестве научных гипотез укажем на следующие последствия грядущего парникового эффекта. Во-первых, согласно наиболее распространенным оценкам, к концу XXI века содержание атмосферного СО2 удвоится, что неизбежно приведёт к повышению средней глобальной приземной температуры на 3 – 5 о С. При этом потепление ожидается более засушливым летом в умеренных широтах Северного полушария.
Во-вторых, предполагается, что подобный рост средней глобальной приземной температуры приведёт к повышению уровня Мирового океана на 20 – 165 сантиметров за счёт термического расширения воды. Что касается ледникового щита Антарктиды, то его разрушение не является неизбежным, так как для таяния необходимо более высокие температуры. В любом случае, процесс таяния антарктических льдов займёт весьма продолжительное время.
В-третьих, концентрация атмосферного СО2 может оказать весьма благоприятное воздействие на урожаи сельскохозяйственных культур. Результаты проведённых экспериментов позволяют предполагать, что в условиях прогрессирующего роста содержания СО2 в воздухе природная и культурная растительность достигнут оптимального состояния; возрастёт листовая поверхность растений, повысится удельный вес сухого вещество листьев, увеличатся средний размер плодов и число семян, ускорится созревание зерновых, а их урожайность повысится.
В-четвёртых, в высоких широтах естественные леса, особенно бореальные могут оказаться весьма чувствительными к измениям температуры. Потепление может привести к резкому сокращению площадей бореальных лесов, а также к перемещению их границу на север леса тропиков и субтропиков окажутся, вероятно, более чувствительными к изменению режима осадков, а не температуры.
Световая энергия солнца, проникает сквозь атмосферу, поглощается поверхностью земли и нагревает её. При этом световая энергия переходит в тепловую, которая выделяется в виде инфракрасного или теплового излучения. Вот это инфракрасное излучение, отражённое от поверхности земли, и поглощается углекислым газом, при этом он нагревается сам и нагревает атмосферу. Значит, чем больше в атмосфере углекислого газа, тем сильнее он улавливает климат на планете. То же самое происходит и в парниках, поэтому это явление называется парниковым эффектом.
Если так называемые парниковые газы будут поступать с теперешней скоростью, то в следующем столетии средняя температура Земли повысится на 4 – 5 о С, что может привести к глобальному потеплению планеты.
Заключение
Изменить свое отношение к природе совсем не означает, что следует отказаться от технического прогресса. Его остановка не решит проблему, а может лишь отсрочить ее решение. Надо настойчиво и терпеливо добиваться снижения выбросов за счет введения новых экологических технологий экономии сырья, потребляемой энергии и увеличения количества высаживаемых насаждений проведения воспитательных мероприятий экологического мировоззрения у населения.
Так, например, в США одно из предприятий по производству синтетического каучука расположено рядом с жилыми кварталами, и это не вызывает протеста жителей, потому что работают экологически чистые технологические схемы, которые в прошлом, при старых технологиях, не отличались чистотой.
Значит, нужен строгий отбор технологий, отвечающих самым жестким критериям, современные перспективные технологии позволят добиться высокого уровня экологичности производства во всех отраслях промышленности и транспорта, а так же увеличения количества высаживаемых зеленых насаждений в промышленных зонах и городах.
В последние годы ведущие позиции в развитии атмосферной химии занял эксперимент, а место теории такое же, как в классических, респектабельных науках. Но по-прежнему существуют области, где приоритетными остаются именно теоретические изыскания: например, только модельные эксперименты в состоянии обеспечить прогнозирование изменений состава атмосферы или оценить эффективность ограничительных мер, реализуемых в рамках Монреальского протокола. Стартовав с решения пусть важной, но частной задачи, сегодня химия атмосферы в сотрудничестве со смежными дисциплинами охватывает весь сложный комплекс проблем изучения и охраны окружающей среды. Пожалуй, можно сказать, что первые годы становления атмосферной химии прошли под девизом: “Не опоздать!” Стартовый рывок закончился, бег продолжается.
Литература
1. Ионов Д.В. Об определении содержания метана в атмосфере по отраженному и рассеянному солнечному излучению из космоса // Исследования Земли из космоса. 1996.
2. Кароль И.Л. Настоящее и будущее атмосферного озона // Природа. 1988. №9. С.10-19.
3. Киселев А.А., Кароль И.Л. // Известия РАН. Сер. Физика атмосферы и океана. 1998. Т.34. №4. С.490-497.
4. Егорова Т.А., Розанов Е.В., Кароль И.Л. и др. // Метеорология и гидрология. 2002. №1. С.5-13.
5. Ионов Д.В., Поляков А.В., Тимофеев Ю.М. Об определении содержания водяного пара в атмосфере по отраженному и рассеянному солнечному излучению из космоса // Исследования Земли из космоса. 1996. С.52-58
Похожие работы
... (II) с выхлопными газами автомобилей, присутствует в выбросах свинцовых заводов и др. Ртуть – обладает повышенной возможностью распределения и биопереноса в окружающей среде. 1.3 Влияние загрязняющих веществ на морфофизиологические показатели растений Хотя сохранение растительного покрова Земли без серьезных нарушений – безусловная необходимость, его состояние в настоящее время ухудшается ( ...
... , относится к среднеповреждаемым видам (степень повреждения до 40%). Аналогичное наблюдение провели В.М. Ионин и В.Ф. Колташева (1961). Авторы не рекомендуют использовать рябину обыкновенную как устойчивый вид при загрязнении атмосферного воздуха выбросами промышленных предприятий. (Кулагин, 1974). Тома считает, что рябина обыкновенная способна к длительному сопротивлению в условиях задымления ( ...
... явлений, могут осуществляться только при отсутствии вредных последствий для жизни и здоровья человека и для окружающей природной среды на основании разрешений, выданных специально уполномоченным федеральным органом исполнительной власти в области охраны атмосферного воздуха. Согласно закону «О санитарно-эпидемиологическом благополучии населения», органы государственной власти РФ, органы ...
... веществ, их концентрацию в воздухе, почве, снежном покрове, установить границы распространения. До сего времени законодательство, как известно, исходит из необходимости охраны атмосферного воздуха главным образом от загрязнений и только в пределах населенных пунктов. Однако такая концепция перестала удовлетворять потребностям практики. В современных условиях атмосферу требуется охранять не ...
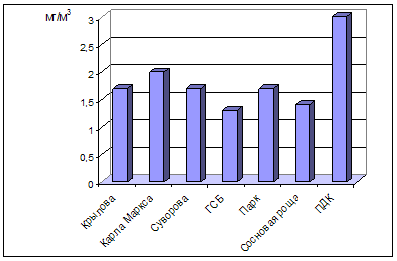
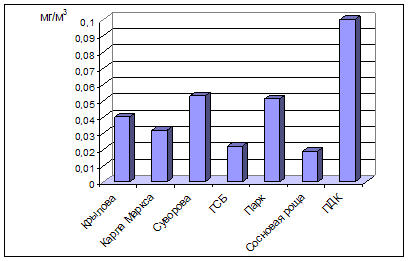
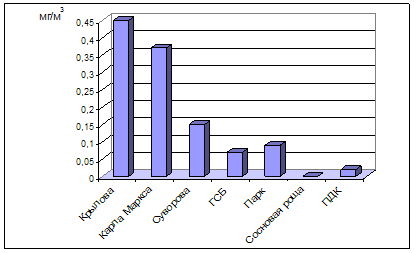
0 комментариев