Потенциометрический и амперометрический иммуноанализ
Введение
Меченные ферментом антитела стали получать с середины шестидесятых годов. Сначала их использовали для визуального обнаружения антигенов в гистологии и линий преципитации в иммуноэлектрофорезе. Количественное определение иммунореагентов с помощью ферментной метки стало возможным после разработки способов иммобилизации антигенов на твердой подложке. Этим работам предшествовало внедрение в иммуноанализ в качестве меток радиоактивных изотопов, и в то, время ферменты казались менее перспективными метками. Радиоиммуноанализ широко применялся в клинических анализах благодаря хорошей чувствительности и достаточной селективности. В настоящее время все чаще стали обсуждать недостатки РИА, связанные, например, с коротким периодом полураспада йода-125 и проблемами захоронения радиоактивных отходов. Однако простота измерения радиоактивной метки при удовлетворительных чувствительности и точности первоначально обеспечивала методу РИА некоторые преимущества перед методом иммуноферментного анализа. Примерно в то же время впервые было описано применение электродов для определения биологических молекул. Первые электроды создавались исключительно на основе ферментов в силу их высокой специфичности к субстратам. Были разработаны ферментные электроды для определения многих компонентов биологических жидкостей, например глюкозы и мочевины. К сожалению, ферменты не обязательно абсолютно специфичны по отношению только к одному субстрату, и поэтому всегда есть вероятность мешающего влияния со стороны других биологических компонентов проб. Несмотря на недостаточную специфичность, ферментные электроды, как и другие электрохимические детекторы, имеют и ряд положительных качеств, в первую очередь относительно низкую стоимость и простоту в эксплуатации. Кроме того, для них характерен низкий предел обнаружения, в ряде случаев приближающийся к пределу обнаружения с помощью РИА.
Электрохимические методы иммуноанализа создавались с целью объединения чувствительности электрохимического детектора и специфичности, присущей реакции взаимодействия антиген-антитело. Существуют два типа электрохимических сенсоров:
амперометрические, в которых потенциал электрода инициирует реакцию й измеряется сила тока;
потенциометрические, в которых на границе раздела сенсор-раствор устанавливается локальное равновесие и измеряется мембранный или электродный потенциал.
В потенциометрическом иммуноанализе доминируют три направления: прямое определение степени связывания белков;
использование ионо- и газоселективных электродов для определения продуктов иммунохимической реакции с ферментной меткой;
включение ионофоров в мембраны ионоселективных электродов.
В большинстве ранних публикаций по протенциометрическим ферментным детекторам описаны связанные с мембраной антигены и их применение для определения специфических антител. Присоединением ионофора к антигену можно достичь усиления выходного сигнала. В более поздних публикациях описаны сенсоры и для определения антигенов, на мембране которых в свою очередь иммобилизованы антитела.
Амперометрические иммуноанализы подразделяют на два основных типа:
1) анализы с использованием ферментных меток, которые катализируют образование электрохимически активного продукта;
2) анализы, в которых сама метка электроактивна или придает электроактивность другим веществам, например путем присоединения нитрогрупп.
Иногда выделяют также вольтамперрметрический иммуноанализ с металлоценовыми метками. Амперометрию можно применять как в гомогенном, так и в гетерогенном иммуноанализе. В гомогенных системах нет необходимости в операции отделения свободного антигена от связанного; основой гомогенного иммуноанализа является изменение электрохимической активности или какого-либо другого свойства метки при связывании меченого антигена с антителами, приводящее к изменению интенсивности сигнала. Соответствующие методики очень просты, однако им свойственны и некоторые недостатки. Так, на реакцию связывания может влиять матрикс, что приводит к повышению фонового сигнала. Гетерогенный иммуноанализ, включающий операцию разделения, обладает большей чувствительностью; в этом случае предел обнаружения может приближаться к пределу обнаружения РИА. Операция разделения уменьшает ошибки, обусловленные влиянием компонентов пробы на электрохимическую реакцию, и предохраняет электрод от загрязнения. Опубликован обзор, посвященный стратегии электрохимического иммуноанализа.
Потенциометрический иммуноанализ
Прямое определение связывания антигенов или антител. Прямое определение степени связывания антигенов представляется вполне целесообразным, поскольку при этом отпадает необходимость во введении метки. В водном растворе белки являются полиэлектролитами и поэтому имеют определенный результирующий электрический заряд. Полярность и величина этого заряда зависят от изоэлектрической точки белка и от ионного состава раствора. Связывание одного белка с другим приведет к образованию комплекса, результирующий заряд которого будет отличаться от зарядов исходных белков. Этот принцип впервые был применен Джанатой на примере конканавалина А, иммобилизованного на покрытой поливинил хлоридом проволоке. Такой электрод позволял определять в растворе дрожжевого маннана в диапазоне концентраций 0,1-1,0 мг/мл, однако аналогичный эффект в системе овальбумин - антитела к овальбумину обнаружить не удалось. Аналогичный подход применили Ямамото и др., которые разработали рабочий электрод из титановой проволоки, модифицированной антигеном или антителом, и электрод сравнения - тита новую проволоку, на которую нанесена мочевина. При изучении связывания хорионического гонадотропина человека с антителами к hCG в вероналовом буфере было обнаружено, что при добавлении в систему связывающего компонента. измеряемый потенциал изменяется экспоненциально.

Аизава и сотр. с помощью пары обычных хлорсеребряных электродов с аналогичными мембранами, одна из которых содержала антиген, определяли наличие антител Вассермана. Асимметричный мембранный потенциал, который возникал в ходе реакции,, зависел от концентрации антител.
Главное ограничение всех этих методик состоит в том, что эффекты, связанные с изменением потенциала, невелики, и поэтому точность и чувствительность анализа в очень большой степени лимитируются эффектами фона. Сравнительно недавно для определения различных веществ стали применяться полевые транзисторы. По сути дела, полевой транзистор - это устройство для измерения заряда; принцип его действия представлен на рис.1. Область полупроводника между истоком и стоком, называемая каналом, обладает переменным сопротивлением, которое зависит от напряженности электрического поля на диэлектрике. В свою очередь это поле изменяется под влиянием напряжения на затворе VG, а также разности потенциалов на поверхности раздела мембрана - раствор. Поэтому в иммунохимических транзисторах иммобилизованные антитела и другие ионы, присутствующие в растворе, вносят вклад в это поле. Разность потенциалов между истоком и стоком Vp обусловливает электрический ток ID. Следовательно, измерение VD и VG должно отражать эффект связывания белков поверхностью. ПТ с мембраной, содержащей антигены к антителам против сифилиса, описан Коллинзом и Джанатой.
Затем Джаната и Блакберн опубликовали результаты теоретических исследований такого устройства с иммобилизованными на канале ПТ антителами. Их выводы справедливы и по отношению к любым потенциометрическим приборам непосредственного измерения. Джаната и Блакберн подчеркивали, что в настоящее время невозможно изготовить устройство для прямого измерения степени специфического связывания в силу мешающих измерениям взаимодействий белков с мембраной и локальных изменений концентраций ионов, а также из-за отсутствия границы раздела с бесконечно большим сопротивлением переносу ионов. Они считают, что выходные сигналы описанных в литературе иммунохимических потенциометрических сенсоров на самом деле являются только артефактами, которые можно объяснить особенностями кинетики реакций на электродах.
Косвенное определение на базе ионо- или газоселективных электродовРассмотренная в предыдущем разделе проблематичность создания приборов для непосредственного потенциометрического иммуноанализа привела к тому, что основное внимание стало уделяться разработке устройств, в которых с помощью стандартных или модифицированных ионо- или газоселективных электродов определяют продукты ферментативной реакции, образующиеся в ходе иммуноферментного анализа.
В потенциометрическом иммуноанализе впервые в качестве ферментной метки применили уреазу. Этот фермент катализирует превращение мочевины в аммиак и диоксид углерода:
![]()
Уреаза имеет значительно более высокую молярную ферментативную активность, чем другие обычно применяемые в качестве меток ферменты. Образующиеся в этой реакции ионы аммония легко определить с помощью обычного аммоний-селективного электрода. Эта реакция положена в основу конкурентных методик иммунохимического определения бычьего сывороточного альбумина и циклического аденозинмонофосфата сАМР. Схема методик - представлена на рис.2. Выделенный центрифугированием осадок, содержащий иммунный комплекс, повторно суспендируют, после чего определяют активность фермента по начальной скорости образования аммиака при добавлении субстрата. Чувствительность при определении БСА составила 10 нг/мл, а сАМР - 10-7 М. Гебауэр и Рехниц или пероксидазой хрена. Таким путем определяли IgG человека и дигоксин соответственно. Привлекает внимание своей новизной и простотой методика определения дигоксина. Метод основан на конкурентном связывании дигоксина в пробе и дигоксина, иммобилизованного на твердой фазе, с ограниченным числом антител против дигоксина, меченных пероксидазой. В качестве твердой фазы используют частицы латекса; на них иммобилизован конъюгат дигоксина с бычьим сывороточным альбумином. После центрифугирования осадок повторно суспендируют и определяют его ферментативную активность по скорости образования С02 после добавления пирогаллола и пероксида водорода. Время проведения анализа невелико, а чувствительность может достигать нескольких нг/мл. В отличие от оптических методов регистрации электрохимические измерения можно выполнять и в мутных растворах.
Очевидно, вместо газоселективных электродов можно применять и ионоселективные электроды. Так, концентрацию IgG человека определяли с помощью фторид-селективного электрода после перерастворения осадка иммунного комплекса, образующегося при взаимодействии IgG человека с антителами против IgG, меченными пероксидазой. Активность ферментной метки измеряли путем определения фторидного иона, образующегося в результате катализируемой пероксидазой реакции окисления п-фторанилина под действием пероксида водорода.
В описанных выше методах с помощью селективных электродов определяли общее количество образующихся веществ или ионов. Другой подход применен Буатье и др. для определения HBgAg - поверхностного антигена гепатита В. Антитела против HBgAg иммобилизовали в желатиновой мембране, которую погружали в изучаемый раствор, затем вынимали и промывали. Мембрану инкубировали с антителами против HBgAg, меченными пероксидазой, и после промывания укрепляли на конце иодид-селективного электрода. Этот сенсор погружали в раствор, содержащий иодидный ион и пероксид водорода. Изменение потенциала электрода через 1 мин, обусловленное уменьшением активности иодидного иона в результате образования иода, использовалось для построения калибровочной кривой при определении концентрации HBgAg. Система позволяла легко определять 0,5 мкг/мл HBgAg. Эта система ближе к истинным иммуносенсорам, так как анализ можно проводить путем простого погружения ИСЭ с модифицированной мембраной в раствор пробы.
Ионофоры в ионоселективных электродных мембранахДо настоящего времени ИСЭ применяли для косвенного определения продуктов ферментативной реакции. В принципе возможно создание и таких электродов, потенциал которых будет непосредственно отражать концентрацию определяемого вещества.
Описан электрод, селективный по отношению к антителам против ДНФ.
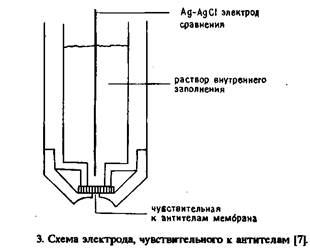
Как показано на рис. 3 "основным элементом этого ИСЭ является поливинилхлоридная мембрана, содержащая ковалентно-связанный конъюгат ДНФ с ионофором. Антитела определяли при фиксированных концентрациях К+ и Na+. Эксперимент проводили путем погружения электрода в растворы, содержащие антитела к ДНФ, и регистрации изменений потенциала по сравнению с раствором без антител. Антитела к ДНФ определяли в диапазоне концентраций 2,8-150 мг/мл.
Описан также электрод, селективный к дигоксину; калий-селективная мембрана этого электрода состоит из ковалентно связанного с дигоксином бензо-15-крауна-5 и поливинил хлорида. Принцип иммуноанализа состоит в конкурентном связывании дигоксина в мембране и в пробе с ограниченным количеством антител. В ходе анализа некоторое количество коньюгата ионофора связывается антителами на внешней поверхности мембраны, что снижает способность мембраны к транспорту ионов. Количество связанного коныогата обратно пропорционально концентрации дигоксина в растворе. При данной концентрации иона калия на электродный потенциал влияет эффективность удаления различного количества ионофора из мембраны. Калибровочная кривая построена в диапазоне концентраций дигоксина 1-100 нмоль/л.
Амперометрический иммуноанализ
Ферментные метки. В электрохимическом иммуноанализе в качестве метки хорошо зарекомендовала себя щелочная фосфатаза. На рис.4 представлено уравнение реакции гидролиза фенилфосфата, который чаще всего применяют в качестве субстрата этого фермента. Образующийся фенол можно окислить в карбонатном буфере при + 750 мВ относительно хлорсеребряного электрода, в то время как субстрат фенил фосфат при положительном потенциале электрохимически неактивен. Образование способного окисляться продукта устраняет необходимость удаления кислорода из пробы перед анализом, как это принято в восстановительных электрохимических экспериментах. Конечно, и ранее щелочная фосфатаза использовалась в иммуноанализе, но только в сочетании со спектрофотометрическим определением продуктов.
Электрохимическое определение фенола осложняется загрязнением поверхности электрода вследствие электрополимеризации феноксильных радикалов, образующихся в результате одноэлектронного окисления фенола.

Осложнения могут возникнуть* также при работе с биологическими образцами из-за адсорбции белков на электроде, сопровождающейся уменьшением измеряемой силы тока. Подобные проблемы стимулировали создание таких методик электрохимического иммуноферментного анализа, в которых амперометрическому определению продуктов ферментативных реакций предшествует хроматографическое разделение смеси. Целью таких методик является попытка решить проблему загрязнения электродов-, а также повысить чувствительность анализа.
Разработана методика конкурентного гетерогенного иммуноферментного определения дигоксина с щелочной фосфатазой в качестве метки и с определением продукта ферментативной реакции фенола в тонкослойной электрохимической ячейке с помощью проточно-инжекционного анализа с электрохимическим детектором или жидкостной хроматографии с электрохимическим детектором.
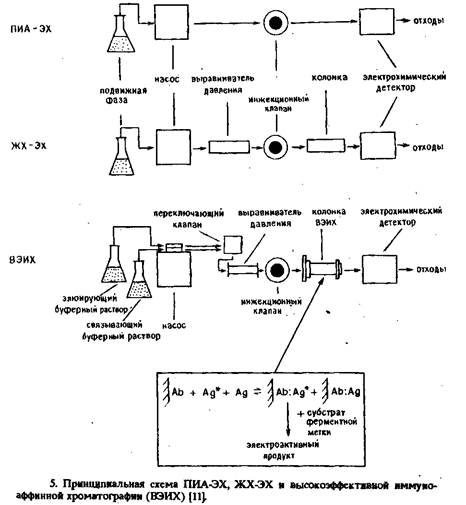
В системе ПИА-ЭХ пробу непосредственно инжектируют в тонкослойную ячейку, тогда как в системе ЖХ-ЭХ фенол задерживается на предколонке с октилдецилсиланом. Каждая система имеет свои достоинства. Например, в ПИА-ЭХ достигается достаточно большая пропускная способность, но меньшая чувствительность, так как инжекция порождает емкостный ток, даже если компоненты раствора субстрата при используемых потенциалах электрохимически неактивны. Емкостный ток обусловлен небольшими различиями между матриксом раствора субстрата и буферной неподвижной фазой. С другой стороны, при ЖХ-ЭХ фенол отделяется от других компонентов смеси, в том числе и тех, с которыми связано возникновение емкостного тока, но это достигается только эа счет значительного увеличения продолжительности анализа.
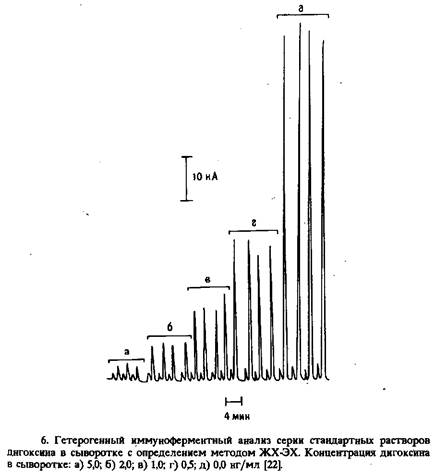
Калибровочную кривую для дигоксина можно построить путем определения пиковых токов растворов сыворотки, содержащих известное количество этого препарата. В варианте ЖХ-ЭХ достигнут предел обнаружения 50 пг/мл; в клинических анализах результаты хорошо согласуются с результатами РИА.
Разработаны также методики конкурентного иммуноферментного анализа в варианте ЖХ-ЭХ для определения кислого а-гликопротеина и иммуноглобулина G. В последней работе достигнут предел обнаружения около 5 нг/мл. Значительно большую чувствительность Обеспечивает двухсайтовый анализ. Так, при определении IgG кролика с щелочной фосфатазой в качестве ферментной метки достигнут предел обнаружения около 10 пг/мл.
В гетерогенном электрохимическом иммуноферментном анализе полезной оказалась и высокоэффективная иммуноаффинная хроматография. Здесь колонку для ВЭИХ, представляющую собой, по сути дела, реактор многократного использования, заполняют антителами, ковалентно связанными с твердым носителем. При применении ферментной метки активность связанного фермента можно измерить путем введения субстрата и определения электроактивного продукта с помощью ЖХ-ЭХ-детектора. Режим проточно-инжекционной хроматографии позволяет тщательно контролировать состояние иммуносорбента, что очень важно для достижения хорошей воспроизводимости. Иммуносорбентные колонки стабильны по меньшей мере в течение 3 месяцев. Такой принцип положен в основу двухсайтовой иммуноферментной методики типа ELISA для определения IgG, в которой роль вторичных антител выполнял конъюгат анти-IgG козла с глюкозооксидазой, а определяли перок с ид водорода, образующийся после введения глюкозы в аффинную колонку. При времени инкубации менее 30 мин достигнута чувствительность 10-12 - 10-15М.
Недавно описана методика быстрого определения hCG с помощью двухсайтового иммуноферментного анализа и иммобилизованных на электроде антител. Активность глюкозооксидазы, связанной с вторыми антителами, определяли электрохимически с помощью медиатора переноса электронов, не прибегая к стадии отдельной инкубации. Средняя чувствительность hCG была равна 9 м. ед. /л.
Все описанные выше методики относятся к числу гетерогенных. Известны и гомогенные методы иммуноферментного анализа с амперометрическим определением. Так, концентрацию антиэпилептического препарата фенитоина можно измерять с помощью конкурентного иммуноферментного анализа, основанного на принципе ПИА, и амперометрического определения NADH. В качестве метки обычно применяют глкжозо-6-фосфатдегидрогеназу, катализирующую восстановление NAD+ до NADH. Оптимальный диапазон определения NADH равен 0,01 его концентрации, создающейся за время, необходимое для каждого анализа. Поэтому непосредственно перед введением в проточную систему пробу необходимо разбавить примерно в 100 раз.
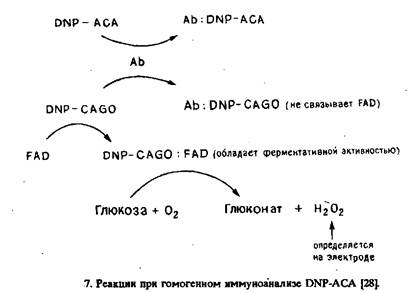
Н-го и др. разработали вариант гомогенного амперометрического иммуноферментного анализа, основанный на ингибировании антителами превращения апоферментов в холоферменты Модельным определяемым соединением была 2,4-динитрофенила-минокапроновая кислота, а в качестве ферментной метки применяли глюкозооксидазу. Катализируемое последней образование пероксида водорода при окислении глюкозы в присутствии кислорода контролировали амперометрически.
Принцип анализа представлен на рис.7. Определяемое вещество DNP-ACA и DNP-апоглюкозооксидаза конкурируют за данное количество антител против DNP. При добавлении флавинадениндинуклеотида последний может связываться со свободной DNP-CAGO с образованием обладающего ферментативной активностью комплекса DNP-CAGO: FAD, который катализирует образование Н202 из 02 в присутствии глюкозы. Таким образом, скорость образования Н202 является мерой концентрации свободной DNP-CAGO и, следовательно, концентрации DNP-
АСА в пробе. Концентрацию Н20, определяют амперометрически на платиновом электроде при + 700 мВ относительно электрода сравнения Ag/AgCl. Рабочий диапазон анализа равен 2-40 мкг/мл.
Вполне успешно использовавшийся для определения гаптенов гомогенный иммуноферментный анализ значительно реже применяли для определения антител. Недавно описаны такие методики для определения антител к лекарственным препаратам. Цель разработки заключалась в упрощении существующих методик определения антител при сохранении требуемой чувствительности. Метод основан на ингибировании ферментативной активности конъюгата антиген-фермент определяемыми антителами, а в качестве фермента применяли глюкозо-6-фосфатдегидрогеназу:

Ферментативную активность измеряли амперометрическим определением скорости окисления NADH на платиновом электроде. Возможности методики были продемонстрированы на примере модельной системы лидокаин-антитела к лидокаину, калибровочная кривая которой получена вплоть до ианограммовых количеств антител. Абсолютная чувствительность анализа зависит от начального количества конъюгата антиген-фермент. Показано, что возможное загрязнение платинового электрода, обусловленное адсорбцией белков, и перекрестные реакции антител практически не влияют на результат анализа.
Неферментативные электроактивные метки. Многообещающим направлением в амперометрическом иммуноанализе представляется применение металлсодержащих соединений. К таким меткам предъявляются следующие требования:
1) хорошие электрохимические свойства,
2) нечувствительность к рН в рабочем диапазоне,
3) растворимость в водных средах,
4) отсутствие в биологических жидкостях,
5) устойчивость и в окисленной, и в восстановленной формах.
Одним из первых производных ферроцена в качестве метки для антител был применен 3-карбокси-4-ферроценил-фенилизотиоцианат, выполняющий роль маркера в электронной микроскопии. Каис и др. впервые предложили использовать в иммуноанализе металлсодержащие метки. Они метили низкомолекулярные гаптены в основном металлоорганическими соединениями. В принципе любой металл может реагировать с подходящим органическим лигандом, однако Каис уделил основное внимание соединениям ртути и железа, хотя были получены также гаптены, меченные хромом, медью, палладием, кобальтом, марганцем, платиной и даже золотом. Иммуноанализ с металлоорганическими метками аналогичен РИА. В этом методе необходимо проводить разделение связанной и свободной фракций метки, а содержание металла в каждой фракции можно определить методом атомно-абсорбционной спектроскопии. К сожалению, хотя металлсодержащие метки и менее опасны, чем радиоактивные, методика анализа весьма сложна и требует довольно дорогого аналитического оборудования. Чувствительность анализа сравнима с чувствительностью простейшего гомогенного метода иммуноферментного анализа типа EMIT.
В 1979 г. две группы исследователей опубликовали статьи, в которых были описаны два варианта гомогенного амперометрического иммуноанализа с неферментативными электроактивными метками. Модельными антигенами в обеих работах были небольшие молекулы. Хейнеман и др. в качестве метки для определения эстриола использовали ацетат ртути. Уровень этого гормона в плазме и моче соответствует определенным стадиям беременности. Силу тока, возникающего от метки на ртутном электроде, измеряли с помощью дифференциальной импульсной полярографии. Последующее добавление антител против эстриола приводит к уменьшению пикового тока, обусловленного волной, которая отвечает восстановлению ацетата ртути при - 300 мВ. Связывание конъюгата эстриола с ацетатом ртути и со специфическими антителами предотвращает восстановление метки при - 300 мВ, что устраняет необходимость разделения связанного и свободного меченого антигенов. Добавление немеченого эстриола к раствору, содержащему связанный с антителами конъюгат эстриол - ацетат ртути, приводит к вытеснению меченного металлом гаптена. Степень вытеснения последнего можно контролировать по увеличению тока. Так как восстановление меченного металлом гаптена происходит при потенциале, при котором становится заметным восстановление кислорода, то для устранения побочных реакций необходимо тщательное удаление кислорода из проб.
В другой работе описана методика определения морфина методом гомогенного иммунохимического анализа с производным ферроцена в качестве метки. Коныогат ферроцена с морфином окисляется на стеклоуглеродном электроде при + 500 мВ относительно стандартного каломельного электрода. Добавление антител против морфина приводит к связыванию конъюгата, что сопровождается уменьшением тока окисления. Вытеснение конъюгата из комплекса с антителами при добавлении кодеина приводит к увеличению тока окисления.
Необходимым условием для осуществления гомогенного иммуноанализа такого типа, по-видимому, является различие в коэффициентах диффузии между свободным меченым антигеном и антигеном, связанным с антителами. Следовательно, такие методики могут в общем случае применяться тогда, когда молекула антигена значительно меньше, чем антитело, так как это приводит к большему различию в коэффициентах диффузии между связанным и свободным антигеном.
Металлосодержание метки можно вводить и в высокомолекулярные антигены с их последующим электрохимическим определением. Однако соответствующие методы значительно сложнее методик определения низкомолекулярных соединений. По нескольким а- и ^-аминогруппам сывороточного альбумина человека были введены остатки хелатирующего агента диэтилентриаминпентауксусной кислоты, связывающего ион индия. При физиологических рН прочность комплекса ДТПА с 1п3+ Очень велика и его диссоциация наступает только при подкислении раствора. На первый взгляд 1п3+ может показаться неудачной меткой, но он имеет то преимущество, что этот металл обычно отсутствует в биологических жидкостях и подвергается характерным обратимым электрохимическим превращениям в комплексообразующих системах. Поэтому анализ можно построить на принципе конкуренции между меченым и нативным антигенами за связывание с определенным ограниченным количеством антител. Связанные с антителами и свободные антигены можно разделить с помощью белка А из Staphylococcus aureus. Ион In3+ затем выделяют из связанной. фракции путем подкисления раствора и определяют методом дифференциальной импульсной анодной вольтамперометрии. Последний определяет чувствительность всего анализа, которая должна быть настолько высокой, что определение концентраций на уровне нмоль/л не должно представлять никаких затруднений. В варианте сандвич-анализа, в котором первые антитела связаны с твердой фазой, а вторые антитела помечены металлом, можно еще более упростить анализ и повысить его чувствительность.
В первых работах с применением меченных ферроценом гаптенов была достигнута лишь ограниченная чувствительность. Сообщение Касса и др. о том, что ферроцен и его производные могут выполнять роль переносчика электронов между электродом и глюкозооксидазой v, оживило интерес к применению этой метки в гомогенном иммуноанализе. Показано, что при восстановлении флавина глюкозооксидазой в присутствии глюкозы окисленную форму фермента можно регенерировать путем переноса электронов на феррициний-ион, образующийся на электроде. Такая система не зависит от присутствия кислорода, так как феррициний-ион становится как бы вторым кофактором глюкозооксидазы: лидокаина.
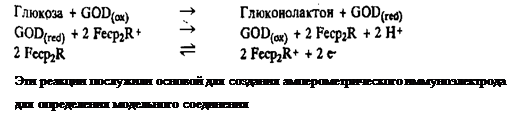
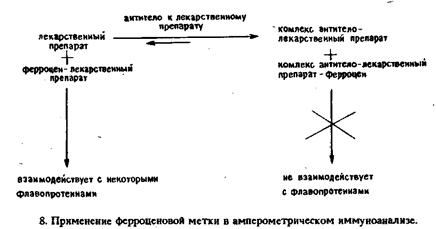
Соответствующая методика включает использование конъюгата лидокаина с ферроценом, который в окисленной форме служит акцептором электронов для глюкозооксидазы. При связывании конъюгата со специфическими антителами способность переносить электроны утрачивается. Добавление свободного лидокаина приводит к вытеснению некоторого количества конъюгата из комплекса с антителами и таким путем к уменьшению ингибирования. Соответствующее изменение силы тока отражает количество присутствующего лидокаина. Разработаны аналогичные методики гомогенного электрохимического иммуноанализа для определения теофиллина и тироксина.
Заключение
Электрохимический иммуноанализ должен найти применение в медицине и ветеринарии, а также и в других областях, например в пищевой промышленности или на водоочистных сооружениях. Сочетание селективности взаимодействия антиген-антитело с низким пределом обнаружения современных электрохимических методов привело к созданию эффективных аналитических методик, которые лишены многих недостатков, свойственных спектроскопическим методам.
Амперометрический иммуноанализ представляется более перспективным, чем потенциометрический, поскольку пока что не найдена идеальная поляризованная мембрана, необходимая для создания действительно иммунохимически селективного потенциометрического электрода или транзистора. Однако любая методика иммуноанализа должна быть надежной, быстрой, простой и дешевой для того," чтобы она смогла реально конкурировать с хорошо отработанными и широко применяемыми методами иммуноанализа.
Похожие работы
... в различных областях, поэтому почти всегда удается найти такую область, в которой один из сигналов достаточно хорошо отделен и пригоден для интегрирования. Особая сложность количественного анализа биологических жидкостей и тканей, которые могут содержать сотни компонентов в очень большом интервале концентраций, в том, что обычно заранее не известно, до какой глубины необходимо проводить анализ и ...
0 комментариев