РЕФЕРАТ
«Противовирусный иммунитет»
2009
Типы вирусных инфекций
Вирусы - это облигатные внутриклеточные паразиты, использующие для синтеза своих белков биохимический аппарат клетки-хозяина. Они чрезвычайно разнообразны по строению и организации генома - некоторые имеют РНК-геном, состоящий всего из нескольких генов, другие обладают ДНК-геномами с числом генов до двух сотен. Структурно вирус представляет собой просто белковый «футляр», в который упакована нуклеиновая кислота. Обнаружены и еще более простые формы живых организмов:
• вироиды - возбудители болезней растений, состоящие только из нуклеиновой кислоты без белковой оболочки, и
• прионы - «инфекционные белки», ассоциированные с дегенеративными неврологическими болезнями животных и человека, включая скрейпи, спонгиозные энцефалопатии крупного рогатого скота и болезнь Крейцфельдта-Якоба.
Вирусы прикрепляются к клеткам хозяина, связываясь со специфическими клеточными рецепторами. Этой специфичностью обусловлен тропизм данного вируса к определенному виду-хозяину или типу клеток. После проникновения вируса в клетку происходит его раздевание - дезагрегация белкового капсида с высвобождением нуклеиновой кислоты. Затем начинается транскрипция и синтез вирусных белков, репликация вирусного генома и, наконец, сборка и созревание нового «поколения» вирусных частиц. Выйдя в межклеточное пространство, они инфицируют близлежащие клетки и ткани. В зависимости от вида вируса и особенностей метаболизма клетки-хозяина этот процесс может различаться в деталях. Так, пикорнавирусам для образования новых вирусных частиц требуется около 8 ч, а ДНК-содержащему цитомегаловирусу человека - до 48 ч.
Механизмы заражения хозяина, персистениии в тканях и патогенеза инфекции широко вирьируют среди различных вирусов. Как правило, вирусы проникают во внутреннюю среду организма через слизистые оболочки. Другой, очень эффективный путь их прямого проникновения в кровоток - через поврежденную кожу, например при укусе насекомого или уколе инъекционной иглой. Размножение вирусов обычно происходит в эпителиальных покровах; вслед за этим в некоторых случаях вирусы проникают в кровь, что приводит к их распространению и инфицированию других тканей. Выздоровление может означать полное устранение вируса из организма-хозяина. Однако некоторые вирусы способны оставаться в организме в скрытой форме после затухания острой инфекции и в какой-то момент реактивироваться с образованием новых инфекционных вирусных частиц. Другие вирусы персистируют в инфекционной форме, несмотря на иммунный ответ хозяина. При таких заболеваниях, как скрейпи и болезнь Крейцфельдта-Якоба, вовсе не бывает острой стадии; их возбудители персистируют в организме, что сопровождается медленной инфекцией, и вызывают проявления болезни спустя многие годы после заражения. В отличие от истинных вирусных, прионовые инфекции не стимулируют ни иммунного ответа, ни продукции интерферонов.
Врожденный антивирусный иммунитет
Ранняя стадия инфекции, как правило, состоит в противоборстве вируса с защитными системами организма-хозяина. Самый первый защитный барьер - это препятствующие внедрению вирусов кожные покровы и слизистые оболочки организма. В случае нарушения их целостности в действие вступают механизмы экстренной неспецифической защиты - интерфероны, НК-клетки и макрофаги.
Интерфероны подавляют репродукцию вирусов
Известно три типа интерферонов:
• ИФсс - лейкоцитарный интерферон, кодируемый у человека семейством генов, расположенных в хромосоме 9;
• МЦв - фибробластный интерферон, кодируемый единственным геном, расположенным в хромосоме 9, и
• ИФу - иммунный интерферон, кодируемый единственным геном, расположенным в хромосоме 12.
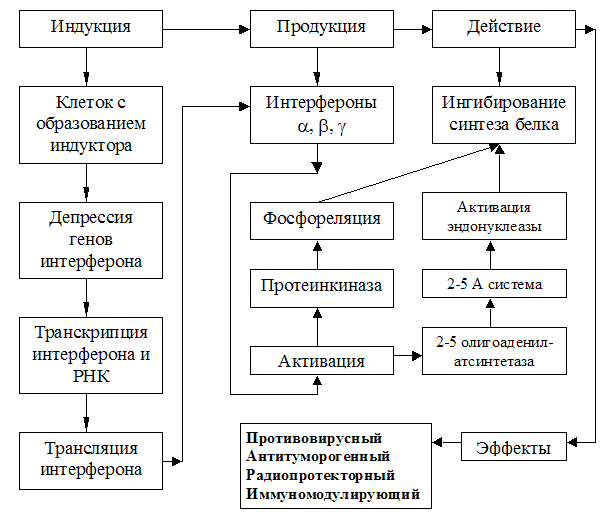
Инфицирование клетки вирусом вызывает синтез ИФсс/в. Под действием интерферонов активируются защитные механизмы соседних клеток, обеспечивая их устойчивость к вирусной инфекции. Активация затрагивает гены ряда белков, в том числе двух, обладающих прямой антивирусной активностью. Это протеинкиназа, которая фосфорилирует сс-субъединицу инициирующего трансляцию фактора eIF-2 и тем самым инактивирует его, блокируя в результате синтез вирусных белков, и другой фермент -2',5'-олигоаденилатсинтетаза, активирующая латентную в обычных условиях эндонуклеазу, способную разрушать вирусные РНК.
Существуют также другие, более специфичные механизмы антивирусного действия интерферонов. Например, белок Мх угнетает первичную транскрипцию генов вируса гриппа, но почти или вовсе не действует на прочие вирусы. ИФу, как и другие типы интерферонов, ингибирует размножение вируса в клетках, но, кроме того, усиливает специфический иммунный ответ, стимулируя повышенную экспрессию молекул МНС класса I и II, а также сильно активируя макрофаги и НК-клетки. О важном значении интерферонов в поддержании противовирусной резистентности организма в целом свидетельствует повышенная восприимчивость к вирусным инфекциям у мышей после введения им антител против интерферонов.
Нормальные киллеры лизируют клетки организма, инфицированные вирусами
Активные НК-клетки появляются уже через двое суток после заражения организма-хозяина вирусом. Они служат главным эффекторным механизмом сопротивления герпесвирусной, в частности цитомегаловирус-нои, инфекции. При отсутствии или уменьшении их активности, например у больных с синдромом Чедиака-Хигаши или у мышей с мутацией beige, наблюдается повышенная восприимчивость к вирусу цитомегалии. Пока не ясно, какие молекулы на поверхности инфицированных вирусом клеток организма распознаются НК-клетками. Однако известно, что интенсивность поражения клеток-мишеней находится в обратной зависимости от уровня экспрессии ими молекул МНС класса I. г-Интерферон повышает функциональную активность НК-клеток. Благодаря этому они собираются в очагах инфекции уже в активированном состоянии. Главным образом, НК-клетки осуществляют реакцию антителозависимой клеточной цитотоксичности.
Защитные механизмы с участием Т- и В-клеток
При отсутствии Т-клеток организм-хозяин весьма восприимчив к атакам вирусов. Так, у бестимусных мышей с врожденным отсутствием зрелых Т-клеток вирус простого герпеса, введенный в кожу, вызывает распространяющееся поражение и в конце концов, проникая в центральную нервную систему, гибель животных. Чтобы защитить этих мышей, достаточно вскоре после заражения перенести им HSV-специфичные Т-клетки. Важное значение Т- и В-клеток, противодействующих вирусным инфекциям, будет рассмотрено ниже.
Антитела и комплемент способны ограничить распространение вируса и предотвратить повторную инфекцию
Антитела могут нейтрализовать инфекционность вирусов
Если вирусу удается преодолеть барьеры врожденного иммунитета, он вызывает развитие адаптивного иммунного ответа с появлением цитотоксических Т-клеток, хелперных Т-клеток и противовирусных антител. Антитела служат главным препятствием для распространения вируса в другие клетки и ткани, особенно для проникновения его в кровоток. В лимфоидной ткани слизистых оболочек образуются преимущественно антитела класса IgA, предотвращающие повторную инфекцию.
Антитела могут быть направлены против любого вирусного антигена, синтезируемого в инфицированной клетке, однако сдерживание инфекции обеспечивают только те из антител, которые специфичны к гликопротеинам, экспрессированным на оболочке вирусов или на мембране инфицированных клеток. Механизмы гуморального противовирусного иммунитета могут быть различными. Так, способ устранения инфекционное вирусных частиц зависит от их локализации - внеклеточной или внутриклеточной. О действии in vivo защитных механизмов свидетельствует то, что инъекция моноклональных вирус-нейтрализующих антител весьма эффективно угнетает репродукцию вирусов. Присутствие в кровотоке нейтрализующих вирус антител - это и важный фактор предотвращения повторной инфекции.
Комплемент участвует в нейтрализации внеклеточных вирусов некоторых видов
Комплемент также способен повреждать оболочку вируса - осуществлять виролиз. Некоторые вирусы непосредственно вызывают активацию комплемента по классическому или альтернативному пути. Тем не менее комплемент не рассматривают как главный фактор зашиты против вирусов, поскольку при недостаточности компонентов системы комплемента не отмечено предрасположенности к тяжелым вирусным инфекциям у человека.
Антитела мобилизуют комплемент и/или эффекторные клетки для разрушения инфицированных вирусами клеток организма
Действие антител, помимо нейтрализации внеклеточных вирусов, состоит в том, что они вызывают разрушение инфицированных вирусами клеток, активируя систему комплемента. В результате его активации происходит сборка лизирующего мембрану комплекса и лизис зараженных клеток. Комплемент - зависимый цитолиз возможен лишь при высокой плотности экспрессии вирусных антигенов на клеточной мембране. В противоположность этому, для лизиса по механизму АЗКЦ необходимо присутствие на поверхности клетки-мишени лишь 103 молекул IgG - такое количество обеспечивает связывание с ней З К-клеток. Эти клетки связываются с нагруженной антителами мишенью через FcyRIll и быстро разрушают ее посредством перфоринов. Насколько важен in vivo каждый из этих механизмов, пока трудно понять. Лучшее доказательство в пользу АЗКЦ получено на мышах при изучении защитного эффекта противовирусных моноклональных антител; не проявляя нейтрализующей активности in vitro, они оказались способны защитить С5-дефицитных животных при введении им высокой дозы вируса.
Т-клетки участвуют в формировании и действии противовирусного иммунитета несколькими путями
В иммунитете к вирусным инфекциям Т-клетки выполняют разнообразные функции. Образование антител в ответ на большинство антигенов зависит от тимуса, поскольку для переключения изотипа и созревания аффинности необходимо участие Т-клеток CD4+. Кроме того, эти клетки помогают в индукции цитотоксических Т-клеток CD8+, а также в привлечении макрофагов в очаг вирусной инфекции и в их активации.
Цитотоксические Т-клетки CD8+
Это главная Т-клеточная система для осуществления в организме противовирусного иммунологического надзора, и действует она весьма эффективно и избирательно. Цитотоксические Т-клетки CD8+, рестриктированные по антигенам МНС класса I, скапливаются в очагах размножения вирусов и разрушают инфицированные ими клетки. Данный механизм иммунологического надзора, по-видимому, весьма важен, так как фактически все клетки тела экспрессируют молекулы МНС класса 1.
Процессинг и презентация вирусных белков
Вероятно, любой вирусный белок может быть процессирован в цитоплазме АПК с образованием пептидов, которые затем транспортируются к эндоплазматическому ретикулуму и ассоциируют с молекулами МНС класса I. Для организма-хозяина это создает определенные преимущества, так как белки вируса, экспрессируемые клеткой в начале цикла его размножения, становятся доступными для Т-клеточного распознавания задолго до появления нового поколения вирусных частиц. Например, Т-клеточный иммунитет к цитомегаловирусной инфекции у мыши специфичен в отношении наиболее раннего вирусного белка рр89. Его протективный эпитоп определен как пептид Lb, состоящий из девяти аминокислотных остатков и презентируемый молекулой МНС класса I. Иммунизация мышей рекомби-нантным вирусом коровьей оспы, несущим ген рр89, полностью защищает их от инфекции CM V. Делеция участка Д З К, кодирующего нанопептид Ld, лишает белок рр89, экспрессируемый вирусом коровьей оспы, протективной активности.
Важность Т-клеточных механизмов в противовирусном иммунитете in vivo установлена различными способами:
• путем адоптивного переноса антигенспецифичных субпопуляций или клонов Т-клеток зараженным животным для проверки на способность устранения вируса;
• на животных, лишенных Т-клеток CD4+ или CD8+ путем введения специфических моноклональных антител, и
• на мышах, избирательно лишенных эмбриональных генов CD4, CD8 и в2-микроглобулина методом генного нокаута.
Как установлено, мыши, лишенные методом генного нокаута определенных субпопуляций лимфоцитов, сохраняют способность к иммунному ответу на вирусную инфекцию. Можно рассматривать это как хорошую иллюстрацию многократного функционального дублирования, вероятно свойственного иммунной системе. Например, Т-клетки CD4+ в отсутствие Т-клеток CD8+ могут компенсировать иммунологическую недостаточность и устранять инфекцию.
Т-клетки CD4+ способны выполнять важные эффекторные функции в иммунном ответе на вирусную инфекцию
В иммунном ответе на инфекцию эпителиальных покровов, вызванную вирусом простого герпеса 1 типа, главной эффекторной клеточной популяцией служат Т-клетки CD4+. Они, как и в реакциях гиперчувствительности замедленного типа, мобилизуют и привлекают макрофаги, и это ускоряет ликвидацию вируса. Макрофаги служат важными участниками этого процесса. В качестве ключевых цитокинов в ответе на герпесвирусную инфекцию действует ИФу, необходимый для активации моноцитов, и фактор некроза опухолей, оказывающий ряд противовирусных эффектов, сходных с эффектами ИФу, но осуществляемых иными путями.
При заражении вирусом кори в организме образуются цитотоксические Т-клетки CD4+, которые распознают и лизируют инфицированные вирусом клетки-мишени, экспрессирующие молекулы МНС класса II. Это указывает, что про-цессинг и презентация антигенов вируса кори происходят обычным способом - путем фагоцитоза и расщепления. Однако существует, предположительно, и другой, еще неизвестный механизм, посредством которого белки или пептиды вируса кори перемещаются из иитозоля в везикулы класса II.
Стратегии обхода вирусами иммунологического контроля
Вирусы со своей стороны обладают разнообразными свойствами защиты от распознавания антителами. Наиболее эффективно этому служит смена антигенов: в вирусных белках, которые обычно становятся мишенями для антител, происходит изменение иммунодоминантных областей. Антигенная изменчивость наблюдается у вирусов иммунодефицита человека и ящура, а также у вируса гриппа; в последнем случае она названа антигенным дрейфом и шифтом. Гуморальный иммунитет к этим вирусным инфекциям сохраняется лишь до появления нового сероварианта возбудителя, что не позволяет рассчитывать на долговременный эффект вакцинации.
Антитела могут удалять вирусные антигены с плазматической мембраны клетки путем кэппин-га. Именно этот механизм, возможно, ограничивает развитие некоторых вирусов персистенцией внутри клеток. Герпесвирусы кодируют гликопротеины, связывающие IgG через Fc-фрагмент, т. е. обладают FcyR-ак-тивностью, которая нарушает активацию комплемента и блокирует действие противовирусных антител.
Некоторые вирусы способны противодействовать эффекту интерферонов: они продуцируют короткие отрезки РНК, которые конкурируют за протеинкиназу и каким-то образом подавляют активацию этого фермента. Ряд вирусов кодирует белки, ингибирующие перенос молекул МНС класса I на плазматическую мембрану клетки. Это дает вирусу преимущество, помогая избежать распознавания цитотоксическими Т-клетками.
Отдельные вирусы обладают генами белков, гомологичных цитокиновым рецепторам или даже самим цитокинам. Синтез и выделение из инфицированных клеток этих белков, в частности растворимых форм рецепторов к ИЛ-Йв, ФНО и ИФу, нарушают локальное действие опосредованных цитокинами защитных механизмов. Вирус Эпштейна-Барр, например, кодирует белок, гомологичный ИЛ-10 млекопитающих и имитирующий его активность in vitro. Полностью значение подобных продуктов вирусного генома in vivo еще предстоит выяснить.
Иммунопатология
Иммунный ответ на вирусные антигены может вызывать повреждения тканей Нарушения, связанные с иммунными комплексами
Иммунные комплексы могут появляться в различных жидкостях организма или на поверхности клеток, чаще всего при хронических, а также при персистентных инфекциях, вызванных, например, вирусами лимфоцитарного хориоменингита либо гепатита В. При избытке вирусного антигена антитела теряют способность нейтрализовывать вирусы; вместо этого они образуют иммунные комплексы, которые оседают в почках или в кровеносных сосудах других органов и вызывают там воспалительные реакции, чреватые повреждением тканей, например такие, как гломерулонефрит.
Связывание вирусов антителами, лишенными нейтрализующей активности, иногда имеет еще одно необычное патологическое следствие: эти иммунные комплексы в результате взаимодействия с Fc-рецептором поглошаются макрофагами, в которых инфекционность вируса усиливается. Это можно наблюдать при инфекции, вызванной вирусом денге. С Fc-рецепторными взаимодействиями иммунных комплексов, вызывающими гиперактивацию системы комплемента, связан также патогенез геморрагической лихорадки и шокового синдрома денге. Повреждение тканей хозяина цитотоксическими Т-клетками При любой вирусной инфекции некоторая часть тканевых повреждений вызвана Т-клеточной активностью. Иногда в эксперименте они настолько существенны, что могут вызвать гибель животного. Яркий пример этого - поражение клеток центральной нервной системы мыши цитотоксическими Т-клетками при иммунном ответе на заражение LCMV. Удаление Т-клеток спасает животных от гибели; таким образом, именно Т-клетки, а не вирусы, повреждают ткани мозга. Подобный механизм предположительно действует в патогенезе хронического активного гепатита у человека.
Вирусы способны инфицировать клетки иммунной системы
Некоторые вирусы непосредственно инфицируют лимфоциты и макрофаги, вызывая патогенный эффект. Кроме того, иммунокомпетентные клетки служат для вирусов благоприятным местом персистенции. Вирусы в неинфекционной форме локализуются в покоящихся лейкоцитах, активация которых может вызвать и реактивацию вирусов с репликацией инфекционных вирионов.
Вирус иммунодефицита человека инфицирует Т-клетки CD4+
Т-клетки и макрофаги поглощают ВИЧ вследствие того, что вирусный гликопротеин gpl20 связывается с маркером CD4 и с определенными рецепторами для хемокинов, CCR3 и CCR5. Подобным же образом ВИЧ проникает в любую другую антигенпрезентирующую клетку. Противовирусные антитела могут способствовать этому процессу, если клетка обладает Fc-рецептором. По сути это альтернативный способ внедрения вируса в фагоцитарные клетки или механизм, усиливающий проникновение, в том случае когда CD4 присутствует в малом количестве.
Период отсутствия клинических симптомов при ВИЧ-инфекции варьирует у разных больных и может быть весьма длительным; примерно у половины инфицированных ВИЧ-инфекция не прогрессирует в СПИД в течение 10 лет. В этот латентный период инфекции возбудитель присутствует в организме в форме провируса, встроенного в геномную ДНК хозяина, и транскрипции вирусной ДНК не происходит. Активацию вируса и начало транскрипции могут вызвать многие факторы. Например, in vitro воздействие ФНО и ИЛ-6 на латентно инфицированные культуры Т-клеток приводит к повышенной продукции инфекционных вирионов. Этот феномен, вероятно, имеет место и in vivo, так как моноциты ВИЧ-инфицированных больных часто выделяют указанные цитокины в патологически высоком количестве. Возможно, существует цикл высвобождения ФНО и ИЛ-6, в определенной фазе которого происходит усиление транскрипции вирусных генов. Репликация вируса ведет к инфицированию все большего числа клеток и выделению все большего количества цитокинов, причем in vitro ее стимулируют не, только указанные, но и другие цитокины и лимфокины, а также митогены и форболовые эфиры. Элиминации вируса не происходит по различным причинам, в том числе из-за его латентной персистенции, мутирования и прогрессирующей иммунологической недостаточности.
Вирусная инфекция может провоцировать аутоиммунные заболевания
Вирусный патогенез аутоиммунных болезней имеет несколько механизмов.
Индуцированное вирусами повреждение тканей. Некоторые вирусные инфекции вызывают повреждение тканей и последующую воспалительную реакцию, в результате которой начинают экспонироваться ранее «скрытые» собственные антигены; они могут пройти процессинг и быть презентированы клеткам иммунной системы. Это наблюдается, например, при инфекциях нервной системы, вызванных вирусом Тейлера и вирусом гепатита мыши, когда мишенями для антител и Т-клеток становятся компоненты миелиновой оболочки аксонов.
Молекулярная мимикрия Иммунная система распознает как «чужое» аминокислотную последовательность вирусного белка, который гомологичен одному из белков организма-хозяина. В результате происходит срыв иммунологической толерантности к собственным скрытым антигенам и последующая атака иммунной системы против тканей хозяина.
Похожие работы
... на вирус иммунодефицита человека (азидотимидин, фосфаноформат) 4. Препараты широкого спектра действия (интерфероны и интерфероногены) [2] Машковский М.Д.[5] создал такую классификацию противовирусных препаратов: А) Интерферон 1. интерферон. Лейкоцитарный интерферон из донорской крови человека. 2. интерлок. Очищенный α-интерферон, полученный из донорской крови. 3. реаферон. ...
... оболочек, нормальной микрофлорой организма, фагоцитозом, воспалением, барьерной функцией лимфатических узлов, противомикробными веществами, содержащимися в тканях и жидкостях организма, выделительной системой. Резистентность организма животных к инфекционным патогенам зависит от пола, возраста, физиологического состояния. При изменении условий окружающей среды факторы естественной защиты могут ...
... авторы с успехом применяли этот метод при изучении различных вирусов — ящура, везикулярного стоматита, ньюкаслской болезни, чумы птиц, полиомиелита, Коксаки и др. Метод бляшек стали широко применять в вирусологии для получения чистых популяций вируса, особенно при изучении их генетических свойств. Методику получения бляшек, предложенную Дальбекко и Фогтом, модифицировали, и в настоящее время есть ...
... также вирусов гриппа А и В, вируса гепатита В и ВИЧ) без предварительной активации. Препарат высоко токсичен, что ограничивает его применение в лечении герпетической инфекции только случаями резистентности герпеса к ацикловиру и его аналогам. Другие препараты, указанные в таблице 6, имеют меньшую клиническую эффективность, поэтому их применение возможно при недоступности современных антивирусных ...

0 комментариев