ПРОФЕССИОНАЛЬНЫЕ ПОРАЖЕНИЯ
СИСТЕМЫ КРОВИ
ПРОФЕССИОНАЛЬНЫЕ ПОРАЖЕНИЯ СИСТЕМЫ КРОВИ
ХИМИЧЕСКОЙ ЭТИОЛОГИИ
Кровь, как высокофункциональная и морфодинамичная система, быстро реагирует на различные воздействия внешней среды, в том числе на вредные производственные факторы.
Изменения крови при действии промышленных ядов можно условно разделить на
- общие гематологические реакции и
- специфические изменения.
Общие гематологические реакции характеризуются однотипными изменениями состава периферической крови, которые возникают при острой интоксикации любым токсичным веществом, независимо от механизма его действия (общетоксическое, наркотическое, раздражающее, гематотропное и др.).
Наиболее частыми являются изменения белой крови в виде нейтрофильного лейкоцитоза с левым ядерным сдвигом, эозинофилопении, лимфопении, увеличения числа моноцитов, что является защитной реакцией организма на воздействие токсинов с участием макрофагально-лимфоцитарной системы крови. Сочетанное взаимодействие ее с почечно-печеночной системой рассматривается как «химический иммунитет». Универсальность системы защиты организма определяет однотипность ответных гематологических реакций. Степень выраженности измененных показателей белой крови обычно соответствует тяжести острой интоксикации.
К специфическим изменениям крови относят гематологические изменения, обусловленные действием конкретного вредного фактора производственной среды, имеющие определяющее значение при установлении диагноза профессионального заболевания.
Классификация профессиональных заболеваний системы крови соответствует основным нозологическим формам, наблюдаемым в гематологии. Вместе с тем гематологические заболевания химической этиологии имеют ряд особенностей, которые необходимо учитывать при установлении диагноза:
1 ) возникновение и развитие патологического процесса определяются характером действующего этиологического фактора, в связи с чем выделяют определенные группы токсичных веществ со сходным и преимущественным механизмом их действия на систему крови;
2) степень выраженности и характер патологических изменений крови зависят от концентрации действующего вещества в воздухе рабочей зоны, путей проникновения в организм, его метаболизма и выделения. Следует учитывать возможность комбинированного и (или) комплексного действия нескольких вредных факторов, а также влияние непроизводственных причин;
3) гематологические нарушения, вызванные действием промышленных ядов, сочетаются с другими клинико-лабораторными проявлениями интоксикации органов дыхания, желудочно-кишечного тракта, нервной и сердечно-сосудистой системы и др., что обосновано подтверждает профессиональный характер заболевания;
4) патологический процесс в системе крови имеет тенденцию к восстановлению при своевременном прекращении вредного действия этиологического фактора, что имеет большое значение для решения вопросов врачебно-трудовой экспертизы.
Помимо общих принципов диагностики профессиональных заболеваний, учитывают частные, среди которых обязательны следующие:
1) с целью выявления отклонений в составе периферической крови проводят сравнение соответствующих показателей у обследованных профессиональных контингентов с гематологической нормой, границы которой ограничены отклонениями 1,5 σ от средней величины;
2) обязательно изучение анализов крови в динамике на протяжении всего периода работы в контакте с вредным производственным фактором и сопоставление этих показателей с результатами исследования крови на момент предварительного медицинского осмотра. При этом следует учитывать направленность изменения показателей, хотя последние могут незначительно отличаться от нормы;
3) тщательный анализ анамнестических данных для исключения роли всевозможных непроизводственных причин, которые могут обусловить развитие аналогичных или сходных клинико-гематологических нарушений с поражением крови профессионального характера;
4) применение специфических методов диагностики в соответствии с выявленной клинической формой поражения крови для подтверждения профессиональной принадлежности;
5) в совокупности с перечисленными выше диагностическими приемами рекомендуется использование теста «элиминации» (улучшение или восстановление состава крови при прекращении контакта с этиологическим фактором) и теста «реэкспозиции» (ухудшение в составе крови при возобновлении контакта).
Основные патогенетические группы
клинических форм поражениий системы крови:
- депрессия гемопоэза (бензол - ПДК 5 мг/м куб, хлорбензол, ПДК - 50 мг/м куб, гексаметилендиамин, ПДК – 1 мг/м куб, гексаметиленамин, ПДК – 0,5 мг/м куб, гексахлорциклогексан, ПДК – 0,05-0,1 мг/м куб, стрептоцид, норсульфазол, сульфацил-натрия, сульфадимезин: ПДК – 1 мг/м куб, сульфапиридазин, сульфадиметоксин, сульфамонометоксин: ПДК 0,1 мг/м куб, пирамидон, анальгин: ПДК – 0,5 мг/м куб),
- нарушение синтеза порфиринов и гема (свинец),
- изменения пигмента крови:
- метгемоглобинемия (амино- и нитросоединения бензола и его гомологов, их лекарственные производные, окислители – бертолетовая и красная кровяная соль и другие),
- карбоксигемоглобинемия (оксид углерода или угарный газ),
- гемолитические анемии (мышьяковистый водород, фенилгидразин, толуилендиамин, гидроперекись изопропилбензола, уксусная эссенция, бертолетовая соль, ядовитые грибы).
I. ДЕПРЕССИЯ ГЕМОПОЭЗА.
Развитие гемодепрессии может быть обусловлено воздействием ряда факторов, в том числе и производственных. В последние годы частота гипопластических (апластических) состояний заметно увеличилась, что связано с бесконтрольным применением лекарств и использованием в промышленности веществ, оказывающих миелодепрессивное действие.
К токсичным веществам, которые в определенных производственных условиях при длительном воздействии и концентрациях, превышающих ПДК, могут вызвать депрессию гемопоэза, относятся следующие химические соединения:
Бензол (С6Н6) является ценным сырьем для изготовления синтетических продуктов, встречается в составе некоторых видов нефти, моторного топлива, в технических горючих газах, нефтяных бензинах-растворителях, как примесь в его гомологах (толуол, ксилол) и других органических растворителях.
Хлорбензол применяется в промышленности в качестве растворителя как компонент при органическом синтезе.
Гексаметилендиамин (ГМД) применяется как промежуточный продукт в производстве солей АГ и СГ (адипинат и себацинат ГМД), из которых методом поликонденсации получают полиамидную смолу нейлон, служащую материалом для изготовления одноименного синтетического волокна и различных пластмассовых изделий. ГМД используют в качестве промежуточного продукта в производстве полиуретанов, из которых получают специальный каучук и пластмассовые изделия; играет роль отвердителя в производстве эпоксидных смол и некоторых красок, а также в производстве химического пеногасителя.
Гексаметиленимин применяется в фармацевтической, химической и других отраслях промышленности.
Гексахлорциклогексан (ГХЦГ). В нашей стране технический ГХЦГ (смесь изомеров) называется гексахлораном, имеет много синонимов, в том числе линдан, гексатокс, гематокс и др. Применяется в качестве инсектицида и ларвицида.
Сульфаниламидные и пиразолоновые лекарственные препараты: стрептоцид, норсульфазол, сульфацила-натрия, сульфадимезина, сульфапиридазин, сульфадиметоксин, сульфамонометоксина, пирамидон, анальгин (размол, просев, фасовка).
Патогенез.
Механизмы развития токсической гемодепрессии включают как возможное непосредственное цитотоксическое действие на самые ранние предшественники гемопоэза — плюрипотентные стволовые клетки, так и на микроокружение последних (стромальные клетки костного мозга и других кроветворных органов, неклеточные элементы), следствием чего является уменьшение количества стволовых клеток, родоначальниц всех трех ростков кроветворения, нарушение их пролиферации и дифференциации.
Даже при низких уровнях воздействия бензола отмечается угнетение пролиферации клеток предшественников нейтрофилов и эритроцитов компенсаторная активация гемопоэза, длительное время препятствующая развитию периферической цитопении.
Гемодепрессоры вмешиваются в процессы перекисного окисления липидов, синтеза ДНК, окислительное фосфорилирование, что приводит к дефекту продукции и сокращение выживаемости клеток, в первую очередь - гранулоцитов.
Аутоиммунные механизмы развития гемодепрессии связаны с нарушением антигенраспознающих свойств Т-лимфоцитов и их депрессивным действием на миелопоэз.
Степень выраженности депрессии эритро-, лейко- и тромбоцитопоэза зависит от интенсивности и продолжительности действия этиологического фактора, индивидуальной чувствительности организма к его действию, состояния эндогенных факторов, влияющих на гемопоэз, в особенности у женщин (манифестирующий или латентный дефицит железа, дисфункция щитовидной, вилочковой желез, яичников и др.).
Патологическая анатомия.
При выраженных формах хронической интоксикации наблюдаются общее малокровие и геморрагический диатез (точечные кровоизлияния в кожу, слизистые оболочки, полость рта, серозные оболочки, внутренние органы, в мягких мозговых оболочках, в веществе больших полушарий мозга, его желудочках. Отмечается аплазия костного мозга с поражением всех его трех ростков (практически исчезновение клеток) и избыточным фиброзом элементов стромы. В печени и почках наблюдаются дистрофические изменения, межуточный склероз, возможно появление инфильтратов из плазматических клеток.
Клиника.
Клиника профессиональных интоксикаций веществами, способными вызывать депрессию гемопоэза, складывается из совокупности гематологических симптомов, которые сочетаются с изменениями других органов и систем, характерных для действия определенного этиологического фактора.
Если в клинической картине ведущим является анемический синдром, то преобладают общая слабость, быстрая утомляемость, частые головокружения, нередко головная боль, ощущение мушек перед глазами, одышка при физической нагрузке. Характерна бледность кожных покровов и видимых слизистых оболочек, смещение границ относительной тупости сердца влево, над верхушкой и проекцией легочной артерии нередко выслушивается систолический шум. Лимфатические узлы и селезенка не увеличены.
В тех случаях, когда превалирует депрессия тромбоцитопоэза, развивается геморрагический синдром с кровоточивостью десен, кожными геморрагиями, носовыми кровотечениями, меноррагиями. В развитии геморрагий имеет значение нарушение гемокоагуляции и структурные изменения сосудистой стенки стромальных клеток вплоть до развития «костномозгового фиброза» с последующими разрывами сосудов.
Изменения периферической крови при воздействии гемотоксичных веществ характеризуются цитопениями, иногда транзиторными. Часто первым гематологическим симптомом является лейкопения, которая может носить транзиторный характер. Диагностическое значение имеет стойкое уменьшение количества лейкоцитов - менее 4,0-10х9/л за счет уменьшения содержания нейтрофилов, что приводит к относительному лимфоцитозу. Возможны качественные изменения лейкоцитов в виде: повышения содержания нейтрофилов с патологической зернистостью, их гиперсегментация, омоложение лейкограммы со сдвигом влево. Наряду с лейкопенией может отмечаться умеренная тромбоцитопения (количество тромбоцитов менее 180-10х9/л и нерезко выраженная эритроцитопения. Содержание ретикулоцитов либо нормально, либо несколько повышено (более 12 %о).
При преобладании депрессия эритропоэза уменьшается содержание гемоглобина (менее 115 г/л у женщин и менее 132 г/л у мужчин) и количество эритроцитов (менее 3,7-10х12/л у женщин и менее 4-10х12/л у мужчин). Анемия обычно нормохромная, чаще умеренная.
При глубокой депрессии кроветворения в крови обнаруживается выраженная панцитопения, проявляющаяся значительным уменьшением всех форменных элементов крови. При этом резко ускорена СОЭ, удлинено время кровотечения (более 6-10 мин).
Стернальные костномозговые пунктаты при умеренной цитопении периферической крови характеризуется легким гипопластическим состоянием в виде снижения сегментоядерных нейтрофилов с возможным либо увеличением, либо снижением числа молодых форм миелоидного ряда, непостоянного ретикулоцитоза. Наличие ретикулоцитоза наряду с гиперплазией эритроидного ростка, повышением митотической активности клеток миелоидного ряда свидетельствует об активации регенераторных процессов и расценивается как компенсаторная реакция на воздействие гематотоксического фактора.
Типичным представителем рассматриваемой группы промышленных ядов является бензол. Хроническая интоксикация бензолом протекает с преимущественным поражением гемопоэза (депрессией) и нервной системы, а также изменениями в других органах и системах. В зависимости от тяжести течения различают три степени выраженности хронической интоксикации бензолом.
Легкие, часто стертые формы хронической интоксикации бензолом протекают с признаками гемо- и нейротоксического действия чаще у женщин с латентным дефицитом железа, заболеваниями женской половой сферы, дисфункцией щитовидной железы и др. Цитопенические реакции носят легкий, транзиторный характер. Диагностическую значимость при этих формах отравления приобретает не только появление цитопении, но и вариабельность, изменчивость гематологических показателей, что свидетельствует о нарушении регуляции гемопоэза.
Возможны легкие симптомы геморрагического диатеза (кровоточивость десен, носовые кровотечения, увеличение менструальных кровопотерь), которые могут быть самым ранним, а иногда и единственным клиническим симптомом. При этом количество тромбоцитов может сохраняться в пределах колебаний нормы.
Для легких форм хронической интоксикации бензолом характерны функциональные расстройства центральной нервной системы, обусловленные его наркотическим действием. Установлено более раннее в сравнении с изменениями крови появление неврологической симптоматики в виде нарушений психологического статуса, поведенческих реакций, вегетативной дисфункции гиперреактивного типа, неврозоподобных состояний.
Средняя степень интоксикации бензолом характеризуется большей выраженностью клинико-гематологических симптомов, геморрагического диатеза, нарушений сердечно-сосудистой системы, отдельных функциональных проб печени, развитие вегетативно-сенсорной полиневропатии. В периферической крови нарастает лейкопения с нейтропенией, обнаруживается тромбоцитопения и умеренно выраженная анемия. Количество ретикулоцитов несколько увеличено или нормально, СОЭ увеличена. В стернальных пунктатах - умеренно выраженное гипоплазия.
Тяжелая форма хронической интоксикации бензолом в настоящее время практически не встречается. Характеризуется глубокой панцитопенией (значительная лейкопения, тромбоцитопения, анемия), отсутствием ретикулоцитоза, чрезвычайно увеличенной СОЭ. В костном мозге - истинная гипоплазия. Резко выражен геморрагический синдром. Наблюдаются артериальная гипотензия и дистрофия миокарда, признаки токсико-химического гепатита. Изменения нервной системы проявляются выраженным астеническим или астеноорганическим синдромом (токсическая энцефалопатия).
Хлорбензол (ХБ) в концентрациях, превышающих ПДК, вызывает менее выраженную депрессию гемопоэза, чем бензол. В большей степени поражает эритропоэз с развитием умеренно выраженной анемии, вследствие нарушения мембранной проницаемости эритроцита, его антитоксической функции, ускорения процессов старения и сокращение продолжительности жизни циркулирующих эритроцитов. Нередки сочетания с нерезкой лейкопенией или тромбоцитопенией. Могут наблюдаться те же неврологические синдромы, что и при интоксикации бензолом. Ранними признаками воздействия ХБ являются изменения кожи (эпидермиты, ониходистрофии, дерматиты).
Гексаметилендиамин (ГМД) наряду с депрессией кроветворения при длительном воздействии вызывает поражение центральной нервной системы с вегетативными расстройствами, паренхиматозных органов (печень, почки), нарушение проницаемости мелких кровеносных сосудов, а также является веществом сенсибилизирующего действия. При длительном контакте с ГМД у работающих наблюдаются легкие явления геморрагического синдрома (носовые кровотечения), функциональные нарушения центральной нервной системы в виде астеновегетативного синдрома с наклонностью к артериальной гипотензии, диспепсические расстройства (плохой аппетит, боли в эпигастральной области). Отмечаются наклонность к анемии, ретикулоцитоз, лейкопения с нейтропенией, тенденция к тромбоцитопении, транзиторные цитопенические реакции, особенно гранулоцитопения, наиболее ранние признаки воздействия ГМД.
Развитие гипопластической анемии вызывают ДДТ и ГХЦГ. Интоксикация указанными пестицидами может протекать с изменениями крови (анемия, лейкопения, тромбоцитопения), которые сочетаются с другими клиническими проявлениями. Следует отметить, что среди больных, страдавших гипопластической анемией и геморрагическими диатезами и лечившихся в гематологических отделениях, наблюдался высокий процент лиц, имевших длительный контакт с пестицидами (ДДТ, ГХЦГ, полихлорпинен, хлорофос). Это обусловлено свойствами пестицидов кумулироваться в жировых тканях, в частности в костном мозге, что подтверждается наличием значительного содержания хлорорганических пестицидов (14,00 ± 0,35 мг/кг против 7,40 ± 0,54 мг/кг в контрольной группе).
У фасовщиц и аппаратчиков последних стадий производства сульфаниламидных и пиразолоновых препаратов при превышении концентраций этих соединений в воздухе рабочих помещений изменения в составе крови могут проявляться лейкопенией, абсолютной нейтропенией и нерезко выраженной анемией. В костномозговых пунктатах в этих случаях обнаруживается увеличение количества миелоцитарных предстадий при одновременном снижении числа зрелых нейтрофилов, несколько замедлено созревание эритробластов. Пиразолоновые препараты оказывают более выраженное действие на гемопоэз, чем сульфаниламидные.
Диагностика.
Профессиональный характер депрессии гемопоэза устанавливается на основании соответствующей
- клинико-гематологической картины;
- санитарно-гигиенических данных об условиях труда заболевшего,
- указаний на длительный контакт с определенным из вышеназванных химических веществ в концентрациях, превышающих ПДК.
Дифференциальная диагностика.
Должна проводиться с гемодепрессиями лекарственного генеза, частота которых заметно увеличилась. Это связано с приемом лекарств, обладающих гемодепрессивными свойствами, в основе которого лежат иммунные нарушения или неэффективный миелопоэз. Наиболее часто развитие указанных состояний наблюдается при приеме амидопирина, бутадиона, анальгина, левомицетина, цитостатиков и др. Установление четкого совпадения возникших изменений крови с периодом приема указанных лекарственных препаратов, более выраженный характер гематологических изменений позволяют связать их между собой.
Надо иметь в виду, что лейкопении (гранулоцитопении) могут иметь распределительный характер - уменьшение количества циркулирующих клеток и скопление их в краевом пуле. Доброкачественные распределительные нейтропении отмечаются при таких заболеваниях, как язвенная болезнь желудка и двенадцатиперстной кишки, воспалительные процессы в желчевыводящих путях, колиты, неврозы и др.
В отличие от доброкачественной лейкопении, при которой нет существенных сдвигов в костномозговом кроветворении, равно как и нарушений в функции лейкоцитов, токсическая лейкопения сопровождается теми или иными изменениями миелограммы, а также функциональной неполноценностью гранулоцитов.
Выявленная анемизация требует тщательной дифференциальной диагностики с различными формами анемий иной этиологии, в основном с железодефицитным малокровием вследствие кровопотерь (язвенное, геморроидальное кровотечение, носовые кровотечения при болезни Рандю-Ослера, менструальные кровопотери и др.). Такая анемия чаще встречается у женщин и сопровождается появлением сидеропенических симптомов (трофические расстройства: выпадение волос, койлонихия, ломкость ногтей, извращение вкуса - pica chlorotica, дисфагия). Общим признаком железодефицитных анемий является гипохромия, повышение общей железосвязывающей способности сыворотки, особенно латентная железосвязывающая способность (без сывороточного железа). Снижается процент насыщения трансферрина.
Однако в клинической практике часто наблюдаются анемии смешанной этиологии (воздействие химического фактора в сочетании с дефицитом железа), особенно у женщин. Подтверждением профессионального происхождения такой формы анемии должны быть данные профессионального анамнеза, сопоставление результатов исследования крови в период предварительных и периодических медицинских осмотров, указывающие на снижение гемоглобина в период контакта с токсичным веществом, выявление других признаков, свойственных интоксикации соответствующим химическим веществом, и установление аналогичного симптомокомплекса у других лиц, работающих в тех же производственных условиях. Имеет также значение наступающее улучшение состава крови и даже полная репарация после устранения профессионального контакта с вредным химическим агентом.
При периферической панцитопении возникает необходимость исключения группы анемий, связанных с нарушением синтеза ДНК и РНК эритро6ластов (мегалобластных анемий), особенно В12-дефицитных анемий. В этих случаях в костном мозге обнаруживаются мегалобласты.
При дифференциальной диагностике токсических цитопений должны быть исключены заболевания, сопровождающиеся гиперспленизмом, характерным проявлением которого является уменьшение всех форменных элементов крови или изолированное понижение количества гранулоцитов вследствие их повышенного разрушения при наличии активного костного мозга (тромбофлебическая селезенка, цирроз печени, синдром Фелти, лимфогранулематоз, туберкулез и сифилис селезенки).
В круг дифференциальной диагностики должны быть включены системные заболевания соединительной ткани, при которых в основе развития цитопений лежит нарушение иммунобиологических реакций в организме. Дифференциальная диагностика в таких случаях должна идти главным образом по пути оценки симптомов и течения основного заболевания.
Разнообразие гематологических изменений, встречающихся при злокачественных новообразованиях (особенно в случаях гипопластического состояния кроветворения), должно настораживать в отношении дифференциальной диагностики с этим серьезным страданием.
Лечение.
Лечение токсических депрессий кроветворения зависит от степени выраженности процесса. Одновременно с процессами повреждения гемопоэза в организме развиваются компенсаторно-приспособительные реакции, направленные на сохранение количества и суммарной функциональной активности клеток периферической крови. При легких гематологических сдвигах, когда кроветворение характеризуется усилением регенераторных процессов, назначение гемостимулирующих средств нецелесообразно. Следует использовать широкий комплекс витаминов группы В и сосудоукрепляющих средств (витамины С, Р).
При выраженных стойких депрессиях гемопоэза в целях стимуляции созревания молодых элементов в более дифференцированные формы назначаются гемостимуляторы и иммуностимуляторы (нуклеиновокислый натрий, пентоксил, лейкоцитин и др.), декарис. При геморрагическом синдроме хороший эффект оказывает аминокапроновая кислота, викасол или витамин К, хлорид кальция, витамин С, рутин.
При глубоких панцитопениях показана комплексная терапия, направленная как на стимуляцию кроветворения, так и оказывающая заместительный эффект: неоднократные гемотрансфузии (цельной крови и ее компонентов - эритро-, тромбо- и лейкоцитной массы) в сочетании с витаминами группы В, гемостимуляторами, сосудоукрепляющими средствами и кортикостероидными гормонами. Последние наиболее эффективны при гемодепрессиях иммунного генеза.
Для лечения гипопластических анемий широкое применение получили анаболические гормоны (неробол).
Для лечения анемических синдромов проводят комплексную терапию, включающую гемостимуляторы, фолиевую, аскорбиновую кислоты. При дефиците железа рекомендуется прием феррамида, ферроплекса, гемостимулина, орферона и других препаратов, содержащих лактат или другие соединения железа, которые следует принимать через 1,5-2 ч после приема пищи, что обеспечивает лучшее всасывание.
Экспертиза трудоспособности.
При решении экспертных вопросов следует иметь в виду, что при прекращении токсического воздействия, как правило, наблюдается положительная динамика гематологических показателей. Продолжительность восстановительного периода зависит от степени выраженности изменений крови и эндогенного состояния гемопоэза. Реабилитационные процессы в системе крови обычно опережают восстановление неврологических симптомов. Несвоевременное прекращение контакта с токсичным веществом при наличии легких, начальных гематологических сдвигов может вызвать прогрессирование гематологической симптоматики.
Поэтому основное правило при решении вопросов экспертизы трудоспособности - прекращение контакта с вредным этиологическим фактором независимо от степени выраженности депрессии кроветворения. Наиболее правильным экспертным решением в этих случаях следует считать своевременную переквалификацию и рациональное трудоустройство на работах, не связанных с воздействием гематотропных веществ. При затяжном восстановлении гематологических нарушений и неудачном трудоустройстве оправдана выплата «процента утраты трудоспособности».
Определение группы инвалидности по профессиональному заболеванию, а также сохранение ее на длительный срок требуют индивидуального подхода с учетом степени выраженности изменений крови и других симптомов интоксикации, характера течения процесса, возраста больного, профессии, а также сопутствующей общей патологии, которая может оказывать отрицательное влияние на кроветворение.
Профилактика.
Основой профилактики гематотоксического действия производственных факторов являются санитарно-гигиенические мероприятия:
- максимальная герметизация технологических процессов,
- снижение действующих концентраций токсичных веществ в воздухе рабочей зоны до ПДК,
- рациональное использование средств индивидуальной защиты.
Не менее важную роль играет правильный профотбор лиц, поступающих на работу в контакте с токсическими гемодепрессорами. Не рекомендуется принимать лиц с манифестирующим или латентным дефицитом железа, различными вариантами геморрагического синдрома, выраженными формами вегетативной дисфункции и др.
ЗАБОЛЕВАНИЯ,
ОБУСЛОВЛЕННЫЕ НАРУШЕНИЕМ СИНТЕЗА ПОРФИРИНОВ И ГЕМА.
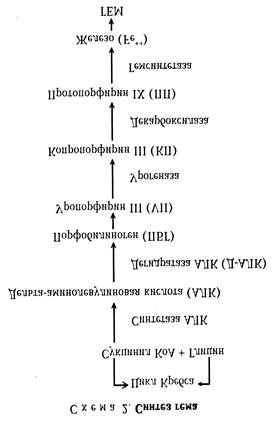
Биосинтез порфиринов является одним из универсальных биологических процессов, так как порфирины в виде комплексов с металлами (металлопорфирины) составляют основу гемоглобина и миоглобина, а также жизненно важных энергетических ферментов (цитохромы В и С, цитохромоксидаза, каталаза, пероксидаза). Порфирины способны нейтрализовать токсичные для клетки эндо- и экзогенных веществ и играют важную роль в сохранении гомеостаза. Название этой группы веществ связано с их свойством - темно-красной окраской в кристаллическом виде (porphyros — пурпурный).
Синтез порфиринов происходит в эритробластах костного мозга, митохондриальном аппарате печени и почек, в клетках центральной нервной системы. Основная часть порфиринов идет на синтез гема, который представляет сложный энзиматический процесс, каждый этап которого регулируется определенным ключевым ферментом.
Участвующие в синтезе гема ферменты можно разделить на три группы. Первая группа связана с синтезом АЛК в янтарно-глициновом цикле. Ключевой фермент - синтетаза АЛК, коферментом этой реакции служит пиридоксальфосфат, производное витамина В6. Вторая группа ферментов осуществляет превращение АЛК в ПБГ. Ключевой фермент — дегидратаза АЛК. Третья группа ферментов связана с заключительным этапом синтеза гема. Ключевые ферменты - декарбоксилаза и гемсинтетаза.
Ряд ферментов, регулирующих процесс биосинтеза гема, содержит
- сульфгидрильные (SH),
- карбоксильные (СООН) и
- аминные (NH2) группы.
Токсичные вещества, особенно тяжелые металлы, могут блокировать эти группировки в ферментах, замещая атомы водорода в них и тем самым нарушая активность ферментов. Наиболее активны в этом плане вещества из группы «тиоловых ядов», которые при попадании в организм вступают во взаимодействие с веществами, содержащими серу, и, в частности, SH-группами. Таким путем многие токсичные вещества независимо от троп-ности их действия способны вызывать изменения в биосинтезе порфиринов.
Нарушения порфиринового обмена установлены при интоксикациях
бензолом,
фосфором,
фтором,
оксидом углерода,
акрилатами,
метгемоглобинообразователями и другими соединениями,
у больных силикозом.
Однако среди всех промышленных ядов, способных вызывать те или иные расстройства синтеза порфиринов и гема, исключительное положение занимает свинец, при действии которого они носят первичный характер и являются определяющим патогенетическим механизмом интоксикации.
Интоксикация свинцом.
Актуальность вопроса. Свинец и его соединения широко используются в промышленности. Главными источниками производства свинца служат добыча его из свинецсодержащих руд и выплавка из концентратов и металлических отходов.
Потенциально опасные производства. Свинец используется
в машино- и приборостроении,
радиоэлектронике (применение свинецсодержащих припоев),
в аккумуляторном,
кабельном,
типографском производстве,
при плавке цветных металлов,
в черной металлургии,
производстве хрусталя,
красок и эмалей для фарфоро-фаянсовой промышленности и др.
Наиболее часто в промышленности используют следующие неорганические соединения свинца:
оксид свинца - свинцовый глет (РЬО),
красный оксид свинца — свинцовый сурик,
хромат свинца - крокоит, или желтый крон,
азид свинца,
свинцовый блеск галенит и др.
Свинцовоопасные профессии. К «свинцовоопасным» профессиям относятся: плавильщики свинца,
- аккумуляторщики (мельники свинцового порошка и намазчики пластин),
- составители шихты в производстве хрусталя,
- аппаратчики в производстве свинцовых пигментов.
Описаны случаи сатурнизма у лиц, занимавшихся
- чеканкой металлических изделий,
- изготовлением свинцовой дроби,
- у декораторов, расписывающих посуду свинецсодержащими красками, и др.
Для большинства производств, где используют свинец, характерно воздействие его в виде аэрозолей - взвеси мельчайших частиц оксида свинца, получаемых вследствие конденсации и окисления паров на воздухе.
Основной путь поступления свинца в организм - ингаляционный. Возможно его поступление и через желудочно-кишечный тракт (с пищей, водой).
Низкое содержание кальция, железа и белка в пищевом рационе увеличивает всасывание свинца в желудочно-кишечном тракте.
Присутствующий в организме свинец может быть условно разделен на обмениваемую (10 %) и стабильную (90 %) фракции.
К обмениваемой относятся свинец крови, 95 % которого связано с эритроцитами, и свинец паренхиматозных органов (печень, почки и др.). Содержание металла в них находится в состоянии динамического равновесия с уровнем свинца в крови. Эта фракция имеет наиболее существенное значение и свидетельствует о текущем либо недавнем контакте со свинцом.
К стабильной фракции относится свинец, находящийся в костях скелета. Эта фракция отражает длительное кумулятивное воздействие.
Выделение свинца из организма происходит с мочой (около 75 °о) и через желудочно-кишечный тракт (около 15 %). На долю других путей выведения свинца (слюна, потовые железы и др.) приходится 6—7 °о. Небольшое количество свинца содержится в грудном молоке.
Патогенез.
Свинец относится к ядам политропного действия. Ведущая роль в патогенезе сатурнизма отводится расстройствам биосинтеза порфиринов и гема, в результате чего снижается активность дегидратазы дельта-аминолевулиновой кислоты (ДАЛК), следствием чего является увеличение содержания ДАЛК в моче.
Угнетение декарбоксилазы копропорфирина и гемсинтетазы, регулирующей соединение двухвалентного железа с протопорфирином, приводит к повышению экскреции копропорфирина с мочой, увеличению содержания свободного протопорфирина в эритроцитах и железа как в сыворотке крови и в эритробластах костного мозга (сидеробласты).
В результате этих нарушений развивается гипохромная гиперсидеремическая си-дероахрестическая сидеробластная анемия. Однако гиперпродукция КП и ПП может иметь другой механизм: за счет их синтеза непосредственно из АЛК. При этом механизме повышение уровня ПП эритроцитов наблюдается без гиперсидеремии.
Свинец нарушает процесс утилизации железа и синтез глобина. Последний относится к важнейшим регуляторам нормального биосинтеза гема.
Наряду с этим установлено непосредственное действие свинца на эритроциты. Свинец вызывает нарушения морфо-функциональных структур эритробластов и зрелых форм, ингибирует активность ряда ферментов энергетического обмена, что приводит к нарушению функциональной полноценности и жизнеспособности эритроцита, следствием чего является сокращение продолжительности их жизни и ускоренная гибель. В ответ на это наблюдается компенсаторная активация эритропоэза, к проявлению которой относится ретикулоцитоз.
Патогенез неврологических симптомов сатурнизма сложен. Дегенеративные изменения нервных клеток обусловлены как непосредственным действием свинца и его вмешательством в процессы регуляции сосудов, двигательной функции, обмен медиаторов, гормонов, витаминов, так и нарушениями порфиринового обмена. Порфирины и их предшественники (АЛК, ПБГ) участвуют в процессах миелинизации, оказывают сосудосуживающее действие, что объясняет сходство и выраженность вегетативных расстройств при сатурнизме и порфириях.
В основе нарушения моторной функции кишечника при свинцовой колике лежат связанные с демиелинизацией дистрофические изменения в интрамуральных ганглиях кишечника и солнечном сплетении. При дистрофии в ауэрбаховском и мейснеровском сплетениях нарушается регулирующее действие вегетативной нервной системы на перистальтику кишечника.
В патогенезе изменений сердечно-сосудистой системы, особенно в период колики, ведущая роль принадлежит расстройствам вегетативной нервной системы с ее выраженной гиперреакцией.
Патологическая анатомия.
Наиболее резкие изменения отмечаются в нервных клетках молекулярного слоя коры головного мозга при отсутствии соответствующей реакции мезодермальных элементов. В нервных клетках передних рогов спинного мозга наблюдается их вакуолизация, растворение хроматофильной субстанции, пигментация, пикноз ядер, сморщивание тела клеток и даже их гибель. Разнообразные изменения в виде сморщивания нервных клеток с потерей их структуры или их вакуолизации отмечаются в периферических узлах симпатической нервной системы. Дистрофические процессы происходят и в периферических нервах. Кроме того, в различных отделах центральной нервной системы, в том числе и в спинном мозге, отмечаются значительные сосудистые расстройства в виде свежих мелких кровоизлияний, стазов, иногда тромбов.
Клиника.
 |
Одним из ведущих синдромов интоксикации свинцом является синдром поражения крови, который характеризуется нарушениями порфиринового обмена и показателей красной крови. Наиболее рано изменяется активность Д-АЛК, снижение которой может наблюдаться при отсутствии других симптомов и нормальном содержании свинца в крови. В связи с этим показатель активности Д-АЛК расценивается как наиболее чувствительный индикатор контакта со свинцом. Увеличение метаболитов порфиринового обмена в биосредах - АЛК и КП в моче и ПА в эритроцитах - относится к ранним, достоверным и специфическим признакам интоксикации свинцом. Установлена прямая зависимость выраженности изменений этих показателей от уровня воздействия свинца и степени тяжести отравления. Появление в крови ретикулоцитоза и увеличенного количества эритроцитов с базофильной зернистостью, как правило, наблюдается при
действии повышенных концентраций свинца. Несмотря на свою неспецифичность, эти изменения красной крови в комплексе с метаболитами порфиринового обмена являются важными лабораторными показателями интоксикации. Анемия при сатурнизме, как следует из механизма ее развития, относится к группе гипохромных гиперсидеремических сидероахрестических сидеробластных анемий, т.е. наиболее характерным признаком ее является гипохромия эритроцитов при повышенном содержании железа сыворотки и наличии в периферической крови сидероцитов, а в костном мозге — сидеробластов. Однако при выраженных интоксикациях анемия может характеризоваться нормохромией эритроцитов и нормальным уровнем сывороточного железа, что может быть объяснено значительным сокращением продолжительности жизни эритроцитов под воздействием высоких концентраций свинца. 06 этом свидетельствует, в частности, выраженный ретикулоцитоз. Наличие анемии является бесспорным признаком выраженной интоксикации.
Изменения нервной системы (нейросатурнизм) могут протекать в виде астенического, астеновегетативного синдрома, а также полиневропатии и энцефалопатии различной степени выраженности.
При начальных проявлениях астенического или астеновегетативного синдрома отмечаются жалобы на общую слабость, повышенную утомляемость, головную боль, головокружение, раздражительность, плохой сон, повышенную потливость. При объективном обследовании выявляются мышечная гипотония, заторможенность дермографизма, гипергидроз, выраженный глазосердечный рефлекс, тенденция к брадикардии, лабильность артериального давления. Указанные жалобы и изменения могут быть различной степени выраженности.
Частой формой нейросатурнизма является периферическая полиневропатия. При ее начальной форме преобладают вегетативные нарушения: боли, парестезии, чувство онемения в конечностях и судороги икроножных мышц, и особенно в состоянии покоя (ночью). Объективно отмечается легкий цианоз или бледность кожных покровов, гипергидроз, гипотермия, болезненность при пальпации по ходу периферических нервов, симметричные дистальные нарушения чувствительности, сначала в виде гиперестезий, а затем гипестезий. Характерно снижение возбудимости обонятельного, вкусового и зрительного анализаторов. Может наблюдаться снижение силы в конечностях. Выраженные формы периферической полиневропатии характеризуются сочетанием вегетативно-сенситивных и двигательных полиневритических расстройств.
Развитие синдрома энцефалополиневропатии в современных условиях наблюдается крайне редко. Учитывая неспецифичность неврологической симптоматики, подтверждение профессионального характера ее требует использования ряда электрофизиологических методов (ЭНМГ, определение скорости распространения импульса по периферическому нерву и др.) и обязательной корреляции со специфическими лабораторными показателями (АЛК и КП мочи, ПП эритроцитов, изменения крови, свинец в биосредах).
Расстройства системы пищеварения при интоксикации свинцом выражаются в нарушении желудочной секреции как в виде повышения, так и ее снижения. За счет ингибирующего действия свинца на кишечные ферменты страдает функция присте-ночного пищеварения. Отмечается также дискинезия тонкой и толстой кишки, наиболее характерным проявлением которой является гипермоторная дискинезия тонкой кишки. Эти нарушения сопровождаются расстройствами всасывательной, моторно-эвакуаторной функций. Перечисленные изменения вызывают неприятный вкус во рту, тошноту, отрыжку, снижение аппетита, ощущение тяжести в эпигастрии, а также непостоянные боли в животе, склонность к запорам.
Наиболее тяжелым расстройством при сатурнизме является кишечная (свинцовая) колика. Клиническая картина колики характеризуется приступообразными резкими болями в животе, стойким запором продолжительностью до 5-7 сут, не поддающимся действию слабительных и клизм; подъемом артериального давления, нередко в сочетании с брадикардией; повышением температуры тела до 37,6-37,8°С, умеренным лейкоцитозом, выделением мочи темно-красного цвета за счет экскреции значительных количеств копропорфирина. Больной возбужден. Живот втянут, напряжен, болезненный во всех отделах. При пальпации боли уменьшаются. Симптомы раздражения брюшины отрицательные. В ряде случаев может наблюдаться синдром поражения мочевыводящих путей с характерной для почечной колики клинической картиной и появлением изменений в моче (микрогематурия, лейкоцитурия и др.). Кожа больного бледна с сероватым оттенком, склеры субиктеричны, возможна свинцовая кайма на деснах.
Свинцовая колика сочетается с выраженными изменениями периферической крови (анемия, ретикулоцитоз, увеличение количества эритроцитов с базофильной зернистостью), порфиринового обмена (повышение содержания АЛК и КП в моче и ПП в эритроцитах). В период колики значительно увеличивается содержание свинца в биосредах.
Следует учитывать и возможность развития атипичных, стертых форм свинцовой колики. Провоцирующими моментами для развития колики могут служить самые различные факторы, наиболее частым из которых является прием алкоголя. Выраженность клинической симптоматики в период колики обусловлена степенью нарушения вегетативных отделов нервной системы, в связи с чем этот синдром может расцениваться как своеобразный «вегетативный криз».
Печень играет важную роль в процессах метаболизма свинца в организме. При тяжелых формах сатурнизма описывались выраженные нарушения функции печени, вплоть до развития токсического гепатита. При современных формах сатурнизма отмечаются нарушения лишь отдельных функциональных проб печени, что обусловлено энзимопатическим действием свинца. Выявлены нарушения ферментов, регулирующих азотистый обмен, синтез порфиринов в митохондриальном аппарате гепатоцита. Могут отмечаться нарушения пигментной функции, сдвиги в белковом спектре. Для поражения печени при интоксикации свинцом характерно наличие дискинезии желчевыводящих путей.
Изменения сердечно-сосудистой системы при воздействии свинца, как правило, обратимы, имеют неспецифический характер и выражаются в неустойчивости артериального давления с тенденцией к гипертензии, повышению тонуса периферических сосудов. Однако имеются наблюдения, когда рецидивирующая колика, сопровождавшаяся гипертензией, приводила в дальнейшем к развитию гипертонической болезни.
При воздействии свинца поражается эндокринная система. Это выражается в нарушении менструальной функции, преждевременных родах и сокращении периода лактации у женщин, а у мужчин — в снижении половой потенции. Нарушается функция щитовидной железы в сторону ее повышения.
Течение интоксикации свинцом характеризуется волнообразностью, обусловленной поступлением в кровь метаболически активного свинца из депо, чему способствуют перенесенные заболевания, употребление алкоголя и др. В зависимости от выраженности клинической картины различают следующие формы свинцовых отравлений.
Начальная форма интоксикации. Клинические симптомы интоксикации отсутствуют. Отмечаются лишь лабораторные изменения: увеличение АЛК мочи до 115 мкмоль/г креатинина (норма - до 19 мкмоль), КП мочи до 450 нмоль на 1 г креатинина (норма - до 120 нмоль), ретикулоцитоз до 25 %о (норма до 12 %о), увеличение количества базофильно-зернистых эритроцитов до 40 %оо (норма до 15 %оо). Содержание гемоглобина и эритроцитов в пределах нормы, уровень свинца в крови не превышает 50 мкг%, или 0,25 мкмоль% (норма до 40 мкг%, или до 0,19 мкмоль%).
Легкая форма интоксикации. Клиническая симптоматика проявляется в виде астенического или астеновегетативного синдрома, начальных форм периферической полиневропатии. Могут наблюдаться изменения желудочно-кишечного тракта - синдром моторной дискинезии. Возможны нарушения отдельных показателей функции печени. Лабораторные изменения выражаются в повышенной экскреции АЛК до 190 мкмоль/г креатинина, КП до 770 нмоль/г креатинина, отмечается ретикулоцитоз до 40 %о, увеличение количества базофильно-зернистых эритроцитов до 60 %оо. Возможно снижение уровня гемоглобина у мужчин до 120 г/л, у женщин до 110 г/л. Содержание свинца в крови не более 80 мкг%, или 0,38 мкмоль%.
Выраженная форма интоксикации характеризуется развитием одного из синдромов или их сочетанием: колики, анемического синдрома, полиневропатии, астеновегетативного синдрома, энцефалопатии, токсического поражения печени. Изменения порфиринового обмена носят выраженный характер: экскреция АЛК превышает 190 мкмоль/г креатинина, КП - 770 нмоль/г креатинина. Ретикулоцитоз более 40%о, количество базофильно-зернистых эритроцитов более 60 %оо. Отмечается анемия гипохромного или нормохромного характера со снижением уровня гемоглобина у мужчин ниже 120 г/л и у женщин ниже 110 г/л. Содержание свинца в крови превышает 80 мкг%, или 0,38 мкмоль%.
При определении формы интоксикации необходимо иметь в виду, что необязательно наличие всех перечисленных синдромов. Иногда поражение одних органов и систем соответствует легкой, а других - выраженной форме интоксикации. В таких случаях диагноз устанавливается в соответствии с наиболее выраженными синдромами пораженных систем. В современных условиях в основном встречаются начальные и легкие формы сатурнизма. При проведении периодического медицинского осмотра среди работающих в контакте со свинцом могут быть выявлены лица с повышенным содержанием АЛК и КП в моче при отсутствии других лабораторных сдвигов. Эти лица нуждаются в более тщательном динамическом наблюдении (повторное проведение исследований через 3—6 мес) и должны быть отнесены к группе лиц повышенного риска.
Прогноз.
Постконтактное течение сатурнизма характеризуется основной тенденцией к восстановлению, сроки которого определяются степенью выраженности интоксикации. Наибольшее число случаев выздоровления приходится на первые 4 года после прекращения контакта. Длительная стабилизация процесса, а порой и отсутствие выздоровления в случаях выраженной интоксикации свинцом объясняется стойкостью изменений нервной системы (синдром полиневропатии), особенно при наличии энцефалопатии, обратное развитие которой не наблюдается. Длительное отсутствие восстановления может быть обусловлено недостаточным лечением и неправильным трудоустройством. Все рабочие, подвергающиеся воздействию свинца, а также перенесшие интоксикацию, подлежат диспансерному наблюдению цехового врача.
Диагностика.
Диагноз интоксикации свинцом основан на данных профмаршрута, санитарно-гигиенической характеристики условий труда, предварительного и периодического медицинских осмотров, а также жалоб и результатов клинического и лабораторного обследований работника. Из показателей порфиринового обмена наиболее специфичными для сатурнизма являются АЛК и КП мочи; в сочетании с показателями периферической крови (ретикулоциты, базофильно-зернистые эритроциты) они приобретают большую информативность.
Дифференциальная диагностика.
Дифференциальная диагностика сатурнизма должна проводиться с рядом общих заболеваний в зависимости от ведущего синдрома интоксикации.
При анемическом синдроме свинцовую интоксикацию следует дифференцировать прежде всего от железодефицитных анемий, злокачественных новообразований желудка и кишечника, протекающих со сходной клинико-лабораторной симптоматикой (бледность кожных покровов, болевой синдром, гипохромная анемия, ретикулоцитоз, увеличение количества базофильно-зернистых эритроцитов). Однако нормальный уровень АЛК, КП и свинца в моче, низкое содержание железа в сыворотке, трофические расстройства, обусловленные гипосидеремией, позволяют отвергнуть диагноз сатурнизма.
Интоксикацию свинцом необходимо дифференцировать от талассемии, для гетерозиготной формы которой характерны гипохромная анемия, ретикулоцитоз, увеличение числа базофильно-зернистых эритроцитов, гипербилирубинемия. Нормальное содержание АЛК, КП и свинца в моче у больных талассемией, мишеневидность эритроцитов, семейный характер заболевания, увеличение селезенки, никогда не наблюдаемое при сатурнизме, позволяют дифференцировать эти два заболевания.
Учитывая, что интоксикация свинцом характеризуется выраженным нарушением порфиринового обмена, дифференциальная диагностика сатурнизма должна проводиться с группой порфирий и в первую очередь с острой перемежающейся порфирией (ОПП). Давно замечено сходство последней с клинической картиной свинцовой интоксикации (полиневропатия, выраженные вегетативные нарушения, абдоминальный синдром, выделение красной мочи). Дифференциальная диагностика основывается на определении в моче порфиринов и их предшественников: при ОПП всегда наблюдается значительное увеличение экскреции порфобилиногена (ПБГ) и уропорфирина (УП) при умеренном увеличении уровня АЛК в моче и нормальном ПП эритроцитов. Для сатурнизма характерно значительное увеличение АЛК и КП в моче, ПП эритроцитов при нормальной экскреции ПБГ и УП.
Одним из синдромов сатурнизма, требующим дифференциальной диагностики, является колика. К важным дифференциально-диагностическим признакам колики относятся некоторые клинические особенности этого синдрома: характер поведения больного (беспокойство, возбуждение), частая смена положения в постели, уменьшение болей в животе при его пальпации, красный цвет мочи при отсутствии гематурии (гиперкопропорфиринурия), а также выраженные изменения крови (анемия, ретикулоцитоз, увеличение числа базофильно-зернистых эритроцитов), порфиринового обмена и значительное увеличение содержания свинца в биосредах. Таким образом, одним из основных дифференциально-диагностических критериев сатурнизма служат показатели порфиринового обмена, в первую очередь АЛК и КП мочи.
Определенные трудности могут возникать при решении вопроса о характере изменений нервной системы, прежде всего периферической полиневропатии, особенно в отдаленном постконтактном периоде, когда наступает полное восстановление других клинических и лабораторных признаков отравления. В таких случаях для дифференциальной диагностики свинцовой полиневропатип от полиневропатии иного генеза рекомендуется однократное (диагностическое) введение комплексона (тетацина-кальция) с определением содержания свинца в моче до и после его введения. Значительное повышение экскреции свинца после введения комплексона позволяет связать полиневропатию с перенесенной свинцовой интоксикацией.
В дифференциальной диагностике свинцовой энцефалопатии основную роль играют 1) профмаршрут, 2) условия труда, 3) данные динамического наблюдения за все годы работы в контакте со свинцом. Токсическая (свинцовая) энцефалопатия, как правило, развивается на фоне выраженного сатурнизма.
Лечение.
В терапии сатурнизма, направленной на выведение из организма свинца, широко используют комплексоны. Комплексоны — циклические соединения, имеющие в структуре различные функциональные группы, которые образуют клешневидные, или хелатные связи с ионом свинца. В результате этой реакции образуются комплексы, практически не диссоциирующие, хорошо растворимые, малотоксичные и быстро выводящиеся из организма почками. Наиболее часто для лечения сатурнизма используют производные полиаминокарбоновых кислот - тетацин-кальций и пентацин, обладающие высокой выделительной активностью в отношении свинца. Однократное введение терапевтической дозы комплексона приводит к увеличению выведения металла с мочой в 50—100 раз и более. Оптимальная разовая доза тетацина-кальция и пентацина 2 г при внутривенном способе введения. Оба препарата используются для лечения легких и главным образом выраженных форм интоксикации свинцом. Достоинством этих препаратов является способность в течение суток купировать свинцовую колику. Схема лечения: 20 мл 10 % раствора тетацин-кальция или 40 мл 5 °о раствора пентацина вводят ежедневно внутривенно струйно медленно в течение 3 дней с последующим интервалом в 3—5 дней. Курс лечения состоит из 2 или 3 циклов, т.е. 6 или 9 вливаний комплексона. При свинцовой колике возможно введение комплексона 2 раза в день.
В последние годы довольно широко используется D-пеницилламин (купренил), обладающий выделительной способностью в отношении свинца. Большое достоинство D-пенициллами-на (D-ПАМ) в пероральном его применении и хорошей переносимости. Препарат выпускается в капсулах по 150 мг. Принимают его после еды. Суточная доза от 450 до 900 мг, длительность приема в зависимости от выраженности интоксикации. Побочное действие D-ПАМ выражается в аллергических реакциях, диспепсических явлениях. Применение антигистаминных препаратов, уменьшение дозы или отмена его приводит к быстрой регрессии этих реакций. При длительном применении D-ПАМ возможны тромбоцитопения, агранулоцитоз, анемия, расстройства желудочно-кишечного тракта. Противопоказанием к приему D-ПАМ являются повышенная чувствительность к пенициллину, заболевания почек с нарушением выделительной функции. Выбор препаратов, их дозы и длительность применения зависят от выраженности интоксикации.
Лечение начальной формы сатурнизма проводится D-ПАМ в дозе 450—600 мг в день в течение 10—14 дней. Такая продолжительность приема вполне достаточна для регрессии лабораторных сдвигов. В случае отсутствия эффекта необходимо продолжать терапию. Лечение может проводиться как в стационаре, так и в условиях поликлиники или санатория-профилактория.
Лечение легкой формы интоксикации проводится или одним D-ПАМ с суточной дозой 600—900 мг, длительностью 3—4 нед или (при особо неблагоприятных условиях труда) комбинацией двух препаратов: 2 цикла (6 вливаний) тетацин-кальция (пентацина) с последующим присоединением D-ПАМ в дозе 450-600 мг в день до полной регрессии клинических и лабораторных изменений. Лечение в условиях стационара.
При выраженных формах используют препараты для внутривенного введения: 3 цикла (9 вливаний) тетацин-кальция (пентацина) с возможным, в случае отсутствия полной нормализации признаков интоксикации, последующим присоединением D-ПАМ в дозе 600—900 мг в день под контролем крови и показателей порфиринового обмена.
Во время приступа свинцовой колики, помимо назначения тетацин-кальция, рекомендуются теплые ванны, грелки на область живота, подкожные инъекции атропина, платифиллина, но-шпы, внутривенное введение сернокислой магнезии (5 мл 25 % раствора), новокаина (10 мл 0,5 % раствора). Лечение в условиях стационара.
Этиологический принцип лечения сатурнизма, направленный на связывание и выведение свинца из организма, должен быть использован и в питании больных. Рекомендуется пища с высоким содержанием белка, кальция, серы, что препятствует повышенному всасыванию свинца в желудочно-кишечном тракте и способствует более быстрому его выведению. В пищевой рацион работающих в контакте со свинцом необходимо включать сырые овощи в виде салатов, а также фрукты, соки, так как эти продукты содержат пектины, являющиеся естественными комплексообразователями и способствующие более быстрому выведению свинца из организма. Рекомендуется применение минеральных вод, содержащих серу. Используют витамины, особенно витамин В1, ввиду его роли как кофермента в синтезе порфиринов и B12. В ряде случаев, когда применение комплексонов приводит к повышенному выведению железа с развитием железодефицитной анемии, показано назначение препаратов железа.
Принципы лечения неврологических расстройств, токсических поражений печени, желудочно-кишечного тракта, эндокринной системы при сатурнизме не отличаются от таковых в общей клинике. Критерием эффективности лечения служит улучшение состояния больного, нормализация показателей крови и особенно порфиринового обмена, так как именно изменения в биосинтезе порфиринов является более стойкими, а следовательно, наиболее информативным показателем терапевтического эффекта.
Больным с интоксикацией свинцом рекомендуется курортное лечение сероводородными ваннами в Пятигорске, Мацесте, Серноводске и др.
Экспертиза трудоспособности.
Экспертные вопросы при сатурнизме решаются в зависимости от форм отравления, возраста, стажа, квалификации больного, санитарно-гигиенических условий труда. При этом следует иметь в виду волнообразность течения сатурнизма.
При начальной форме интоксикации после лечения рекомендуется временный перевод на работу вне контакта со свинцом сроком на 1-2 мес с использованием трудового больничного листа, в последующем - возвращение на прежнюю работу. Лица с начальной формой интоксикации требуют особого внимания, поскольку своевременное проведение лечебно-оздоровительных мероприятий позволяет предупредить прогрессирование сатурнизма и сохранить трудоспособность рабочего.
Больные с интоксикацией свинцом легкой степени после стационарного лечения временно переводятся на легкую работу сроком до 2 мес с выдачей трудового больничного листа. В дальнейшем они могут быть возвращены на прежнюю работу при условии полной нормализации всех показателей и прежде всего порфиринового обмена. При остающихся признаках периферической полиневропатии или в случае рецидивов интоксикации необходимо прекращение контакта со свинцом. Рекомендуется рациональное трудоустройство и переквалификация, особенно это касается лиц молодого возраста. В ряде случаев больные направляются на МСЭК.
При выраженных формах интоксикации, даже при полном обратном развитии проявлений сатурнизма после проведенного стационарного лечения, необходимо прекращение контакта со свинцом навсегда. Больных направляют на МСЭК для определения группы инвалидности и/или процента утраты трудоспособности по профессиональному заболеванию.
Профилактика.
Важными профилактическими мероприятиями являются
- замена свинца и его соединений другими, менее токсичными веществами,
-максимальная механизация операций по обработке свинецсодержащих материалов,
- герметизация источников пылевыделения свинца,
- рациональная вентиляция,
- механическая очистка помещений от пыли.
Из мер личной гигиены большое значение имеет использование респираторов, спецодежды, мытье рук слабым раствором уксусной кислоты.
Лечебно-профилактическим мероприятием является витаминизация рабочих с ежедневным приемом витамина С в течение месяца не менее 2 раз в год, применение пектиносодержащих органических веществ (яблочный, сливовый и другие соки с мякотью).
Существенную роль в профилактике имеют предварительные и периодические медицинские осмотры.
ИЗМЕНЕНИЯ ПИГМЕНТА КРОВИ МетгемоглобинемияК числу токсичных веществ, вызывающих образование в крови патологического пигмента метгемоглобина, относятся ароматические амидо- и нитросоединения бензольного ряда, некоторые лекарственные средства, в молекулу которых входят эти группы, а также окислители: бертолетовая соль, красная кровяная соль и др.
Наиболее часто в промышленности встречаются
- анилин, или амидобензол, ПДК 0,1 мг/м куб.,
- нитроанилин, ПДК 0,1 мг/м куб.,
- нитробензол, ПДК Змг/м куб.,
- динитробензол, ПДК 0,1 мг/м куб.,
- нитротолуол, динитротолуол, тринитротолуол (ТНТ), ПДК 1 мг/м куб.,
а также их хлорпроизводные продукты и различные изомеры.
Потенциально опасные производства. Перечисленные соединения используют в производстве синтетических красителей, пластмасс, фармацевтической, текстильной, пищевой промышленности, при производстве взрывчатых веществ и др.
Пути поступления в организм. Ароматические амидо- и нитросоединения поступают в организм через органы дыхания и кожу. Последний путь играет ведущую роль при высокой температуре воздуха в производственных помещениях, что способствует увеличению всасывания яда через неповрежденную кожу. Попав в организм, эти соединения обнаруживаются в головном мозге, почках, сердечной мышце, печени. Они могут создавать временное депо в подкожножировой клетчатке и печени, что обусловливает возможность возникновения рецидивов интоксикации.
Патогенез.
Токсическое действие ароматических амидо-и нитросоединений сводится к нарушению пигментообразования и появлению в крови патологического пигмента метгемоглобина (MtHb). Образование метгемоглобина является активным химическим процессом окисления двухвалентного железа гемоглобина в трехвалентное. При интоксикациях амидо- и нитросоединениями бензольного ряда окисление гемоглобина в MtHb происходит под влиянием промежуточных продуктов их метаболизма в организме (хинонимина, фенилгидроксиламина). В физиологических условиях в крови человека постоянно происходит образование метгемоглобина (0,1—2,5 %) и восстановление его до гемоглобина с помощью активных ферментных систем эритроцита, участвующих в процессе гликолиза (глюкозо-6-фосфат-дегидрогеназа — Г-6-ФД, глютатионредуктаза — ГР). Вопрос о физиологической метгемоглобинемии рассматривается в настоящее время с позиций защитной функции метгемоглобина, так как этот пигмент участвует в обезвреживании многих токсичных веществ путем связывания их в комплексные соединения. Не менее важна роль MtHb в физиологических условиях как разрушителя избыточных количеств перекиси водорода, образующихся в процессе внутриэритроцитарного энергетического обмена.
В норме процессы образования и восстановления метгемоглобина строго сбалансированы. Однако равновесие системы HbO^^MtHb может быть сдвинуто влево и вправо. Сдвиг влево наблюдается крайне редко, сдвиг вправо встречается довольно часто и может быть обусловлен рядом причин: усилением образования и поступления в кровь эндогенных метгемогло-бинообразователей; ослаблением защитных, восстанавливающих метгемоглобин систем; поступлением метгемоглобинообра-зователей извне, что наблюдается в производственных условиях при контакте с ароматическими амидо- и нитросоединениями.
В отличие от гемоглобина, метгемоглобин не способен присоединять кислород, вследствие чего при интоксикации метгемо-глобинообразователями наблюдается резкое снижение кислородной емкости крови. Метгемоглобин не только снижает транспорт кислорода к тканям, но и увеличивает сродство кислорода с оксигемоглобину, уменьшает его диссоциацию при переходе из легких к капиллярам, нарушая дыхательную функцию крови. Восстановление метгемоглобина при однократном остром воздействии происходит достаточно быстро (3—7 дней). Однако при длительном воздействии метгемоглобинообразова-телей к концу рабочего дня или в середине рабочей недели может определяться в крови «остаточный метгемоглобин», не успевший диссоциировать.
Амидо- и нитросоединения бензольного ряда способны к образованию не только метгемоглобина, но и еще одного патологического деривата гемоглобина — сульфгемоглобина (SFHb). Последний почти постоянно определяется при остром отравлении этими соединениями и появление его свидетельствует о значимой интенсивности воздействия. Сульфгемоглобинемия, как правило, наблюдается на фоне метгемоглобинемии, так как концентрации ароматических амино- и нитросоединений, необходимые для образования SFHb, выше, чем те, при воздействии которых образуется MtHb.
Специфическим признаком воздействия метгемоглобинооб-разователей являются дегенеративно измененные эритроциты с наличием в них патологических включений — телец Гейнца, выявляемых при витальной окраске 1 °о раствором метиленово-го фиолетового. Тельца Гейнца — продукт денатурации и преципитации гемоглобина, появление которых связано с действием токсичных веществ на сульфгидрильные группы и другие ти-оловые системы цитоплазмы эритроцита. Следствием дегенеративных изменений в эритроцитах (нарушение проницаемости, пластичности их) с образованием в них телец Гейнца может быть развитие гемолиза, который рассматривается как вторичный в патогенезе поражения системы крови метгемоглобинооб-разователями. Количество телец Гейнца зависит от интенсивности воздействия и тяжести развившейся интоксикации.
По степени гемотоксического эффекта ароматические амидо-и нитросоединения делятся на высокоагрессивные (анилин, мета- и парахлоранилины, изомерные пара- и метанитрохлор-бензолы, аминотолуолы); умеренно агрессивные (нитробензол, ортонитрохлорбензол, динитротолуол, тринитротолуол и др.) и слабые (пара- и метанитротолуолы, ортохлорпаранитроанили-ны и др.).
Патологическая анатомия.
При выраженных острых отравлениях метгемоглобинообразователями обнаруживается резкое венозное полнокровие внутренних органов, мозга, отек последнего. Обращает на себя внимание своеобразный шоколадно-бурый оттенок крови, ее медленная свертываемость. Многочисленные мелкие кровоизлияния в серозные и слизистые оболочки желудка, кишечника, легких, возможен резкий отек легких.
При гистологическом исследовании обнаруживаются дистрофические изменения в печени, почках. В просвете извитых ка-нальцев почек метгемоглобиновые цилиндры. В селезенке и лимфатических узлах отложение гемосидерина вследствие гемо-лиза эритроцитов.
Клиника острой интоксикации.
Различают три степени отравления: легкое, средней тяжести и тяжелое. Степень тяжести определяется уровнем накопления MtHb и развившейся вследствие этого гипоксемией. Метгемоглобине-мия развивается исподволь.
Легкая степень интоксикации характеризуется общей слабостью, головной болью, головокружением, а затем синюшностью слизистых оболочек, пальцев, ушных раковин, в редких случаях плохой ориентацией в окружающей обстановке. Появление цианоза наблюдается при содержании MtHb 15 °о. Спустя несколько часов после отравления вышеперечисленные жалобы исчезают, метгемоглобинемия снижается, восстанавливается трудоспособность.
При средней степени интоксикации возникает более резкий цианоз видимых слизистых и кожных покровов, отмечается четкая неврологическая симптоматика (головная боль, головокружение, нарушение ориентации, заплетающаяся речь, неуверенность походки, повышение сухожильных рефлексов, вялая реакция зрачков на свет). В крови увеличивается содержание метгемоглобина до 30—50 %, появляется большое количество телец Гейнца, отмечается некоторое замедление СОЭ. Клинико-лабораторные симптомы отравления, как правило, наблюдаются в течение 5—7 сут, хотя обратное развитие основных признаков болезни начинается уже спустя 24—48 ч.
При тяжелых отравлениях резко выражена синюшность кожных покровов и слизистых оболочек, которая иногда приобретает сине-черный оттенок и обусловлена не только значительной мет- и сульфгемоглобинемией, но и резким венозным застоем. Тяжесть состояния определяется нарастающей неврологической симптоматикой, обусловленной наркотическим действием метгемоглобинообразователей.
В крови резкая метгемоглобинемия более 50 %, большое количество телец Гейнца (более 50 °оо), увеличение сульфгемоглобина. На 5—7-е сутки возможно развитие гемолитической анемии. Изменения крови характеризуются выраженным усилием эритропоэза, что подтверждается значительным ретикулоцитозом, появлением макроцитоза и нормобластоза. Стимуляция регенерации эритроидного ряда обусловлена гипоксемией, и, кроме того, наличием продуктов распада дегенеративно измененных эритроцитов, которые являются значительными раздражителями эритропоэза.
В случае развития внутрисосудистого гемолиза наблюдается гемоглобинурия, которая обусловливает развитие почечного синдрома. Отмечается гипербилирубинемия за счет непрямой фракции билирубина, нарушение активности некоторых органо-специфических ферментов печени в сыворотке крови. В случае массивного воздействия метгемоглобинообразователей могут наблюдаться рецидивы интоксикации, что связано с выходом в кровь депонированного в жировой ткани и печени яда. Повторное развитие метгемоглобинообразования, проявляющееся усилением клинико-лабораторных симптомов интоксикации, прогностически неблагоприятный симптом. Развитие его провоцируется приемом алкоголя, тепловыми процедурами (горячий душ, ванны).
Длительность основных симптомов такой формы интоксикации обычно составляет 12—14 дней.
Клиника хронического отравления.
При хронической интоксикации метгемоглобинообразователями изменения крови проявляются легко выраженной анемией или только тенденцией к снижению количества гемоглобина и эритроцитов. Анемия носит регенераторный характер и, как правило, сопровождается компенсаторным ретикулоцитозом. Иногда появляются эритроциты с базофильной зернистостью. В крови могут обнаруживаться единичные тельца Гейнца и небольшая метгемоглобинемия (в пределах 5—7 °о), быстро исчезающая после оставления производства. При длительном воздействии указанных веществ возможна лейкопения.
Помимо изменений крови, в клинической картине хронической интоксикации отмечается ряд характерных синдромов: токсическое поражение печени, нервной системы (вегетососудистая дистония, астеновегетативный синдром), органов зрения, мочевыводящих путей. При этом выраженность того или иного синдрома и особенности клинического течения интоксикации зависят от химической структуры действующего яда и от характера группы, входящей в состав бензольного ядра. Так, для ТНТ характерно развитие профессиональной катаракты, изменений крови и токсического гепатита. Поражение мочевыводящих путей наблюдается только при действии амидосоединений, главным образом двуядерных.
Диагностика острых отравлений метгемоглобинообразователями
базируется в первую очередь на данных профмаршрута, подтверждающих контакт с высокими концентрациями ароматических амидо- и нитросоединений и на характерной клинико-лабораторной симптоматике. Наиболее существенным подтверждением диагноза является определение в крови метгемоглобина спектрофотометрическим способом и телец Гейнца в эритроцитах. Рекомендуется также определение сульфгемоглобина, общего гемоглобина и оксигемоглобина.
Диагноз хронической интоксикации амидо- и нитросоединениями
бензольного ряда может быть установлен при наличии комплекса выявленных нарушений (в крови, печени, нервной системе). Такая сочетанная патология подтверждает профессиональный характер поражения. При этом необходим длительный контакт с указанными соединениями. Надо иметь в виду, что в диагностике хронической интоксикации изменения крови занимают весьма скромное место, так как анемия либо отсутствует, либо выражена незначительно. Отличительной ее особенностью является быстрая нормализация после устранения токсического воздействия.
Обнаружение в крови телец Гейнца, а также небольшого увеличения MtHb и SFHb может иметь диагностическое значение в тех случаях, если эти исследования проводились непосредственно на производстве или вскоре после отстранения от работы.
Лечение.
При острых интоксикациях пострадавшего следует вывести из загазованной атмосферы. При попадании яда на кожу необходимо обильное промывание загрязненных участков водой и слабо-розовым раствором перманганата калия. К патогенетическим методам лечения относится оксигенотерапия (до уменьшения цианоза), при наличии гипокапнии — кратковременное вдыхание карбогена (95 % кислорода + 5 % 002). Для ускорения восстановления метгемоглобина в гемоглобин показано введение 1 % раствора метиленового синего (1—2 мл на 1кг массы тела в 5 °о растворе глюкозы), так как он обладает высоким окислительно-восстановительным потенциалом, усиленно окисляя молочную кислоту. Рационально использовать препарат хромосмон (1 % раствор метиленового синего на 25 % растворе глюкозы). К веществам, активизирующим процессы деметгемоглобинизации, относятся также 40 % раствор глюкозы (30—50 мл), 30 % раствор гипосульфита натрия, 5 % раствор аскорбиновой кислоты (до 60 мл). Рекомендуется введение витамина В12 (600 мкг внутримышечно). Наиболее выраженный клинический эффект при отравлении метге-моглобинообразователями наблюдается при применении гипербарической оксигенации (ГБО).
Среди терапевтических средств могут применяться по показаниям форсированный диурез, кардиальные средства. Противопоказано использование сульфаниламидных препаратов в связи с их способностью к образованию MtHb.
При хронических интоксикациях метгемоглобинообразователями объем и характер терапевтических мероприятий зависят от ведущего клинического синдрома. В связи с тем что наблюдаемые сдвиги в составе красной крови, как правило, исчезают после прекращения воздействия, проведения противоанемической терапии не требуется.
Экспертиза трудоспособности.
Вопросы трудоспособности при острых интоксикациях метгемоглобинообра-зователями должны решаться с учетом тяжести перенесенной интоксикации. При легких формах довольно быстро наблюдается полное восстановление трудоспособности и рабочие могут возвратиться к прежней работе. В случае развития тяжелых форм интоксикации после лечения рекомендуется временный перевод на работу вне контакта с токсичными веществами и оформление трудового больничного листа. При наличии стойких остаточных явлений и осложнений со стороны различных органов и систем (печени, системы крови, нервной системы) обязательно прекращение работы в контакте с метгемоглобинообразователями, в связи с чем рекомендуется направление в МСЭК для получения группы инвалидности на период переквалификации. Решение экспертных вопросов при хронических воздействиях базируется на тех же принципах — в зависимости от выраженности клинической симптоматики.
Карбоксигемоглобинемия.
К группе кровяных ядов, образующих патологические пигменты, относится оксид углерода СО. Оксид углерода — бесцветный газ без запаха и вкуса, является самым токсичным компонентом продуктов неполного сгорания углеродсодержащих веществ. СО входит в состав многих газовых смесей (светильный, водяной, доменный, генераторный, коксовый газ и др.).
При несоблюдении санитарно-гигиенических требований и нарушении технологических условий высокие концентрации СО могут наблюдаться в доменном и мартеновском производствах, в литейных, газогенераторных цехах, при испытании моторов, в автогаражах, кабинах тепловозов и самолетов, на предприятиях химической промышленности при синтезе ряда веществ. В повышенных концентрациях СО может находиться при взрывных работах в шахтах, может выделяться в составе летучих продуктов частичной деструкции полимеров во время получения из них различных материалов при высокой температуре. СО выделяется в больших количествах при возникновении пожаров. ПДК 20 мг/м куб.
Оксид углерода поступает в организм через дыхательные пути, выделяется с выдыхаемым воздухом.
Патогенез. Проникая в кровь, СО абсорбируется эритроцитами, вступает во взаимодействие с железом гемоглобина, образуя стойкое соединение карбоксигемоглобин (НЬСО). Известно, что каждый грамм гемоглобина способен связывать 1,34 мл кислорода или СО. Однако сродство СО к гемоглобину в 360 раз больше, чем кислорода, поэтому даже небольшие концентрации СО вытесняют кислород из связи с гемоглобином. Процесс присоединения СО к НЬ в присутствии оксигемоглоби-на можно представить как одновременно протекающие и взаимно сопряженные реакции: Hb02 + СО=НЬСО + 02. Образование карбоксигемоглобина приводит к торможению оксигенации гемоглобина, нарушению его транспортной функции и развитию гемической гипоксии. В присутствии карбоксигемоглобина диссоциация оксигемоглобина замедляется, в связи с чем развивается кислородная недостаточность. Кроме того, СО соединяется с тканевыми системами, содержащими железо (миоглобин, цитохромоксидаза, цитохром С, цитохром Р 450, каталаза, перок-сидаза), вызывая тем самым гистотоксическую гипоксию. Степень выраженности гипоксемии находится в прямой зависимости от количества образованного карбоксигемоглобина. В патогенетических механизмах хронической интоксикации оксидом углерода важную роль играет увеличение негемоглобинового железа плазмы, которое обладает более высоким сродством к оксиду углерода, чем железо гемоглобина, и, связывая СО, является защитным буфером, предупреждающим образование НЬСО. Нарушения порфиринового обмена, наблюдающиеся при СО-интоксикации, свидетельствуют о возможно непосредственном действии СО на ферментные системы, участвующие в биосинтезе порфиринов.
Патологическая анатомия.
В центральной нервной системе отмечаются диффузные тяжелые изменения нервных клеток, сосудов с последующим развитием некротических изменений и пролифераций глиозных элементов. Одновременно обнаруживаются значительные сосудистые расстройства в глубоких слоях коры и ствола головного мозга в виде резкого полнокровия, стазов, периваскулярного и перицеллюлярного отека, появления в капиллярах резко расширенных и спазматически сократившихся участков с образованием в стенках сосудов складок и инвагинаций. В мелких сосудах отмечается коагуляция белков плазмы с образованием гиалиновых тромбов. В подкорковой области и стволе — мелкие кровоизлияния. При поздней смерти в коматозном состоянии — дистрофические изменения в нервных клетках коры, подкорковой области и ствола выражены еще сильнее и характеризуются распространенным острым набуханием и вакуолизацией протоплазмы с полным или частичным растворением нисслевского вещества, распадом и растворением ядерной субстанции и гибелью клеток. Кровоизлияния встречаются во всех отделах мозга, они более многочисленны в подкорковых узлах и в продолговатом мозге.
В мышцах наблюдаются кровоизлияния, дистрофические и некротические изменения в виде светло-красных, светло-желтых, серозоотечных, студневидных набухших участков.
Все периферические сосуды резко полнокровны. Во многих органах имеются мелкие и крупные кровоизлияния. В желудке — кровоизлияния и геморрагические эрозии. В сердце, печени, почках отмечаются дистрофические изменения. Сердце с расширенными полостями, в волокнах миокарда некробиотичес-кие и некротические изменения; в миокарде находят круглоклеточные и гистиоцитарные инфильтраты и отек его. В костном мозге более или менее значительный миелопоэз и снижение эри-тропоэза. Селезенка увеличена, полнокровна.
Клиника острой интоксикации СО
характеризуется полиморфизмом. Основным критерием, определяющим степень интоксикации, является сохранность сознания на месте проис-
шествия. Выделяют три степени интоксикации: легкую, средней тяжести и тяжелую. Легкая степень отравления протекает без потери сознания и характеризуется головной болью в височной и лобной областях, часто опоясывающего характера (симптом «обруча»), «пульсацией в висках», шумом в ушах, головокружением, тошнотой, иногда рвотой, общей слабостью, сонливостью. Отмечается учащение пульса и дыхания. Содержание НЬСО в крови составляет 10—30 %.
Интоксикация средней тяжести протекает с кратковременной потерей сознания. Отмечаются сильная головная боль, головокружение, тошнота, рвота, мышечная слабость. Возможны судороги. Присоединяются психические нарушения: возбуждение или оглушенность, нарушение памяти с дезориентацией в месте и времени, галлюцинации, мания преследования и др. Выраженная одышка, тахикардия, гипертензия. Содержание НЬСО в крови достигает 30—60 %.
Тяжелая степень интоксикации характеризуется длительной потерей сознания, клоническими и тоническими судорогами, непроизвольным мочеиспусканием и дефекацией, выраженной одышкой, тахикардией. Возможна резкая гипертермия, свидетельствующая о развитии токсического отека мозга. Уровень НbСО в крови достигает 60—80 %.
Помимо описанных форм, выделяют апоплексическую (молниеносную) форму, возникающую при воздействии крайне высоких концентраций СО (авария, катастрофа, пожар). Пострадавший моментально теряет сознание: падает, возможны единичные судороги, быстро наступает остановка дыхания.
При острой интоксикации СО и в отдаленном ее периоде возможны поражения различных органов и систем. Больше всего страдает нервная система, чувствительность которой к токсическому действию СО объясняется исключительной требовательностью к регулярному снабжению кислородом. При тяжелой интоксикации после выхода из комы появляется двигательное беспокойство с последующей вялостью, заторможенностью, сонливостью. Может развиться ретроградная амнезия, психические расстройства («СО-психозы»), которые протекают с различными фобиями, галлюцинациями, маниакальным состоянием. Описаны синдром паркинсонизма, а также психические нарушения в форме корсаковского симптомокомплекса. Считают, что изменения центральной нервной системы при остром отравлении СО следует рассматривать как острую токсическую энцефалопатию.
При острой интоксикации СО изменения сердечно-сосудистой системы носят различный характер. Наряду с функциональными расстройствами в виде тахикардии, экстрасистолии, изменения предсердно-желудочковой проводимости наблюдается гипертонический синдром с выраженной тахикардией. В некоторых случаях развивается картина экзотоксического шока.
При вдыхании высоких концентраций СО может наступить внезапная смерть вследствие остановки дыхания и первичного токсикогенного коллапса. В тяжелых случаях на ЭКГ отмечаются нарушения коронарного кровообращения, напоминающие инфаркт миокарда. Эти изменения носят транзиторный характер и исчезают через 2—3 нед. Считают, что отравление СО является фактором риска для больных ишемической болезнью сердца.
Поражение органов дыхания наблюдается в основном у пострадавших на пожаре и выражается в нарушении проходимости верхних дыхательных путей в результате бронхореи и гиперсаливации. Отмечается отечность слизистых оболочек носоглотки, острый риноларингит, трахеобронхит вследствие сочетанного воздействия дыма, высокой температуры вдыхаемого воздуха, ожога верхних дыхательных путей. Возможен отек легких от воздействия высокотоксичных продуктов, выделяющихся при горении полимерных соединений.
Изменения крови характеризуются увеличением количества эритроцитов и содержания гемоглобина, что приводит к повышению вязкости крови и замедлению СОЭ. Изменения белой крови проявляются кратковременным нейтрофильным лейкоцитозом с палочкоядерным сдвигом, появляющимся в первые сутки интоксикации с последующей нормализацией.
Одним из тяжелейших осложнений острой интоксикации СО является миоренальный синдром. Длительное бессознательное состояние, сопровождающееся позиционным давлением собственного тела на кожу и мышцы, приводит к нарушению микроциркуляции на отдельных участках, что вызывает трофические нарушения в виде эритемы, отека, образования пузырей, трофических язв на коже конечностей, спины, ягодиц. Этому способствует и тканевая гипоксия. В результате ишемии и некроза мышц наступает острая почечная недостаточность. Миоренальный синдром значительно ухудшает течение интоксикации и ее прогноз.
Хроническая интоксикация СО.
Вопрос о хронической интоксикации оксидом углерода остается дискутабельным. Однако в последние годы большинство авторов склоняется в пользу возможного развития и этой формы отравления. Считают, что хроническая интоксикация оксидом углерода может развиваться как исподволь, так и в результате сочетания повторных острых легких отравлений с длительным действием малых концентраций СО.
Для ранней стадии хронического воздействия СО наиболее характерны функциональные расстройства центральной нервной системы, проявляющиеся вегетативной дисфункцией и ангиодистоническим синдромом с наклонностью к ангиоспазмам. При этом доминируют церебральные сосудистые расстройства, сочетающиеся с кардиальными, а нередко и с артериальной гипертензией. При воздействии повышенных концентраций СО на этом фоне развивается выраженное астеническое состояние, возможны диэнцефальные кризы, органическое диффузное поражение мозга — токсическая энцефалопатия. Длительное воздействие СО в концентрациях, несколько превышающих ПДК, может привести к умеренно выраженному поражению сердечной мышцы в виде ее дистрофии, нередко с признаками нарушения коронарного кровообращения. Изменения крови проявляются эритроцитозом или наклонностью к нему, увеличением содержания гемоглобина. Наиболее характерным и постоянным признаком хронического воздействия СО даже малой интенсивности является увеличение негемоглобинового железа плазмы, что служит важным компенсаторным фактором, поддерживающим гомеостаз организма на начальном этапе интоксикации. При этом наблюдаются определенные сдвиги в порфириновом обмене: повышено содержание копропорфирина в эритроцитах, увеличена экскреция с мочой дельта-аминолевулиновой кислоты и копропорфирина.
Диагностика.
Диагноз острой интоксикации оксидом углерода ставят на основании клинических симптомов и данных санитарно-гигиенической характеристики условий труда. Особое значение придают характеру головной боли (симптом «обруча»), сочетанию изменений нервной, сердечно-сосудистой системы и органов дыхания, а также трофическим изменениям кожи. Абсолютным признаком острого отравления СО является наличие в крови повышенного содержания НЬСО. Однако следует иметь в виду, что диагностическая значимость этого показателя, как и окраски кожных покровов, велика лишь при определении их на месте отравления. В противном случае диссоциация карбоксигемоглобина, особенно при рано начатой оксигенотерапии, приводит к несоответствию между содержанием его в крови и клинической симптоматикой.
Диагноз хронической интоксикации оксида углерода вызывает затруднения в связи с полиморфизмом клинической симптоматики и неспецифическим ее характером. Он может быть поставлен только на основании детального ознакомления с условиями труда заболевшего, с учетом длительного стажа работы и совокупности обнаруженных клинических синдромов. При этом необходим строгий дифференцированный подход в каждом конкретном случае в целях исключения непрофессиональных причин, которые вызывают аналогичные нарушения в той или иной системе. Если при острой интоксикации образование карбоксигемоглобина является надежным признаком отравления, то при хроническом воздействии содержание карбоксигемоглобина крови незначительно превышает физиологическую норму (10 % и более при норме до 5 %); кроме того, отсутствует параллелизм между выраженностью интоксикации и уровнем НЬСО в крови. Определенное диагностическое значение имеют повышенное содержание железа в плазме крови и сдвиги в порфириновом обмене.
Лечение. Лечебные мероприятия начинаются с удаления пострадавшего из помещения с повышенной концентрацией оксида углерода. В легких случаях рекомендуется горячее питье (чай, кофе), грелка к ногам, под кожу вводят 1—2 мл 10% раствора кофеина, вдыхание увлажненного кислорода через носовые катетеры. Положительный эффект оказывает применение аскорбиновой кислоты, витаминов группы B, внутривенное или внутримышечное введение 10—20 мг (4—8 мл) цитохрома С с обязательным предварительным определением индивидуальной чувствительности к препарату. При средней и тяжелой степени интоксикации доза цитохрома С может быть увеличена до 40 — 80 мг. При нарушении ритма дыхания — внутривенно 0,3—0,5 мл 1% раствора лобелина. При остановке дыхания — искусственное аппаратное дыхание в сочетании с подачей кислорода в первые 2—4 ч непрерывно, в дальнейшем по 30—40 мин с 10—15-минутными перерывами. При гипокапнии показано кратковременное вдыхание карбогена. В условиях стационара внутривенно вводят смесь следующего состава: 500 мл 5 % раствора глюкозы, 20—30 мл 5 % раствора аскорбиновой кислоты, 50 мл 2 % раствора новокаина. При возбуждении рекомендуется внутримышечно смесь 2 мл 2,5 °о раствора аминазина, 1 мл 1 % раствора димедрола, 2 мл 2,5 % раствора пипольфена, 1 мл 2 % раствора промедола. При судорогах 5 мл 10 % раствора барбамила внутривенно. Сердечно-сосудистые средства в зависимости от состояния кровообращения.
Наиболее эффективным методом лечения острого отравления оксидом углерода средней, особенно тяжелой, степени является гипербарическая оксигенация (ГБО). При средней степени давление должно быть 1—1,5 атм, в тяжелых случаях до 2— 2,5 ати. Общая длительность сеанса 80—90 мин. Обычно в течение суток проводят 1 сеанс ГБО, в наиболее тяжелых случаях сеансы ГБО можно повторять до 4 раз в сутки. Особый эффект достигается при сочетании ГБО с инъекциями цитохрома С. Проводят комплекс мероприятий по профилактике возможного отека легких (введение мочевины, лазикса), спинномозговые пункции, краниоцеребральная гипотермия, коррекция кислотно-основного состояния, предупреждение пневмоний (антибиотики, гепарин). Лечение больных тяжелыми формами острого отравления оксидом углерода должно проводиться в специализированных токсикологических центрах.
При хронической интоксикации рекомендуется длительное комбинированное применение витаминов А, группы В, С, РР, фолиевой кислоты в сочетании с оксигенотерапией. Показано введение глюкозы, пантотената кальция, глютаминовой кислоты, АТФ. По показаниям — сердечные и сосудорасширяющие средства.
Экспертиза трудоспособности.
После острых легких отравлений пострадавший трудоспособен на своей прежней работе. После перенесенной интоксикации средней тяжести и тяжелой формы показан перевод на другую работу с выдачей трудового больничного листа. При наличии стойких отдаленных последствий рекомендуется направление на МСЭК для установления группы инвалидности по профессиональному заболеванию или определения процента утраты трудоспособности.
В начальных стадиях хронической интоксикации СО после временного перерыва в работе по трудовому листу нетрудоспособности (1—2 мес) и соответствующего лечения наступает полное восстановление нарушенных функций, поэтому рабочий может приступить к своей прежней работе. При выраженных формах хронической интоксикации необходим постоянный перевод на работу вне контакта с токсичными веществами и рациональное трудоустройство. Показано направление на МСЭК для определения группы инвалидности по профессиональному заболеванию и процента утраты трудоспособности.
Профилактика.
Необходима герметизация аппаратуры и трубопроводов, где может выделяться оксид углерода. Осуществляют постоянный контроль за концентрацией оксида углерода в воздухе помещений и быстрое удаление выделившегося газа путем использования мощных вентиляционных устройств, автоматической сигнализации об опасных концентрациях СО. При необходимости применяют индивидуальные средства защиты (в аварийных ситуациях — специальные маски с подачей чистого воздуха).
ГЕМОЛИТИЧЕСКИЕ АНЕМИИ.
Среди разнообразных промышленных ядов выделяют группу токсичных веществ, обладающих способностью вызывать повреждение эритроцитов, т.е. оказывать гемолитическое действие.
Гемолитические анемии — разнообразная группа заболеваний, объединяемая одним общим признаком — укорочением продолжительности жизни эритроцитов или эритрокариоцитов. Следствием этих изменений является та или иная степень малокровия, раздражение эритропоэза, ретикулоцитоз.
В течение многих лет среди гематологов дискутировался вопрос о правомерности использования термина «гемолитическая анемия» применительно к больным с нормальным уровнем гемоглобина, но укороченной жизнью эритроцитов. В настоящее время он принят во всем мире и используется независимо от уровня гемоглобина у больных.
Гемолитические анемии делятся на наследственные и приобретенные.
Наследственные гемолитические анемии можно дифференцировать по локализации поражения: мембраны эритроцита, его ферментов, структуры гемоглобина [Идельсон Л.И., 1985].
Приобретенные гемолитические анемии разделяются по принципу уточнения фактора, вызывающего гемолиз: антитела, механическая травма эритроцитов, химические яды. Среди последних выделяют вещества, оказывающие прямое или непосредственное гемолитическое действие, выраженность которого определяется уровнем и временем воздействия, путями проникновения в организм. К этой группе относятся следующие химические соединения.
Мышьяковистый водород — тяжелый бесцветный газ, в производственных условиях его образование происходит при воздействии технических кислот на металлы и соединения, содержащие мышьяк. Водород, образующийся в ходе реакции, восстанавливает элементарный мышьяк. При его распаде образуется диэтиларсин, вследствие чего появляется характерный чесночный запах. ПДК мышьяковистого водорода 0,3 мг/м куб. Основной путь поступления в организм — ингаляционный.
Фенилгидразин - используют в фармацевтической промышленности для изготовления препаратов пирамидона. ПДК производных гидразина 0,1 мг/м.
Толуилендиамин - используют преимущественно в производстве красителей и некоторых полимерных соединений. ПДК 2 мг/м.
Гидроперекись изопропилбензола (гипериз) находит применение как катализатор в производстве полиэфирных и эпоксидных смол, каучуков, стеклопластиков и др.; применяется как промежуточный продукт в производстве фенола и ацетона. ПДК 1 мг/м куб.
Острый внутрисосудистый гемолиз могут вызвать при приеме внутрь уксусная эссенция, бертолетова соль, ядовитые грибы.
Патогенез.
Патогенетические механизмы гемолитических анемий складываются из сочетания различных процессов, ведущим из которых является нарушение целостности эритроцита, обусловленное либо непосредственным воздействием токсичного вещества на основные липидные и белковые элементы мембраны, либо воздействием его на ферменты, регулирующие энергетические процессы в эритроците и синтез гемоглобина. Все это приводит к ускоренной гибели эритроцита.
В основе гемолитического действия токсичных химических веществ по аналогии с лекарственными препаратами лежит их способность вызывать патологическое окисление, так называемый оксидантный гемолиз, что сопровождается накоплением перекисных соединений. Это приводит к функциональным и структурным изменениям гемоглобина, необратимым сдвигам в липидах мембран эритроцита и ингибированию активности сульфгидрильных групп. Большинство токсичных веществ образуют оксидирующие дериваты только в организме при условии нарушения функционального состояния защитных систем, особенно системы глютатиона, который является важнейшим биокатализатором. Так, острый внутрисосудистый гемолиз, вызываемый ArH2, развивается в результате не только прямого действия на мембрану эритроцита, но и ингибиции активности каталазы эритроцита и редуктазы глютатиона.
Некоторые химические вещества вызывают «вторичное» гемолитическое действие вследствие особенностей их метаболизма и токсикокинетики в организме. Таков механизм гемолитической анемии, сопутствующей острой интоксикации метгемоглобинообразователями. Эти же соединения при продолжительном воздействии способны вызывать хронический компенсированный гемолиз, который обусловлен укорочением продолжительности жизни эритроцитов и протекает в клетках ретикулогистиоцитарной системы. Подобные же изменения жизненного цикла эритроцитов являются одним из патогенетических механизмов развивающейся анемии при выраженной свинцовой интоксикации.
В последние годы установлено, что при длительном воздействии различных токсичных химических веществ или их комплексов, часто включающих органические растворители в концентрациях, не вызывающих клинических проявлений интоксикации, в том числе анемии, могут наблюдаться изменения мор-фофункционального состояния эритроцитов и сдвиги в их метаболизме. При этом в первую очередь страдают мембраны эритроцитов, о чем свидетельствуют нарушения фосфолипидного . состава мембран, сдвиги калий-натриевого баланса и повышение проницаемости мембран для радиоактивного фосфора. Структурные и функциональные нарушения эритроцитов могут приводить к изменению процессов их жизнедеятельности и сокращению продолжительности жизни. При воздействии токсичных веществ малой интенсивности эти состояния вполне компенсированы за счет некоторого усиления регенерации, о чем свидетельствует определяемый в крови умеренный ретикулоцитоз. Уровень эритроцитов и гемоглобина остается нормальным или наблюдается его небольшое снижение.
Патологическая анатомия.
Патоморфологические изменения различаются в зависимости от времени наступления и причин смерти:
1) умершие в ближайшие сроки после отравления («острая смерть») от резкого кислородного голодания вследствие массового распада эритроцитов («аноксемическая смерть»);
2) умершие в более поздние сроки («смерть в подостром периоде») при явлениях олигурии, часто анурии, т.е. от тяжелых изменений в почках.
В зависимости от степени гемолиза эритроцитов и пропитывания тканей растворенным гемоглобином кожа приобретает различной интенсивности желтовато-бронзовую окраску. Желтушность менее выражена в более поздние сроки смерти. Кровь имеет темно-красный цвет, что указывает на действие гемолитического яда. Отмечается различной степени выраженности отек слизистых оболочек полости рта, гортани, отек легких, вещества мозга.
Наиболее выраженные микроскопические изменения обнаруживаются в почках, что обусловлено гемоглобин- и гемосидеринурией и скоплением больших масс распавшихся эритроцитов. В печени мелкокапельное ожирение печеночных и ретикулоэндотелиальных клеток; значительное отложение железа. В селезенке также отложение гемосидерина. В случае смерти в подостром периоде, помимо отека и дистрофических изменений в нервных клетках, обнаруживаются мелкие кровоизлияния, выраженная нейронофагия.
Клиника острых внутрисосудистых гемолитических анемий,
вызванных токсичными веществами, оказывающими прямое гемолитическое действие, имеет много общего. Поскольку наиболее типичным представителем гемолитической группы ядов является мышьяковистый водород, клиника острой интоксикации приводится на модели гемолиза, вызванного этим веществом.
Легкие формы интоксикации АrНз характеризуются скудной клинической симптоматикой: слабость, головная боль, тошнота, небольшой озноб. Возможна легкая иктеричность склер. Как правило, при этих формах больные в стационар поступают только в случае групповых интоксикаций. Наиболее характерным признаком выраженных форм отравления является наличие скрытого периода продолжительностью 2—8 ч, хотя гемолиз начинается сразу после поступления яда в организм. Затем следует период прогрессирующего гемолиза, который характеризуется появлением нарастающей общей слабости, головной болью, болями в эпигастральной области и правом подреберье, в пояснице, тошнотой, рвотой, лихорадкой. В это же время отмечается появление гемоглобин- и гемосидеринурии, в связи с чем моча приобретает темно-красный цвет. Нередко гемоглобинурия является первым признаком отравления, развивающимся ранее остальных симптомов.
Бурное развитие гемолиза приводит к выраженной эритроци-топении, снижению гемоглобина, в ответ на что отмечается значительная активация эритропоэза. Ретикулоцитоз периферической крови может достигать 200—300 %о, отмечается значительное увеличение количества эритроцитов с базофильной пункта-цией. Как правило, наблюдается нейтрофильный лейкоцитоз со сдвигом влево, иногда лимфо- и эозинопения. При развитии выраженного гемолиза повышается температура тела до высоких цифр (38—39 °С). В связи с бурным распадом эритроцитов наблюдаются изменения в моче: гемоглобинурия, значительная протеинурия. Обычно на 2—3-е сутки, а иногда и раньше, появляется желтуха, нарастает билирубинемия, первоначально преимущественно за счет непрямой фракции. Следует отметить, что между выраженностью билирубинемии и интенсивностью гемолиза нет прямой зависимости, поскольку уровень билирубина определяется функциональным состоянием печени. В тех случаях, когда функция печени сохранена, даже при значительном разрушении эритроцитов может быть умеренная гипербилирубинемия. При сочетании гемолиза с нарушением функциональной способности печени отмечается более высокое содержание билирубина за счет обеих фракций. Обычно на 3—5-е сутки, когда в процесс вовлекается печень, развивается период печеночной недостаточности, увеличиваются размеры печени, нарастает интенсивность желтухи, ферментемия. Нередко в те же сроки развивается почечная недостаточность, характеризующаяся прогрессирующей олигурией, вплоть до анурии, азотемией, нарушением фильтрации, реабсорбции, экскреторной функции. Почечные расстройства обусловлены, с одной стороны, закупоркой почечных канальцев продуктами распада гемоглобина, а с другой — ранним развитием признаков дегенеративного поражения проксимальных канальцев, ишемией коры органа. В периоде нефропатии моча светлая, определяется только микрогематурия.
При своевременном лечении отмечается регрессия симптомов почечной недостаточности и наступает период выздоровления или обратного развития, который продолжается от 4 до 6—8 нед. Особенностью интоксикации АrНз является довольно длительное сохранение (иногда до полугода) некоторых нарушений со стороны крови (анемизация), нервной системы (полиневритический синдром), почек (нарушение некоторых функциональных проб, иногда вплоть до развития пиелонефрита).
Диагностика
отравлений мышьяковистым водородом в типичных случаях особых затруднений не вызывает и базируется на данных о загрязнении воздуха рабочей зоны АrНз и характерной клинико-лабораторной симптоматике. Имеет значение обнаружение мышьяка в биосредах и диализируемой жидкости.
Лечение
интоксикаций мышьяковистым водородом комплексное: оно должно быть направлено на прекращение гемолиза, выведение элементарного мышьяка из организма, дезинтоксикацию, ликвидацию симптомов печеночной и почечной недостаточности.
Для лечения гемолиза используют введение гипертонического (10—20 %) раствора глюкозы и 4 % раствора гидрокарбоната натрия для коррекции ацидоза.
Выведение свободного гемоглобина достигается с помощью форсированного диуреза с использованием маннитола, мочевины, лазикса. Форсированный диурез показан только после устранения гемодинамических расстройств. В качестве дезинтокси-кантов применяют полиглюкин, гемодез, кокарбоксилазу, витамины группы В.
В качестве антидотов используют тиоловые соединения: мекаптид 40 % раствор 1—2 мл внутримышечно до 5—7 мл/сут; антарсин 5 % раствор 1 мл внутримышечно; унитиол 5 % раствор внутривенно капельно на 10% растворе глюкозы от 50 до 150 мл в сутки.
Экспертиза трудоспособности.
Трудоспособность при острых гемолитических состояниях определяется тяжестью перенесенной интоксикации.
При легких формах отравления, когда основные проявления интоксикации сводятся к обратимым гематологическим изменениям, наблюдается восстановление трудоспособности после соответствующего лечения. В этих случаях рабочие могут возвратиться на прежнюю работу.
При тяжелых формах отравления, когда, несмотря на длительное лечение, наблюдаются остаточные явления интоксикации (симптомы функциональной недостаточности печени, почек, анемия), необходимо прекращение контакта с веществами гемолитического действия. На срок переквалификации возможно пенсионирование по профессиональной группе.
Похожие работы
... среду [Менщикова, 2008]. 3.2. Анализ содержание GSH и активность глутатионзависимых ферментов в эритроцитах крови практически здоровых людей, проживающих в различных по уровню загрязнения районах г.Красноярска Город Красноярск административно разделен на 7 районов, различаемых по уровню техногенной нагрузки, которая определяется структурой промышленности и энергетики, исходного и ...
... санаторно-курортное лечение. 13. ПРОФИЛАКТИКА БЕНЗОЛЬНОЙ ИНТОКСИКАЦИИ Как и при других профессиональных интоксикациях и заболеваниях, включает: 1) совершенствование трудовых и технологических процессов; 2) качественное проведение предварительных при поступлении на работу в контакте с бензолом профилактических медицинских осмотров согласно приказу № 90 от 14 марта ...
... больных матерей отделять и вскрамливать искусственно; 5) клинически излеченных пациентов выписывать из лепрозория и наблюдать в течение всей жизни врачом лепрологом. ПРОФЕССИОНАЛЬНЫЕ ЗАБОЛЕВАНИЯ КОЖИ Профессиональными заболеваниями кожи называют такие поражения, которые возникают исключительно или преимущественно при воздействии на организм определенных профессиональных вредностей. Одно из ...
... этих показателей. Наблюдаемые возрастные различия указанных параметров не проявляют видимой закономерности, не поддаются трактовке и обусловлены, вероятно, рядом неучтенных влияний. 3.2. Динамика показателей периферической крови. Обобщенный анализ динамики изучаемых показателей по всему массиву обследованных (без учета возраста) позволил отметить следующие факты. При анализе постэкспозиционной ...
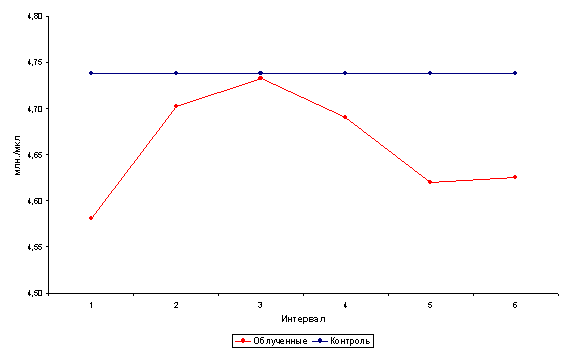
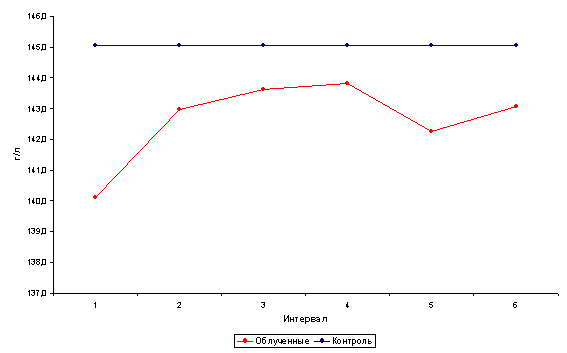
0 комментариев