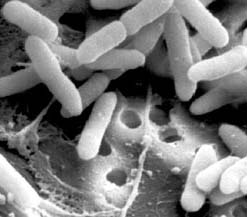
Синегнойная палочка (Pseudomonas aeruginosa) – основной возбудитель инфекционных поражений человека, вызываемых псевдомонадами[1]. Первое описание раневой инфекции, вызванной синегнойной палочкой, принадлежит Люке (1862 г.), отметившему характерное сине-зеленое окрашивание перевязочного материала. Чистая культура микроорганизма была выделена Жессаром (1882 г.), изучившим его культуральные свойства[2].
Первая вспышка госпитальной инфекции, вызванной P. aeruginosa, зарегистрирована в 1897 г. (Багински), но уже в 1899 г. С.Н. Серковский указывал, что патогенные свойства бактерии чаще реализуются в организме лиц с ослабленным иммунитетом (у детей и истощенных больных). Начиная с 70-х годов ХХ века P. aeruginosa – один из основных возбудителей локальных и системных гнойно-воспалительных процессов, особенно в условиях стационаров.
Цель данной работы – рассмотреть синегнойную палочку как возбудитель госпитальной инфекции.
Задачи:
- дать характеристику синегнойной палочки;
- выявить патогенез поражения;
- рассмотреть методы профилактики и лечения.
1. Характеристика синегнойной палочки
Pseudomonas aeruginosa – грамотрицательная палочка (при микроскопических исследованиях микроорганизмов часто применяется окраска по Граму, это позволяет дифференцировать – отличать – бактерии друг от друга; микроорганизмы, которые по Граму окрашиваются в сине-фиолетовый цвет, называются грамположительными, те же, что принимают красную окраску – грамотрицательные). Занимает особое место среди возбудителей инфекций мочевыводящих путей, так как ее возбудитель – Peudomonas aeruginosa – характеризуется значительной природной устойчивостью к большинству антимикробных препаратов, применяемых в клиниках, что обусловливает появление тяжелых осложнений после инфицирования мочеполовой системы Характерный биологический признак Peudomonas aeruginosa – способность синтезировать водорастворимый феназиновый пигмент – пиоцианин, окрашивающий питательную среду в сине-зеленый цвет. Это значительно упрощает идентификацию 70–80% штаммов синегнойной палочки. Они хорошо растут на искусственных средах, не ферментируют лактозу и образуют гладкие круглые колонии флуоресцирующего зеленоватого цвета со сладковатым запахом. В мазке, приготовленном из чистой культуры, палочки могут располагаться одиночно, парами или образовывать короткие цепочки.
Грамотрицательные палочки, подвижны, имеют 1–2 полярных жгутика, в мазке располагаются одиночно, попарно, короткими цепочками, синтезируют крахмалоподобное вещество типа внеклеточной слизи, более вирулентные штаммы синтезируют повышенное его количество. Хорошо растет на простых питательных средах, имеет ограниченную потребность в питательных веществах. Растет в широком диапазоне температур (4–42 °С). Выраженный хемоорганотроф, строгий аэроб, протеолитическая активность сильно выражена, сахаролитическая низкая. Продуцирует бактериоцины – пиоцины (белки, оказывают бактерицидный эффект на микроорганизмы аналогичного или генетически близкого вида). Характерным является пигментообразование. Наиболее часто встречаются: пиоцианин (окрашивает среду, отделяемое ран в сине-зелёный цвет), флюоресцин (флюоресцирует при УФ-облучении). Некоторые штаммы могут синтезировать и другие пигменты. Высоковирулентные штаммы синтезируют пиоцианин, обладающий свойствами бактериоцина, в больших количествах. При выделении культур могут наблюдаться атипичные непигментированные штаммы.
Патогенное действие обусловлено образованием экзотоксинов и высвобождением эндотоксинов при гибели клеток. Вырабатывает следующие экзотоксины: экзотоксин А – вызывает нарушение организации матрицы белкового синтеза, экзоэнзим S – вызывает глубокие патологические процессы в лёгких, цитотоксин – вызывает нейтропению и цитолиз других клеток, гемолизины, фосфолипазы. Среди продуктов жизнедеятельности значение имеют энтеротоксический фактор (возможно ответственный за развитие диарейного синдрома), фактор проницаемости, нейраминидаза (нарушает метаболизм нейраминовой кислоты), протеолитические ферменты (протеазы, коллагеназа).
Имеет соматический О и жгутиковый Н антигены, у мукоидных штаммов можно обнаружить капсульный К антиген.
По значимости пути распространения синегнойной инфекции делят на основные и редко встречающиеся. К источникам, имеющим важное значение, относят первую очередь больных с синегнойной инфекции, а также руки обслуживающего персонала. Существенным фактором распространения синегнойной инфекция могут служить заражённые предметы обихода, растворы, кремы для рук, полотенца для лица, гениталий, помазок для бритья и т.п. К редко встречающимся факторам следует отнести распространение инфекции через инструменты, приборы и аппаратуру, которые подвергались дезинфекции, оказавшейся неэффективной.
Синегнойная палочка хорошо растет на простых питательных средах в аэробных условиях при температуре 30–37 °С, а также и при 42 °С (что можно использовать как дифференциально-диагностический признак). Образование слизи – характерная особенность; слизь придает характерную вязкость бульонным культурам и колониям мукоидных штаммов. На жидких питательных средах образует характерную серовато-серебристую пленку; по мере старения культур возникает помутнение среды сверху вниз. На плотных питательных средах образует весьма разнообразные колонии. При росте на плотных средах у многих штаммов наблюдают феномен радужного лизиса, развивающийся спонтанно. Феномен характерен только для P. aeruginosa, его можно рассматривать как таксономический признак. Более того, он индивидуально выражен у отдельных штаммов и его можно использовать для внутривидовой дифференциальной диагностики. При образовании пигмента происходит окрашивание некоторых сред (например, агара Мюллера–Хинтона) в зеленый цвет. Протеолитическая активность сильно выражена: разжижает желатин, свертывает сыворотку крови, гидролизирует казеин; утилизирует гемоглобин. Сахаролитическая активность, наоборот, низкая: окисляет только глюкозу с образованием глюконовой кислоты. Эта бактерия продуцирует бактериоцины – пиоцины, способность к синтезу и чувствительность к которым широко варьирует у различных штаммов псевдомонад. На этом основано пиоцинотипирование псевдомонад, применяемое для внутривидовой дифференциальной диагностики чистых культур этого микроорганизма. Кроме продукции пиоцинов синегнойная палочка может образовывать пигменты – характерный и имеющий важное диагностическое значение признак. Среди пигментов наиболее часто встречают:
- Пиоцианин. Окрашивает питательную среду, отделяемое ран и перевязочный материал в сине-зеленый цвет.
- Флюоресцин (пиовездин), флюоресцирующий при УФ-облучении (длина волны – 254 нм).
- Пиорубин (красный).
- Пиомеланин (черный).
- L-оксифеназин (желтый)[3].
Синегнойная палочка поражает в основном лиц с ослабленным иммунитетом: госпитализированных больных с сопутствующими заболеваниями, лиц пожилого возраст и детей. Попадая в организм через катетеры, инструменты или растворы для орошении мочеиспускательного канала либо влагалища, синегнойные палочки вызывают инфекции мочеполовой системы
Предрасполагающими факторами для развития инфекции являются мочекаменная болезнь, врожденные пороки развития половых органов, постоянные или часто повторяющиеся катетеризации, удаление предстательной железы. Характерно заражение в больничной обстановке, например, в урологических отделениях. Синегнойные палочки занимают одно из первых мест среди возбудителей инфекций, развивающихся в пересаженной почке.
|
|
Синегнойная инфекция мочевыводящих путей, как правило, протекает хронически, длится месяцами, а иногда и годами, нарушая функцию почек. Часто инфекция протекает бессимптомно и выявляется при бактериоскопическом исследовании мочи лихорадящих больных, нуждающихся в частой и постоянной катетеризации мочевого пузыря. Иногда урогенитальная инфекция переходит в генерализованную форму с клиническими явлениями сепсиса (массивный выход возбудителей в кровь с последующим поражением многих органов и систем; считается неблагоприятным признаком).
Культуральная диагностика с последующей бактериоскопией не представляет трудностей, поскольку синегнойной палочки хорошо растёт на различных питательных средах. Культуральная диагностика («культура», «посев») – помещение взятого у больного материала на специальные питательные среды, состав которых подобран так, чтобы для выявляемого возбудителя создавались бы максимально благоприятные условия для развития и размножения. Появление специфических для возбудителя колоний (зон роста) свидетельствует о его присутствии в материале, взятом для исследования. Дополнительно «выращенных в культуре» возбудителей могут исследовать под микроскопом, оценивать на устойчивость к различным группам антибиотиков, «перевивать» на среды с другим составом для исследования ферментативных свойств и т.п.
С помощью серологической диагностики в относительно короткие сроки можно правильно поставить диагноз путём выявления как антигенов возбудителя инфекции, так и антител, вырабатываемые в ответ на антигенную стимуляцию иммунной системы. Антиген – вещество (обычно белковой природы), характерное и специфичное для выработавшего его организма. В чужеродном по составу антигенов организме стимулирует выработку иммунной системой последнего антител, направленных на изоляцию и уничтожение вышеупомянутых антигенов. Определение антигенов и антител широко используется в лабораторной диагностике различного рода инфекций. Выявление антигена какого-либо возбудителя подтверждает присутствие этого возбудителя в организме. Обнаружение антител свидетельствует о реакции организма на внедрение чужеродного агента. «Спектр» антител позволяет судить о стадии заболевания, а титр (количество) антител – с определёнными оговорками – о массивности инфекции.
Заподозрить синегнойную инфекцию позволяет характерное окрашивание ран, перевязочного материала в сине-зелёный цвет. Для выделения идентификации возбудителя используют культуральный метод. Забор материала следует производить до начала антибактериальной терапии. Растет на простых питательных средах, в частности используют агар Мюллер-Хинтон. При росте на плотных средах дает характерный феномен радужного лизиса, развивающийся спонтанно, при образовании пигмента окрашивает некоторые среды в зелёный цвет. Используется метод пиоцианинотипирования, основанный на том, что штаммы резистентны к своему пиоцианину и обладают различной чувствительностью к пиоцианинам других штаммов. На жидких средах дают рост в виде поверхностной пленки, со временем образуется помутнение, распространяющееся сверху вниз.
2. Патогенез пораженийПатогенное действие P. aeruginosa обусловлено образованием веществ, проявляющих свойства экзотоксинов, и высвобождением эндотоксинов при гибели и распаде бактериальной клетки.
Экзотоксины бактерий представлены продуктами жизнедеятельности с широким спектром биологической активности. Среди них основное значение имеют:
1. Экзотоксин А – белок с молекулярной массой 66 000–72 000 Д. Молекула токсина состоит из одной полипептидной цепи с 4 дисульфидными мостиками, свободных сульфгидридных групп не содержит. Токсин термолабилен, расщепляется трипсином, панкреатической эластазой, проназой, а также распадается под действием собственных протеолитических ферментов. Механизм действия связан с модификацией белков через АТФ-рибозилирование. Его мишень – фактор элонгации 2 (ФЭ-2); следствие – нарушение организации матрицы белкового синтеза (аналогичным свойством обладает дифтерийный токсин). Действие проявляется (в экспериментах на подопытных животных) в токсическом действии общего характера: отеках, некрозах, гипертензии с последующим коллапсом, метаболическом ацидозе, дыхательной недостаточности, параличе внутриклеточного синтеза белков и т.д.
2. Экзоэнзим S – белок с АДФ-трансферазной активностью; термостабилен. Инактивируется под действием денатурирующих и восстанавливающих агентов, ионов Cu2+ и Fe2+. Образуется в двух формах: первая – ферментативно активный белок с молекулярной массой 49 000 Д; вторая – неактивный белок-предшественник с молекулярной массой 53 000 Д. Этот экзоэнзим в очищенном виде нетоксичен для животных. In vivo вызывает глубокие патологические процессы в легких.
3. Цитотоксин оказывает выраженное цитотоксическое действие на полиморфно-ядерные нейтрофилы; способствует развитию нейтропении. Вызывает ультраструктурные изменения в клетках, нарушение физиологических градиентов K+, Na+, Ca2+ и глюкозы через повышение проницаемости клеточных мембран; последнее обусловливает набухание клеток и потерю ими крупных (например, белковые) молекул.
4. Гемолизины. Бактерия образует две гемолитические субстанции – термолабильный гемолизин с лецитиназной активностью (фосфолипаза С) и термостабильный гемолизин (фосфолипаза). И первый, и второй гемолизины вызывают солюбилизацию и гидролиз фосфолипидов с образованием фосфорилхолинов. In vivo гемолизины приводят к развитию некротических поражений, особенно в печени и легких.
Среди эндотоксинов, образуемых синегнойной палочкой, выделяют:
1. Энтеротоксический фактор. Несмотря на то, что он не выделен в чистом виде, в настоящее время подтверждены его белковая природа, термолабильность и чувствительность к действию трипсина.
2. Фактор проницаемости, также лабильный к нагреванию и действию трипсина. Подтверждена его роль в развитии патологических процессов в тканях.
3. Нейраминидаза. Она нарушает процессы метаболизма веществ, содержащих нейраминовые кислоты, например в соединительнотканных элементах. Этот фермент способен в 2–3 раза усиливать действие других токсинов синегнойной палочки[4].
Несмотря на наличие большого набора факторов вирулентности, синегнойную палочку все же следует рассматривать как оппортунистический патоген, так как синегнойная инфекция редко наблюдается у иммунокомпетентных лиц с неповрежденными анатомическими барьерами. Большинство штаммов P. aeruginosa обладает поверхностными микроворсинками, обеспечивающими адгезию к эпителию. Взаимодействие с клетками реализируется через рецепторы, включающие N-ацетилнейраминовые кислоты; определенную роль играет и вырабатываемая бактериями слизь. Прикрепление к субстратам стимулирует дефицит фибронектина, наблюдаемый при многих заболеваниях, особенно при муковисцидозе и других хронических заболеваниях легких.
Псевдомонады – типичные внеклеточные микроорганизмы, и их размножение напрямую обусловлено способностью противостоять действию факторов колонизационной резистентности макроорганизма. В частности, слизь и секретируемые цитотоксины затрудняют элиминацию бактерий фагоцитами и иммунокомпетентными клетками, что особенно выражено у пациентов с иммунодефицитами.
Патологические состояния, предрасполагающие к развитию синегнойной инфекции[5]
| Состояния | Проявления синегнойной инфекции |
| Частые внутривенные вливания | Эндокардит, остеомиелит |
| Лейкозы | Сепсис, периректальный абсцесс |
| Болезни злокачественного роста | Пневмония, сепсис, менингит, диарея |
| Муковисцидоз | Пневмония |
| Ожоги | Целлюлит, сепсис |
| Операции на органах ЦНС | Менингит |
| Трахеостомия | Пневмония |
| Язвы роговицы | Панофтальмит |
| Катетеризация сосудов | Гнойный тромбофлебит |
| Катетеризация мочевых путей | Инфекции мочеполовой системы |
| Период новорожденности | Диарея, менингит |
В марте-мае 1998 г. в Канаде была зафиксирована вспышка «синдрома горячей стопы», возможно вызванного P.aeruginosa, у 40 детей в возрасте от 2 до 15 лет, пользовавшихся одним бассейном. Данный синдром характеризовался эритематозной сыпью с узловатыми элементами на подошвенной поверхности стопы, отеком, чувством жжения и интенсивным болевым синдромом. Данная симптоматика развивалась в среднем через 40 часов после купания в бассейне.
При физикальном обследовании были обнаружены красно-пурпурные узлы диаметром 1–2 см, не сопровождавшиеся регионарной лимфоаденопатией. Через несколько дней на стопах появилось шелушение.
У одного ребенка из пустулы на стопе была выделена Pseudomonas aeruginosa. Такой же штамм Pseudomonas aeruginosa в высокой концентрации был выделен из воды бассейна. Биопсия кожи у этого пациента выявила нейтрофильную инфильтрацию вокруг сосудов и потовых желез. При биопсии, взятой у другого пациента, были обнаружены микроабсцессы в дерме.
Результаты двух исследований, опубликованные в медицинском журнале – The New England Journal of Medicine, показывают, что проведение бронхоскопических обследований и манипуляций может быть причиной возникновения вспышек нозокомиального инфицирования пациентов Pseudomonas aeruginosa.
В ходе эпидемиологического расследования были обнаружены конструктивные и производственные дефекты эндоскопического оборудования, в частности нарушение герметичности заглушки биопсийного порта. Вследствие этого микроорганизмы проникали внутрь прибора, и, кроме того, резко снижалась эффективность дезинфекции бронхоскопического оборудования (P.aeruginosa сохраняла жизнеспособность после трех циклов стандартной обработки ортофтальальдегидом).
В обоих исследованиях были проанализированы данные медицинских карт пациентов, результаты микробиологического исследования клинического материала, полученного у пациентов, и образцов, взятых с бронхоскопического оборудования для выявления случаев инфекций, возникших в течение 2–4 недель после процедуры. В одном исследовании было выполнено типирование изолятов P.aeruginosa методом электрофореза в пульсирующем геле (PFGE) для сравнения характеристик штаммов, выделенных у пациентов и обнаруженных на бронхоскопическом оборудовании.
В данных исследованиях были проанализированы данные двух клиник о 60 и 414 пациентах, у которых было выполнено 66 и 665 бронхоскопий, соответственно.
По данным D.L. Kirschke и соавторов у пациентов из первой клиники было проведено 43 микробиологических исследования клинического материала, P.aeruginosa была обнаружена в 20 (47%) образцах, 6 из которых содержали также и S.marcescens.
Во второй клинике – больнице Джона Хопкинса в Балтиморе (США), было отмечено увеличение частоты нозокомиальных инфекций, вызванных P.aeruginosa, в три раза по сравнению с базовыми показателями (с 10,4% до 31,0%). У 97 пациентов (23%) в образцах клинического материала обнаружена синегнойная палочка. Путем типирования изолятов с помощью PFGE было установлено, что штаммы, выделенные от пациентов, идентичны полученным с поверхностей бронхоскопов, в том числе из биопсийного порта.
Было отмечено, что контаминация P.aeruginosa отмечалась при использовании определенных моделей бронхоскопов новых модификаций (BFIT160, BF160, BFP40, Olympus America). В то же время показатели обсемененности эндоскопов других моделей, в том числе аппаратов для обследования желудочно-кишечного тракта, оказались в допустимых пределах. Кроме того, было установлено, что при прекращении использования аппаратов перечисленных новых модификаций частота нозокомиальных инфекций, вызванных синегнойной палочкой, возвращалась к исходным показателям.
Несмотря на то, что не было выявлено никаких нарушений в технологии проведения бронхоскопических процедур и последующей дезинфекции оборудования, штаммы Р.aeruginosa постоянно обнаруживались в мазках, взятых с поверхностей биопсийных портов бронхоскопов. Оказалось, что полученные клиниками новые модели бронхоскопов отличались нарушением герметичности заглушки биопсийного порта. Вследствие этого микроорганизмы проникали внутрь прибора, а затем не подвергались эрадикации при обработке прибора, так как воздушные пробки в полости порта препятствовали адекватному контакту дезинфектанта с поверхностью и высушиванию этой полости аппарата на завершающем этапе обработки.
Сохраняющаяся контаминация бронхоскопов P.aeruginosa приводила не только к инфицированию пациентов, но и к получению ложно положительных результатов бактериологического исследования, ошибочной регистрации вспышки нозокомиальной синегнойной инфекции и необоснованному назначению антибактериальной терапии. Однако, при первичном заражении пациентов во время бронхоскопической процедуры, антибиотикотерапия препятствовала развитию нозокомиальной инфекции.
Европейской исследовательской группой проведено исследование чувствительности клинических штаммов P.aeruginosa к меропенему и другим антибиотикам (MYSTIC – Meropenem Yearly Susceptibility Test Information Collection), выделенных от пациентов в следующих отделениях: гематологическом, ОРИТ, палатах общего профиля и у пациентов с муковисцидозом. Во всех отделениях пациентам проводили антибактериальную терапию меропенемом.
В исследовании приняло участие более 100 центров в 32 странах (Северной и Южной Америке, Европе, Африке, Средней Азии, Юго-восточной Азии и Австралии). В каждом центре в течение года было выделено до 100 грамположительных и грамотрицательных клинически значимых микроорганизмов в соответствии с принятыми в каждом центре методиками. Повторные изоляты от одного пациента в исследование не включались.
Была изучена чувствительность штаммов P.aeruginosa, выделенных с 1997 по 2000 гг. в 52 центрах в 10 европейских странах, с определением минимальных подавляющих концентраций (МПК) меропенема, имипенема, цефепима, пиперациллина / тазобактама и амикацина.
Определение МПК проводили в соответствии с рекомендациями Национального комитета по клиническим лабораторным стандартам (NCCLS), США. Внутренний контроль качества проводили с использованием штаммов Американской коллекции типовых культур (АТСС), рекомендованных NCCLS.
Штаммы P.aeruginosa, имевшие значения МПК цефтазидима >32 мг/л, ципрофлоксацина >4 мг/л, гентамицина >16 мг/л расценивались как полирезистентные.
Полирезистентные штаммы P.aeruginosa составили 12,2% (265/2172) из всех исследованных штаммов, причём они выделялись у пациентов независимо от профиля отделения. Наиболее часто полирезистентные штаммы выделяли у пациентов с муковисцидозом (15%). В отделениях гематологии и ОРИТ полирезистентные штаммы составили 13,3% и 11,7%, соответственно. Наименьший уровень выделения полирезистентных штаммов был в палатах общего профиля – 4%.
По мнению исследователей, выявленные различия в уровне полирезистентных штаммов, возможно, обусловлены селективным давлением, которое значительно выше в гематологическом отделении, где у пациентов часто имеется выраженный иммунодефицит, и антибиотики используются более «агрессивно». Также факторами, оказывающими влияние на формирование полирезистентности, являются частота и длительность госпитализации и политика инфекционного контроля.
Были выявлены различия в частоте полирезистентных штаммов в зависимости от географического региона. Наибольшая распространённость была отмечена в Турции – 50%, в Италии – 25%, Чехии и России – 22%. Наиболее низкий уровень (3% и ниже) отмечен в Испании, Великобритании, Германии, Болгарии и на Мальте.
3. Лечение и профилактикаИнфекции, вызванные синегнойной палочкой, плохо поддаются терапии в связи с множественной её резистентностью, передаваемой R-плазмидами. Механизмы резистентности: блокада транспорта препарата к внутриклеточной мишени (анатомические особенности поверхностных структур) и инактивация ферментами (бета-лактамазы инактивируют пенициллины и цефалоспорины, ацетилтрансфераза и нуклеотидаза инактивируют аминoгликозиды). В многоцентровом исследовании NPRS-3, синегнойная палочка отличалась очень высоким уровнем резистентности к гентамицину (61,3%), а также к пиперациллину, пиперациллину / тазобактаму, ципрофлоксацину. Наиболее активными в отношении P.aeruginosa являлись амикацин (резистентность 6,7%) и цефтазидим (резистентность 11,2%), меропенем (резистентность 3%)[6].
Инфекции, вызванные синегнойной палочкой, плохо поддаются антибиотикотерапии, что обусловлено частым выделением полирезистентных штаммов.
Резистентность к антибиотикам обусловлена двумя основными механизмами – блокада транспорта препарата к внутриклеточной мишени и его инактивация бактериальными ферментами. Первый обеспечивают анатомические особенности поверхностных структур P. aeruginosa. Второй обусловлен способностью бактерии синтезировать бета-лактамазы (инактивирующие пенициллины и цефалоспорины), ацетилтрансферазы, нуклеотидазы (инактивирующие аминогликозиды). Кроме того, в формировании резистентности к антибактериальным препаратам у P. aeruginosa имеют значение и другие механизмы, в частности активное выведение (efflux), что может обусловливать неэффективность цефалоспоринов, карбапенемов, фторхинолонов.
В настоящее время наиболее эффективными антибиотиками при лечении синегнойной инфекции являются антипсевдомонадные цефалоспорины (цефтазидим, цефепим), карбапенемы (меропенем, имипенем); часто в лечении используются комбинации этих антибиотиков с фторхинолонами (ципрофлоксацин) или аминогликозидами (амикацин).
Особые трудности представляет профилактика синегнойной инфекции, так как возбудитель также часто устойчив к действию антисептиков и дезинфектантов. Более того, доказана возможность длительного сохранения возбудителя в растворах фурацилина, используемого для хранения катетеров и хирургического инструмента, а также для промывания ран.
Pseudomonas aeruginosa может вырабатывать вещества, способные нейтрализовать некоторые дезинфектанты. В то же время она чувствительна к высушиванию, действию хлорсодержащих дезинфицирующих препаратов, быстро погибает под действием высокой температуры и давления[7].
Возбудитель устойчив к действию антисептиков и дезинфектантов, может сохраняться в растворах фурацилина, способен нейтрализовывать некоторые дезинфектанты, чувствителен к высушиванию, хлорсодержащим веществам, высоким температурам и давлению. Создана вакцина Aerugen, предназначенная для профилактики инфекций, вызываемых Pseudomonas aeruginosa, разработанная фирмами Berna Biotech и Orphan Europe для применения у пациентов с муковисцидозом. Основным в профилактике внутрибольничных инфекций остается соблюдение правил асептики и антисептики.
Заключение
Синегнойная палочка встречается в почве, в воде, в желудочно-кишечном тракте человека и животных. Она является одним из самых подвижных микроорганизмов и способна не только сохраняться в окружающей среде, но и успешно размножаться. Оптимальная температура для развития 37 °С.
Синегнойную палочку можно обнаружить и в носоглотке. Она устойчива к большинству антибиотиков и чувствительна лишь к 5%-ному раствору хлорамина, 3%-ному раствору перекиси водорода и 2%-ному раствору фенола (карболовой кислоты).
Синегнойная палочка способна вызывать различные заболевания. Но она никогда не поражает здоровые ткани, проникает только в поврежденные. Поражает в основном людей с ослабленным иммунитетом с сопутствующими заболеваниями, пожилых людей и детей.
Чаще всего синегнойной палочкой человек заражается в стационарных лечебных заведениях из-за высокой скученности людей с ослабленным иммунитетом. В больницах синегнойные палочки переносятся с зараженной пищей или водой, а также через санузлы, раковины, ручки кранов для воды, предметы, особенно влажные, общие полотенца, а также через руки медицинского персонала. Реже инфекция распространяется через инструменты, приборы и аппаратуру, которые плохо дезинфицируются.
Синегнойная палочка может вызвать инфекцию мочевыводящих путей (заносится при введении катетеров), инфекцию глаз (как результат травмы или оперативного вмешательства), инфекцию кожи и мягких тканей (раневые инфекции, дерматит, пиодермия)[8].
Часто ее обнаруживают у страдающих отитом – воспалением среднего уха. Более серьезные болезни, вызываемые палочкой: пневмония, эндокардит (заражение клапанов сердца), менингит и абсцесс мозга. Инфекция может поражать суставы и желудочно-кишечный тракт. Инфекция, обнаруженная в каком-то одном органе, часто перерастает в общее заражение организма, если бактерии попадают в кровь.
Заражение синегнойной палочкой происходит в три этапа: прикрепление бактерии и размножение на этом участке, проникновение бактерии глубже в ткани, возникновение локальной инфекции, общая инфекция – заражение синегнойной палочкой всего организма. Эта болезнь называется бактериемия.
Список литературы
1. Арутюнян С.И. Синегнойная палочка в носу. // Айболит. – 2006. – №2 (244) от 19 января.
2. Красильников А.П., Романовская Т.Р. Микробиологический словарь – справочник. Минск: Асар, 1999.
3. Медицинская микробиология. / Под ред. В.И. Покровского, О.К. Поздеева. – М.: ГОЭТАР МЕДИЦИНА, 1998.
4. Митрохин С.Д. Значение синегнойной палочки в инфекционной патологии человека. // Инфекция и антимикробная терапия. – 2004. – №3. – Том 6.
5. Руководство по медицинской микробиологии. / Под ред. Т.В. Перадзе. Пер. с англ. М.: Медицина, 1982.
6. Сидоренко С.В., Яковлев С.В. Инфекции в интенсивной терапии. – М., 2000.
7. Состояние резистентности к антиинфекционным химиопрепаратам в России. / Под редакцией Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова. – М.: Медицина, 2003.
[1] Красильников А.П., Романовская Т.Р. Микробиологический словарь – справочник. - Минск: Асар, 1999. - с. 310
[2] Медицинская микробиология. / Под ред. В.И.Покровского, О.К.Поздеева. - М.: ГОЭТАР МЕДИЦИНА, 1998, - с. 183
[3] Митрохин С.Д. Значение синегнойной палочки в инфекционной патологии человека. // Инфекция и антимикробная терапия. – 2004. - №3. – Том 6.
[4] Руководство по медицинской микробиологии. / Под ред. Т.В.Перадзе. Пер. с англ. М.: Медицина, 1982.
[5] Медицинская микробиология. / Под ред. В.И.Покровского, О.К.Поздеева. - М.: ГОЭТАР МЕДИЦИНА, 1998.
[6] Состояние резистентности к антиинфекционным химиопрепаратам в России. / Под редакцией Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова. – М.: Медицина, 2003.
[7] Сидоренко С.В., Яковлев С.В. Инфекции в интенсивной терапии. - М., 2000.
[8] Арутюнян С.И. Синегнойная палочка в носу. // Айболит. – 2006. - №2 (244) от 19 января.
Похожие работы
... aeruginosa Синегнойная палочка СЭМ компьютерная окраска. Научная классификация Царство: Бактерии Тип: Протеобактерии Класс: Gamma Proteobacteria Порядок: Pseudomonadales Семейство: Pseudomonadaceae Род: Pseudomonas Вид: Pseudomonas aeruginosa Pseudomonas aeruginosa - это грамотрицательная подвижная бактерия палочковидной формы, является облигаторным ...
... микробиологического контроля за состоянием санитарно-противоэпидемического режима; г) широкое использование биологически инертного шовного материала; д) осуществление бактериологической этиологической расшифровки внутрибольничных инфекций. 7. К особенностям организации профилактики ВБИ в детских соматических отделениях относятся: а) применение катетеризации только по строгим показаниям и ...
... на те мелкие нарушения, которые в комплексе становятся причиной, например, такого серьезного заболевания, как ишемическая болезнь сердца. Этот недуг, как и другие сердечно-сосудистые нарушения, эффективно лечится низко-интенсивным лазером. Наиболее действенным методом лечения является сочетание наружного воздействия и внутреннего (внутривенного). При наружном применении лазерный луч направляется ...
... ответов: 1-1-б; 2-в; 3-а; 4-г; 11-1;21-2; 2-1-в; 2-а; 3-б;12-1, 2;22-2; 3-2, 5; 13-5;23-2; 4-2; 14-2, 5;24-2; 5-2, 5;15-3, 6;25-1, 2; 6-1, 2, 3, 5; 16-1;26-1, 3, 5; 7-4, 5;17-4;27- 1; 8-2;18-3;28-4; 9-2, 4; 19-3;29-4; 10-3, 5;20-24; 30-3 Тесты для тематического контроля знаний Общая фармакология. 1. Фармакокинетика изучает: 1. дозирование лекарственных веществ 2. всасывание, ...
0 комментариев