НАЦІОНАЛЬНА АКАДЕМІЯ НАУК УКРАЇНИ
ІНСТИТУТ ФІЗІОЛОГІЇ ім. О. О. Богомольця ЛЕВАШОВ ОЛЕГ МИХАЙЛОВИЧУДК 577.359:591.044-612.275
ВПЛИВ ГіПОКіНЕЗії НА БІОЕЛЕКТРИЧНІ ВЛАСТИВОСТІ КІСТКИ
14.03.04 - патологічна фізіологія
АВТОРЕФЕРАТ
дисертації на здобуття наукового ступеня
кандидата медичних наук
Київ – 2008
Дисертацією є рукопис
Робота виконана у відділі клінічної патофізіології
Інституту фізіології ім. О.О.Богомольця НАН України
Науковий керівник: заслужений діяч науки та техніки України,
доктор медичних наук, професор
Березовський Вадим Якимович,
Інститут фізіології ім. О.О.Богомольця НАН України,
завідувач відділу клінічної патофізіології
Офіційні опоненти: доктор медичних наук, професор
Гуляр Сергій Олександрович,
Інститут фізіології ім.О.О.Богомольця НАН України,
провідний науковий співробітник відділу загальної
та молекулярної патофізіології
доктор медичних наук, професор
Бруско Антон Тимофійович,
завідувач відділу патоморфології з експериментально -
біологічним відділенням Інституту травматології та
ортопедії АМН України
Захист відбудеться “08 квітня” 2008 р. в 14.00 годин на засіданні
спеціалізованої вченої ради Д 26.198.01 при Інституті фізіології
ім. О.О.Богомольця НАН України за адресою:
01024, м. Київ, вул. Богомольця, 4.
З дисертацією можна ознайомитися в бібліотеці Інституту фізіології
ім.О.О.Богомольця НАН України за адресою:
01024, м. Київ, вул. Богомольця, 4.
Автореферат розісланий “05” березня 2008 р.
Вчений секретар
спеціалізованої вченої ради
доктор біологічних наук Сорокіна-Маріна З.О.
ЗАГАЛЬНА ХАРАКТЕРИСТИКА РОБОТИ
Актуальність теми. Зменшення фізичного навантаження на скелет людини внаслідок зниження частки фізичної праці в матеріальному виробництві, поширення гіпокінетичних станів, збільшення середньої тривалості життя є головними причинами широкого розповсюдження захворювань кісткової системи серед мешканців промислово розвинених країн (Рожинская Л.Я., 2000; Корж Н.А. и соавт., 2002; Оганов В.С., 2003; Поворознюк В.В., 2004-2006; Geusens P.P., 2006; Johnell O., 2006). У зв'язку з цим дослідження патофізіологічних механізмів порушень, які виникають у кістковій тканині при низькому функціональному навантаженні, з метою розробки нових методів їхньої ранньої діагностики, профілактики та корекції є одним із актуальних завдань сучасної медицини.
Специфічним фактором регуляції фізіологічної перебудови кісткової тканини є механічні деформації та напруження, що виникають у кістці під впливом функціонального навантаження. Відповідно до біоелектричної теорії, одним із месенжерів у процесі взаємодії фізичного навантаження з остеогенними клітинами можуть бути електричні струми, що виникають у кістці у відповідь на її деформацію. Механізми генерації електричних потенціалів (потенціалів навантаження - ПН) пов'язують із п'єзоелектричними та електрокінетичними явищами, що виникають у кістковій тканині при механічному навантаженні (Hastings G.W., 1998). Однак дотепер питання про роль біоелектричних явищ у фізіології та патології кісткової системи залишається невирішеним (Williams P.A.,1996, Бруско А.Т., Гайко Г.В, 2005). Не існує чітких уявлень про закономірності виникнення, поширення, а також про механізми передачі електричного сигналу до клітин, що беруть участь у процесах перебудови кістки. Немає обґрунтованої відповіді на питання, чому відновлення фізіологічного рівня функціонального навантаження після тривалої гіпокінезії не достатньо для повного відновлення структури та складу кістки. Відповісти на ці та багато інших питань неможливо без комплексних досліджень біоелектричних властивостей кісткової тканини. Підтвердженням тому є результати робіт сучасних дослідників (Oostendorp T.F. et al., 2000; El-Lakkani A., 2001; Gabriel C., 2005), в яких показано, що процеси генерації та передачі електричних сигналів у кістковій тканині значною мірою залежать від її пасивних електричних властивостей (ПЕВ) - поляризаційної здатності, електропровідності тощо. Вважають, що показники, які характеризують ПЕВ кістки, можуть істотно змінюватися вже на початкових, доклінічних стадіях розвитку патології кісткової системи, що має важливе значення для практичної медицини (Gu W.Y., 1999; Legare A., 2002; Sierpowska J., 2005-2006). Необхідність більш глибокого розуміння ролі біоелектричних механізмів у розвитку патологічних процесів у кістці при низькому функціональному навантаженні стала підставою для проведення цього дослідження.
Зв'язок роботи з науковими програмами, планами, темами. Робота виконана згідно з планами наукових досліджень відділу клінічної патофізіології Інституту фізіології ім. О.О. Богомольця НАН України за темою “Дослідити механізми адаптації організму до гіпокінезії та можливі шляхи попередження її негативних наслідків” (Номер державної реєстрації 0101U002635), і проекту NN-26 (R) НТЦ України “Дослідити вплив мікрогравітації на кісткову тканину та профілактичну дію газових сумішей зі зниженим вмістом кисню на розвиток остеопенії”, який виконувався на замовлення Національного космічного агентства України.
Мета та завдання дослідження. Мета роботи - встановити патофізіологічні закономірності змін біоелектричних властивостей кістки в умовах низького функціонального навантаження.
Завдання дослідження:
1. Дослідити закономірності виникнення електричного потенціалу навантаження у стегновій кістці молодих, дорослих і старих щурів при різних ступенях механічного впливу й експериментальної гіпокінезії.
2. Визначити характер і спрямованість змін пасивних електричних властивостей стегнової кістки щурів різних вікових груп в умовах стереотипного функціонального навантаження.
3. Дослідити закономірності змін біоелектричних властивостей кістки в умовах дозованої гіпокінезії та роль змін складу й структури кісткової тканини у цих процесах.
4. Дослідити стан кисневого метаболізму м'язової та кісткової тканин задніх кінцівок щурів в умовах гіпокінезії і його зміни під впливом переривчастої нормобаричної гіпоксії (ПНГ).
5. На підставі порівняльного аналізу результатів проведених досліджень оцінити можливість використання біоелектричних показників для оцінки стану кісткової тканини.
Об'єкт дослідження - біоелектричні властивості кісткової тканини.
Предмет дослідження – потенціал навантаження та пасивні електричні властивості стегнової кістки білих щурів в умовах стереотипного й низького функціонального навантаження та парціального тиску кисню.
Методи дослідження. При виконанні роботи використано методи дозованого обмеження рухливості щурів, переривчастої нормобаричної гіпоксичної стимуляції, відведення потенціалу навантаження з поверхні кістки, мультичастотного імпедансометричного тестування, остеометрії, гравіметрії, термічної денатурації, хімічної демінералізації кістки та варіаційної статистики.
Наукова новизна одержаних результатів. Уперше проведено комплексні дослідження біоелектричних властивостей (БВ) стегнової кістки білих щурів в умовах стереотипного та низького функціонального навантаження. Встановлено закономірності змін електричного потенціалу навантаження в залежності від ступеня механічного впливу на кістку та віку тварин. Уперше показано, що характер і виразність змін БВ кістки протягом життя тварини визначаються віковими особливостями складу та морфометричних показників кістки. Встановлено, що жорстка тривала гіпокінезія призводить до істотних змін біоелектричних властивостей кістки. Показано важливу роль мінералорганічної складової кісткового матриксу та води у зміні окремих показників БВ кістки в умовах гіпокінезії. Встановлено, що критичним моментом у розвитку гіпокінетичної остеопенії є підвищення гідратації кісткової тканини, що спричинює різке збільшення її електропровідності. Вперше показано, що ПНГ зменшує прояви гіпокінетичних порушень кисневого метаболізму і БВ стегнової кістки. Встановлено, що у механізмі остеопротекторної дії ПНГ важливу роль відіграє активація анаболічних процесів у кістковій тканині, що супроводжується підвищенням вмісту органічних речовин.
Практичне значення одержаних результатів. Одержані результати сприяють більш глибокому розумінню ролі біоелектричних факторів у регуляції фізіологічної перебудови кістки при зміні режимів функціонального навантаження. Результати роботи свідчать про те, що на певному етапі розвитку гіпокінетичної остеопенії зміни ПЕВ можуть сягати такого рівня, коли реалізація біоелектричних механізмів регуляції ремоделювання кістки стає суттєво обмеженою. Виконані дослідження дають змогу говорити про перспективність використання методу мультичастотної імпедансометрії для оцінки якості кісткової тканини в клінічній практиці. Нові дані про закономірності та специфіку змін ПЕВ кістки в умовах гіпокінезії можуть бути використані для розробки діагностичних алгоритмів, а створений пристрій для досліджень електричних характеристик біологічних об'єктів вже використовується у відділі клінічної патофізіології Інституту фізіології ім. О.О. Богомольця НАН України. Результати досліджень можуть бути використані при викладанні курсу патофізіології та фізіології кісткової системи для фахівців медико-біологічного профілю.
Особистий внесок здобувача. Автором самостійно проведений аналіз літератури, досліджені пасивні електричні властивості, склад і остеометричні показники стегнової кістки щурів, проведені обробка й аналіз отриманих результатів. Частину досліджень з реєстрації потенціалу навантаження та визначенню кисневого метаболізму м'язової та кісткової тканини виконано в співробітництві зі співавторами друкованих праць - провідним інженером Сафоновим С.Л., п.н.с. Левашовым М.І. і м.н.с. Лахіним П.В. Планування досліджень, обговорення результатів і формулювання висновків проводилося разом з науковим керівником - доктором медичних наук, професором Березовським В.Я.
Апробація результатів дисертації. Основні положення роботи були представлені на конференції для молодих учених Інституту фізіології ім. О. О. Богомольця НАН України „Перспективні напрями досліджень сучасної фізіології” (Київ, 2003); школі-семінарі для молодих учених ”Наукові космічні дослідження”, (Жукін, 2003); науково-практичній конференції “Вторинний остеопороз: епідеміологія, клініка, діагностика, профілактика та лікування”, (Київ-Тернопіль, 2003); IV Міжнародному симпозіумі “Актуальні проблеми біофізичної медицини” (Київ, 2004); школі-семінарі для молодих учених ”Наукові космічні дослідження”, (Жукін, 2004); IV Національному конгресі геронтологів і геріатрів України (Київ, 2005); школі-семінарі для молодих учених ”Наукові космічні дослідження”, (Жукін, 2005); V науково-практичної конференції „Морфогенез і патологія кісткової системи в умовах промислового регіону”, (Луганськ, 2005); XVII з'їзді фізіологів України (Чернівці, 2006); VIII World Congress of International society for Adaptive Medicine (Moscow, 2006); V Міжнародному симпозіумі “Актуальні проблеми біофізичної медицини”, (Київ, 2007). Публікації. За матеріалами дисертації опубліковано 6 статей у наукових журналах, з них 5 – у фахових виданнях, 12 тез доповідей на наукових конференціях, з'їздах, симпозіумах, отримано 1 деклараційний патент України на винахід.
Обсяг і структура дисертації. Дисертація викладена на 186 сторінках (обсяг основного тексту -157 стор.) і складається зі вступу, чотирьох розділів, висновків, списку використаних літературних джерел (233 найменування), робота проілюстрована 53 рисунками та 20 таблицями.
ОСНОВНИЙ ЗМІСТ МАТЕРІАЛИ та МЕТОДИ ДОСЛІДЖЕННЯ
Дослідження виконані на 233 щурах-самцях лінії Вістар віком від 1 до 24 міс. Усі тварини отримані з віварію Інституту фізіології ім. О.О. Богомольця НАН України, де вони знаходилися на стандартному раціоні харчування. Доступ тварин до їжі та води не обмежувався. Щурів виводили з експерименту за допомогою декапітації після знерухомлення в умовах ефірного наркозу. Всі маніпуляції з тваринами здійснювали відповідно до вимог біоетики та міжнародних принципів Європейської конвенції про захист хребетних тварин, які використовуються для експериментальних та інших наукових цілей.
Дозовану гіпокінезію створювали обмеженням рухливості тварин у герметичному контейнері, що складається з блоку комірок. Жорсткому режиму обмеження рухливості відповідало відношення площі проекції тіла тварини до площі обмежувальної комірки - 1:1 (Літовка І.Г.,2006). Конструкція контейнера забезпечувала можливість заміни в ньому атмосферного повітря на нормобаричну гіпоксичну газову суміш (НГГС) із заданим парціальним тиском кисню.
Гіпоксичну газову суміш одержували за допомогою мембранного газорозподільного елемента. Об'ємну швидкість подання повітря та НГГС контролювали ротаметром "РМ-063", вміст кисню - газоаналізатором "МИК-М". Періодичність подання газової суміші й атмосферного повітря в контейнер для щурів забезпечувалася в автоматичному режимі за допомогою програмного блоку керування роботою компресорів. НГГС із парціальним тиском кисню 90-98 мм рт. ст., що еквівалентно об'ємній частці кисню рівній 12-13% кисню, подавали дослідним тваринам щодня протягом 8 год у режимі 20 хв - гіпоксична газова суміш, 20 хв - атмосферне повітря.
| |
|
|
|
| |
Механічне навантаження на кістку здійснювали в аксіальному напрямку. Його значення розраховували виходячи з умов фізіологічного розподілу вагового навантаження між передніми та задніми кінцівками щура, згідно з яким 40% вагового навантаження припадає на передні кінцівки, а 60% - на задні (Fukuda S. et al., 2004). Дослідження проводили при 3 ступенях навантажень: І ступінь - 30%, ІІ ступінь - 50% і ІІІ ступінь - 100% від маси тіла тварини. Реєстрацію ПН проводили на двокоординатному самописці XY Recorder (Прага). Вимірювали амплітуду ПН (мкВ) та розраховували його величину, яка припадає на одиницю навантаження (мкВ/г).
| |
|
|
|
| |
Підготовку препаратів і вимір електричних показників проводили за методикою Kosterich J. et al., (1984) з використанням платинових електродів у напрямку перпендикулярному до поздовжньої осі препарату, в умовах його повної імерсії у 0,9%-му розчині NaCl при 370С. З метою стандартизації результатів досліджень поряд з абсолютними значеннями використовували відносні значення показників ПЕВ, які визначали з урахуванням довжини та площі перетину препарату.
Схема остеометричних досліджень складалася з визначення таких показників: маса та довжина стегнової кістки й препарату, максимальний, мінімальний і середній діаметр діафіза та кістковомозкового каналу, середня товщина стінки діафіза. Розраховували також індекси відношення діаметра кістковомозкового каналу до діаметра діафіза й відношення товщини стінки діафіза до його діаметра й діаметра кістковомозкового каналу (Алексєєв В.П.,1966). Всі остеометричні показники визначали за допомогою мікрометра з оптичною системою, який забезпечує точність вимірів ± 0,01мм і припустиму похибку ±0,004 мм.
Демінералізацію препаратів проводили за допомогою повного занурення в 10%-й розчин динатрієвої солі етилендіамінтетраоцтової кислоти (ЕДТА), рН 8,0. Розчин міняли щодня. Контрольні дослідження ПЕВ проводили на 14 і 28 добу демінералізації. Препарат витягали з розчину ЕДТА, ретельно промивали у 0,9%-му розчині NaCl та залишали на 24 год у свіжоприготовленому розчині. Через добу препарат ще раз промивали 0,9%-м розчином NaCl та визначали показники ПЕВ відповідно до описаної вище методики. Повноту демінералізації контролювали спалюванням препарату в муфельній печі наприкінці експерименту.
Дозовану термічну денатурацію препаратів проводили за допомогою його повного занурення на 30 с у 0,9%-й розчин NaCl , нагрітого до 40, 45, 50, 55, 60, 65, 70, 80, 90 або 1000С ±0,50С. Всі виміри проводили через 25 с після забирання препарату з нагрітого розчину при 370 С.
Напруження кисню в литковому м'язі щурів вимірювали in situ полярографічним методом з використанням відкритого платинового електрода на полярографі LP7 (Прага) (Березовський В.А.,1975). Споживання кисню в окремих фрагментах стегнової кістки визначали за допомогою платинового електрода за методикою Shirrmacher K. et al.,(1997). Спонгіозну частину кісткових фрагментів відмивали у 0,9%-му розчині NaCl при 25-280С і рН 7,4. Маса кісткових фрагментів становила від 70 до 100 мг, товщина - 130-500 мкм. Фрагменти стегнової кістки поміщали в циліндричну термостатовану комірку об'ємом 2мл3, яка була заповнена фізіологічним розчином, при 370С и рН 7,4. Хроноамперограму реєстрували протягом 30 хв при швидкості руху діаграмної стрічки 10 мм/с. Споживання кисню за хвилину розраховували за кривою спаду кисню в часі на 100 г тканини. Коефіцієнт розчинності кисню приймали рівним 0,024 мл·мл-1·атм-1 при 370С.
Дослідження вмісту в кістці мінеральних, органічних речовин і води проводили гравіметричним методом при 20-220С і відносній вологості 75-80%. На 1-му етапі за допомогою ''ТВ-500'' визначали масу вологого препарату з точністю ±1 мг. На 2-му етапі препарат висушували в сушильній шафі при 1050С до стабільної маси та визначали його “суху масу”. На 3-му етапі препарат спалювали в муфельній печі при 7000С не менше ніж 5 год і визначали його “озолену масу”. Кількість води в препараті розраховували як різницю між масою вологого й сухого препарату, органічних речовин - як різницю між масою сухого й озоленого препарату. Кількість мінеральних речовин прирівнювали до вмісту золи. Щільність вологого та сухого препаратів кістки розраховували за допомогою розподілу його маси на об'єм.
Статистичний аналіз результатів проводили з використанням пакета програмного забезпечення “Statistica” 6.0 і Microsoft Exel 2000. Вірогідність різниці середніх величин визначали за t - критерієм Стьюдента і U - критерієм Манна - Уітні. Значення р<0,05 вважали вірогідними.
РЕЗУЛЬТАТИ ДОСЛІДЖЕНЬ та ЇХ ОБГОВОРЕННЯ
Потенціал навантаження стегнової кістки щурів при різних ступенях механічних впливів. При дії на стегнову кістку стандартного навантаження (Н), яке становило 50% від маси тіла щура, реєструвалися характерні двофазні коливання електричного потенціалу, амплітуда (А) яких сягала 1200 мкВ, а тривалість - 0,5 с.
Перша фаза ПН мала позитивне початкове відхилення й виникала у відповідь на додаток механічного навантаження. Друга фаза виникала при усуненні навантаження. Її початкове відхилення мало зворотну спрямованість, а амплітуда дорівнювала або була близька до амплітуди першої фази. Значення електричного потенціалу (мкВ), що доводиться на одиницю навантаження (г) – (А/Н), перебувала в діапазоні від 1 до 3 мкВ/г. При східчастому збільшенні навантаження від 30 до 100% маси тіла щура амплітуда ПН зростала в експонентній залежності.
У щурів, що перебували в умовах 28-добової жорсткої гіпокінезії, амплітуда ПН стегнової кістки при навантаженнях I, II і III ступеня була на 37, 35 і 23% відповідно менше, ніж у тварин контрольної групи.
Середня амплітуда ПН у контрольних щурів становила 720,0±89,5, 1102,6±10,8 і 1537,6±189,6 мкВ, а у дослідних - 456,8±54,5, 812,8±83,6 і 1287,7± 173,1 мкВ відповідно при навантаженнях I, II і III ступеня. При навантаженнях I і II ступеня розходження в амплітуді ПН між тваринами контрольної та дослідної груп були статистично вірогідними (p<0,05).
Загальна закономірність збільшення амплітуди ПН при збільшенні ступеня навантаження на стегнову кістку була характерна як для контрольних, так і для дослідних щурів. Однак у тварин, які перебували в умовах гіпокінезії, значення приросту амплітуди ПН були завжди менше, ніж у контрольних. Як у контрольних, так і у дослідних щурів значення електричного потенціалу, що доводиться на одиницю навантаження, при впливах I і II ступеня збільшувалися, а III ступеня - зменшувалися. Однак середні значення А/Н у дослідних тварин при навантаженнях I і II ступеня були на 36% менше, ніж у контрольних. При навантаженнях III ступеня вірогідних розходжень в амплітуді ПН і значенні А/Н між контрольними та дослідними тваринами не встановлено.
Дослідження впливу вікових змін кісткової тканини на ПН стегнових кісток проводили на щурах віком 2 , 6 і 24 міс. Загальна тенденція до збільшення амплітуди ПН зі збільшенням навантаження на кістку була властива для тварин усіх вікових груп.
Зростаючи в експонентній залежності, ПН сягав максимальних значень при навантаженнях III ступеня. При всіх ступенях навантаження максимальні амплітуди ПН були зареєстровані у стегнових кістках 6-місячних щурів. У 2-місячних щурів ПН не перевищував 9,1-10,3-11,6% амплітуди ПН 6-місячних тварин при відповідних ступенях навантаження. У 24-місячних тварин ПН був лише 54,5-78,7-81,4% такого показника 6-місячних щурів при відповідних ступенях навантаження. Слід зазначити, що найбільші розходження амплітуди ПН у 2, 6 і 24-місячних щурів були зафіксовані при навантаженнях I та II ступеня.
Незалежно від віку щурів, при збільшенні навантажень від 30 до 50% від маси тіла значення електричного потенціалу, що доводиться на одиницю навантаження, збільшувалися, а при навантаженнях, які сягали 100% від маси тіла - знижувалися.
Максимальне значення цього показника було зареєстровано в 6-місячних щурів і сягало 6,3-7,8 мкВ/г. У 2-місячних щурів він не перевищував 0,8-0,9 мкВ/г, а у щурів 24-місячного віку він зменшувався до 2,8-4,2 мкВ/г.
Пасивні електричні властивості компактної кістки білих щурів при стереотипному функціональному навантаженні. При мультичастотному імпедансометричному тестуванні електрична ємність препаратів стегнової кістки контрольних щурів змінювалася згідно з експонентною залежністю, досягаючи мінімуму на частоті 1 МГц.
Максимальне значення реактивного опору реєстрували на частоті 10 кГц. Воно суттєво зменшувалося як на більш високих, так і на більш низьких частотах. Оскільки реактивний опір відображає стан поляризаційних процесів у біологічних тканинах, можна говорити про те, що на частоті 104 Гц вони сягали максимального ступеня виразності. Властивості частотної динаміки імпедансу й активного опору були дуже близькі. На частотах 104,105 Гц їх значення суттєво не змінювалися, на частотах 102,103Гц вони зростали, а на частоті 106 Гц – зменшувалися.
Для встановлення зв'язку вікових змін структури та складу кістки з її ПЕВ були проведені дослідження на 49 щурах-самцях віком від 1 до 24 міс. Для стегнової кістки одномісячних щурів були характерні низькі значення імпедансу, активного та реактивного опору і високі показники ємності.
Із віком тварини імпеданс, активний і реактивний опір збільшувалися, а ємність зменшувалася. Найбільш значні зміни ПЕВ відзначалися протягом перших 3-4-х місяців життя. У дорослих щурів показники ПЕВ залишалися відносно сталими, а після 18 міс значення імпедансу, активного й реактивного опору починали поступово зменшуватися, а ємності - збільшуватися.
Маса стегнових кісток збільшувалася втричі протягом перших 3-х місяців життя, від 6 до 12 міс - сягала пікових значень, а після 18 міс починала зменшуватися, що свідчило про початок вікової інволюції кісткової тканини. Остеометричні дослідження показали, що діаметр кістковомозкового каналу в період активного росту щурів (1-6 міс) збільшувався істотніше. У тварин віком від 6 до 14 міс його показники залишалися відносно стабільними, а після 14 міс він знову починав збільшуватися. Товщина стінки діафіза в перші 3-4 міс життя щурів також зростала більше ніж удвічі. Потім темпи його приросту істотно сповільнювалися та зберігалися такими до 12-місячного віку. У щурів після 18 міс життя товщина стінки діафіза починала поступово зменшуватись. Аналіз закономірностей вікової динаміки остеометричних показників стегнових кісток щурів дозволив виділити найбільш характерні періоди їх змін. Вони відповідали віку 1-3, 6-14, 18-24 міс і практично повністю збігалися з описаними вище періодами вікових змін ПЕВ кістки. Дослідження вікової динаміки основних складових кісткового матриксу показало, що вміст мінеральних речовин істотно збільшувався у перші 3-4 міс життя щура (з 45,5±1,1 до 56,6±1,6%). Із віком мінералізація кістки продовжувала збільшуватися, але значно меншими темпами. У щурів віком від 12 до 18 міс масова частка мінеральних речовин залишалася стабільно високою (60,4±0,2%), а після 18 міс почала відзначатися чітко виражена тенденція до її зниження. У 24-місячних тварин масова частка мінеральних речовин у складі кісткового матриксу не перевищувала 53,7±1,3%. Вікова динаміка вмісту органічних речовин наближалася до динаміки вмісту мінеральних речовин. У одномісячних щурів масова частка води у кістковій тканині сягала 35,0±1,4%, у щурів 6-місячного віку вона зменшувалася до 17,0±0,3%. У тварин, вік яких перевищував 18 міс, вміст води в кістковій тканині починав поступово збільшуватися й до 24-місячного віку сягав 26,39±1,35%. Щільність кістки також найбільше зростала в перші 3 міс життя щурів. До 18 міс вона залишалася стабільною, а потім починала поступово зменшуватися.
Кореляційний аналіз показав, що між віковими змінами показників гідратації та мінералізації компактної кістки щурів існувала значна зворотна залежність (r=-0,894; р<0,01). Показники вмісту органічних і мінеральних речовин також були пов'язані зворотною кореляційною залежністю, однак ступінь її виразності був значно меншим (r=-0,406; p<0,05). Аналіз кореляційних зв'язків показників ПЕВ і складу кістки показав наявність вірогідного прямого зв'язку між ємністю, вмістом води й органічних речовин (r=+0,858; r=+0,485) та імпедансом, активним і реактивним опором і вмістом мінеральних речовин (r=+0,766; r=+0,765; r=+0,893). Вірогідний зворотний кореляційний зв'язок був виявлений між ємністю і вмістом мінеральних речовин (r=-0,877), а також між імпедансом, активним, реактивним опором і вмістом води (r=-0,594; r=-0,592; r=-0,901) та органічних речовин (r= -0,491; r=-0,392; r=-0,304). Отримані результати свідчать про те, що вікові розходження пасивних електричних властивостей стегнової кістки щурів визначаються особливостями її складу та структури в різні періоди життєвого циклу.
Пасивні електричні властивості кістки при дозованій гіпокінезії. Після 28-добової жорсткої гіпокінезії у 67% дослідних тварин спостерігалися характерні ознаки остеопенії – низька маса й щільність кістки в порівнянні з тваринами контрольної групи. В 33% щурів ці показники не відрізнялися від контролю. Отримані результати свідчили про наявність міжіндивідуальної варіабельності та відносної "інертності" реакції компактної кістки щурів на зменшення функціонального навантаження, що узгоджується з даними інших дослідників. У кістках тварин, що мали ознаки остеопенії, відзначалося вірогідне зменшення об'ємної маси мінеральних речовин (на 15,6%) та збільшення вмісту води (на 10,6%). Порівняльний аналіз показав, що у контрольних тварин щільність сухої кістки сягала 1,95±0,09 мг/мм3, а у тварин, що мали ознаки остеопенії - не перевищувала 1,65±0,13 мг/мм3 (р<0,05). Зменшення функціонального навантаження на кінцівки в умовах жорсткого 28-добового обмеження рухливості істотно не впливало на ріст стегнової кістки в довжину, але помітно знижувало темпи її аппозиційного росту, що призводило до зменшення маси стегнової кістки, середнього діаметра діафіза та просвіту кістковомозкового каналу на 16,6, 19,0 і 20,4% відповідно (p<0,05).
Для ПЕВ препаратів стегнових кісток, що мали ознаки остеопенії, на всьому діапазоні частот були властиві низькі величини електричного імпедансу, активного й реактивного опору і високі показники електричної ємності. Так, на частоті 104 Гц зменшення середньої величини електричного імпедансу сягало 50,1%, реактивного й активного опорів - 80,4 і 50,2% відповідно при збільшенні електричної ємності на 396,0%.
При збільшенні тривалості гіпокінезії до 45 діб у всіх дослідних щурів спостерігалися ознаки остеопенії. Маса стегнової кістки тварин була вірогідно меншою, ніж контролю (750,01±65,01 і 894,55±30,61 мг відповідно), а щільність кісткової тканини не перевищувала 1,62±0,04 мг/мм3 (р<0,05). Вміст мінеральних і органічних речовин у компактній кістці дослідних щурів вірогідно зменшувався, а вміст води - збільшувався. Якщо в контрольній групі щурів мінеральна насиченість кісткової тканини становила 1,46±0,03 мг/мм3, то у тварин дослідної групи вона не перевищувала 1,23±0,04 мг/мм3 (p<0,001). У щурів, що перебували в умовах 45-добової гіпокінезії, відзначалася більш висока гідратація кісткової тканини порівняно зі щурами контрольної групи і порівняно з тваринами, які знаходилися в умовах жорсткої 28-добової гіпокінезії (0,43±0,01, 0,73±0,05 і 0,52±0,03 мг/мм3 відповідно). Характер і загальна спрямованість змін діаметра діафіза та кістковомозкового каналу стегнових кісток щурів після жорсткої 45-добової гіпокінезії був таким, як і у тварин після жорсткої 28-добової гіпокінезії, проте ступінь їх виразності був найбільшим, що призводило до вірогідного зменшення товщини стінки діафіза на 22,2% (р<0,05).
Гіпокінетичні порушення складу й остеометричних параметрів стегнової кістки дослідних щурів супроводжувалися характерними змінами її ПЕВ. На рис.10 представлена динаміка ємності, імпедансу, активного та реактивного опору препаратів стегнової кістки тварин контрольної й дослідної груп при проведенні мультичаcтотного імпедансометричного тестування.
Загальна спрямованість змін ПЕВ препаратів тварин після 45-добової гіпокінезії на всьому діапазоні частот була такою самою, як і у тварин після 28-добової гіпокінезії, однак ступінь їх виразності був значно більшим. На частоті 104 Гц питома ємність і реактивний опір становили 773,8 і 17,1% відповідно щодо контролю. Вірогідно, хоча не так значно, зменшувалися імпеданс і активний опір (до 26,6 і 26,4% відповідно щодо контролю).
Залежність електричних показників кістки від змін складу та фізико-хімічних властивостей основних компонентів кісткового матриксу. Для моделювання змін водно-мінерального балансу кістки в умовах гіпокінезії використаний метод демінералізації препаратів in vitro. Контролем були недемінералізовані препарати тих самих тварин.
Демінералізація препаратів кістки супроводжувалася зменшенням їхньої вихідної маси на 55% та збільшенням вмісту води на 48%. Істотно змінювалися ПЕВ препаратів. Якщо імпедансу свіжовиділених препаратів сягав 1,5 кОм, то після демінералізації він не перевищував 40 Ом. Активний опір до кінця періоду демінералізації зменшувався більше ніж у 34 рази, а реактивний опір - в 60 разів. Демінералізовані препарати втрачали залежність показників ПЕВ від частоти тестового струму. Очевидно, що в умовах гіпокінезії повної демінералізації кістки ніколи не відбувається, але і сама модель хімічної модифікації кісткової тканини лише з відомим ступенем припущення відображає реальні процеси, що відбуваються в кістці при зменшенні функціонального навантаження. Однак два факти, що випливають із результатів цієї серії досліджень, становлять інтерес і можуть бути використані для пояснення особливостей зміни пасивних електричних властивостей кістки в умовах реальної гіпокінезії: 1 - процеси демінералізації та гіпергідратації кістки є двома взаємозалежними процесами, які протікають паралельно; 2 - гіпомінералізація та гіпергідратація кістки спричинюють збільшення її електропровідності й ємності.
Для дослідження впливу змін фізико-хімічних властивостей органічного матриксу на ПЕВ кісткової тканини використаний метод дозованої термічної денатурації. Встановлено, що при нагріванні препаратів кістки від 37 до 65єС ємність, імпеданс, активний і реактивний опір істотно не змінювалися. Подальше нагрівання препаратів до 100єС супроводжувалося вірогідним збільшенням ємності на 105% і зменшенням на 47% імпедансу, активного й реактивного опору, що свідчило про розвиток денатураційних процесів в органічному матриксі.
Той факт, що зони фазових змін основних електричних показників кістки відзначалися при температурі, що перевищувала 600С і були подібні до зон фазового переходу колагену у процесі його термічної денатурації, дає змогу говорити про наявність зв'язку між ПЕВ кістки та фізико-хімічними властивостями її органічного матриксу і, в першу чергу, колагену.
Кисневий метаболізм і пасивні електричні властивості кістки при гіпокінезії в умовах нормоксії і переривчастої нормобаричної гіпоксії. Напруження кисню (РО2) у литковому м'язі щурів, які перебували в умовах жорсткої 28-добової гіпокінезії в атмосферному повітрі, не перевищувала 13,5±1,7 мм рт.ст., що на 43,7% менше відповідного показника контрольних тварин. РО2 у литковому м'язі щурів, які перебували в умовах жорсткої гіпокінезії та дихали нормобаричними гіпоксичними газовими сумішами, було вірогідно вище і сягало 19,2±1,9 мм рт.ст. (p<0,05).
Споживання кисню (VО2) кістковою тканиною діафізарної частини стегнової кістки контрольних щурів становило 0,09±0,012 млО2·100г-1·хв-1.
У тварин, які перебували в умовах жорсткої 28 добової гіпокінезії в атмосферному повітрі, VО2 не перевищувало 0,03±0,011 млО2·100г-1·хв-1 (p<0,05). При аналогічних режимах гіпокінезії в умовах переривчастої нормобаричної гіпоксії величини споживання кисню практично не відрізнялися від показників контрольної групи тварин. У щурів, які перебували в умовах гіпокінезії та протягом 8 год щодня дихали НГГС, маса стегнової кістки була лише на 15,5% (p<0,05) меншою, ніж у тварин контрольної групи. Діаметр діафіза та просвіту кістковомозкового каналу, а також товщина стінки діафіза не відрізнялися від відповідних показників контрольної групи тварин, хоча загальна тенденція до їх зменшення ще спостерігалася.
Аналіз складу кістки показав, що у щурів, які перебували в умовах гіпокінезії та дихали НГГС, відмінності у вмісті мінеральних речовин і води із тваринами контрольної групи не перевищували 9 і 21% відповідно (p<0,05). При цьому відзначалася характерна тенденція до збільшення вмісту органічних речовин. У щурів, що одержували НГГС на етапі преадаптації й у період дії гіпокінезії, маса та щільність кістки не відрізнялися від маси кістки тварин контрольної групи. Не було статистично достовірних відмінностей і у значеннях основних остеометричних показників, а також у вмісті мінеральних речовин і води. Однак тенденція до збільшення вмісту органічних речовин мала характер статистично значимої закономірності. Якщо вміст органічних речовин у компактній кістці тварин контрольної групи становив 0,52±0,03 мг/мм3, то у тварин дослідної групи він сягав 0,72 ±0,02 мг/мм3 (p<0,05).
Дихання НГГС у період обмеження рухливості щурів хоча й не попереджало повністю порушень ПЕВ кісткової тканини щурів, але істотно зменшувало ступінь їх виразності. Розбіжності у значеннях ємності, імпедансу, активного і реактивного опору між дослідними та контрольними тваринами не перевищували 26,5, 30,6, 30,5 і 22,5% відповідно. Використання НГГС на етапі 14-добової преадаптації та в умовах гіпокінезії призводило до вірогідного зменшення ємності на 42,2%, p<0,05, збільшення імпедансу, активного та реактивного опору на 43,2, 43,3 і 78,5% відповідно, p<0,05. Такі зміни показників ПЕВ кістки цілком закономірно можна пов'язати зі зміною її складу й, у першу чергу, збільшенням вмісту органічних речовин, які, як це відомо, мають більшу поляризаційну здатність і меншу електропровідність.
Виходячи з результатів проведених досліджень, вплив гіпокінезії на біоелектричні властивості кістки можна представити у вигляді наступної схеми:
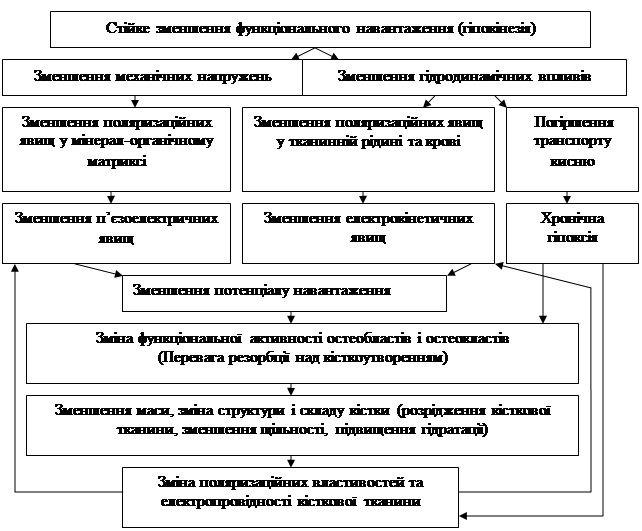

Таким чином, на підставі проведених досліджень можна стверджувати, що відсутність адекватного навантаження на кістку може бути причиною виникнення низки змін з боку клітинних і позаклітинних елементів кісткової тканини, які призводять до порушень її здатності генерувати електричні потенціали у відповідь на механічне навантаження та забезпечувати необхідний рівень біоелектричної регуляції процесів фізіологічної перебудови кістки
ВИСНОВКИ
У дисертації наведено результати досліджень впливу гіпокінезії на біоелектричні властивості стегнової кістки щурів, які отримані методом визначення електричного потенціалу навантаження на поверхні кістки та мультичастотного імпедансометричного тестування в умовах дозованого механічного навантаження й обмеження рухливості. Отримано нові результати про закономірності змін потенціалу навантаження та пасивних електричних властивостей кістки в різних режимах гіпокінезії і переривчастої нормобаричної гіпоксії, які можуть бути використані для розробки нових підходів до діагностики й корекції патології кісткової системи.
1. Електричний потенціал, який виникає на поверхні стегнової кістки щура при механічному навантаженні, зростає в експоненціальній залежності від величини прикладеного зусилля. Найбільший приріст потенціалу на одиницю навантаження забезпечують впливи, що не перевищують 50% маси тіла тварини.
2. У періоді постнатального життя щурів електричний потенціал навантаження стегнової кістки залежить від віку тварини. Амплітуда потенціалу та його приріст на одиницю навантаження найменші у щурів пубертатного періоду, у дорослих - вони сягають максимальних значень, а в періоді вікової інволюції – зменшуються.
3. У дорослих щурів після жорсткої 28-добової гіпокінезії електричний по-тенціал навантаження знижується на 20-25%. Найбільш чітко ці зміни виявляються у діапазоні навантажень, що не перевищують 50% від маси тіла тварини. Це може бути однією з причин низької ефективності профілактичного використання фізичних навантажень при розвитку вікової остеопенії та уповільненого відновлення кісткової тканини в період післядії гіпокінезії.
4. Вікові відмінності пасивних електричних властивостей стегнової кістки щурів визначаються особливостями її складу та структури в різні періоди життєвого циклу. Встановлено наявність вірогідного прямого кореляційного зв'язку між електричною ємністю та вмістом води (r=+0,858) і органічних речовин (r=+0,485), а також між імпедансом, активним і реактивним опором і вмістом мінеральних речовин (r=+0,766; r=+0,765; r=+0,893). Найбільш істотні зміни пасивних електричних властивостей кістки щурів відбуваються в періоди пубертації (1-3 міс) та інволюції (вік тварин перевищує 18 міс).
5. Жорстке тривале обмеження рухливості щурів призводить до зменшення маси, щільності та збільшення ступеня гідратації кістки. Для розгорнутої картини індукованої гіпокінезією остеопенії притаманно зменшення імпедансу, активного й реактивного опору і значне збільшення ємності кісткової тканини.
6. Критичним етапом у зміні пасивних електричних властивостей кістки при низькому функціональному навантаженні є підвищення гідратації кісткової тканини, що призводить до значного збільшення її електропровідності. Наявність тісного зворотного кореляційного зв'язку між вмістом води та мінералів у кістковій тканині (r=-0,890) дозволяє використати показник рівня гідратації як додатковий критерій ступеня її демінералізації.
7. Жорстка гіпокінезія зменшує напруження кисню в недостатньо навантажених м'язах і швидкість споживання кисню кістковою тканиною. Переривчаста нормобарична гіпоксія попереджає істотні зміни цих показників та активує анаболічні процеси у кістковій тканині, про що свідчить збільшення вмісту органічних речовин у кістковому матриксі.
8. Переривчаста нормобарична гіпоксія зменшує прояви індукованої гіпокі-незією остеопенії та змін пасивних електричних властивостей кісткової тканини. Максимальний остеопротекторний ефект виявлено після впливу газових сумішей з низьким РО2 на етапі преадаптації та у період обмеження рухливості.
СПИСОК ПРАЦЬ, ОПУБЛІКОВАНИХ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
1. Левашов О.М., Сафонов С.Л. Влияние моделирования микрогравитационной разгрузки задних конечностей на пассивные электрические свойства бедренной кости белых крыс//Пробл. управления и информатики – 2003, №5. -С.122-130. (Особистий внесок здобувача: Моделювання розвантаження задніх кінцівок щурів, проведення досліджень електричних властивостей стегнової кістки, написання статті).
2. Березовский В.А., Левашов О.М., Сафонов С.Л. Пассивные электрические свойства компактной костной ткани в норме и при дефиците механической нагрузки//Укр. мед. альманах. -2003. -Т.6, №2. -С.162-164. (Особистий внесок здобувача: Моделювання дозованої гіпокінезії, проведення досліджень електричних властивостей стегнової кістки, статистична обробка результатів, участь у написанні статті).
3. Березовский В.А., Левашов О.М., Сафонов С.Л. Влияние дозированной гипертермии на пассивные электрические свойства компактной костной ткани//Клін. та експерим. патологія. -2004. -Т.ІІІ, №2,Ч.1. -С.212-214. (Особистий внесок здобувача: Проведення дозованої термічної денатурації кістки та досліджень її електричних властивостей, участь у написанні статті).
4. Березовський В.Я., Левашов О.М., Сафонов С.Л., Левашов М.І., Літовка І.Г. Імпедансометричне тестування компактної кісткової тканини щурів за умов обмеження рухливості//Фізол. журн. -2005. -Т.51, №5. -С.23-30. (Особистий внесок здобувача: Проведення імпедансометричного тестування кісткової тканини, участь у написанні статті).
5. Березовский В.А., Левашов О.М., Сафонов С.Л., Лахин П.В. Мультичастотная импедансометрия состояния костной ткани//Укр. морфол. альманах. -2005. -Т.3, №4. -С.5-10. (Особистий внесок здобувача: Проведення досліджень стану кісткової тканини за методом мультичастотної імпедансометрії, статистична обробка результатів, участь у написанні статті).
6. Левашов О.М., Березовский В.А., Левашов М.І., Сафонов С.Л. Влияние прерывистой нормобарической гипоксии на кислородный метаболизм и биофизические свойства кости при гипокинезии//Укр. мед. альманах. -2007. -Т.10, №5. -С.105-109. (Особистий внесок здобувача: Проведення досліджень споживання кисню кістковою тканиною, статистична обробка даних, участь у написанні статті).
7. Деклараційний патент №750019А, Україна, МКІ А61К 50/00 G01R 17/00. Пристрій для досліджень електричних характеристик біологічних об’єктів: Березовський В.Я., Сафонов С.Л., Левашов О.М.; Заявлено12.06.2003; Опубл.15.12.2006, Бюл. №2. – 4 с. (Особистий внесок здобувача: Участь у розробці технічного завдання на пристрій, проведення лабораторних випробувань, участь у написанні заявки на видачу патенту).
8. Левашов О.М., Сафонов С.Л. Влияние микрогравитации на пассивные электрические свойства кости//Наукові космічні дослідження: Школа-семінар для молодих науковців: Матеріали доповідей. - Жукін, 2003. - К.:ІВЦ Політехніка, 2003. –С.47-49.
9. Березовский В.А., Левашов М.И., Сафонов С.Л., Левашов О.М. Использование метода импедансометрии в остеологии //“Вторинний остеопороз: епідеміологія, клініка, діагностика, профілактика та лікування”, 19-21 березня 2003 р., Київ-Тернопіль. – Пробл. остеології. -2003. –Т.6, №1-2. –С.53-54.
10. Levashov M., Berezovskiy V., Saphonov S., Levashov O. The bone electrical properties in hypokinetic rats//24th Annual International Gravitational Physiology Meeting. -Santa Monica, California, USA, 4-9 May 2003. Abstracts. -P.S. I,NN15.
11. Левашов О.М., Сафонов С.Л. Влияние гипокинезии на состав костного матрикса и пассивные электрические свойства костной ткани//Наукові космічні дослідження: Школа-семінар для молодих науковців: Матеріали доповідей. - Жукін, 2004. -К.:ІВЦ Політехніка, 2003. –С.55-56.
12. Левашов О.М. Спрямована хімічна модифікація кісткової тканини як метод моделювання патофізіологічних змін її електричних властивостей при дефіциті механічного навантаження: Конф. для мол. учених Інституту фізіології ім.О.О.Богомольця НАН України „Перспективні напрями досліджень сучасної фізіології”. Київ, 17-18 листопада 2003 р. //Фізіол. журн. -2004. –Т.50, №3. –С.105-106.
13. Berezovskiy V., Levashov O., Saphonov S. Changes in composition and passive electrical properties of rats compact bone tissue in hypokinesia and normobaric hypoxic stimulation//25th Annual International Gravitational Physiology Meeting. - Moscow, Russia, 6-11 June 2004. Abctracts. P.S. II, NN7.
14. Левашов О.М. Потребление кислорода костной тканью при уменьшении функциональной нагрузки на кость//Наукові космічні дослідження: Школа-семінар для молодих науковців: Матеріали виступів доповідей. - Жукін, 2004. -К.:ІВЦ Політехніка, 2005. –С.26-27.
15. Левашов О.М. Возрастные особенности гидратации компактной кости ткани белых крыс: Тези доп. IV Нац. конгр. геронтологів і геріатрів України. - Київ, 11-13 жовтня 2005р. //Пробл. старения и долголетия -2005. -Т.14, приложение. - С.32
16. Березовский В.А., Левашов М.И., Сафонов С.Л., Левашов О.М., Лахин П.В. Возрастные изменения пассивных электрических свойств костной ткани: Тези доп. IV Нац. конгр. геронтологів і геріатрів України. - Київ, 11-13 жовтня 2005 р.//Пробл. старения и долголетия -2005. -Т.14, приложение. - С.82.
17. Березовський В.А., Левашов О.М., Сафонов С.Л., Левашов М.І., Безчасна В.О. Склад і біоелектричні властивості компактної кістки білих щурів у різні періоди постнатального онтогенезу: Матеріали XVII з‘їзду Укр. фізіол. т-ва з міжнарод. участю, Чернівці, 18-20 травня 2006 р. //Фізіол. журн. –2006. –Т.52, №2. –С.213.
18. Levashov O.M., Saphonov S.L., Levashov M.I. The effects of normobaric hypoxic preadaptation on bone electrical properties and bone composition in hypokinetic rats//VIII World Congress International society for Adaptive Medicine (ISAM), Moscow, Russia, June 21-24, 2006. Abstracts. - II-4.16. –P.91.
19. Березовский В.А., Левашов О.М., Сафонов С.Л., Левашов М.И. Stress generated potential (SGP) как индикатор состояния кости//Материалы V Международ. симпоз. “Актуальные проблемы биофизической медицины”, Киев, 17-19 мая 2007 г. – С. 21-22.
АНОТАЦІЯ
Левашов О.М. Вплив гіпокінезії на біоелектричні властивості кістки. - Рукопис. Дисертація на здобуття наукового ступеня кандидата медичних наук за фахом 14.03.04 - патологічна фізіологія. - Інститут фізіології ім. О.О. Богомольця НАН України, Київ, 2008.
У дисертації наведено результати досліджень впливу низького функціонального навантаження на біоелектричні властивості кістки, які отримано методом відведення потенціалу навантаження (ПН) з поверхні стегнової кістки щурів лінії Вістар та її мультичастотного імпедансометричного тестування в умовах дозованого механічного навантаження та жорсткого 28- і 45-добового обмеження рухливості. Встановлено, що гіпокінезія вірогідно зменшує ПН, особливо у діапазоні навантажень фізіологічного рівня. Розвиток гіпокінетичної остеопенії супроводжується зменшенням імпедансу, активного й реактивного опорів і значним збільшенням ємності кістки. Жорстка тривала гіпокінезія зменшує напруження кисню в ненавантажених м'язах і швидкість споживання кисню кістковою тканиною. Використання переривчастої нормобаричної гіпоксії (ПНГ) зменшує порушення кисневого метаболізму та активує анаболічні процеси в кістковому матриксі, що призводить до покращення пасивних електричних властивостей кістки. Найбільший остеопротекторний ефект спостерігався при використанні ПНГ на етапі преадаптації і всього періоду обмеження рухливості. Отримані результати про закономірності змін активних і пасивних електричних властивостей кістки в умовах гіпокінезіїі можуть бути використані для розробки нових методів діагностики та корекції патології кісткової системи.
Ключові слова: кістка, гіпокінезія, потенціал навантаження, пасивні електричні властивості.
АННОТАЦИЯ
Левашов О.М. Влияние гипокинезии на биоэлектрические свойства кости. – Рукопись. Диссертация на соискание ученой степени кандидата медицинских наук по специальности 14.03.04 – патологическая физиология. – Институт физиологии им. А.А. Богомольца НАН Украины, Киев, 2008.
В диссертации приводятся результаты исследований влияния низкой функциональной нагрузки на биоэлектрические свойства кости, полученные методом отведения потенциала с поверхности бедренной кости и мультичастотного импедансометрического тестирования препаратов диафизарной части бедренной кости крыс линии Вистар в условиях дозированной механической нагрузки и жесткой 28- и 45-суточной гипокинезии. Получены новые данные о закономерностях изменений активных и пассивных электрических свойств кости в условиях низкой функциональной нагрузки, которые могут быть использованы для разработки неинвазивных методов диагностики и коррекции патологии костной системы. Установлено, что при ступенчатом увеличении механической нагрузки на кость, величина электрического потенциала, возникающего на поверхности кости в области ее максимальной деформации, возрастает в экспоненциальной зависимости. Наибольший прирост величины потенциала на единицу нагрузки имеет место при нагрузках физиологического уровня. В условиях стереотипной функциональной нагрузки межиндивидуальные вариации потенциала нагрузки бедренной кости крыс в значительной степени определяются возрастными изменениями состава и структуры костной ткани. Величина ПН у крыс пубертатного возраста на порядок меньше, чем у взрослых крыс. У крыс, вступивших в период старческой инволюции, ПН начинает вновь уменьшаться. Амплитуда и величина ПН, приходящаяся на единицу нагрузки, у крыс, находившихся в условиях жесткой 28-суточной гипокинезии, были на 20-25% меньше, чем у контрольных животных. Эти различия были наиболее отчетливо выражены при загрузках, достигавших 30% и 50% от массы тела крысы. Снижение эффективности биоэлектрической регуляции физиологической перестройки костной ткани может быть одной из причин низкой эффективности физических нагрузок при развитии возрастной остеопении и замедленного восстановления костной ткани в периоде последействия гипокинезии. Результаты мультичастотного импедансометрического тестирования показали, что пассивные электрические свойства компактной кости половозрелой крысы в условиях стереотипной функциональной нагрузки имели выраженную зависимость от частоты тестирующего тока. Максимальные значения реактивного сопротивления, а следовательно, и степени поляризации костной ткани, регистрировались на частоте 10000 Гц. Анализ результатов исследований показал наличие достоверной прямой корреляционной связи электрической емкости с содержанием воды (r=+0,858) и органических веществ (r=+0,485), а также импеданса, активного и реактивного сопротивления с содержанием минеральных веществ (r=+0,766; r=+0,765; r=+0,893). Установлено, что пассивные электрические свойства бедренной кости крыс в различные периоды постнатального развития определяются особенностями возрастной динамики ее состава и структуры.
Наиболее существенные изменения пассивных электрических свойств кости крыс происходят в периоды пубертации (1-3 мес) и инволюции (старше 18 мес), т.е. в периоды наиболее выраженных изменений массы, линейных размеров, степени минерализации и гидратации кости. Жесткая 28- и 45-суточная гипокинезия приводила к уменьшению массы, минеральной плотности и увеличению степени гидратации кости. Развернутая картина гипокинетической остеопении характеризовалась уменьшением импеданса, активного и реактивного сопротивления и значительным увеличением емкости кости. Установлено, что критическим этапом в изменении пассивных электрических свойств кости при низкой функциональной нагрузке является повышение гидратации костной ткани, что приводит к значительному увеличению ее электропроводности. Наличие тесной обратной корреляционной связи между содержанием воды и минералов в костной ткани (r=-0,890) позволяет использовать показатель гидратации в качестве дополнительного критерия степени ее деминерализации. Жесткая 28-суточная гипокинезия уменьшала напряжение кислорода в ненагруженных мышцах и снижала скорость потребления кислорода костной тканью. Использование прерывистой нормобарической гипоксии на протяжении периода ограничения подвижности уменьшало выраженность нарушений кислородного метаболизма, что приводило к активации анаболических процессов и увеличению содержания в костном матриксе органических веществ. Прерывистая нормобарическая гипоксия уменьшала проявления остеопении и нарушений пассивных электрических свойств кости в условиях жесткой гипокинезии. Максимальный остеопротекторный эффект наблюдается при использовании прерывистой нормобарической гипоксии на этапе преадаптации и периода ограничения подвижности.
Ключевые слова: кость, гипокинезия, потенциал нагрузки, пассивные электрические свойства.
ANNOTATION
Levashov O.M. Effects of hypokinesia on bone bioelectrical properties. - Manuscript. Dissertation on the candidate of medical sciences degree competition on the specialty 14.03.04 - pathological physiology. - O.O. Bogomoletz Institute of Physiology of the National Academy of Science of Ukraine, Kyiv, 2008. The dissertation is devoted to studying of the bone bioelectric properties at the different loading and dosed hypokinesia. The methods of stress generated potential (SGP) taking from the fresh femur bone surface and bone multi-frequency bioelectrical impedance measurements were used in 233 mail Vistar rats. It was set that hard limitation of mobility during 28- and 45-day's for certain diminished of the SGP amplitude especially in the range of physiology level loadings. It was exposed, that hard hypokinesia decreased bone mass and mineral content in bone tissue. The mean of bone hydratation increased. Hypokinetic osteopenia is accompanied with the diminishing of impedance, active and reactive resistances value and considerable increase of bone electrical capacity. The oxygen tension in unloaded muscles and bone oxygen consumption diminished too. The intermittent normobaric hypoxia (INH) prevented of the oxygen metabolism disturbances and activated the anabolic processes in bone tissue. The bone passive electrical properties were improved too. The maximal osteoprotection effect was got in experiments when INH was used for 14 days of preadaptation period and for all period of hypokinesia. The results of this study may be used for development of new noninvasive diagnostic and correction methods of the bone system pathology.
Keywords: bone, hypokinesia, stress generated potential, passive electric properties.
Похожие работы
... інфаркт міокарда. Діагноз підтверджує підвищення вмісту в крові креатин-фосфокінази (зокрема її МВ-фракції), міоглобіну, С-реактивного протеїну, фібриногену та продуктів його розпаду. 2.2 Методи обстеження хворих при захворюваннях органів дихання Велике значення в діагностиці захворювання легень має топографічна і порівняльна перкусія та аускультація легень. У діагностиці захворювань ...
... анурію, що є наслідком блокади канальців продуктами розпаду еритроцитів. Це призводить до швидкого накопичення в крові азотистих шлаків і створює реальну загрозу життю хворого. 5. Професійні отруєння сільськогосподарськими пестицидами і мінеральними добривами Пестициди - хімічні речовини, що використовуються для захисту рослин і тварин від бактерій, вірусів, спор, грибів, комах, гризунів, а ...
... різних умовах; • узагальнюючим критерієм оцінки рівня досконалості володіння вправою є ступінь надійності її використання в життєдіяльності. 3.2 Засоби і методи розвитку рухових якостей дітей 3.2.1 Використання різних методів для розвитку рухових якостей дітей В теорії і практиці фізичного виховання розрізняють два підходи до навчання вправ: загалом, або по частинах з наступним об'єднанням ...
... на одній із сторін, в залежності від положення голови, наявності сколіозної дуги і нахилу тазу. Розділ 2 Особливості фізичної реабілітації при захворюванні невриту лицьового нерва 2.1 Адаптаційні можливості організму людини до занять фізичною культурою Фізична культура - єдиний засіб для оздоровлення організму і позбавитись хронічних захворювань. ЛФК– складова частина медичної реабілітації ...
0 комментариев