Харківський Національний університет імені В.Н. каразіна
Адіб Халаф Фадел АлАмуш
УДК 577.352+577.182.26
Вплив граміцидину S на агрегацію тромбоцитів і стійкість мембран еритроцитів до гемолізу
03.00.13 - фізіологія людини i тварин
Автореферат
дисертації на здобуття наукового ступеня
кандидата біологічних наук
Харків - 2008
Дисертацією є рукопис.
Робота виконана в Харківському національному університеті імені В.Н. Каразіна Міністерства освіти і науки України
Науковий керівник: доктор біологічних наук, професор
Перський Євген Ефроїмович,
Харківський національний університет імені В.Н.Каразіна, завідувач кафедри біохімії
Офіційні опоненти: доктор біологічних наук, професор
Гордієнко Євген Олександрович,
Інститут проблем кріобіології і кріомедицини НАН України,
завідувач відділу низькотемпературного консервування
доктор біологічних наук, професор
Клімова Олена Михайлівна,
Державне підприємство Інститут хірургії АМН України,
завідувач діагностичної лабораторії
Захист відбудеться 09.04.2008 року о 15 годині на засіданні спеціалізованої вченої ради Д 64.051.17 у Харківському національному університеті імені В.Н. Каразіна МОН України, 61077, м. Харків, пл. Свободи, 4, ауд. ІІІ-15.
З дисертацією можна ознайомитися в Центральній науковій бібліотеці Харківського національного університету імені В.Н. Каразіна МОН України: 61077, м. Харків, пл. Свободи, 4.
Автореферат розісланий 07.03.2008 року
Вчений секретар
спеціалізованої вченої ради
ЗАГАЛЬНА ХАРАКТЕРИСТИКА РОБОТИ
Актуальність теми. Взаємодія біологічно активних сполук з клітинними мембранами лежить в основі протікання і регуляції великої кількості фізіологічних процесів, і її вивчення є однією з найважливіших проблем біології.
Хоча сучасна фізіологія досягла суттєвих успіхів у дослідженні цієї проблеми, багато ще у ній залишається незрозумілим. Це стосується і молекулярних механізмів взаємодії ряду антибіотиків, зокрема, граміцидину S, з клітинними мембранами.
Граміцидин S має різнобічну біологічну активність. Подавляючи грампозитивні та, дещо слабкіше, грамнегативні бактерії, він в той же час згубно діє на клітини тваринного организму. Саме тому він використовується в медицині лише як зовнішній лікарський засіб [Гаузе Г.Ф., 1952, Арнаудов Г.Д., 1978 ].
Однак, незважаючи на більш ніж півстолітню історію використання антибіотику після його повного хімічного синтезу, чітких уявлень про причини та механізми його біологічної активності досі не існує.
Усі наявні уявлення зводяться лише до природного припущення про те, що руйнування фосфоліпідних мембран при взаємодії з граміцидином S є результатом його особливих властивостей, характерних для будь-яких дефектоутворюючих часток на межі мембрана - оточуючий розчин [ Edidin V, 2002].
Практично не існує навіть феноменологічного опису загальних рис і особливостей взаємодії антибіотика з різними типами тваринних клітин. До цього часу дослідження проводились, в основному, на модельних фосфоліпидних мембранах, а ефекти граміцидину S оцінювались лише за його гемолітичною дією [Гаузе Г.Ф.,1952; Егоров Н.С.,1994] . В той же час практично не вивчались особливості дії граміцидину S на мембрани нативных клітин. Немає відомостей про вплив ліпідного складу плазматичних мембран на характер біологічної активності граміцидину S. Невідома роль структурного стану мембран в їх стійкості по відношенню до нього. До сих пір за межами уваги дослідників залишались також, як правило, характер і ступінь впливу антибіотика на структурно-функціональні властивості клітин еукаріот.
Між тим, необхідність таких досліджень визначається, як мінімум, двома причинами По-перше, такі відомості важливі для розуміння загальних принципів взаємодії сполук, подібних до граміцидину S, з мембранами клітин. По-друге, вони, в принципі, можуть бути корисними для з’ясування шляхів зниження активності граміцидину S по відношенню до тваринних клітин без втрати його протимікробної активності.
Для вирішення цих проблем доцільним є вивчення дії граміцидину S на клітини крові, насамперед, на тромбоцити і еритроцити. Це визначається головним чином тим, що при потраплянні в організм граміцидина S він неминуче повинен взаємодіяти з цими клітинами. Тромбоцити та еритроцити, в свою чергу, відіграють найважливішу роль в процесах гемостаза та транспорта сполук відповідно. Серед цих процесів головними є агрегація тромбоцитів і постачання в тканини кисню та вилучення з них вуглекислого газу. Крім того, на цей час накопичені фундаментальні відомості про структурну організацію, властивості та функції цих клітин [Murrer E.H., Day H.I., 1974; Walsh P.N., 1974; McMillan D.C., Powell C., Bowman Z.S., 1995; Gnatenko D.V., Perrotta P.L., Bahou W.I., 2006]. Тому вони є хорошими та досить зручними моделями для вивчення дії граміцидину S, оскільки характер їх змін при цьому дозволить зробити висновки про механізми біологічної активності антибіотика.
В зв’язку з цим актуальним є вивчення впливу граміцидину S на агрегацію тромбоцитів і стійкість еритроцитів до гемолізу in vitro у середовищах різного іонного складу і при модифікації структурного стану мембран фізичними і хімічними факторами.
Зв’язок роботи з науковими програмами, планами, темами. Робота виконана відповідно з планом науково-дослідних робіт Харківського національного університету імені В.Н. Каразіна: в рамках держбюджетних тем "Закономірності фізико-біохімічних та структурно-функціональних механізмів адаптації біологічних сполук до несприятливих факторів середовища в онтогенезі" (№ держреєстрації 0103U005734) та “Механізми впливу фізичних факторів і біологічно активних речовин на ДНК, білки та біомембрани" (№ держреєстрації 0197U016741)
Мета і задачі дослідження. Метою роботи було встановлення закономірностей агрегації тромбоцитів та гемолізу еритроцитів під впливом граміцидину S за умов дії різних факторів, що змінюють хімічний склад та структурний стан мембран.
Для вирішення цієї мети були поставлені наступні задачі:
1. Дослідити концентраційну залежність впливу граміцидину S на зміни форми тромбоцитів.
2. Вивчити концентраційну залежність впливу граміцидину S на АДФ-індуковану агрегацію тромбоцитів за умов дії різної концентрації Са2+ і Mg2+ та оцінити енергію активації цього процесу.
3. Дослідити вплив різних фізико-хімічних чинників (температура, іонізуюче опромінення, перекисне окислення ліпідів мембран) на АДФ-індуковану агрегацію тромбоцитів.
4. Вивчити концентраційну залежність гемолізу еритроцитів під дією граміцидину S та оцінити енергію активації цього процесу.
5. Дослідити вплив ліпідного складу та перекисного окислення ліпідів мембран еритроцитів на їх гемоліз за дією граміцидину S.
Об'єкти дослідження - комплекси граміцидину S з мембранами тромбоцитів і еритроцитів.
Предмет дослідження – агрегація тромбоцитів та гемоліз еритроцитів під впливом граміцидину S.
Методи дослідження – оптичний метод реєстрацій агрегації тромбоцитів та гемолізу еритроцитів, спектрофотометрія, полум'яна фотометрія, полярізаційно-флуоресцентна мікроскопія, тонкошарова хроматографія, визначення продуктів ПОЛ, методи статистичного аналізу.
Наукова новизна одержаних результатів. У роботі було вивчено вплив граміцидину S на агрегацію тромбоцитів і гемоліз еритроцитів в умовах модифікації плазматичних мембран г-опроміненням та біологічно активними сполуками. Вперше встановлено, що взаємодія граміцидину S з інтактними тромбоцитами призводить до їх набрякання і зміни форми, подібної до такої, що відбувається під впливом відомих індукторів агрегації. Цей процес є Са2+, Mg2+ - залежним.
Вперше продемонстровано, що граміцидин S руйнує агрегати тромбоцитів, що утворюються під впливом індукторів агрегації, не руйнуючи при цьому плазматичну мембрану клітин.
Встановлено, що зменшення впорядкованості ліпідів у плазматичній мембрані тромбоцитів та еритроцитів при їх г-опроміненні чи перекісному окисленні ліпідів веде до полегшення вбудовування граміцидину S до мембрани, але, водночас, призводить й до зменшення міцності зв'язування антибіотика до неї.
Показано, що ступінь і швидкість дезагрегації тромбоцитів граміцидином S найбільші в області структурних фазових переходів ліпідів мембран (180С – 330С). При вищих температурах ці параметри дезагрегації знижуються, що свідчить про більшу стійкість агрегатів при температурі тіла.
На еритроцитах здорових донорів і людей з серцево-судинними захворюваннями вперше доведено, що біологічна активність граміцидину S залежить від вмісту холестерину та відношення холестерин/фосфоліпіди в мембранах. Його збільшення знижує гемолітичну дію антибіотика по відношенню до цих клітин.
Практичне значення одержаних результатів. Одержані експериментальні результати виявили характер взаємодії граміцидину S з інтактними тромбоцитами і еритроцитами - набрякання, зміна форми і руйнування агрегатів перших і гемоліз других, а також особливості цих процесів в залежності від структурного стану клітинних мембран – рівня їх розпорядкованості під дією іонізуючого опромінення, перекисного окислення ліпідів і відношення холестерин/фосфоліпіди. Отримані дані розширюють уявлення про механізми взаємодії пептидних антибіотиків з клітинними мембранами і можуть бути використані при розробці штучних антибіотиків, не руйнуючих тваринні клітини. Їх можна також залучати при читанні загальних і спеціальних курсів лекцій «Біоорганічна хімія», «Біохімія», «Клітинна фізіологія» тощо у вищих навчальних закладах.
Особистий внесок здобувача. Вибір теми дисертаційної роботи, постановка мети і задач, вибір об'єктів та методів досліджень, обговорення та інтерпретація одержаних експериментальних результатів і формулювання висновків було здійснено разом з науковим керівником.
Автор особисто опрацював фахову літературу за темою дисертації, виконав експериментальні дослідження і провів статистичний аналіз одержаних результатів.
Апробація результатів дисертації. Основні положення роботи були представлені і обговорені на: конференції молодих вчених біологічного факультету Харківського національного університету імені В.Н. Карабіна (2005), І Міжнародній науковій конференції студентів та аспірантів «Молодь та поступ біології» (Львів, 2005), засіданні Харківського біохімічного товариства (2006), ІХ Українському біохімічному з'їзді (Харків, 2006), ІV з'їзді Українського біофізичного товариства (Донецьк, 2006).
Публікації. За матеріалами дисертації опубліковано 7 робіт, у тому числі 4 статті у фахових наукових журналах та 3 в матеріалах і тезах конгресів, з'їздів, конференцій, які повністю відбивають основний зміст дисертації.
Структура та обсяг дисертації. Дисертація викладена на 148 сторінках машинописного тексту і складається з вступу, огляду літератури, матеріалів та методів досліджень, результатів досліджень та їх обговорення, висновків. Список використаних літературних джерел містить 218 найменувань. Робота ілюстрована 21 рисунком і 14 таблицями.
ОСНОВНИЙ ЗМІСТ РОБОТИ
ОГЛЯД ЛІТЕРАТУРИ
В огляді літератури представлені дані про структуру, властивості і біологічну дію граміцидину S на бактеріальні і тваринні клітини. Розглянуті сучасні уявлення про основи його біологічної активності, а також не з’ясовані ще молекулярні механізми взаємодії антибіотика з нативними мембранами.
МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕННЯ
Дослідження проведені на тромбоцитах і еритроцитах здорових донорів і людей з серцево-судинними захворюваннями (атеросклероз і післятромбофлебічний синдром) обох статей віком 41 – 60 років.
Збагачену тромбоцитами плазму (ЗТП) та еритроцитарну масу одержували з крові методами [MacCenzie R.D., 1974] та [Grossman S.J. and Jollow D.J.,1992] відповідно. В усіх експериментах кількість клітин в ЗТП становила, в середньому, ~ 2,5 Ч 108 / мл, а в суспензії еритроцитів ~ 106 / мл. Кількість клітин у зразках підраховували в камері Горяєва. Тромбоцити фарбували метиленовим синім.
Отримані зразки зберігали у скляному силикованому посуді і всі вимірювання проводили на протязі 3 – 5 годин після приготування і не пізніше 24 годин після отримання крові.
Агрегацію тромбоцитів викликали додаванням до 0,9 мл ЗТП 0,1 мл розчину АДФ (Reanal, Угорщина) в концентрації 2 Ч 10 -5 М.
Для дослідження впливу граміцидину S на агрегацію тромбоцитів і гемоліз еритроцитів 2-% розчин антибіотика в етанолі (фармацевтичний препарат, Фармахим, РФ), розводили розчином 0,15 М NaCl, рН 7,4 в 30 – 50 разів до концентрації, в якій він додавався до ЗТП та суспензії еритроцитів. Попередні контрольні досліди показали, що етанол в концентрації до 1% не впливає на агрегацію тромбоцитів і гемоліз еритроцитів.
Процеси агрегації тромбоцитів і гемолізу еритроцитів в різних експериментах вивчали за змінами світлопропускання (Т), або оптичної густини (D) [Лопатин В.Н.,Седько Ф.Я.,1988]. Вимірювання проводили на фотоелектроколориметрі ФЕК-М з максимумами світло пропускання 540 нм для ЗТП і 670 нм для еритроцитарної суспензії. Запис кінетики досліджуваних процесів проводили автоматично на самописці ЕПП-09М.
За одержаними кінетичними кривими визначали ступінь і швидкість цих процесів. Ступінь агрегації і дезагрегації тромбоцитів та гемолізу еритроцитів розраховували, як різницю між початковими і поточними значеннями світлопропускання (∆Т), або оптичної густини (∆D) і виражали в абсолютних величинах. Для обох типів клітин швидкість досліджуваних процесів визначали за тангенсом кута нахилу дотичної до відповідної ділянки кінетичної кривої на її піввисоті. Для еритроцитів виміряли також час їх повного гемолізу.
По кривим швидкості гемолізу еритроцитів і дезагрегації тромбоцитів в діапазоні температур 40С- 440С за рівнянням Ареніуса розраховували енергії активації цих процесів.
Структурні властивості мембран тромбоцитів і еритроцитів змінювали шляхом індукції перекисного окислення ліпідів (ПОЛ). Для цього ЗТП і суспензію еритроцитів інкубували протягом 15 хв з 0.5 М аскорбінової кислоти і 12 мкМ солі Мору. Інгібування ПОЛ здійснювали розчином (50 мкг/мл) б - токоферолу в гексані (Sigma, США). Інтенсивність ПОЛ тромбоцитарних і еритроцитарних мембран оцінювали за накопиченням в зразках сполук малонового діальдегіду (МДА) по реакції з 2-тіобарбітуровою кислотою. Концентрацію МДА розраховували на основі коефіцієнту його молярної екстинкції (е = 1,53 Ч 105 М-1 см-1 Ч л) за інтенсивністю поглинання при л = 532 нм [EsterbauerH., Cheeseman K.H., 1990].
Концентрацію білка в зразках визначали за методом Лоурі [Lowry O. еt al., 1955].
Тромбоцити також опромінювали г - випромінюванням 60Со дозами 2,58 Ч 10-4 Кл/кг і 6,45 Ч 10-3 Кл/кг на установці «Исследователь» при потужності випромінюваної дози в активній зоні 5,16 Ч 10-2 Кл/кг/хв.
Для зв’язування вільних іонів плазми Са2+ і Мg2+ ЗТП інкубували відповідно з ЕГТА і ЕДТА (Sigma, США) в концентраціях 0,05 – 2 мМ протягом 2 хвилин. Концентрацію Са2+ і Мg2+ в зразках виміряли на полум'яному спектрофотометрі СФП-1.
Процеси утвлрення і розпаду тромбоцитарних агрегатів контролювали мікрофотографічно цифровою камерою Cannon EOS 300D на поляризаційно – флуоресцентному мікроскопі м POLAM-L при 100-кратному збільшенні.
Мембрани еритроцитів отримували за методом [Grossman S.J., Jollow D.J.,1992]. Ліпіди мембран еритроцитів екстрагували за методом [Bligh E.G., Dyer W.J., 1959].
Фракціонування загальних ліпідів проводили тонкошаровою хроматографією на силікагелевих платівках марки Sulufol UV 254 (Sklarny Kavalier, Чехія). Розподіл фосфоліпідів проводили методом тонкошарової хроматографії на платівках Silicagel
Wolem TLC (Германія).
Ідентифікацію ліпідів виконували за допомогою стандартів (“Sigma”, США). Кількісний вміст фракцій проведено відповідно до стандартних методик (Фіндлей Дж., Еванз У., 1990).
Якщо про це не зазначено спеціально, всі експерименти проводили при кімнатній температурі (t = 200С).
Для статистичної обробки результатів використовували критерій вірогідності Стьюдента та Манн-Уітні. Вірогідними вважали результати с р<0,05. Криві, що представлені на рисунках, є типовими для серії повторних дослідів (не менше, ніж три в кожній серії).
РЕЗУЛЬТАТИ ДОСЛІДЖЕНЬ ТА ЇХ ОБГОВОРЕННЯ
Дослідження впливу граміцидину S на інтактні тромбоцити.
З метою дослідження особливостей впливу граміцидину S на інтактні тромбоцити були вивчені часові залежності світлопропускання ЗТП в присутності різних концентрацій антибіотика. Динаміка світлопроскуння ЗТП після додавання до неї граміцидину S являє собою криву з максимумом (Рис.1). Збільшення світлопропускання, про яке свідчить висхідна частина кривої, є наслідком зміни розсіювачої здібності поверхні тромбоцитів, що відбувається за рахунок зміни їх розміру і форми. Цей ефект повністю аналогічний першій стадії дії класичних індукторів агрегації, коли зміни світлопропускання ЗТП виникають за рахунок активації тромбоцитів – їх набрякання, зміни форми і звільнення рецепторів до фібриногену. Їх взаємодія з молекулами останього утворює в подальшому фібриногенові містки, які з’єднують окремі тромбоцити в агрегати [Seiss W., 1989; Blockmans et at al, 1995; Тomasiak M.et al., 2004].
Зниження світлопропускання ЗТП після досягнення максимуму (низхідна частина кінетичної кривої) відображає зворотний процес – частковий розпад агрегатів, що формуються під впливом індукторів, в умовах in vitro [Seiss W., 1989; Сабаль ?,?, Черенкевич ?,?, 1990; Тomasiak M.et al., 2007].
Таким чином, дія граміцидину S на інтактні тромбоцити аналогічна дії індукторів агрегації і полягає в зміні їх форми і активації.
Наступна дія індуктора агрегації АДФ на тромбоцити, що були активовані граміцидином S, призводить до подальшого розвитку агрегації (Рис.1). Але ступінь агрегації при постійній концентрації АДФ зменшується з підвищенням концентрації антибіотика (Табл..1). Це явище можна зрозуміти, виходячи з того, що існує критична концентрація граміцидину S, після котрої він починає руйнувати тромбоцити. Дійсно, як видно з рис. 1, при концентрації 7,8 мкмоль/л, шо відповідає 14,94 Ч106 молекул граміцидину S, які припадають на один тромбоцит, низхідна частина кінетичної кривої перетинає початковий рівень свїтлопропускання. Оскільки він відповідає нативним клітинам, негативна величина світлопропускання свідчить про руйнування частини тромбоцитів в ЗТП [Latimer P. et al, 1977]. Це і є причиною зменшення ступеня агрегації під дією АДФ. Час початку руйнування тромбоцитів зменшується з підвищенням вмісту граміцидину S в ЗТП після досягнення ним критичної концентрації (Табл.1).
Табл.1.
Концентраційні залежності впливу граміцидину S на зміни форми тромбоцитів і ступінь їх агрегації наступної дії АДФ.
| Показник | Концентрація граміцидину S, мкмоль/л | |||
| 5,4 | 6,2 | 7,8 | 9,1 | |
| Кількість молекул граміцидину S / тромбоцит Ч106 | 13,01 ± 0,551 | 14,94 ± 0,629 | 18,79 ± 1,122 | 21,92 ± 1,538 |
| Максимальна зміна форми тромбоцитів після додання граміцидину S відносно базового рівня - ∆Т,% | 6,38* ± 0,515 | 7,68*, ** ± 0,608 | 6,0** ±0,49 | 6,0 ± 0,49 |
| Максимальна зміна форми тромбоцитів через 7,5 хвилин після додання граміцидину S відносно базового рівня - ∆Т,% | 4,13* ± 0,393 | 1,88*, ** ± 0,147 | - 0,75*,** ± 0,061 | - 2,25*,** ± 0,153 |
| Час початку руйнування тромбоцитів після додання граміцидину S, с | Не руйнуються | Не руйнуються | 392 | 254 |
| Ступінь агрегації тромбоцитів після послідовного додання граміцидину S і АДФ - ∆Т,% | 20,3*, ** ± 2,31 | 15,0*, ** ± 1,26 | 12,0* ± 0,98 | 11,6* ± 0,85 |
Примітка:* - вірогідно відносно мінімальної концентрації граміцидину S (р < 0,05)
** - вірогідно відносно попередньої концентрації граміцидину S (р < 0,05)
Суттєвим є питання про роль іонів Са2+ і Мg2+ у взаємодії граміцидину S з тромбоцитами. Іони Са2+ відіграють важливу роль в процесі агрегації тромбоцитів, оскільки вони беруть участь у формуванні центру зв’язування рецепторів до фібриногену з його молекулами [Sanerheber R.D. et al, 1980; RinkT.J., 1988]. В той же час немає повного розуміння відносно природи цього кальцію – позаклітинний він, або внутріклітинний, який міститься у кальцієвих депо тромбоцитів [Тomasiak M.et al., 2007]. Щодо іонів Мg2+, то в широкому діапазоні концентрацій вони не впливають на агрегацію, а у
концентраціях вищих, ніж фізіологічні, – пригнічують її. Що ж стосується впливу малих концентрацій, то й тут гадки дослідників неоднозначні [Kempfert G., Behrends S., 2003].
Тому у діапазоні від малих до середніх концентрацій було вивчено вплив іонів Са2+, а після їх зв’язування за допомогою ЕГТА – доданих іонів Мg2+, на ступінь і швидкість АДФ-індукованої агрегації тромбоцитів. Одержані дані наведені у Табл. 2.
Як видно, при низьких концентраціях іонів Са2+ в середовищі агрегація тромбоцитів практично не відбувається, що може вказувати на позаклітинну природу кальцію, що бере участь у процесі агрегації.
Крім того, наведені дані свідчать, що у безкальцієвому середовищі іони Мg2+ можуть заміщати собою іони Са2+ в ролі кофактору процесу агрегації тромбоцитів.
Табл..2.
Вплив іонів Са2+ і Мg2+ на ступінь (∆D) і швидкість (V) агрегації тромбоцитів
| Са2+ | Мg2+ | ||
| Концентрація, mM | ∆D, o.о. | Концентрація, mM | V, о.о./хв. |
| 0,10 | 0,02 ± 0,015 | 0,1 | 0,42 ± 0,046 |
| 0,25 | 0,04 ± 0,021 | 0,5 | 0,67 ± 0,085*, ** |
| 0,50 | 0,09 ± 0,033 | 1,0 | 0,89 ± 0,107*, ** |
| 0,75 | 0,19 ± 0,041*, ** | 2,0 | 1,21 ± 0,131*, ** |
| 1,0 | 0,30 ± 0,052*, ** | 5,0 | 1,46 ± 0,142*, ** |
| 1,50 | 0,37 ± 0,056* | 10,0 | 1,62 ± 0,148* |
| 2,0 | 0,49 ± 0,070*, ** | 15,0 | 1,58 ± 0,139* |
| 3,0 | 0,51 ± 0,071* | 20,0 | 1,64 ± 0,150* |
| 4,0 | 0,48 ± 0,068* | 25,0 | 1,64 ± 0,150* |
Примітка:* - вірогідно відносно мінімальної концентрації Са2+ і Мg2+ (р < 0,05)
** - вірогідно відносно попередньної концентрації Са2+ і Мg2+ (р < 0,05)
Для з’ясування ролі іонів Са2+ і Мg2+ у взаємодії граміцидину S з інтактними тромбоцитами було проведено дослідження їх агрегації у ЗТП, з якої за допомогою ЕДТА були вилучені іони обох елементів.
На Рис.2 зображені кінетичні криві світлопропускання ЗТП в цих умовах на початкових стадіях зміни форми і активації тромбоцитів. Згідно з цими кривими, при зниженні концентрації Са2+ і Мg2+ в середовищі зміна форми клітин стає менш складною і при повній відсутності обох іонів вони, не активуючись, лише набрякають.
Цей результат підтверджує те, що граміцидин S у концентрації, коли кількість його молекул, що припадають на один тромбоцит, нижче критичної, діє, як типовий індуктор агрегації.
Дослідження впливу граміцидину S на АДФ-індуковану агрегацію тромбоцитів.
На рис.3 зображені часові залежності світлопропускання ЗТП за послідовною дією АДФ і граміцидину S, зіставлені з фотографіями ЗТП на різних стадіях процесу. Додавання граміцидину S до тромбоцитів після завершення АДФ-індукованої агрегації викликає зменшення світлопропускання зразка. Це зменшення, як видно з фотографій, являє собою розпад агрегатів, що утворилися
Хоча механізм руйнування тромбоцитарних агрегатів остаточно ще не з’ясований, можна, однак, припустити таке.
Молекули граміцидину S, вбудовуючись у мембрану, порушують ліпід-ліпідні й ліпід-білкові взаємодії й, імовірно, викликають в мембрані пружне напруження. Міцність білкових містків, що з'єднують тромбоцити в агрегаті, є набагато меншою міцності мембрани, позаяк в ній діють великі гідрофобні сили [Овчинников Ю.А.,1987 ].
Тому напруга, викликана вбудовуванням молекул антибіотика у мембрану, може зніматися за рахунок розривів саме білкових (фібриногенових) містків. При розриві цих зв'язків агрегати будуть розпадатися, при цьому кількість центрів, що розсіюють світло, збільшується, що приводить до зменшення світлопропускання зразка
АДФ; 4 – 5 хвилин після додавання граміцидину S. Концентрація граміцидину S – 4,15 мкмоль/л.
Зв'язування граміцидину S з мембраною клітини є динамічним процесом, який складається з кількох стадій і включає електростатичні – за участю іонів Са2+ й гідрофобні взаємодії з різними хімічними групами мембрани тромбоцитів. Природно, що процеси взаємодії антибіотика з мембранами індивідуальних тромбоцитів і тих, які знаходяться у складі агрегатів, повинні відрізнятись і мати свої особливості. Для з’ясування цих особливостей були виміряні ступінь і швидкість дезагрегації тромбоцитів в залежності від концентрації граміцидину S. Отримані дані наведені в Табл..3.
Як і припускалося, і ступінь і швидкість дезагрегації тромбоцитів за дією граміцидину S зростають з підвищенням його концентрації. Більш цікавим є те, що руйнування тромбоцитарних агрегатів відбувається вже при концентрації антибіотика 8,6 Ч 105 молекул у розрахунку на одну клітину. Це на півтора порядки менше молекул граміцидину S, ніж їх кількість, при котрій починають руйнуватися індивідуальні клітини - (14,94 - 18,79) Ч106, Табл..1.
Така суттєва різниця може бути наслідком того, що при утворенні агрегатів на мембрані клітин, що входять до їх складу, з’являються ділянки з більшою спорідненістю до антибіотика і меншою механічною міцністю
Табл..3
Концентраційні залежності ступеня і швидкості дезагрерації тромбоцитів при дії граміцидину S
| Показник | Концентрація граміцидину S, мкмоль/л | |||
| 2,07 | 4,15 | 8,30 | 16,60 | |
| Кількість молекул граміцидину S / тромбоцит Ч106 | 4,81 ± 0,217 | 9,23 ± 0,341 | 19,92 ± 1,248 | 39,84 ± 2,691 |
| Ступінь дезагрегації тромбоцитів після додавання граміцидину S - ∆Т, % | 8,4 ± 2,15 | 33,3*, ** ± 3,713 | 46,7*, ** ± 4,066 | 71,7*, ** ± 5,810 |
| Швидкість дезагрегації тромбоцитів після додавання граміцидину S - ∆Т % / хв | 1,9 ± 0,13 | 3,4*, ** ± 0,29 | 4,8*, ** ± 0,612 | 7,3*, ** ± 0,732 |
Примітка:* - вірогідно відносно мінімальної концентрації граміцидину S (р < 0,05)
** - вірогідно відносно попередньої концентрації граміцидину S (р < 0,05)
Дослідження впливу граміцидину S на АДФ-індуковану агрегацію тромбоцитів при дії фізичних і хімічних чинників.
В основі взаємодії граміцидину S з мембранами клітин лежать, по суті, хімічні реакції утворення зв’язків між амінокіслотними залишками антибіотика і реакційноспроможними групами ліпідів [Егоров Н.С.,1994]. Не кажучи вже про те, що і хімічні реакції і рухливість ліпідів є температурнозалежними, в області від кімнатної до теиператури тіла мембранні ліпіди зазнають фазових структурних переходів, які змінюють їх реакційні властивості [Оічинников Ю.А.,1987].
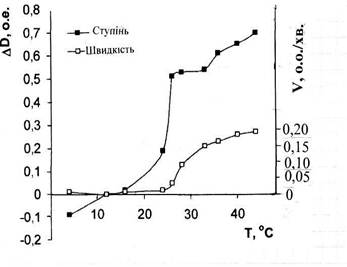
Рис. 4. Температурні залежності ступеня (∆D) і швидкості (V) розпаду агрегатів тромбоцитів при дії граміцидину S.
Тому в цій області слід чекати особливостей у характері взаємодії антибіотика з тромбоцитами.
На рис. 4 приведені температурні залежності оптичних параметрів ЗТП, які відображають і ступінь і швидкість руйнування тромбоцитарних агрегатів в області температур структурних переходів ліпілів.
Як видно, крім звичайного зростання величини обох досліджених параметрів з температурою, в области t = 180С – 330С спостерігається різкий скачок підвищення ступеня і швидкості руйнування тромбоцитарних агрегатів під дією граміцидину S. В цій області величини обох параметрів дезагрегації стають максимальними. При подальшому рості температури це підвищення стає повільнішим, що свідчить про більшу стійкість агрегатів до дії антибіотика при температурі тіла.
Виявлені особливості свідчать, що характер зв’язування граміцидину S з клітинними мембранами в значній мірі залежить від їх структурного стану. Для більш глибокого з’ясування цього явища були вивчені температурні залежності ступеня і швидкості дезагрегації тромбоцитів під дією антибіотика після їх г-опромінення і індукції в мембранах ПОЛ. Отримані дані представлені в Табл.4 і Табл.5.
г-опромінення тромбоцитів в області вивчених температур дозою 2,58 Кл/кг Ч 10-4 приводить до підвищення, а дозою 6,54 Кл/кг Ч 10-3 – до зниження ступеня і швидкості дезагрегації тромбоцитів, причому величина ціх змін росте с температурою. Ця різниця в дії використаних доз, очевидно, є наслідком того, що малі дози випромінювання частково руйнують біополімери мембран, розпорядковуючи, таким чином, їх структуру і, відповідно, механічну міцність. Під впливом же великих доз біополімери можуть зшиватися між собою, підвищуючи тим самим механічні властивості мембран [ Веnderitt M. et al., 1999 ].
Табл..4.
Вплив г-опромінення на температурну залежність ступеня (ДD) та швидкості (V) дезагрегації тромбоцитів при дії граміцидину S
| Показник | Умови експерименту | Доза oпромінення, Кл/кг Ч 10-4 | Т0, С | ||
| 20 | 25 | 30 | |||
| ДD, o.o. | Контроль | - | 0,11 ± 0,031 | 0,23** ± 0,042 | 0,47** ± 0,096 |
| Опромінення | 2,58 | 0,05* ± 0,017 | 0,73*, ** ± 0,118 | 15,27*,** ± 2,72 | |
| 64,50 | 0,08 ± 0,021 | 0,14 ± 0,038 | 6,58*, ** ± 1,83 | ||
| V, о.о./хв | Контроль | - | 0,011 ± 0,031 | 0,023** ± 0,042 | 0,12** ± 0,029 |
| Опромінення | 2,58 | 0,007* ± 0,002 | 0,064*, ** ± 0,019 | 4,22*, ** ±1,38 | |
| 64,50 | 0,012 ± 0,028 | 0,012* ± 0,031 | 2,94*, ** ± 0,75 | ||
Примітка:* - вірогідно відносно контролю (р < 0,05)
** - вірогідно відносно попередньої температури (р < 0,05)
Індукція ПОЛ в мембранах тромбоцитів значно підвищує ступінь руйнування тромбоцитарних агрегатів під дією граміцидину S при всіх досліджених температурах. Однак в умовах експерименту вклад ПОЛ у кумулятивний ефект цього підвищення – сумісно з температурою – знижується з ростом останньої. Як видно з Табл. 5, при 100С він становить 112%, а при 360С – лише 12%. В усякому разі підвищення ступеня дезагрегації тромбоцитів може свідчити про полегшення вбудування антибіотика в клітинну мембрану за рахунок того, що окислення ліпідів приводить до порушення її структурної впорядкованості [Marsh S.A., 2006] і, як слідство, зниження механічної міцністі.
Доданий до ЗТП б-токоферол, який інгібує процеси ПОЛ (Табл.5), діє протилежним напрямом і суттєво зменшує біологічну активність граміцидину S.
Табл.5.
Вплив індукованого ПОЛ та б-токоферолу на температурну залежність ступеня дезагрегації тромбоцитів (ДТ) при дії граміцидину S
| Показник | Умови експерименту | Концентрація МДА,нмоль/109 тромбоцитів | Т0, С | |||
| 10 | 20 | 28 | 36 | |||
| ДТ, % | Контроль | 1,38 ± 0,15 | 15,0 ± 1,62 | 21,2** ± 2,08 | 35,3** ± 2,64 | 39,1 ± 3,21 |
| Індукція ПОЛ | 4,15* ± 0,78 | 31,9* ± 2,75 | 35,0*, ** ±3,04 | 40,1*,** ± 3,35 | 44,0 ±3,80 | |
| б-токоферол | 0,97* ± 0,11 | 23,6* ± 2,21 | 18,1** ± 2,51 | 26,0*,** ± 2,63 | 23,9* ± 2,94 | |
Примітка:* - вірогідно відносно контролю (р < 0,05)
** - вірогідно відносно попередньої температури (р < 0,05)
При цьому, починаючи з 20 0С, .рівень розпаду тромбоцитарних агрегатів навіть нижчій, ніж в контролі.
Розрахунки енергії активації розпаду тромбоцитарних агрегатів при дії граміцидину S показують, що під впливом ПОЛ ії величина суттєво знижується (Табл.6). .Таким чином, окислення ліпідів, що зменшує структурну впорядкованость плазматичної мембрани, водночас знижує і міцність зв’язування тромбоцитів між собою. Цей ефект полегшує антибіотику процес руйнування агрегатів. .
Табл.6.
Вплив індукованого ПОЛ на енергію активації дезагрегації тромбоцитів при дії граміцидину S
| Показник | Умови експерименту | Концентрація МДА,нмоль/109 тромбоцитів | Енергія активації, кДж/моль |
| Дезагрегація тромбоцитів | Контроль | 1,38 ± 0,05 | 415 ± 38 |
| Індукція ПОЛ | 4,15 ± 0,78* | 325 ± 27* |
Примітка:* - вірогідно відносно контролю (р < 0,05)
Дослідження впливу граміцидину S на гемоліз еритроцитів при дії фізичних і хімічних чинників.
В Табл. 7 наведені дані про залежність швидкості і повного часу гемолізуеритроцитів під дією граміцидину S при 200С. Згідно з отриманими результатами обидва показника гемолізу рівномірно зростають з підвищенням концентрації антибіотика. Найбільш цікавим, однак, у цих результатах є можливість порівняти кількість молекул граміцидину S, які, припадаючи на один еритроцит, викликають гемоліз, з кількістю його молекул на тромбоцит, що приводять як до руйнування індивідуальних клітин, так і їх агрегатів. В одних і тих же умовах ці величини складають (17,46±??)Ч109 і, відповідно (13,01 ± 0,55) Ч106 та (0,86 ± ??) Ч109 молекул антибіотика на клітину.
Табл..7.
Концентраційні залежності швидкості (V) і повного часу (t) гемолізу еритроцитів під дією граміцидину S
| Показник | Концентрація граміцидину S, , мкмоль/л | |||||
| 29 | 31 | 33 | 35 | 37 | 39 | |
| Кількість молекул граміцидину S / еритроцит Ч109 | 17,46 ± 0.873 | 18,67** ± 1,103 | 19,87** ± 1,205 | 21,08* ±1,312 | 22,28* ±1,428 | 23,49* ± 1,508 |
| V, о.о./хвЧ103 | 33 ± 2,9 | 54* ± 5,1 | 67* ± 5,6 | 92* ± 8,5 | 125* ± 11,7 | 150* ± 13,0 |
| t, хв | 15,0 ± 1,8 | 11.67* ± 1,2 | 9,02 ± 0,77 | 8,0* ± 0,063 | 6,67* ± 0,59 | 5,17* ± 0,43 |
Примітка:* - вірогідно відносно мінімальної концентрації граміцидину S (р < 0,05)
Це явище, очевидно, по-перше може бути пов’язано із значно більшими розмірами еритроцитів у порівнянні з тромбоцитами. Але важливішою причиною є, безумовно, різна будова мембран – питомий склад їх білковх та ліпідних компонентів, в обох типів клітин. Саме тому граміцидин S не тільки руйнує мембрану тромбоцитів, як і еритроцитів, але й виступає для перших в якості індуктора агрегації.
В той же час загальні особливості взаємодії граміцидину S з еритроцитами, які базуються на загальних же властивостях мембран будь-яких клітин, мають ті ж характерні риси, що і у випадку тромбоцитів.
З рис.5 видно, що час повного гемолізу еритроцитів знижується, а його швидкість збільшується з підвищенням температури. Декілька слабше, ніж у еритроцитів, але все ж виявляється прискорення гемолізу в облвсті фазових переходів ліпідів мембран.
Як і у випадку тромбоцитів індукція ПОЛ в мембранах еритроцитів збільшує, а його інгібування б – токоферолом – зменшує рівень гемолізу, що іде на протязі одного й того ж часу. під дією граміцидину S.
Сумісна дія підвищення температури і ПОЛ інтенсифікує гемоліз, але вклад цих складових у загальний процес неоднаковий (Рис. 6). ПОЛ змінює, в основному, хімічну структуру ліпідів, в той час, як підвищення температури – їх рухливість. Згідно Рис.6 в області температури тіла рухливість ліпідів відіграє важливішу роль у підвищенні біологічної активності антибіотика.
Вплив ПОЛ на гемоліз еритроцитів, однак, є суттевим. Розрахунки енергії активаціїповного гемолізу, приведені в Табл.8, свідчать, що ПОЛ значно знижує енергетичний бар’єр руйнування мембрани.
Порівняння енергії активації руйнування мембран еритроцитів з енергією активації дезагрегації (Табл.6) показує, що другий процес вимагає більшої енергії. Це може бути пов’язано з меншою доступністю ліпідів, вкритих глікокалісом, в мембрані тромбоцитів, більшим вмістом в ній білків, необхідністю для антибіотика, крім вбудовування в мембрану, розривати щей фібріногенові містки між клітинами.
Табл.8.
Вплив індукованого ПОЛ на енергію активації гемолізy еритроцитів за дією граміцидину S
| Показник | Умови експерименту | Концентрація МДА,нмоль/л | Енергія активації, кДж/моль |
| Гемоліз еритроцитів | Контроль | 5,1 ± 0,53 | 178 ± 23 |
| Індукція ПОЛ | 7,25 ± 0,72* | 109 ± 17* |
Примітка:* - вірогідно відносно контролю (р < 0,05)
Дослідження впливу ліпідного складу мембран еритроцитів на їх гемоліз за дією граміцидину S.
Дослідження залежності гемолізу за дії граміцидину Sеритроцитів здорових донорів і людей з порушеннямі ліпідного обміну, хворих на атероскдлероз і післятромбофлебічний синдром плоказало суттеу залежність стійкості клітинних мембран від їх ліпідного складу (Табл.9). Як видно, швидкість гемолізу еротрицотів вирогідно знижується із збільшенням питомої кількості холестерину і зниженням питомої кількості загальних фосфоліпідів.
Це явище можна пояснити так. На штучних фосфоліпідних мембранах показано [Овчинников Ю.А.,1987], що радікали амінокислотних залишки граміцидин S можуть взаємодіяти с фосфатними групами мембранних фосфоліпідів з утворенням ковалентних зв’язків. Очевидно, зниження відношення холестерин /фосфоліпіди в мембраніх еритроциту зменшує і кількість молекул антибіотика, які спроможні вбудуватися в неї, а тим самим гальмує процес руйнування клітини.
Табл. 9.
Вплив ліпідного складу мембран еритроцитів на швидкість їх гемолізу за дією граміцидину S
| Умови експерименту | Холестерин, % | Фосфоліпіди,% | Холестерин Фосфоліпіди | Швидкість гемолізу, о.о./хв |
| Контроль | 39,5±0,9 | 47,6±3,2 | 0,83 | 0,35 ± 0,062 |
| Післятромбофлебічний синдром | 44,9±1,4* | 40,5±2,6* | 1,10 | 0,29 ± 0,045 |
| Атеросклероз | 57,7±2,1* | 30,0±2,7* | 1,92 | 0,11 ± 0,016* |
Примітка:* - вірогідно відносно контролю (р < 0,05)
ВИСНОВКИ
1. У роботі із використанням оптичного методу досліджено концентраційні залежності дії граміцидину S на агрегацію тромбоцитів і гемоліз еритроцитів - як інтактних, так і в умовах модифікації плазматичних мембран г-опроміненням та біологічно активними сполуками в діапазоні температур 40С - 440С.
2. Доведено, що взаємодія граміцидину S з інтактними тромбоцитами призводить до їх набрякання і зміни форми, подібної до такої, що відбувається під впливом індукторів агрегації. Цей процесс є Са2+, Mg2+ - залежним
3. Уперше показано, що граміцидин S руйнує агрегати тромбоцитів, які утворюються під впливом індукторів агрегації, не руйнуючи при цьому плазматичну мембрану клітин.
4. На основі оцінки відношення: кількість молекул граміцидину S/тромбоцит, при яких настає активація тромбоцитів та руйнування їх агрегатів, показано , що її критична величина для першого процесу вища, ніж для другого.
5. Показано, що ступінь і швидкість дезагрегації тромбоцитів граміцидином S найбільші в області структурних фазових переходів ліпідів мембран (180С – 330С). При вищих температурах ці параметри дезагрегації знижуються, що свідчить про більшу стійкість агрегатів при температурі тіла.
6. Встановлено, що зменшення впорядкованості ліпідів у плазматичній мембрані тромбоцитів та еритроцитів при їх г-опроміненні чи перекісному окисленні ліпідів веде до полегшення вбудовування граміцидину S у мембрани, але, водночас, призводить й до зменшення міцності зв'язування антибіотика з нею.
7. Уперше показано, що біологічна активність граміцидину S по відношенню до еритроцитів залежить від вмісту холестерину та відношення холестерин/фосфоліпіди в мембранах. Його збільшення знижує гемолітичну дію антибіотика по відношенню до цих клітин.
СПИСОК ОПУБЛІКОВАНИХ ПРАЦЬ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
1. Ал-Амуш А., Берест В.П., Гаташ С.В., Перский Е.Э. Влияние катионов на агрегацию тромбоцитов // Вісник Харківського національного університету ім. В.Н.Каразіна. Серія: біологія. – 2006. – Вип. 3, № 729. – С. 5-9.
2. Адиб Халаф Фадел Аль Амуш, Берест В.П., Хакл Е.В. Активация и дезагрегация тромбоцитов in vitro при действии грамицидина S // Вісник проблем біології і медицини. – 2007. – Вип. 1. – С. 167-172.
3. Хакл Е.В., Берест В.П., Адиб Халаф Фадел Аль Амуш, Гаташ С.В. Влияние ПОЛ и ионизирующего излучения на дезагрегацию тромбоцитов под действием полипептидного антибиотика грамицидина S // Біофізичний вісник. – 2007. – Вип. 1 (18). – С. 96-101.
4. Адиб Халаф Фадел Аль Амуш, Берест В.П., Хакл Е.В., Перский Е.Э. Влияние температуры на дезагрегацию тромбоцитов, вызванную грамицидином S // Вісник Харківського національного університету ім. В.Н.Каразіна. Серія: біологія. – 2007. – Вип. 5, № 768. – С. 3-9.
5. Аламуш Адіб. Вплив позитивних іонів на агрегацію тромбоцитів / Тези доповідей Першої Міжнародної конференції студентів та аспірантів «Молодь та поступ біології». – Львів, 11-14 квітня 2005. – С. 218.
6. Hackl E.V., Berest V.P., Аlamush A., Gatash S.V., Vasyl’eva L.V. Calcium dependent pathway of gramicidin S effect on human blood platelets / Матеріали ІХ Українського біохімічного з’їзду. – Харків, 24-27 жовтня 2006. – Т. 1. – С. 112.
7. Hackl E.V., Berest V.P., Аl-Amoush A., Gatash S.V. Interaction of antimicrobial peptide with model and cell membranes / Тези доповідей ІV з’їзду Українського біофізичного товариства. – Донецьк, 19-21 грудня 2006. – С. 94-95.
АНОТАЦІЯ
Адіб Халаф Фадел Ал-Амуш. Вплив граміцидину S на агрегацію тромбоцитів і стійкість мембран еритроцитів до гемолізу. Рукопис.
Дисертація на здобуття наукового ступеня кандидата біологічних наук за спеціальністю 03.00.13 – фізіологія людини і тварин. Харківський національний університет імені В.Н. Каразіна, Харків, 2008.
Дисертація присвячена вивченню впливу граміцидину S на агрегацію тромбоцитів та стійкість мембран еритроцитів до гемолізу здорових донорів та хворих на деякі серцево-судинні захворювання. Було проаналізовано часові, концентраційні та температурні залежності світлопропускання та оптичної густини збагаченої тромбоцитами плазми (ЗТП) та суспензії еритроцитів для інтактних клітин та після опромінення і активації ПОЛ у клітинах обох типів, а також в залежності від ліпідного складу мембран еритроцитів.
Граміцидин S по-різному впливає на мембрани індивідуальних тромбоцитів та тих, які знаходяться в складі АДФ-індукованих агрегатів.. Він змінює форму та активує їх в першому випадку, при чому цей процес є Ca+ - та Mg+ -залежним. Додання АДФ до ЗТП після граміцидину S призводе до подальшого рoзвитку агрегації.
Граміцидин S руйнує утворені під дією АДФ агрегати тромбоцитів а при високих його концентраціях рyйнує і самі клітини. Температурні залежності ступеню і швидкості дії антибіотика свідчать про те, що найбільш стійкими агрегати є при темпаратурі тіла людини.
г-опромінення тромбоцитів дозой 2,58 Кл/кг Ч 10-4 призводить до підвищення, а при 6,54 Кл/кг Ч 10-3 - до зниження ступеню та швидкості дезагрегації тромбоцитів. Величини цих змін зростають з підвищенням температури. Індукція ПОЛ в мембранах тромбоцитів та еритроцитів збільшує, а гальмування його б-токоферолом знижує ступінь та швидкість дезагрегації перших та час повного гемолізу останніх під дією граміцидину S. Вплив ПОЛ є мінімальним в області температур 30 - 360 С. ПОЛ також знижує енергію активації дезагрегації тромбоцитів та гемолізу еритроцитів.
Біологічна активність граміцидину S по відношенню до еритроцитів залежить від вмісту холеcтерину і фосфоліпідів в їх мембранах. Підвищення відношення холестерин/ фосфоліпіди робить їх більш стійкими до гемолізу.
Ключові слова: граміцидин S, тромбоцити, еритроцити, ліпіди мембран, активація, агрегація, дезагрегвація, гемоліз, ПОЛ, г-опромінення.
АННОТАЦИЯ
Адиб Халаф Фадел Ал-Амуш. Влияние грамицидина S на агрегацию тромбоцитов и стойкость мембран эритроцитов к гемолізу. Рукопись.
Диссертация на соискание учёной степени кандидата биологических наук по специальности 03.00.13 – физиология человека и животных. Харьковский национальный университет имени В.Н. Каразина, Харьков, 2008.
Диссертационная работа посвящена изучению влияния грамицидина S на агрегацию тромбоцитов и стойкость мембран эритроцитов к гемолізу здоровых доноров и больных с сердечно-сосудистыми заболеваниями. С целью изучения особенностей этих процессов были проанализированы временные, концентрационные и температурные зависимости светопропускания и оптической плотности ОТП и суспензии эритроцитов для интактных клеток и обоих типов клеток в условиях г-облучения и ПОЛ, а также в зависимости от липидного состава мембран эритроцитов.
Показано, что грамицидин S по-разному взаимодействует с мембранами индивидуальных тромбоцитов и тромбоцитов, находящихся в составе агрегатов, образовавшихся в результате индукции АДФ.
В первом случае, не разрушая мембраны, он приводит к изменению формы клеток и их активации, аналогичным тем, которые вызывают классические индукторы агрегации. Этот процесс является Са2+, Mg2+ - зависимым – при отсутствии этих ионов в среде происходит лишь набухание тромбоцитов. Добавление АДФ к ОТП после грамицидина S приводит к дальнейшему развитию агрегации.
В то же время грамицидин S разрушает уже существующие АДФ –индуцированные тромбоцитарные агрегаты, а в высоких концентрациях в расчёте число молекул грамицидина S на клетку – и к разрушению самих тромбоцитов. Это может свидетельствовать о том, что в АДФ-активированных тромбоцитах появляются участки мембран с большим сродством к грамицидину S и меньшей прочностью, чем у неактивированных клеток.
Температурные зависимости степени и скорости разрушения тромбоцитарных агрегатов грамицидином S обнаруживают особенности в области структурных фазовых переходов липидов мембран (180С – 330С). В этой области величины обоих параметров дезагрегации максимальны. При более высоких температурах степень и скорость дезагрегации снижаются, что свидетельствует о большей устойчивости агрегатов при температуре тела.
г-облучение тромбоцитов в области 200С- 360С дозой 2,58 Кл/кг Ч 10-4 приводит к повышению, а дозой 6,54 Кл/кг Ч 10-3 – к понижению степени и скорости дезагрегации тромбоцитов, причём величина этих изменений растёт с температурой.
Индукция прооксидантами ПОЛ в мембранах тромбоцитов и эритроцитов повышает, а его торможение б – токоферолом понижает степень и скорость дезагрегации первых и скорость и время полного гемолиза вторых под действием грамицидина S. Влияние ПОЛ на биологическую активность грамицидина S зависит от температуры и в области 300С- 360С минимально.
В то же время Пол снижает энергию активации как дезагрегации тромбоцитов, так и гемолиза эритроцитов.
Биологическая активность грамицидина S по отношению к эритроцитам зависит от содержания холестерина и отношения холестерин/фосфолипиды в мембранах. Повышенный уровень этого отношения у больных с сердечно-сосудистыми заболеваниями снижает гемолитическое действие антибиотика.
Ключевые слова: грамицидин S, тромбоциты, эритроциты, липиды мембран, агрегация, дезагрегация, гемолиз, ПОЛ, г-облучение.
SUMMARY
Adeeb Khalaf Fadel Al-Amoush. Influence of gramicidin S on platelets functional properties and erythrocyte membrane stability. – The manuscript.
The thesis for degree of candidate of science in biology on speciality 03.00.13 – physiology of man and animals. – V.N. Karazin Kharkov National University, Kharkov, 2008.
The thesis is dedicated to research of influence of gramicidin S (GS) on platelets aggregation and erythrocyte membrane stability against hemolysis in healthy donors and patients with some heart and blood vessels disorders. Time, concentration and temperature dependencies of the light passage and optical density were analyzed in platelet-rich plasma and erythrocyte suspension for intact cells, after г-radiation and activation of POL in both cell types and in relation with lipid content of erythrocyte membrane
GS effects were different for individual platelets and and ADP-induced platelet aggregates. GS changed the platelets shape and activate individual cells. This process is Ca2+ - and Mg2+ -dependent. If ADP was added to platelets after GS they were aggregating. ADP-induced aggregates were destructed by GS. High concentration of GS destructed the platelets membranes.
Temperature dependencies of degree and velocity of GS-induced effects suggest that platelet aggregates have the most stability at human body temperature.
After г-radiation at the dose (2,58 -12,9) x10-1 Cl/kg platelets were aggregated at less degree and more slowly, than intact cells: at the dose (25,8 – 64,5)x10-1 Cl/kg this process took place with higher velocity and degree.
POL induction increased and б-tokoferol decreased the degree and velocity of platelets desaggregation by GS and the time of total erythrocyte hemolysis. POL effects were minimal at 30-360C. POL decreased the activation energy of platelet desaggregation and erythrocyte hemolysis.
GS biological activity towards erythrocytes was dependent on cholesterol/phospholipids ratio. Its increasing at some heart and blood vessels deseases made membranes of erythrocytes less sensitive to GS-induced hemolysis.
Key words: Gramicidin S, platelets, erythrocytes, membranes lipids, activation, aggregation, desagregation, hemolysis, ascorbate-induced lipid peroxidation, г-irradiation.
0 комментариев