Спецификация нервной ткани
Региональная спецификация нервной ткани
У взрослых животных клетки различных областей нервной системы имеют существенные отличия в своем фенотипе в зависимости от той функции, которую они выполняют. Клетки мозжечка отличаются от клеток коры полушарий, и оба типа клеток — от сетчатки. Каким образом происходит формирование таких различных фенотипов клеток в процессе развития? Как и у других клеток, фенотип нейрона определяется тем, какие гены он экспрессирует, что, в свою очередь, контролируется факторами транскрипции, белками, которые связываются с регуляторными зонами одного или нескольких генов и влияют на процессы их транскрипции. Развитие характеризуется последовательной и иерархической экспрессией факторов транскрипции, каждый из которых влияет на экспрессию последующего и ограничивает конечный фенотип клетки.
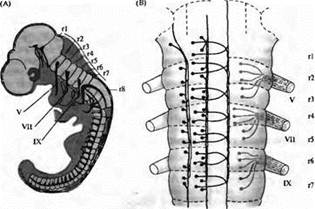
Рис. 1. Развитие заднего мозга позвоночных β виде сильно сегментированной структуры. (А) Диаграмма трехдневного эмбриона цыпленка, иллюстрирующая сегментарную организацию ромбомеров (r1-r8) в заднем мозге. (В) Паттерн организации клеток в ромбомерах r1-r7 трехдневного мозга цыпленка. Ретикулярные нейроны (слева) и брахиомоторные нейроны (справа) образуют сегментарный повторяющийся паттерн. Мотонейроны и их аксоны образуют черепно-мозговые нервы V, VII и IX пары.
Исследованию региональной спецификации нервной ткани в мозгу позвоночных значительно помогло то, что были открыты гомологи генов плодовой мухи дрозофилы, которые определяют расположение и зависящую от расположения дифференцировку клеток эмбриона. Эти гены оказались сходными с генами позвоночных и часто выполняют сходные функции. Большинство из этих генов кодирует факторы транскрипции.
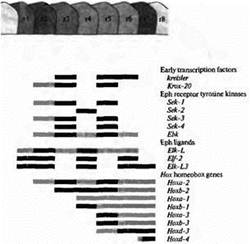
Рис. 2. Сегментарная экспрессия генов в ромбомерах с r1 до r8 в заднем мозге позвоночных. Серые полоски указывают ромбомеры, в которых происходит экспрессия генов; черные полоски указывают высокий уровень экспрессии. Ранние факторы транскрипции, рецептор тирозинкиназы семейства Eph и его лиганды образуют сегментарный паттерн ромбомеров Семейство гомеобоксных генов Нох определяет судьбу клеток в пределах каждого ромбомера в зависимости от сегмента. Данные получены на эмбрионах цыплят и мышей.
Гомеотические гены и сегментацияУдивительными примером подобного сходства в функционировании генов у настолько разных животных являются результаты исследований заднего мозга позвоночных. В отличие от всего остального мозга позвоночных, задний мозг эмбриона (rhombencephalon) имеет четкое сегментарное строение. Каждый сегмент его демонстрирует общий паттерн нервной дифференцировки, однако от сегмента к сегменту дифференцировка имеет свои особенности (рис. 1). Было идентифицировано несколько генов, паттерны экспрессии которых на ранних стадиях развития коррелируют с границами сегментов заднего мозга (рис. 2). Эти гены делятся на две категории:
(1) Гены первой категории играют роль в создании общей структуры, состоящей из повторяющихся сегментных единиц. Некоторые гены этой группы кодируют факторы транскрипции (kreisler, Krox-20), другие кодируют рецептор тирозинкиназы (Sek-l по Sek-4) или его лиганды (Elf-2). (Рецептор тирозинкиназы представляет собой трансмембранный белок, у которого внутриклеточный домен, представляющий собой фермент тирозинкиназу, активируется при связывании лиганда с внеклеточным доменом.)
(2) Вторая категория содержит гены, которые определяют судьбу каждого сегмента. Эти гены образуют высококонсервативное семейство Нох генов.
Свойства Нох генов были впервые описаны у дрозофилы, у которой они регулируют гомеостаз. Гомеотические гены представляют собой управляющие гены, которые координируют экспрессию многих других генов во время развития. Например, мутация гомеотических генов семейства Нох у дрозофилы приводит к тому, что одна часть тела заменяется другой; таким образом на месте антенны может развиться нога. Гомеотические гены содержат консервативную последовательность ДНК, гомеобокс. Гомеобокс кодирует последовательность из 60 аминокислот, которые распознают и связываются с определенной последовательностью ДНК серии подчиненных генов. Каждый гомеотический ген, таким образом, координирует экспрессию большого числа генов, которые вместе определяют строение одного сегмента эмбриона.
Сегментарный паттерн экспрессии генов семейства Нох наблюдается в заднем мозгу цыплят и грызунов, что приводит нас к предположению, что Нох гены могут играть роль гомеотических управляющих генов, регулирующих процессы развития позвоночных и создания определенных структур относительно рострокаудальной оси в определенных областях заднего мозга эмбриона. Данные, полученные при помоши трансплантации, выключения определенных генов и эктопической экспрессии, согласуются с этими идеями. Дополнительным доказательством является изучение мутаций Нох генов и других гомеобоксных генов у человека, которые приводят к изменениям в определенных областях ЦНС.
Следующий очевидный вопрос: а что определяет паттерн экспрессии Нох генов? Ответом, по крайне мере частично, является градиент ретиноевой кислоты. Ретиноевая кислота вырабатывается в Гензеновском узелке, который называется Шпемановским организатором (Spemann organizer) у эмбрионов птиц и позвоночных (см. рис. 3). Но ретиноевая кислота не просто активирует транскрипцию всех Нох генов: была описана систематическая разница чувствительности различных генов Нох семейства к ретиноевой кислоте. Таким образом, диффузия ретиноевой кислоты из Гензеновского узелка способствует формированию градиента, который играет большую роль в упорядоченной экспрессии различных Hax генов в рострокаудальном направлении в заднем мозге.
Хорда и базальная пластинкаСтроение и функпчонирование нервной системы позвоночных варьируют в дорзовентральном и рострокаудальном направлении. Например, полоска специализированных глиальных клеток, названных базальной пластинкой (floor plate), расположена по средней линии вдоль вентральной поверхности спинного мозга. Соседние, более латерально расположенные базальиые области нервной трубки образуют мотонейроны, более дорзальные зоны дают начало интернейронам, и самые дорзальные области образуют нервный гребень.
Характерные свойства вентральной хорды, такие как дифференцировка базальной пластинки и образование мотонейронов, регулируются сигналом из спинного мозга (notochord). Таким образом, если пересадить в эмбрион еше одну хорду, рядом с нервной трубкой, то это приведет к формированию второй базальной пластинки и второй группы мотонейронов (рис. 3), а если у эмбриона удалить хорду, то ни мотонейроны, ни базальная пластинка не формируются.
Сигналы из хорды, которые управляют формированием клеток базальной пластинки и мотонейронов, являются продуктами транскрипции гена Sonic hedgehog24). Белок Sonic hedgehog синтезируется клетками хорды (а затем также клетками базальной пластинки), концентрируется на их поверхностях и диффундирует к соседним клеткам. Высокий уровень Sonic hedgehog на поверхности хорды приводит к формированию клеток базальной пластинки из клеток нервной трубки. Более низкий уровень ведет к экспрессии гомеотического гена (Mkx-2.2), что вызывает развитие клеток в висцеральные мотонейроны. Еще более низкий уровень Sonic hedgehog вызывает транскрипцию Рах-6, которые угнетают экспрессию Nkx-2.2, что позволяет клеткам развиваться по их основному пути и становиться соматическими мотонейронами.
Общая схема региональной дифференцировкиРострокаудальный и дорзовентральный градиенты факторов транскрипции определяют локальную идентификацию клеток в пределах ЦНС. Эти же факторы способны приводить к развитию довольно различных свойств в зависимости от того, в каком месте эмбриона они экспрессируются. Например, белок Sonic hedgehog определяет вентральный фенотип вдоль рострокаудальной оси, приводя к образованию мотонейронов в спинном мозге, серотонинергических нейронов в передней части заднего мозга, дофаминергических нейронов в задней части заднего мозга, глазодвигательных нейронов в передней области среднего мозга. Подобным же образом другие факторы транскрипции (ВМР-4 и ВМР-7) приводят к образованию дорзального фенотипа30). Общим правилом является то, что возможные пути развития плюрипотентной клетки-предшественницы в определенной области развивающейся нервной системы в первую очередь ограничиваются ее положением относительно переднезадней оси, например, путем экспрессии Нох генов (рис. 23.9)31). Возможные клеточные фенотипы в дальнейшем еще более ограничиваются с учетом дорзовентрального положения по средней линии при помощи таких посредников, как Sonic hedgedog.
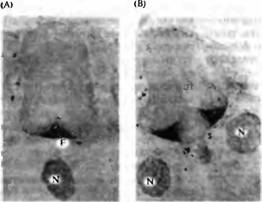
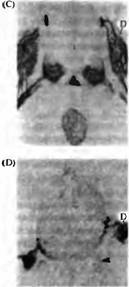
Рис. 3. Индуцированное хордой образование базальной пластинки и двигательных нейронов во время развития спинного мозга. (А и В) Специфическая окраска при помощи антител к клеткам базальной пластинки (F). (А) Нормальный эмбрион цыпленка. (В) Добавление клеток второй хорды (N) вызывает образование второй базальной пластинки. (С и D) Специфическая окраска при помощи антител к клеткам базальной пластинки, двигательным нейронам и афферентам спинального ганглия. (С) Нормальный эмбрион. (D) При удалении хорды клетки базальной пластинки и двигательной пластинки отсутствуют, а клетки спинального ганглия (D) занимают необычное вентральное положение. Аксоны сенсорных интернейронов, которые обычно идут в составе вентральной части спинного мозга, сейчас формируют пучки волокон, которые покидают спинной мозг (стрелка).
Происхождение нейронов и клеток глииУ позвоночных индукционные взаимодействия между клетками играют важную роль в определении их дальнейшей судьбы. У более простых организмов судьба клетки может быть определена автономно на основании ее происхождения.
Происхождение клеток и индукционные взаимодействия в простых нервных системахПроисхождение клеток наиболее хорошо исследовано на примере простых беспозвоночных, таких как пиявка, кузнечик, плодовая муха и маленькая нематода Caenorhabditis elegans. В этих препаратах возможно проследить развитие каждой клетки и исследовать формирование таких характеристик, как свойства мембраны, трансмиттеры, рост аксонов и их ветвление. У С. elegans, которая содержит всего около 300 нейронов, эмбрион настолько маленький и прозрачный, что можно идентифицировать каждый нейрон и проследить его работу при помощи микроскопа. Альтернативным подходом может быть маркирование отдельных клеток и определение того, какие типы клеток из них получаются. Такого рода анализ, впервые предложенный Вайсблатом, Стентом и их коллегами для эмбрионов пиявки, включает в себя введение внутриклеточных маркеров, таких как флуоресцентный декстран или фермент пероксидаза хрена (HPR), в отдельные клетки и таким образом исследование дальнейшего потомства либо на живом эмбрионе, либо после окраски эмбриона, когда можно увидеть клетки, в которых находится фермент. Можно провести сравнительные эксперименты, вводя комплементарные цепи ДНК, кодирующие гены флуоресцентного белка, или создавая трансгенных животных, которые экспрессируют этот протеин.
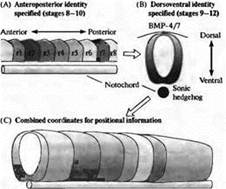
Рис. 4. Система координат пространственной информации в заднем мозге позвоночных, устанавливаемая в два этапа. (А) Сначала определяется рострокаудальная позиция, например по экспрессии гена Hox. (В) После этого дорзовентральная позиция определяется градиентами сигналов средней линии, такими как Sonic Hedgehog и BMP 4/7. (С) Результирующая двумерная система координат пространственной информации ограничивает возможный репертуар клеточной дифференцировки плюрипотентных клеток-предшественников.
Эксперименты подобного рода показывают, что у простых беспозвоночных вполне возможно воспроизвести определенную последовательность в делении и дифференцировке клеток. Таким образом, используя луч лазера можно вызывать гибель отдельных идентифицированных клеток с целью проследить, каким образом это повлияет на судьбу оставшихся клеток. В большинстве случаев выжившие клетки игнорируют потерю своего соседа, направление их развития определено автономно, на основании того, к какой клеточной линии они принадлежат. У подобных клеток экспрессия генов определяется факторами, которые изначально находятся в их цитоплазме или ядре и представляют собой независимые внутриклеточные сигналы. В других случаях, однако, потеря соседа может повлиять на судьбу выживших клеток. Таким образом, даже у животных, у которых имеются жестко определенные паттерны деления клеток, их дальнейшее развитие может изменяться в зависимости от индукционных взаимодействий.
Индукционные взаимодействия при развитии глаз дрозофилыСтереотипно происходящее развитие сложного глаза дрозофилы представляет собой еще одну систему, в которой возможно прямое наблюдение для идентификации отдельных клеток и прослеживания их дальнейшего развития. Кроме того, генетика дрозофилы дает очень большие возможности для оценки роли происхождения клеток и индукционных взаимодействий между ними в дифференцировке нервной ткани. Возможно выделение мутантов, у которых нет определенного клеточного типа или у которых паттерн дифференцировки лишь незначительно нарушен, что позволяет определить их влияние на судьбу остальных клеток.
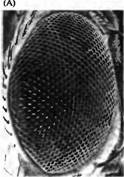
Рис. 4. Индукционные взаимодействия, регулирующие развитие фоторецепторных клеток у дрозофилы. (А) Сканограмма сложного глаза дрозофилы. Каждая фасетка представляет собой один омматидий. (В) Нормальное развитие дифференцировки восьми фоторецепторов в каждом омматидий. Seven/ess (sev-- ) и bride of seven (boss ) мутации нарушают дифференцировку R7. (С) Сигнальные каскады, регулирующие дифференцировку R7. Продукт boss гена, интегральный мембранный белок, экслрессируемый в R8 (Boss), активирует продукт гена sev, рецептора тирозинкиназы (SevRTK). Sev киназа запускает внутриклеточный сигнальный каскад, активирующий MAP киназу, которая имеет несколько мишеней. MAP киназа фосфорилирует протеин Van (который бы иначе блокировал дифференцировку), приводя к его распаду. MAP киназа также вызывает экспрессию белка Phyl который вместе со вторым протеином, Sina, приводит к распаду фактора транскрипции Ttk88 Ttk88 предотвращает нервную дифференцировку. MAP киназа также активирует Pntp2 и АР-1, два фактора транскрипции, которые способствуют нейрональной дифференцировке.
Подобная техника была использована в экспериментах Бензера, Реди, Рубина, Толимсона, Цирупски и их коллег, которые исследовали дифференцировку нейронов и сопутствующих (опорных) клеток глаза. Глаз дрозофилы состоит из кристаллоподобного набора повторяющихся единиц, называемых омматидиями (рис. 4A), каждый из которых содержит 8 фоторецепторов (R1-R8). Первая клетка, которая определяет начало дифференцировки в каждом омматидии, является одним из фоторецепторов, R8. Клетки R8 появляются хаотично в области нейроэпителия. Как только началась дифференцировка клетки R8, это приводит к ингибированию дифференцировки ее соседей в клетки R8. Затем дифферениировке подвергаются клетки R2 и R5, после чего R4, R1 и R6 и, наконец, R7 (рис. 4В). Были обнаружены две мутантные линии, в которых глаза развиваются нормально, за исключением того, что не образуется R7 (рис. 4В). Такие линии были названы sevenless (sev--) и brideof-sevenless (boss-- ) для обозначение отсутствия образования R7. При детальном исследовании этих мутантных линий впервые были изучены молекулярные механизмы того, как индукционные взаимодействия между клетками могут влиять на дальнейшее развитие клеток. Ген sevenless кодирует рецептор (называемый Sevenless, или Sev), для которого продукт экспрессии bride-of-sevenless гена, названный Boss, является лигандом. Во время развития R8 индуцирует образование R7. Это происходит, когда Boss, экспрессируемый на поверхности клетки R8, связывается с Sev, который расположен на клетке-предшественнице R7 (рис. 4С). Взаимодействие между Boss и Sev активирует внутриклеточный домен Sev рецептора, тирозинкиназу, которая инициирует сигнальный каскад в клетке R7, приводящий к ее дифференцировке. Сигнальный каскад является сложным путем, который включает в себя последовательную активацию серии протеинкиназ (ферментов, которые фосфорилируют белки), что приводит к ингибированию негативного влияния, а также увеличению позитивного влияния на экспрессию генов R7. Большое количество сигналов, которые приводят к изменениям в эспрессии генов, осуществляют это через тирозинкиназы, которые управляют данными клеточными каскадами.
Происхождение клеток в ЦНС млекопитающихИзучать последовательность развития клеток в ЦНС млекопитающих технически более сложно, потому что отдельные клетки труднее идентифицировать и заполнить красителем. Удачными методиками исследования здесь показали себя картирование путей развития генетически помеченных клеток у химерных животных — эмбрионов и взрослых, а также инфицирование клеток ЦНС развивающихся животных специально созданными вирусами (рис. 5). Подобные вирусы сконструированы таким образом, что они перманентно включаются в состав хромосом клетки-хозяина, реплицируются во время деления клетки, и, следовательно, передаются потомкам этой клетки. Таким образом, информация, находящаяся в вирусе, не уменьшается при делении клеток. Присутствие вируса может быть затем обнаружено на любой стадии развития клеток, используя белок, который он кодирует. При условии, что изначально количество инфицированных клеток мало, в дальнейшем можно будет сделать вывод, что кластер клеток, содержащих данный белок, является клоном, потомством той самой клетки, которая была ранее инфицирована.
Например, когда такой вирус был введен в глаз новорожденного крысенка, а сетчатка была исследована во взрослом возрасте, белок содержали как глиальные клетки, так и несколько типов нейронов. Таким образом, общая клетка-предшественница в сетчатке при делении образует как нейрональные, так и глиальные клетки.
В отличии от пиявки или дрозофилы, в сетчатке грызунов нет специфической последовательности развития клеток, когда одна клетка образует несколько различных типов нейронов. В данном случае, вероятно, клетка--предшественник имеет некоторую внутреннюю информацию (intrinsic competence) о том, как отвечать на внешние сигналы и сигналы, которые находятся в окружающей ее среде. Эти сигналы меняются со временем, что приводит к последовательному формированию клеток разных типов. С другой стороны, когда подобные эксперименты проводились в коре больших полушарий, клоны, которые содержали бы и глиальные клетки, и нейроны, были довольно редки. Это дает основания полагать, что в момент инфицирования отдельные популяции клетокпредшественииков глиальных и нервных клеток уже сформировались в вентрикулярной области коры. Более того, клоны большей частью содержали исключительно пирамидные или непирамидные клетки, показывая, что разделение между этими двумя линиями происходит на раннем этапе нейрогенеза.
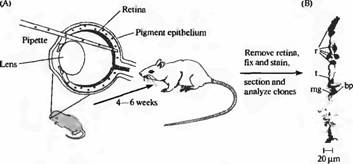
Рис. 5. Клетки одного клона помечены при помощи введения ретровирусных маркеров в сетчатку крысы. (А) Ретровирус, кодирующий бета-галактозидазу был введен в глаз между сетчаткой и пигментным эпителием в раннем периоде развития, что привело к заражению нескольких предшественников клеток сетчатки. (В) Окрашивание сетчатки взрослого при помощи гистохимической реакции на бета галактозидазу выявляет кластеры, содержащие метку и являющиеся потомками одной клетки-предшественницы. Изображение клона включает в себя 5 палочек (г), одну биполярную клетку (bp) находящуюся вблизи к терминали палочки (t)
Резюмируя вышесказанное, в нервной системе простых организмов возможный спектр дальнейшего развития клетки (lineage history) ограничивает потенциал ее развития. В ЦНС более сложных животных существуют индукционные взаимодействия между клетками, которые играют исключительную роль в направлении развития клетки. В хорошо известной и искрометной аналогии Сидней Бреннер охарактеризовал два пути развития клетки как «план по-американски» и «план по-европейски»: «по-европейски» то, кто ты есть (какой нейрон), определяется твоими предками; «по-американски» это определяется твоими соседями.
Литература
1. Vol.860). New York Academy of Sciences, New York. [22]
2. Klockgether, T., and Evert, B. 1998. Genes involved in hereditary ataxias. Trends Neurosci. 21: 413-418.
3. Paulson, H. L., and Fischbeck, К. Н. 1996. Trin-ucleotide repeats in neurogenetic disorders. Anna. Rev. Neurosci. 19: 79-107.
4. Penfield, W., and Rasmussen, T. 1950. The Cerebral Cortex of Mon: A Clinical Study of Localization of Function. Macmillan, New York.
Похожие работы
... уровне направленные мутации, что открывает дорогу к обнаружению важных генов позвоночных, которые могут иметь гомологов у некоторых видов более просто устроенных беспозвоночных. Развитие нервной системы в раннем периоде В раннем периоде морфогенеза позвоночных область гаструлы, из которой в дальнейшем формируется нервная система, представляет собой простую полоску эктодермы (рис. 1). ...
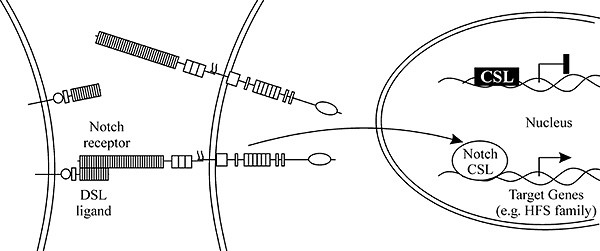
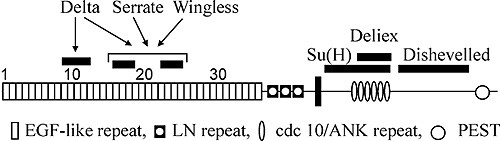
... , 2001). Гены Notch-сигнального пути у дрозофилы В локальных межклеточных взаимодействиях между незрелыми клетками Notch-путь контролирует ответ на специфические сигналы во время развития и определяет судьбу широкого спектра клеток в онтогенезе. На основании данных о генетических и молекулярных взаимодействиях ряд генов у Drosophila melanogaster с определенностью относят к кодирующим элементам ...
... клейма надпись "Российская Федерация", а в нижней - "Госветнадзор". Овальное ветеринарное клеймо подтверждает, что ветеринарно - санитарная экспертиза мяса и мясопродуктов проведена в полном объеме и продукт выпускается для продовольственных целей без ограничений. На мясо, подлежащее обезвреживанию, ставится только ветеринарный штамп, указывающий порядок использования мяса согласно действующим ...
... нарушаются элементарные дидактические требования, преобладает пассивное восприятие учебной информации учащимися, нерационально тратится учебное время. Глава 2. Методика использования аудиовизуальных и технических средств обучения при изучении раздела «Технология обработки ткани 5 класс» 2.1 Комплексно-методическое обеспечение раздела 1. Учебно-методическая документация № п/п Наименование ...
0 комментариев