Содержание
Термодинамика полиморфизма липидных структур
1. Гидрофобные силы
2. Образование мицелл
3. Форма мицелл: почему образуется бислой?
4. Оптимальная площадь поверхности, приходящаяся на молекулу
5. Геометрия мицелл и критический параметр упаковки
6. Форма липидных молекул
Термодинамика полиморфизма липидных структур
Данные, представленные в предыдущем разделе, показывают, что гидратированные липиды обладают структурным полиморфизмом. Во всех липидных структурах неполярные углеводородные области молекул агрегируют, а полярные головки контактируют с водой. В этом разделе мы кратко рассмотрим термодинамические принципы образования мицелл амфифильными липидами. Термодинамический анализ будет проводиться с учетом геометрической формы молекул, что позволит с единых позиций рассмотреть такие разные вопросы, как механизм разрушения мембран под действием детергентов и механизм влияния холестерола на фосфолипидный бислой.
1. Гидрофобные силыС точки зрения термодинамики основной силой, стабилизирующей гидратированные липидные агрегаты, являются гидрофобные взаимодействия. К другим стабилизирующим факторам относятся:
Вандерваальсовы силы: короткодействующие слабые силы притяжения между соседними гидрофобными цепями. Притяжение возникает за счет взаимодействия между индуцированными диполями.
Водородные связи: образуются между полярными головками некоторых липидов. В ряде случаев мостики между отрицательно заряженными липидами образуются с помощью двухвалентных катионов.
Все эти силы по своей стабилизирующей способности значительно уступают гидрофобным взаимодействиям. Под действием гидрофобных сил система принимает такую структурную организацию, при которой сводятся к минимуму контакты между неполярными участками липидных молекул и водой. Эти силы имеют энтропийную природу и связаны с ограничениями, налагаемыми на упаковку молекул воды вокруг неполярных углеводородов.
Динамическая структура чистой воды весьма сложна, однако ясно, что она стабилизируется прежде всего межмолекулярными водородными связями. Когда какой-либо ион, например С1~, попадает в воду, он сольватируется, при этом молекулы воды образуют вокруг него гидратную оболочку. С точки зрения энтропии упорядочение молекул воды невыгодно, но это с избытком компенсируется сильными электростатическими взаимодействиями, так что суммарное изменение свободной энергии при растворении соли в воде оказывается термодинамически выгодным. Когда в воде растворяется неполярное вещество, структура воды вокруг каждой молекулы также нарушается. Молекулы воды стремятся ориентироваться таким образом, чтобы сохранились межмолекулярные водородные связи, но поскольку те молекулы воды, которые непосредственно контактируют с молекулами растворенного неполярного вещества, соседствуют с меньшим число молекул воды, в системе возникают значительные структурные напряжения. Это приводит к уменьшению энтропии системы, причем в данном случае компенсирующие электростатические взаимодействия отсутствуют. В результате суммарное изменение свободной энергии при переносе иеполярного вещества из неполярного растворителя в воду термодинамически неблагоприятно из-за энтропийных эффектов, связанных с нарушением структуры воды как растворителя. Аналогией водных систем с растворенными в них неполярными молекулами могут служить кристаллогидраты неполярных молекул или атомов, в которых вода образует решетки или клатраты, окружающие "растворенное" вещество.
Невыгодные взаимодействия между неполяриым растворяемым веществом и водой - это и есть "гидрофобные силы". С помощью термодинамических измерений можно количественно оценить стремление неполярных веществ минимизировать контакты с водой. Гидрофобные силы являются главным фактором стабилизации практически всех биологических макромолекулярных структур, включая глобулярные белки, а также фосфолипидный бислой. "Гид-рофобность" таких простых молекул, как углеводороды, можно количественно оценить по данным равновесного распределения растворяемого вещества между двумя растворителями, например водой и гептаном.
Выразим концентрацию растворенного вещества в воде и в углеводороде в мольных долях, Нг0 и нс Тогда константа равновесия К будет равна
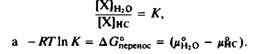
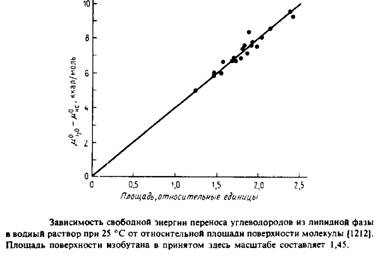
Стандартная свободная энергия переноса вещества из одной фазы в другую, ДСперенос. является мерой его гидрофобности. Показано, что гидрофобность пропорциональна площади поверхности контакта между водой и неполярным растворенным веществом. Чем крупнее молекула, тем значительнее нарушения структуры воды из-за увеличения площади контакта. Как видно из рис.2.16, гидрофобность углеводородов возрастает пропорционально площади их поверхности. Используя вандерваальсов радиус для расчета площади поверхности контакта между молекулами воды и углеводородами, подсчитали, что AGnepeHOC составляет около - 25 кал/А2. Для углеводородов с неразветвленной цепью гидрофобность составляет около - 800 кал/моль в расчете на одну - СНг-группу. Другими словами, при увеличении длины цепи на два метиленовых звена константа равновесия увеличивается в 10 раз.
Рассмотрим, что происходит при растворении углеводородов с длинной цепью в воде. Из-за весьма неблагоприятных "гидрофобных" взаимодействий, описанных в - предыдущем разделе, их растворимость будет очень мала. Такие углеводороды, как додекан, смогут растворяться в воде лишь до определенной концентрации, а выше этой концентрации они будут образовывать отдельную фазу. При дальнейшем добавлении до декана будет просто увеличиваться содержание додекановой фазы, а концентрация додека-на, растворенного в воде, не изменится.
Посмотрим теперь, что произойдет при попадании в воду амфи-фильной молекулы, например додецилсульфата натрия. Молекула этого типичного детергента состоит из неполярной части и из сильно заряженной полярной группы, расположенной на одном из концов цепи. Когда достигается предел растворимости мономерной формы этого детергента, он также образует отдельную фазу. Однако в данном случае эта "фаза" диспергирована в виде небольших агрегатов, называемых мицеллами, по всему объему воды.
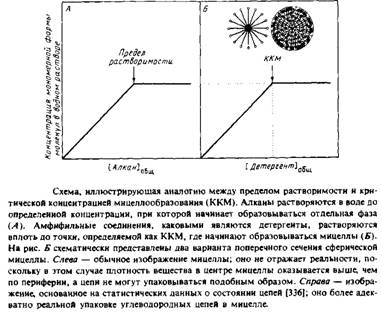
Поскольку взаимодействия между полярной головкой и водой являются более предпочтительными, то энергетически выгодно, чтобы эта часть молекулы контактировала с водой, а ее неполярная область была исключена из такого контакта. Концентрация, при которой 50°/о детергента находятся в составе мицелл, называется критической концентрацией мицеллообразования. С практической точки зрения удобнее определять ККМ как концентрацию, при которой начинают образовываться мицеллы. ККМ соответствует пределу растворимости молекул в мономерном состоянии. Дальнейшее добавление додецилсульфата приводит к увеличению концентрации мицелл.
Липидные агрегаты или мицеллы могут иметь разные размеры и форму. Так, додецилсульфат образует в воде сферические мицеллы, содержащие около 60 молекул на мицеллу. Некоторые детергенты и амфифильные молекулы могут образовывать как глобулярные, так и цилиндрические агрегаты. Фосфолипиды спонтанно агрегируют с образованием бислоев, которые по сути представляют собой своеобразную разновидность мицелл. Причины, по которым природные фосфолипиды образуют стабильные бислои, будут рассмотрены в следующем разделе. А здесь мы проведем количественный анализ связи между гидрофобностью и ККМ.
Водный раствор амфифильного соединения может состоять из смеси разных форм, включая мономеры и различные агрегаты из большого числа молекул. В равновесии химический потенциал амфифильного соединения в каждой из форм будет одинаковым:
кТ= ftv + jy\n = Константа, одинаковая для всех N,
где fiN - стандартный химический потенциал агрегатов, содержащих N молекул, Х\ - мольная доля амфифильных молекул в агрегатах, содержащих N молекул, к - константа Больцмана, Т - температура. Для простоты рассмотрим монодисперсную систему с М молекулами на один агрегат. Это означает, что есть только один тип агрегатов с N = М, находящихся в равновесии с мономером. Хотя это и явное упрощение, но оно вполне приемлемо для молекул, образующих сферические мицеллы или небольшие моноламел-лярные везикулы. Теперь рассмотрим условия равновесия системы при критической концентрации мицеллообразования и представим ККМ как такую концентрацию, при которой Х\ = Хм:
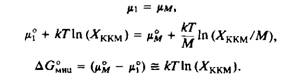
Основной вклад в величину ДО°иц дает свободная энергия гидрофобного переноса за счет вытеснения воды из неполярных областей амфифильных агрегатов при формировании мицеллы. Обратите внимение, что более отрицательные величины AG„„U соответствуют меньшим значениям А"ккм, т.е. очень гидрофобные молекулы стремятся агрегировать при более низких концентрациях. Фактически для простых амфифильных молекул с одной углеводородной цепью, как в случае алкилсульфатов, зависимость ДО„нц от длины цепи очень близка к зависимости ДОперенос ДЛ* алкильных цепей от их длины. С точки зрения термодинамики перенос неполярных групп из воды в жидкий углеводород аналогичен их переносу во внутреннюю гидрофобную область мицеллы. Количественно это выражается в том, что при каждом увеличении длины цепи на два метиленовых звена ККМ уменьшается примерно на порядок.
В случае мембран это означает, что для природных фосфолипи-дов, которые обычно имеют две длинные алкильные цепи на молекулу, гидрофобная составляющая AG„„U очень сильно благоприятствует их переходу в агрегированное состояние. Величина
ККМ для таких липидов составляет <10~'°М. Другими словами, в большинстве случаев концентрация мономерных фосфолипидов, находящихся в равновесии с мембраной, пренебрежимо мала. Поэтому для связывания и переноса мономерных форм липидов внутри клетки или между клетками природа создала специальные белки.
3. Форма мицелл: почему образуется бислой?В предыдущем разделе было показано, что в водном растворе природные фосфолипиды самопроизвольно агрегируют. Чем же определяется форма мицелл? Следует напомнить, что некоторые природные липиды, например фосфатидилэтаноламин с ненасыщенными жирнокислотными цепями, не образуют стабильных бислоев при диспергировании в воде. Чтобы выяснить механизмы, лежащие в основе стабильности бислоя, и понять, почему некоторые мембранные компоненты способствуют формированию небислойных структур, необходимо более глубоко рассмотреть термодинамику этих систем и обсудить, как форма липидных молекул влияет на их упаковку в мицеллах. Читатели, интересующиеся лишь качественной стороной проблемы, могут опустить этот раздел и сразу перейти к следующему.
Почему мембранные фосфолипиды не образуют глобулярных мицелл? При обсуждении вопроса об упаковке амфифильных молекул в мицеллах определенной геометрии следует рассмотреть стерические требования к упаковке с двух точек зрения. Неполярная часть молекулы характеризуется определенным молекулярным объемом и максимальной длиной этого участка. Без учета других характеристик эти два параметра будут определять максимальный радиус сферической мицеллы, а также число молекул, входящих в мицеллу. Другой параметр, который следует принять во внимание, - это оптимальная площадь, поверхности, занимаемой полярной головкой. У природных фосфолипидов площадь, приходящаяся на молекулу в некоей сферической мицелле, будет намного больше, чем требуется для оптимальной упаковки головок, и эти амфифильные соединения не образуют стабильных сферических мицелл. Мы сначала оценим факторы, которые определяют оптимальную площадь поверхности на молекулу для амфифильных веществ на поверхности мицеллы, а затем посмотрим, как величина этой площади отражается на критическом параметре упаковки, который определяет, какая форма мицелл является более предпочтительной для того или иного амфифильного соединения.
4. Оптимальная площадь поверхности, приходящаяся на молекулуТеоретически распределение липидов между различными агрегированными структурами определяется химическим потенциалом стандартного состояния молекул в каждой структуре, ц%. Чтобы продолжить рассмотрение, необходимо раскрыть смысл параметра /iN с учетом геометрии мицелл. Следуя представлениям Израелашвили и др., примем, что величина химического потенциала молекулы, имеющей среднюю площадь поверхности S и находящейся в составе мицеллы с параметром агрегации N, имеет три составляющие. Именно зависимость ц% от средней площади, приходящейся на молекулу, позволяет объяснить геометрическую форму мицелл:
![]()
Слагаемые 1 и 2 отражают вклад сил притяжения и отталкивания на поверхности мицеллы, а слагаемое 3 представляет собой суммарную энергетическую составляющую, относящуюся к объемной фазе мицеллы. Физический смысл этих составляющих нетрудно понять. Н\ - это свободная энергия, связанная с алкильными цепями. В первом приближении она одинакова для всех мицелл, в которых алкильные цепи изолированы от воды и образуют углеводородоподобную фазу. Этот член, а точнее величина (Hn - Hi), зависит от длины цепи неполярной части молекулы и тем самым определяет ККМ. Таким образом, величина является мерой гидрофобности.
Слагаемые 1 и 2 отражают энергетический вклад межмолекулярных взаимодействий на границе раздела вода-углеводород. Их величина зависит от плотности упаковки липидных молекул в мицелле, а следовательно, от формы мицеллы. Наиболее благоприятна такая форма, которая минимизирует свободную энергию системы. Попытаемся понять это, исходя из следующих простых термодинамических представлений.
Слагаемое 1: yS, поверхностное натяжение на границе раздела фаз. Этот член, отражающий силы притяжения, эквивалентен поверхностному натяжению, стабилизирующему границу раздела жидкость-жидкость в системах вода-углеводород.7 - это коэффициент поверхностного натяжения; он имеет размерность энергии в расчете на 1 см2 и обычно равен примерно 50 эрг/см2. Эта величина эквивалентна работе, совершаемой при изменении площади поверхности на 1 см2 при поверхностном давлении 50 дин/см. Поверхностное натяжение можно также рассматривать как "отрицательное давление", возникающее за счет различных сил межмолекулярного притяжения на границе раздела фаз. В этом случае оно имеет размерность дина/см и составляет около 50 дин/см.
Слагаемое 2: C/S, силы межмолекулярного отталкивания. В первом приближении их можно представить как сумму всех сил отталкивания на границе раздела фаз, включая электростатические и стерические. Главной особенностью этого члена является то, что все входящие в него силы отталкивания обратно пропорциональны средней площади, приходящейся на молекулу на гидрофобной поверхности мицелл. Другими словами, чем плотнее упакованы молекулы, тем сильнее становятся эти взаимодействия и тем неблагоприятнее их влияние.
Эти два слагаемых лежат в основе предложенного Тэнфордом принципа действия противоположных сил. Стремлению молекул к ассоциации противодействуют силы отталкивания, объединенные константой С, что в конечном счете определяет оптимальную упаковку молекул в бислое.
Величину S, отвечающую оптимальной упаковке, можно получить, положив dn%/dS = 0, т.е. минимизировав свободную энергию по площади поверхности, приходящейся на молекулу. Это дает
![]()
Даже при таком сверхупрощенном рассмотрении видно, что So задается молекулярной константой С. Например, можно ожидать, что для додецилсульфата будет иметь место сильное электростатическое отталкивание между заряженными сульфатными группами на поверхности мицеллы, и это приведет к большим значениям So, особенно при низкой ионной силе. И в самом деле, полярная головка этой молекулы занимает большую площадь на поверхности мицеллы, удерживая группы на достаточном удалении друг от друга. Это взаимодействие и определяет сферическую форму мицелл додецилсульфата. Чтобы убедиться в этом, проведем следующее рассмотрение.
5. Геометрия мицелл и критический параметр упаковкиГоворя о наиболее стабильной геометрии мицелл, следует принять во внимание три молекулярных параметра.
Sb, оптимальная площадь поверхности, занимаемой молекулой на гидрофобной поверхности раздела. Она частично зависит от свойств раствора, особенно ионной силы в случае заряженных молекул.
максимальная длина алкильной цепи в простых амфифильных молекулах с одной цепью и в фосфолипидах. Она определяет верхний предел размера мицелл, например радиус сферической мицеллы или толщину бислоя. Обратите внимание, что мицеллы никогда не имеют полостей или дырок, поэтому радиус сферической мицеллы не может превышать /, хотя и может быть меньше этой величины. Обычно он несколько меньше длины максимально вытянутой цепи, имеющей полностью-трансконфигурацию.
V, молекулярный объем углеводородной области амфифильной молекулы. Объем мицеллы, ограничиваемый границей раздела фаз углеводород-вода, считают равным Mv, где М - число молекул в мицелле.
Площадь поверхности, приходящейся на единицу объема, зависит от геометрии мицеллы, и именно этим в конечном счете определяется, какие мицеллы образуются различными амфифильными соединениями. Рассмотрим некоторые возможные формы мицелл.
Сферы. Если размер определяется длиной углеводородной цепи, то из всех возможных структур сфера имеет наибольшее отношение поверхности к объему; к образованию мицелл такой формы особенно склонны липиды с большой величиной So, такие, как додецилсульфат.
Деформированные сферы. Для них характерно меньшее значение отношения поверхность/объем, чем для сфер:
а) эллипсоиды: по-видимому, их образование маловероятно , поскольку на некоторых участках поверхности упаковка молекул в высшей степени невыгодна;
б) глобулы: состоят как бы из двух слившихся сфер. Их образование считается весьма вероятным.
Стержни и цилиндры. Характеризуются еще более низким отношением поверхность/объем. По краям, по-видимому, имеют закругления в виде полусфер, позволяющие устранить контактирование воды с неполярной областью при сохранении приемлемой упаковки молекул. Вислой. Имеет наименьшее отношение поверхность/объем; легче всего его образуют липиды с большим молекулярным объемом. Обратите внимание, что диски и плоские фрагменты бислоя энергетически весьма невыгодны из-за контактирования их краев с водой. При замыкании бислоя в сферические везикулы этот краевой контакт устраняется. Замыканию благоприятствует и энтропийный фактор, поскольку при этом образуются частицы меньших размеров, чем протяженные плоские фрагменты бислоя. Однако некоторые белки и пептиды стабилизируют фосфолипидные диски.
Зная параметр v/lSo, можно предсказать, какие мицеллы будут преимущественно образовываться теми или иными молекулами. Этот параметр называется критическим параметром упаковки и зависит от объема и длины неполярного участка молекулы, а также от оптимальной площади поверхности полярной головки. Рассмотрим, например, сферическую мицеллу радиусом R, содержащую М молекул.
Полная поверхность мицеллы = MSo = 4rrR2, Полный объем мицеллы = Mv = т/? 3, так что радиус мицеллы
![]()
Поскольку радиус мицеллы не может быть больше / - максимально возможной длины углеводородной цепи липидной молекулы, то условие упаковки липидов в сферические мицеллы будет выглядеть как
![]()
Аналогичные расчеты легко провести также для мицелл цилиндрической формы и для плоского бислоя. Критические параметры в этом случае будут равны
Цилиндр: = 1/2, Бислой: = 1.
Отсюда следует, что при заданных v, I и So, если величина < 1: 3, то будут образовываться сферические мицеллы, если 1 /3 < v/lSo < 1 /2, то мицеллы будут глобулярными или цилиндрическими, а если 1 /2 < v/lSo < 1, то липиды будут образовывать стабильный бислой. Наличие двух длинных ацильных цепей в природных фосфолипидах увеличивает объемную составляющую, именно это и приводит к формированию стабильного бислоя. У фосфолипидов с одной цепью, какими являются большинство синтетических детергентов, параметр v/lSo лежит между 1/3 и 1/2, поэтому они не образуют стабильных бислоев. По тем же причинам не образуют стабильных бислоев диацильные фосфолипиды с очень короткими цепями.
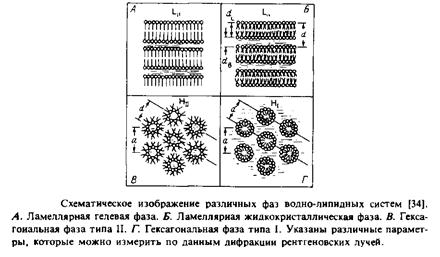
Особый интерес представляет случай, когда природные липиды характеризуются параметром v/ISo > 1 и, следовательно, не образуют стабильных бислоев. Эти липиды, имеющие относительно небольшие полярные головки, как мы уже видели, формируют обращенную гексагональную фазу. Их роль в биологических мембранах неясна, хотя и служит предметом активного обсуждения.
6. Форма липидных молекул
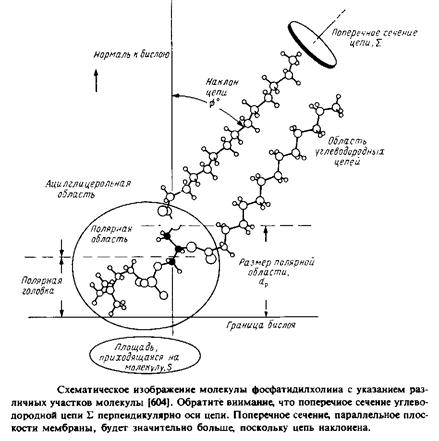
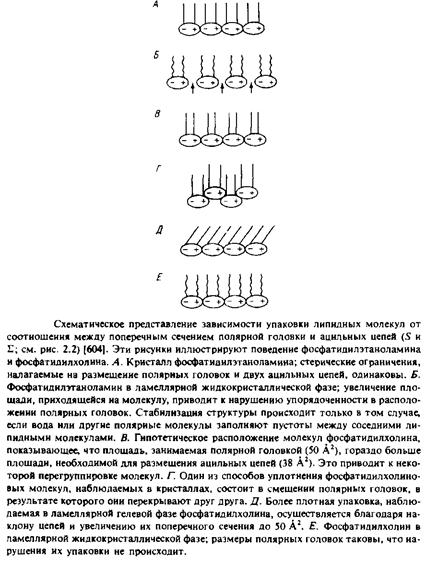
Итак, мы начали с рассмотрения термодинамических аспектов агрегации липидов. Однако ясно, что качественный анализ можно провести, проанализировав способы упаковки различных липидов с учетом геометрической формы их молекул. Это четко видно при сопоставлении общей формы липидных молекул, в частности при сравнении площади поперечного сечения углеводородного участка молекулы, примерно равной v/l, с оптимальной площадью поверхности, необходимой для размещения полярной головки So. Такой подход мы использовали, когда анализировали различия в характере упаковки фосфатидилэтаноламина и фосфатидилхолина в кристаллах и в фазе геля бислоя. Упрощенно липидные молекулы можно представить в виде конусов, цилиндров или перевернутых конусов в зависимости от соотношения между этими двумя величинами.
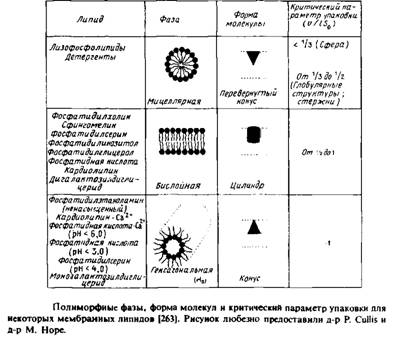
На рис.2.18 схематично показаны все эти формы и приведены конкретные примеры. Конечно, это – образное представление результатов термодинамического анализа, проведенного в предыдущих разделах, но оно позволяет легко осмыслить хотя бы на качественном уровне большой массив экспериментальных данных. На основе простого рассмотрения формы липидных молекул можно понять роль отдельных липидов в бислое, например в отношении стабилизации участков мембраны с большой кривизной и упаковки молекул вокруг мембранных белков.
Похожие работы
... является курсом, для изучения которого необходимо наличие знаний об основных принципах организации биологических молекул, строении и механизмах действия ферментов. Дисциплина биохимия мембран относится к дисциплинам специализации федерального компонента. 5. Распределение времени, отведенного на изучение дисциплины по учебному плану Форма учебной работы Форма обучения Очная По ...
... к уменьшению латеральной диффузии. 5. Липидно-белковые взаимодействия Большинство методов, применяемых для изучения упорядоченности и динамических свойств мембран, используется и для исследования липидно-белковых взаимодействий. Работы по изучению этих взаимодействий были в основном направлены на выяснение влияния мембранных белков на физическое состояние липидов. Рассмотрим типичную мембрану ...
... группы обращены внутрь цилиндра и формируют водный канал. Упаковка самих цилиндров также является гексагональной. Очень важно, что некоторые липиды образуют небислойные структуры. Действительно, многие очищенные мембранные липиды не образуют стабильных бислоев, а предпочитают находится в гек- сагональной фазе Ни. В качестве примера можно упомянуть ненасыщенные фосфатидилэтаноламины, а также ...
... . ЛИТЕРАТУРА: 1. Курс низших растений //Под ред. М. В. Горленко – М.: Высш. школа, 1981. 2. Жизнь растений, т. 1–3, - М.: Просвещение, 1974-77. 3. Н. Грин, У. Стаут, Д. Тейлор. Биология, т. 1-3. – М.: Мир, 1990. 4. Н.П.Горбунова , Е.С.Клюшникова, Н.А.Комарницкий. и др. Малый практикум по низшим растениям. – М.: Высш. школа, 1976. 5. Русанов В. А. Низшие растения. Методические указания ...
0 комментариев