Ферменты
Возможность проведения различных манипуляций с ДНК in vitro всецело зависит от наличия очищенных ферментов, которые специфическим образом разрезают, модифицируют и соединяют молекулы. В настоящее время отсутствуют чисто химические методы, с помощью которых можно было бы осуществлять перестройку молекул ДНК с такими селективностью и разнообразием, которые характерны для ферментативных реакций. В то же время даже с помощью довольно небольшого числа ферментов можно получать рекомбинантные молекулы ДНК. Большинство этих ферментов были открыты при обстоятельствах, не связанных с их использованием при манипулировании с молекулами ДНК. На самом деле каждый фермент играет важную роль катализатора в том или ином химическом процессе, протекающем в организме, из которого он выделен. Использование ферментов в качестве инструмента при манипулировании с ДНК зависит, в частности, от их доступности и стабильности, а особенно от их чистоты, и прежде всего от того, свободны ли они от примесей, влияющих на ферментативную активность.
Разные экзонуклеазы расщепляют цепь предпочтительно либо с 5'-, либо с 3'-конца, но иногда они не проявляют такой специфичности. Эндонуклеазам свободные концы не требуются, поэтому данные ферменты могут гидролизовать кольцевые молекулы ДНК. Разрезание осуществляется по внутренним фосфодиэфирным связям, при этом образуются фрагменты разной длины. С помощью экзонуклеаз тоже могут образовываться короткие полинуклеотидные фрагменты, однако конечным продуктом во многих случаях являются нуклеозидмонофосфаты, поскольку экзонуклеазы осуществляют гидролиз, отщепляя последовательно один остаток за другим.
Наконец, нуклеазы отличаются одна от другой по тому, с какой стороны от межнуклеотидного фосфодиэфирного мостика осуществляется гидролиз. Одни ферменты делают разрез между фосфатом и 3'-гидроксильной группой с образованием 5'-фосфомоноэфирных продуктов, другие – между фосфатом и 5'-гидроксильной группой.
Нуклеазы
а. Общие свойства
Нуклеазы позволяют специфическим образом модифицировать молекулы ДНК и РНК. Каждый фермент может быть отнесен к тому или иному классу в соответствии с его специфичностью или типом реакции, которую он катализирует. Так, ряд ферментов, подобно рестриктирующим эндонуклеазам, действует только на ДНК. Другие, подобно панкреатической РНКазе, гидролизуют только РНК. Есть ферменты, которые используют в качестве субстратов как ДНК, так и РНК. Одни нуклеазы предпочтительно действуют либо на двухцепочечные, либо на одноцепочечные полинуклеотидные субстраты, другие не проявляют такой выраженной предпочтительности.
Нуклеазы можно также разделить на две следующие категории: экзонуклеазы и эндонуклеазы.
Большинство ферментов упоминаются в тексте этой книги. Нуклеазы, отмеченные звездочкой, используются как рутинные реактивы в экспериментах по получению рекомбинантных молекул ДНК и поэтому рассматриваются более детально.
б. Нуклеазы, специфичные в отношении одноцепочечной ДНК
Эндонуклеазы. Некоторые эндонуклеазы гидролизуют одноцепочечные молекулы ДНК примерно в тысячу раз быстрее, чем двухцепочечные. Такая специфичность используется во многих экспериментах – при конструировании рекомбинантных ДНК, при гетеродуплексном анализе и даже при анализе экспрессии генов. Некоторые реакции, катализируемые подобными эндонуклеазами.
Несколько разных эндонуклеаз такого типа были достаточно хорошо очищены и охарактеризованы, чтобы их можно было использовать в качестве реактивов. Одна из них, нуклеаза S1, получена из высушенных препаратов плесневого гриба Aspergillus oryzae; источниками двух других широко используемых ферментов являются Neurospora и Mung beans. Каждый из этих трех ферментов проявляет максимальную активность и точность распознавания одноцепочечных и двухцепочечных молекул при определенных условиях. Все три фермента гидролизуют как ДНК, так и РНК. При разрыве фосфодиэфирных связей с помощью этих ферментов образуются 5'-монофосфатные и З'-гидроксильные концы.
Экзонуклеазы. Экзонуклеаза E. coli exo VII специфична в отношении одноцепочечных ДНК. Она обладает необычной экзонуклеазной активностью в том смысле, что инициирует отщепление как с 5'-, так и с З'-концов цепи, в то время как наиболее известные экзонуклеазы специфичны к какому-то одному концу. Продуктами гидролиза отдельных цепей экзонуклеазой ехо VII являются олигонуклеотиды длиной примерно 25 мономерных единиц, которые содержат 5'-фосфомоноэфирные концевые группы.
в. Нуклеаза Bal 31
Псевдомонада Alteromonas espejiana секретирует единственную дезоксирибонуклеазу, получившую название Bal 31. В отношении одноцепочечной ДНК, в том числе одноцепочечных участков двухцепочечной ДНК, Bal 31 ведет себя как эндонуклеаза, действуя аналогично другим эндонуклеазам, специфичным к одноцепочечным ДНК. Однако в отношении интактной двухцепочечной ДНК этот фермент проявляет экзонуклеазную активность, по-видимому, благодаря тому, что он способен распознавать локальные одноцепочечные участки. Bal 31 разрезает обе цепи на обоих концах дуплекса, т.е. осуществляет деградацию одновременно в направлениях 3' – >5' и 5'–>3'. В результате двухцепочечная молекула постепенно укорачивается. Если эмпирически оценить скорость этого процесса, то с помощью фермента Bal 31 можно получать фрагменты ДНК нужной длины. Хотя укорочение разных молекул ДНК происходит несинхронно, получается набор фрагментов, длина которых близка к заданной. В результате исчерпывающего гидролиза с помощью Bal 31 промежуточные олигонуклеотидные продукты расщепляются до 5'-мононуклеотидов.
г. РНКазы Н
Существует группа ферментов, получивших название РНКазы Н потому, что они специфически расщепляют цепь РНК в гибридном дуплексе РНК-ДНК. РНКаза Н E. coli представляет собой эндонуклеазу, продуктами действия которой являются олигорибонуклеотиды с 5'-фосфомоноэфирными концами. Этот фермент широко используется как реактив. Клетки эукариот тоже содержат подобную эндонуклеолитическую РНКазу Н. РНКаза Н-экзонуклеолитическая активность присуща экзонуклеазе III E. coli и обратным транскриптазам, кодируемым ретровирусами. Экзонуклеаза III расщепляет РНК до 5'-нуклеозид-монофосфатов в направлении З'–>5', а продуктами гидролиза цепи РНК с помощью обратной транскриптазы являются 5'-фосфорилированные олигорибонуклеотиды длиной от двух до десяти нуклеотидов.
Эндонуклеазы рестрикции
Эволюция наделила различные виды бактерий уникальными эндонуклеазами, позволяющими им отличать их собственную ДНК от чужеродной. Тем самым природа снабдила ученых богатым набором высокоспецифичных реактивов для расщепления ДНК. При изучении ДНК большое значение имеют две важные особенности рестриктирующих эндонуклеаз. Первая связана с замечательной способностью фермента узнавать специфические короткие нуклеотидные последовательности в ДНК. Вторая состоит в том, что существует большое количество различных эндонуклеаз рестрикции, каждая из которых узнает специфическую последовательность.
а. Три типа эндонуклеаз рестрикции
Эндонуклеазы типов I и И. Ферменты, относящиеся к группе эндонуклеаз типов I и II, – это сложные белки, обладающие активностями рестриктирующей эндонуклеазы и метилазы. Эти интересные ферменты не используются, однако, при конструировании рекомбинантных молекул ДНК. Ферменты типа I связываются с ДНК в специфических участках и затем производят двухцепочечные разрезы на разном расстоянии от сайтов узнавания, варьирующем от 400 п.н. до 7 т.п.н. Для осуществления ферментативного гидролиза ДНК необходимы Mg2+, ATP и S‑аденозилметионин. Последний активирует фермент. Разрезание сопровождается гидролизом АТР, при этом фермент утрачивает эндонуклеолитическую активность, но сохраняет АТРазную. Таким образом, эндонуклеазы типа I являются ДНК-зависимыми АТРазами. Кроме того, они представляют собой сайтспецифические метилазы, катализирующие образование 6‑метиладениновых остатков в сайте узнавания. Например, сайтом узнавания для фермента из E. coli K12 является
5'-AACNNN NN N GTGC‑3' 3‑TTGNNNNNNCACG‑5'
где N – любое основание, a N‑комплементарное ему основание. Эндонуклеаза разрезает цепь на значительном расстоянии от сайта узнавания, но при этом метилирование с образованием 6‑метил-аденина происходит в пределах этого сайта. Эндонуклеазная активность проявляется только при наличии полностью неметилированного сайта. Сайт узнавания для фермента E. coli K12 состоит из двух коротких специфических олигонуклеотидов, разделенных шестью-восемью неспецифическими парами оснований. Такая структура типична для сайтов узнавания ферментов типа I, обнаруженных у различных штаммов бактерий. Специфические олигонуклеотидные последовательности для разных ферментов различаются, но метилированные остатки А всегда находятся в одинаковых позициях.
Родственные системы рестрикции-модификации типа I кодируются аллельными локулами геномов различных кишечных бактерий. С каждой системой связаны три сцепленных гена: hsdR, hsdM и hsdS, расположенные в порядке, соответствующем порядку транскрипции. Полипептидные продукты hsdM и hsdS транслируются с одной двухцистронной мРНК и вместе составляют метилазу. Первый из них обладает метилазной активностью, а второй осуществляет сайтспецифическое узнавание. Продукт гена hsdR обладает эндонуклеазной активностью. Все три полипептида содержатся в различных пропорциях в активных препаратах ферментов типа I.
Ферменты типа III, так же как и эндонуклеаза типа I, обладают нуклеазной и метилазной активностями. Однако, несмотря на то, что ферменты типа III активируются S‑аденозилметионином и для своей работы требуют АТР, они не катализируют ее гидролиза. Эндонуклеазы типа III делают двухцепочечные разрезы в ДНК на расстоянии примерно 25 п.н. от своих сайтов узнавания. В присутствии АТР и S‑аденозилметионина те же ферменты катализируют сайтспецифическое метилирование. Ферменты типа III‑гетеродимерные белки. Их субъединицы кодируются двумя сцепленными генами, локализованными у некоторых штаммов Е. coli во внехромосомных геномах. Каждый такой ген представляет собой отдельную транскрипционную единицу. Один генный продукт узнает специфическую последовательность и обладает метилазной активностью, другой выполняет эндонуклеазную функцию.
Поскольку ферменты типа I не разрезают молекулы ДНК на репродуцирующиеся фрагменты и эндонуклеазные активности ферментов типа I и III конкурируют с метилированием, ни один из них не используется в качестве реагента при получении рекомбинантных ДНК.
Эндонуклеазы типа II. Рестриктирующие эндонуклеазы типа II являются основным инструментом при конструировании рекомбинантных молекул ДНК и при анализе структуры ДНК. Эти ферменты способны узнавать специфические короткие нуклеотидные последовательности и связываться с ними, но в отличие от эндонуклеаз типов I и III они производят двухцепочечные разрезы по специфическим фосфодиэфирным связям либо в пределах самого сайта узнавания, либо на вполне определенном небольшом расстоянии от него. Один и тот же фермент разрезает данную молекулу ДНК с образованием одинаковых наборов фрагментов. Длина фрагментов определяется расстоянием между специфическими последовательностями, узнаваемыми этим ферментом. Ферменты типа II гидролизуют фосфодиэфирные связи между 3'-гидроксильной группой и фосфатом, в результате чего образуется 5'-фосфомоноэфирная группа с одной стороны от разрыва и 3'-гидроксильная группа – с другой.
Сайт узнавания и разрезания для рестриктирующей эндонуклеазы Eco RI. Разрезание происходит в два этапа: сначала гидролизуется одна цепь, потом – другая. При обычных условиях продуктами реакции являются два дуплексных фрагмента с комплементарными одноцепочечными концами. В условиях, способствующих стабилизации водородных связей между четырьмя нуклеотидами из разных цепей, фрагменты могут реассоциировать.
б. Типичная рестриктирующая эндонуклеаза типа II
Эндонуклеаза Eco RI. Широко используемая рестриктирующая эндонуклаза Eco RI разрезает ДНК в тех местах, где встречается последовательность 5'-GAATTC‑3'. Как и в случае других рестриктирующих эндонуклеаз типа II, эта последовательность является палиндромом, т.е. в обеих цепях точно напротив друг друга находятся одинаковые последовательности, читаемые в направлении 5'–>3'. Eco RI гидролизует фосфодиэфирные связи между остатками G и А в каждой цепи. Поскольку эндонуклеаза Eco RI разрезает обе цепи в том месте, где встречается палиндромная последовательность 5'-GAATTC‑3', молекула ДНК разрезается на характерный для нее набор фрагментов.
Липкие концы. Эндонуклеаза Eco RI производит ступенчатые двухцепочечные разрезы, при этом у образующихся фрагментов ДНК на концах образуются короткие комплементарные одноцепочечные хвосты из четырех оснований – 5'-ААТТ‑3'. В зависимости от ионной силы раствора и температуры эти комплементарные хвосты либо остаются спаренными, либо денатурируют, и тогда образуются отдельные фрагменты с короткими одноцепочечными выступами на 5'-концах. При соответствующих условиях комплементарные хвосты воссоединяются. Одноцепочечные концы, образующиеся при расщеплении ДНК эндонуклеазой Eco RI, получили название липких, поскольку они способны спариваться друг с другом. Важным следствием образования ступенчатых разрывов является то, что фрагменты, получающиеся в результате обработки эндонуклеазой Eco RI двух разных ДНК, могут соединяться с помощью липких концов. При этом различия, затрагивающие двухцепочечные спиральные сегменты указанных ДНК, на процесс соединения не влияют.
Фермент. В отличие от рестриктирующих эндонуклеаз типов I и III ферменты типа II, подобные Eco RI, не катализируют метилирования. Метилазную активность проявляет другой белок. Активная эндонуклеаза Eco RI представляет собой димер, состоящий из двух идентичных полипептидных цепей с мол. массой 31000. Исходя из гомодимерной структуры можно было бы ожидать, что фермент будет действовать симметрично на идентичные последовательности двух частей сайта узнавания и разрезать обе цепи одновременно. Однако на самом деле гидролиз происходит последовательно.
Белок взаимодействует с участком около десяти пар оснований; шесть из них находятся в пределах сайта узнавания, остальные являются фланкирующими. Именно эти фланкирующие последовательности, по-видимому, определяют выбор цепи, которая будет разрезана первой. Кроме того, фланкирующие пары оснований влияют на общую скорость разрезания в данном сайте узнавания, так что в разных сайтах одной молекулы ДНК гидролиз осуществляется с разной скоростью. Были получены кристаллы комплекса Eco RI и олигонуклеотида 5'-TCGCGAATTCGCG‑3' и проведен их рентгеноструктурный анализ. Это позволило в деталях выяснить способ взаимодействия данного фермента и ДНК. Было установлено, что между двумя остатками аргинина и одним глутаматом, с одной стороны, и парами оснований в сайте узнавания ‑ с другой, образуются водородные связи, в результате чего происходит частичное раскручивание В-ДНК. О свойствах других рестриктирующих эндонуклеаз типа II известно значительно меньше, но, по-видимому, они аналогичны свойствам Eco RI.
в. Различные группы рестриктирующих эндонуклеаз типа II
Большой каталог реактивов. У всех ферментов обнаружено около 90 разных сайтов узнавания. Каждый из ферментов получен из определенного прокариотического организма, что и отражено в его названии. Так, Eco RI ведет свое происхождение из штамма Escherichia coli К12; Hae II и HaeIII – из Haemophilus aegyptius; Bam HI – из Bacillus amyloliquefaciens штамма H; Mbo I и Mbo II – из Moraxella bovis и т.д. Два разных фермента, имеющие одинаковые сайты узнавания, называются изошизомерами. Однако изошизомеры не обязательно делают разрез в одном и том же месте; сравните, например, Xma I и Sma I.
Палиндромные сайты узнавания и разрезания. Эндонуклеаза Eco RI – одна из многих рестриктирующих эндонуклеаз типа II, которые узнают различные палиндромные нуклеотидные последовательности и делают разрезы, в результате чего образуются фрагменты с комплементарными одноцепочечными хвостами. В пределах этой группы можно выделить несколько разновидностей ферментов. Например, Eco RI, Hind III и некоторые другие эндонуклеазы узнают последовательности из шести пар оснований; эндонуклеаза Hinf I узнает пять пар оснований, из которых центральным остатком может быть любой из четырех нуклеотидов. Эднонуклеаза Bgl I узнает шесть специфических нуклеотидных остатков, но они должны быть разделены в середине любыми другими пятью парами оснований. Эндонуклеаза Not I имеет сайт узнавания протяженностью восемь пар оснований; такие ферменты, как Taq I и Mbo I, имеют сайты узнавания из четырех нуклеотидов. Другая известная особенность касается свойств одноцепочечных концов, образующихся при действии различных рестриктирующих эндонук-леаз. Эндонуклеазы Eco RI, Hind III, Mbo I и Оа I образуют одноцепочечные хвосты, состоящие из 5'-концевых остатков каждой цепи, а эндонуклеазы Pst I и Hae II – из 3'-остатков.
Эндонуклеазы, имеющие различные сайты узнавания и разрезания, часто образуют идентичные липкие концы. Например, под действием эндонуклеаз Mbo I, Bcl I и Bam HI образуются 5'-концевые 5'-GATC‑3'. В результате фрагменты, получающиеся при расщеплении данной ДНК любым из этих ферментов, при смешивании и отжиге будут соединяться друг с другом. Однако фрагменты, получающиеся из различных ДНК при разрезании эндонуклеазой Bgl I, вряд ли будут соединяться при отжиге, поскольку одноцепочечные хвосты могут содержать любую последовательность из трех нуклеотидов.
Другие рестриктирующие эндонуклеазы типа II также узнают специфические палиндромные нуклеотидные последовательности, но разрезают фосфодиэфирный мостик в середине узнаваемой последовательности, в результате чего образуются фрагменты ДНК с тупыми двухцепочечными концами.
Непалиндромные сайты узнавания с разрезанием на некотором расстоянии от них. Ферменты типа II, но другой разновидности тоже узнают специфические нуклеотидные последовательности, но гидролизуют фосфодиэфирные мостики вне этих последовательностей. При этом узнаваемая последовательность не является палиндромом. В этих случаях рестриктирующие эндонуклеазы, по-видимому, «отсчитывают» точное число пар оснований от узнаваемой последовательности и затем разрезают цепи. Механизм отсчета таков, что места гидролиза разных цепей смещены одно относительно другого на один нуклеотид. В результате образуются фрагменты ДНК с одноцепочечными выступами длиной только в один нуклеотидный остаток.
г. Картирование сегментов ДНК с помощью рестриктирующих эндонуклеаз типа II
С помощью рестриктирующих эндонуклеаз можно разрезать сложные геномы или длинные сегменты ДНК на воспроизводимые наборы более мелких единиц. В свою очередь такие единицы можно разделить по размерам с помощью нескольких методов. Чаще всего для этого используют электрофорез фрагментов ДНК в полужидком геле, приготовленном на основе агарозы или полиакриламида. Обычно подвижность двухцепочечного фрагмента в электрическом поле обратно пропорциональна логарифму его размера. Используя в качестве маркеров фрагменты известной длины, легко определить размер интересующего нас фрагмента с помощью линейки и простого графика. Для проведения такого анализа обычно достаточно менее 1 мкг ДНК, поскольку фрагменты легко выявляются при окрашивании соответствующим красителем, например бромистым этидием.
Набор фрагментов, получающихся при расщеплении ДНК определенной рестриктирующей эндонуклеазой, является своеобразным «отпечатком пальцев» этой ДНК. Определяя, какие фрагменты образуются при расщеплении ДНК несколькими рестриктазами по отдельности и в разных комбинациях, часто удается установить порядок расположения сегментов в исходной молекуле, т.е. построить физическую карту ДНК, где указано положение каждого сегмента. Сложные геномы или большие молекулы ДНК дают при обработке рестриктирующими эндонуклеазами сложные наборы фрагментов, и для их анализа используют специальные компьютерные программы.
д. Защита ДНК посредством метилирования
Родственные метилазы. Геномы бактерий, кодирующие рестриктирующие эндонуклеазы, защищены от самодеградации с помощью специфических систем модификации. Метилазы, осуществляющие специфическую модификацию, узнают те же нуклеорестрикции в ДНК проявляют устойчивость к действию определенных эндонуклеаз. Например, в ДНК позвоночных часто встречаются динуклеотиды 5'-meCG‑3'. Если сайт рестрикции эндонуклеазы Hpa II содержит такой метилированный динуклеотид, то фермент не может разрезать ДНК в этом месте. Этот факт используется для определения в сложных геномах состояния метилирования таких динуклеотидов 5'-CG‑3', которые находятся в сайтах узнавания Hpa II. Несмотря на неспособность эндонуклеазы Hpa II разрезать динуклеотид 5'-CmeCGG‑3', ее изошизомер, эндонуклеаза Msp I, осуществляет такое разрезание. Сравнивая чувствительность фрагментов ДНК к двум указанным ферментам, можно локализовать метилированный цитозин на карте. Подобным же образом часто встречающуюся в ДНК растений последовательность 5'-СmеСTAGG‑3' можно отличить от неметилированной формы, 5'-СС‑3', если сравнить продукты, получающиеся при расщеплении ДНК с помощью изо-шизомеров Bst NI и Eco RII.
Независимые метилазы E. coli. При включении фрагментов эукариотической ДНК в бактериальные векторы и их репликации в клетках Е. coli или других прокариот характерный для них тип метилирования утрачивается и они метилируются способом, специфичным для новой клетки-хозяина. Например, в клетках Е. coli динуклеотиды 5'-CG‑3' не метилируются, и в результате сайты, ранее защищенные от действия эндонуклеазы Hpa II, становятся чувствительными к ней. Однако два обычных фермента E. coli: dam ДНК-метилтрансфераза, которая метилирует остаток А в последовательности 5'-GATC‑3', и dcm ДНК-метилтрансфераза, метилирующая остаток С в последовательности 5'-СС‑3', – образуют новые устойчивые сайты; ни одна из этих метилаз не является частью системы рестрикции-модификации. Кроме того, эукариотическая ДНК, реплицированная в E. coli, становится устойчивой к эндонуклеазам Mbo I и Bcl I благодаря тому, что в пределах их сайтов узнавания находится 6‑метиладенин. Заметим, что тот же самый 6‑метиладенин в сайте 5'-GATC‑3' не мешает работе эндонуклеаз Bam HI, Bgl I или Sau 3А; однако разрезание с помощью Sau 3А блокируется, если метилирован остаток С.
Фосфомоноэстеразы
Часто при проведении экспериментов с рекомбинантными ДНК или при анализе структуры ДНК приходится отщеплять концевые фосфомоноэфирные группы. Известно множество неспецифических фосфомоноэстераз. Эти ферменты, выделенные из клеток Е. coli и кишечника теленка, были получены в высокоочищенном виде. Фосфатазы гидролизуют как 5'-, так и 3'-концевые фосфомоноэфиры в ДНК и РНК.
Фосфомоноэфирные группы, находящиеся на конце одноцепочечных разрывов в дуплексной ДНК или экранированные нависающей над ними второй цепью, подобные тем, которые образуются при разрезании эндонуклеазой Pst I, удаляются с помощью фосфатазы только при слабоденатурирующих условиях.
Полинуклеотидкиназа
Киназы составляют большой класс ферментов, катализирующих фосфорилирование многих биохимических соединений – от небольших молекул до очень крупных макромолекул, включая полипептиды и полинуклеотиды.
Полинуклеотидкиназа, широко используемая в качестве реактива в экспериментах с рекомбинантными ДНК, была выделена и очищена из клеток E. coli, инфицированных бактериофагом Т4. Фермент кодируется геномом бактериофага. Донором фосфата служит АТР, а одним из продуктов реакции является ADP. В ходе реакции специфически фосфорилируются 5'-концевые гидроксильные группы молекул ДНК и РНК; 3'-концевые гидроксильные группы не фосфорилируются. Одной из важных сфер применения полинуклеотидкиназы является мечение 5'-конца полинуклеотидной цепи с помощью радиоактивного 32Р с использованием АТР, меченной по у-фосфату. Последовательное действие фосфатазы и полинуклеотидкиназы приводит к замещению немеченого 5'-концевого фосфомоноэфира на радиоактивный без каких-либо других изменений в цепи.
ДНК-лигаза
Получение рекомбинантных молекул ДНК включает объединение in vitro сегментов ДНК из различных источников. Благодаря тому, что при расщеплении ДНК определенными эндонуклеазами образуются фрагменты с липкими концами, при отжиге эти фрагменты довольно легко соединяются, однако водородные связи, удерживающие их вместе, в обычных условиях оказываются относительно слабыми и легко разрушаются. Для ковалентного сшивания фрагментов используют ДНК-лигазу, которая катализирует образование фосфодиэфирных связей между соседними нуклеотидами.
Чтобы лигирование было успешным, в объединяемых цепях должен произойти отжиг комплементарных концов; в этом случае происходит лигирование обеих цепей. Если два одноцепочечных сегмента удерживаются рядом за счет образования водородных связей с интактной комплементарной цепью, то образование фосфодиэфирной связи происходит только в одной цепи. ДНК-лигаза фага Т4 способна также соединить двухцепочечные молекулы с тупыми концами, катализируя образование фосфо-диэфирных связей в обеих цепях.
Цепи удлиняются путем последовательного присоединения нуклеотидов к праймеру со свободной 3'-гид-роксильной группой; выбор нуклеотидного остатка на каждом этапе определяется ДНК-матрицей. ДНК-полимераза I E. coli катализирует и некоторые другие важные реакции. Две из них имеют особое значение для экспериментов с рекомбинантными ДНК: это 3'–>5'- и 5'–>3'-экзонуклеазные реакции. В обоих случаях образуются продукты с 5'-фосфомоноэфирными концами. Две указанные экзонуклеазные активности присущи разным участкам молекулы ДНК-полимеразы I, которые можно разделить, обработав белок протеолитическими ферментами. После разделения обнаруживается, что 3'–>5'-экзонуклеазная и полимеразная активности связаны с большим по размеру полипептидом, содержащим карбоксильную группу на конце, а 5'–>3'-экзонуклеазная активность – со вторым, более мелким фрагментом.
б. Никтрансляция
Реакции, катализируемые ДНК-полимеразой I, нашли широкое применение. Например, часто используется способность ДНК-полимеразы I катализировать одновременно как полимеризацию, так и 5'–>3'-экзонуклеазное расщепление. Фермент, выступая в роли экзонуклеазы, осуществляет деградацию цепи в 5'–>3'-направлении, начиная с 5'-конца одноцепочечной бреши в двухцепочечной ДНК, а выступая в роли полимеразы, восстанавливает цепь путем последовательного присоединения мононуклеотидных остатков к свободной 3'-гидроксильной группе на другом конце бреши. Собственно синтеза ДНК не происходит: брешь лишь перемещается вдоль цепи, чем и объясняется название этого процесса – никтрансляция. Проводя никтрансляцию в присутствии а-32Р-меченных дезоксинуклеозидтрифосфатов, в качестве субстратов получают меченые фрагменты ДНК с высокой удельной активностью.
в. Заполнение брешей
ДНК-полимераза способна превращать фрагменты ДНК с липкими концами во фрагменты с тупыми концами при наличии выступающего 5'-конца. 3'-гидроксильный конец служит праймером, 5'-выступ – матрицей; пробел на 3'-конце заполняется путем последовательного присоединения дезоксинуклеотидных остатков. Для заполнения лучше использовать большой карбоксиконцевой фрагмент ДНК-полимеразы I, получаемый в результате протеолиза; это позволяет избежать 5'–>3'-экзонуклеазного расщепления матрицы. Липкие концы можно превратить в тупые и с помощью специфичной к одноцепочечной ДНК нуклеазы, однако в этом случае утрачивается несколько нуклеотидных остатков.
РНК-зависимые ДНК-полимеразы
Эти ферменты были выделены из РНК-содержащих опухолеродных вирусов. Они позволяют синтезировать ДНК на РНК-матрице in vitro. Реакция, катализируемая обратными транскриптазами, аналогична стандартным реакциям с участием ДНК-полимераз и, как в случае с другими ДНК-полимеразами, нуждается в затравке. В качестве матрицы обычно используется одна цепь РНК, на которой синтезируется комплементарная цепь ДНК. В результате образуется гибридная молекула РНК–ДНК. Часто удобным праймером служит короткая цепочка полидезоксириботимидиловой кислоты, поскольку она способна спариваться с полирибоаде-ниловой кислотой, обычно находящейся на концах эукариотических мРНК; в результате такого спаривания инициируется синтез ДНК-копии этой РНК.
кДНК-копия молекулы мРНК может быть превращена в двухцепочечную ДНК. Для этого, прежде всего, с помощью РНКазы Н или щелочного гидролиза удаляют исходную матричную РНК. Оставшаяся одноцепочечная кДНК служит собственным праймером при синтезе второй комплементарной цепи ДНК. Как это происходит, не совсем ясно. Последняя реакция может катализироваться либо ДНК-полимеразой I, либо обратной транскриптазой. По-видимому, праймером служит короткая шпилечная структура, образующаяся вблизи 3'-гидроксильного конца первой цепи. Конечный дуплекс все еще содержит шпильку на одном из концов, которая разрезается специфичной в отношении одноцепочечной ДНК нуклеазой с образованием двух полностью комплементарных цепей ДНК.
Терминальная дезоксинуклеотидил-трансфераза
а. Полимеризация без матрицы
Терминальная дезоксинуклеотидилтрансфераза является в определенном смысле полимеразой, поскольку она катализирует синтез полидезоксирибо-нуклеотидов из дезоксирибонуклеозидтрифосфатов с высвобождением неорганического пирофосфата. Подобно ДНК-полимеразам, она не способна инициировать синтез новой полимерной цепи и поэтому требует присутствия праймера со свободной концевой 3'-гидроксильной группой. Однако в отличие от истинных ДНК-полимераз она не нуждается в матрице и не способна что-либо копировать вообще. Продукт полимеризации соответствует дезокси-нуклеозидтрифосфатам, используемым в качестве субстрата. Если в реакции участвует dATP, то продуктом является полидезоксиадениловая кислота, находящаяся на 3'-конце праймера; если используется dGTP, то к праймеру оказывается присоединенной poly. Поскольку терминальная дезоксинуклеотидилтрансфераза не копирует матрицу, продуктом синтеза является одноцепочечный полимер. При использовании в качестве праймера двухцепочечной молекулы на каждом конце дуплекса образуются одинаковые 3'-хвосты. На самом деле терминальная дезоксинуклеоти-дилтрансфераза предпочитает одноцепочечные, а не двухцепочечные праймеры. Если имеется полностью двухцепочечный фрагмент ДНК, к которому нужно присоединить одноцепочечные хвосты, можно использовать различные методы получения одноцепочечных концов, способных служить праймерами.
б. Синтез липких концов
С помощью дезоксинуклеотидилтрансферазы к молекулам ДНК, не имеющим липких концов, можно присоединить такие концы. Тупые концы образуются при механическом разрыве больших молекул ДНК, при обработке ДНК с помощью рестриктирующих эндонуклеаз, дающих тупые концы, или при действии неспецифических ДНКаз. Например, если к одному набору фрагментов ДНК присоединить poly, а к другому – poly и смешать эти фрагменты, то произойдет их соединение друг с другом. Пробелы, образующиеся из-за неравной длины poly- и ро1уА) – хвостов, могут быть заполнены с помощью ДНК-полимеразы I, а концы соединены ДНК-лигазой. Такой подход использовался при конструировании первой рекомбинантной молекулы ДНК. И хотя открытие рестриктирующих эндонуклеаз сильно упростило процедуру получения липких концов при рекомбинации молекул ДНК in vitro, иногда для их создания все еще используется терминальная дезоксинуклеотидил-трансфераза.
РOLY-полимераза
Подобно терминальной дезоксинуклеотидил-трансферазе, po1y-полимераза присоединяет нуклеотидные остатки к 3'-концу цепи без участия матрицы. Однако po1y-полимераза проявляет специфичность в отношении РНК. Праймером является полирибонуклеотид, а субстратом – АТР. При этом GTP, СТР, UTP или dATP не могут заменить ATP. Po1y-полимераза выполняет высокоспециализированную и важную функцию в экспериментах с рекомбинантными ДНК: ее используют для присоединения po1y-концов к молекулам РНК при синтезе кДНК.
Похожие работы
... межпредметных связей между биологией и химией.Следует использовать знания,полученные учениками при изучении неорганической химиии в курсе 8-9 классов (темы:”Кислород,оксиды,горение”, ”Водород”, ”Кислоты,соли,основания”, “Строение вещества”). Формирование понятие “фермент” в курсе “Общая биология” Дальнейшее знакомство с ферментами ученики продолжают в курсе “Общая биология”. Здесь происходит ...
... (белка). Для целей определения ферментов могут быть использованы не только измерение поглощения света, но также измерения флюоресценции - спектрофлюорометрические методы. Такое определение активности фермента в ряде случаев по чувствительности превосходит спектрофотометрические методы на целый порядок величины. Некоторые коферменты и субстраты обладают сильной флюоресценцией. НАД и НАДФ в ...
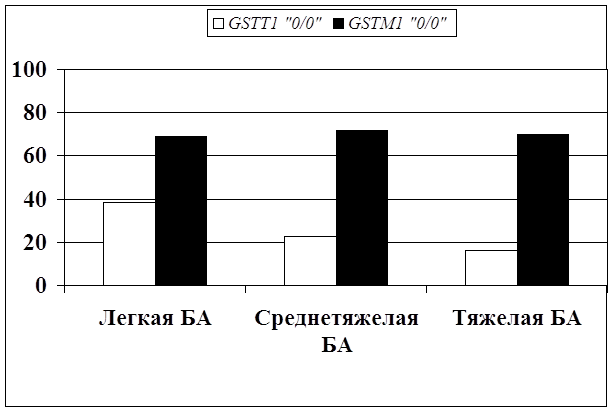
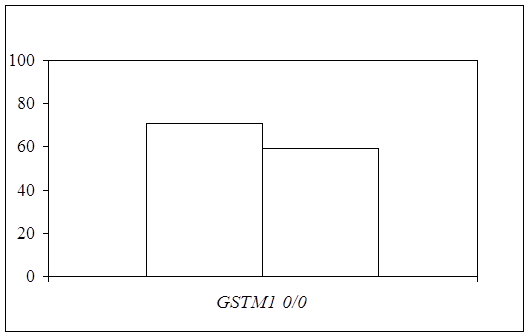
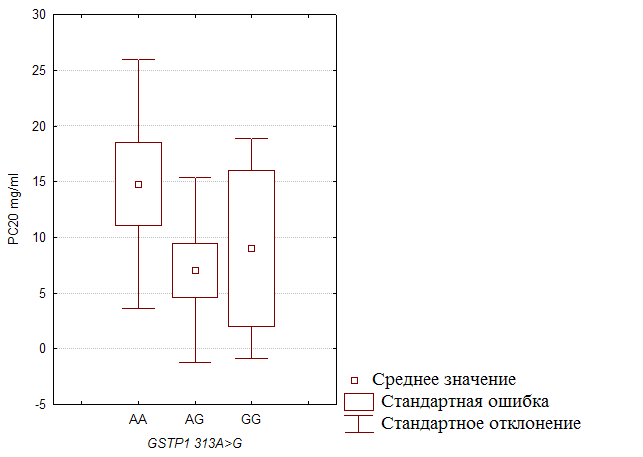
... препаратов. Установлена связь полиморфизма 313A>G гена GSTP1 с изменчивостью уровня аланинаминотрансферазы (р=0,021). 7. Выявлены различия в структуре генетической подверженности к бронхиальной астме и туберкулезу по генам ферментативной системы метаболизма ксенобиотиков: гены GSTM1, CYP2E1 и CYP2C19 связаны с бронхиальной астмой и значимыми для заболевания качественными и ...
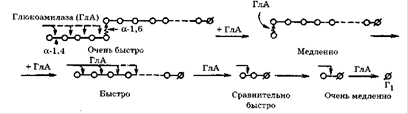
... амілази і пуллуланази або альфа-амілази і глюкоамілази, активних при високій температурі. Однак складність культивування анаеробних бактерій в заводських умовах робить цей спосіб отримання препарату амілолітичних ферментів практично непридатним. З літературних даних відомо, що найбільш термостабільними гідролітичними ферментами, такими як альфа-амілази, пуллуланази, а в ряді випадків і протеази є ...

0 комментариев