План
Введение
1. Аммиачные удобрения
Водный аммиак или аммиачная вода
Мочевина
Натриевая селитра
Сульфат аммония
2. Калийные удобрения
Поташ
Сульфат калия
3. Фосфорные удобрения
Двойной суперфосфат
Суперфосфат
Фосфоритная мука
4. Комплексные удобрения
Аммофос
Кали-магнезия
Нитроаммофоска
Нитрофоска
Вывод
Приложения
Литература
Введение
Минеральные удобрения - источник различных питательных элементов для растений, в первую очередь это азот, фосфор и калий, а затем кальций, магний, сера, железо. Все эти элементы относятся к группе макроэлементов, так как они поглощаются растениями в значительных количествах. При полном отсутствии любого элемента в почве растение не может расти и развиваться нормально. Все минеральные элементы участвуют в сложных преобразованиях органических веществ, образующихся в процессе фотосинтеза. Растения для образования своих органов - стеблей, листьев, цветков, плодов, клубней - используют минеральные питательные элементы в разных соотношениях.
В целом прогнозируется, что в течение оставшихся лет текущего десятилетия мировое потребление минеральных удобрений будет увеличиваться в соответствии с ростом мирового населения. Несмотря на то, что в развитых странах Западной и Восточной Европы, включая бывший СССР и Северную Америку, живёт лишь около четверти населения земного шара, в 1990 году на эти страны приходилось 56% от общего мирового потребления минеральных удобрений. Однако доля развивающихся стран в общем, объёме потребления увеличилась с 29% в 1980 году до 44% в 1990 году и ожидается, что эта доля будет продолжать увеличиваться, хотя и более медленными темпами, чем в 80-е годы. Потребление в Северной Америке и Западной Европе, по-видимому, сократится из-за изменений в сельскохозяйственной политике (в частности, из-за мер, направленных на сокращение излишков продукции растениеводства в Западной Европе), а также из-за возрастающей обеспокоенности по поводу экологических проблем, которая в некоторых из этих стран привела к введению законодательных актов, направленных на защиту окружающей среды. Опасения, связанные с нитратами, (сильные в Западной Европе), распространяются на другие развитые регионы. Уже отмечено, и, по-видимому, будет продолжаться сокращение потребления минеральных удобрений в Восточной Европе и бывшем СССР - вследствие недавних экономических изменений. Приведённый прогноз по увеличению спроса в этих регионах, безусловно, нуждается в пересмотре в свете последних экономических изменений.
Согласно более позднему прогнозу, в бывшем СССР и Восточной Европе общее потребление минеральных удобрений будет сокращаться приблизительно на 3 млн. т в год. В целом, однако, прогнозируется, что мировое потребление удобрений будет увеличиваться. [14]
Целью этой курсовой работы является обобщение современных сведений о выпуске минеральных удобрений, особенностях их использования в зависимости от физиологического действия, химического состава, а также собраны некоторые сведения об истории их разработки.
Немаловажным является также разработка справочных материалов, которые могут быть использованы для создания электронных изданий и в курсе преподавания химии в школах.
Курсовая состоит из четырех разделов, иллюстративного материала и списка использованной литературы.
1. Аммиачные удобрения
Аммиачная селитра - (NH4NO3), содержащая 34-35% азота, наиболее распространенная форма азотных удобрений. Соль бесцветна, гигроскопична t пл. - 169,6, поэтому выпускается в гранулированном виде (диаметр гранул 1-3 мм) и хранится в сухом помещении в пятислойных бумажных или полиэтиленовых мешках. [1]
Значение азотного удобрения для растений, а также роль бобовых культур (связывающих молекулярный азот) в обогащении почвы азотом были показаны французским ученым Буссенго (современник Либиха), который уже тогда отмечал положительное действие чилийской селитры как удобрения. [7]
При внесении данного удобрения в кислую почву необходимо опережающее известкование, поскольку аммиачная селитра - физиологически кислое удобрение. При его использование нужно помнить, что одна половина азота содержится в форме аммония, который способен поглощаться почвой, другая - в форме нитратов, обладающих большой подвижностью в почвенном растворе. Это позволяет широко дифференцировать способы, дозы и сроки применения в зависимости от свойств почвы, климата и биологических особенностей удобряемых культур. Аммиачную селитру вносят в качестве допосевного удобрения. [3]
Соль получается при нейтрализации азотной кислоты аммиаком.
Производство минеральных удобрений по видам, тыс. т
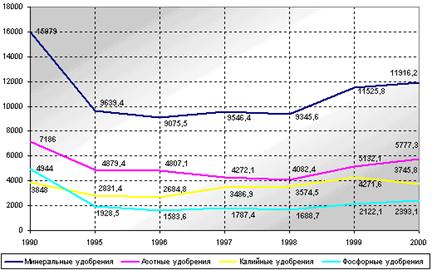
К 2000 г. производство минеральных удобрений сократилось по сравнению с 1990 г. в 1,3 раза, в том числе азотных - в 1,2 раза, фосфорных - в 2,1 раза, производство калийных удобрений увеличились в 1,03 раза (рис.1).
В последние десять лет в производстве минеральных удобрений наблюдалась тенденция к снижению относительных объемов выпуска фосфорных и росту производства калийных удобрений. [14]
Водный аммиак или аммиачная водаВодный аммиак или аммиачная вода NH4OH - раствор аммиака в воде, содержащий 20-25% аммиака. Для удобрения применяют водный аммиак двух сортов: с содержанием 20% аммиака (16%N) и 25% (20,5 N). При температуре 150С удельный вес водного аммиака первого сорта составляет 0,910. Второго сорта - 0,927. Аммиачная вода не разрушает черные металлы, замерзает при температуре - 33-560С. Ее лучше перевозить на близкие расстояния. Азот в этих удобрениях находится в основном в форме свободного аммиака, и только незначительная часть в виде катиона NH4+. Это определяет их отличие от твердых нитратных и аммонийных азотных удобрений не только по физическим, но и по агрохимическим свойствам. [1]
Начало использования аммиака связано с именем советского ученого Прянишникова Д.Н. (1865-1948). Он создал основную теорию азотного питания растений. Ученые и практики были убеждены, что растения могут питаться лишь нитратным азотом селитры, и констатировали, что внесение аммонийных удобрений вызывает угнетение и гибель растений. Но многолетние исследования Д.Н. Прянишникова свидетельствуют о том, что растения не только способны усваивать азот из аммония, но и поглощают его быстрее нитратного. [6]
По агрономической эффективности жидкий аммиак не уступает твердым азотным удобрениям, а в некоторых случаях может быть более эффективным, в частности на легких почвах в условиях орошения или в увлажненных районах. Чтобы исключить потери азота при улетучивании аммиака, жидкие азотные удобрения необходимо заделывать в почву в зависимости от дозы азота и типа почв на глубину: безводный аммиак - 14-18 см, водный - 10-12 см. [4] Выпуск аммиака, сырья для производства азотных удобрений, по итогам I полугодия 2005 года возрос на 16% до 1,3 млн [15]
МочевинаМочевина - [CO (NH2) 2] содержит 46% азота. Это самое концентрированное из твердых азотных удобрений. Азот в мочевине находится в органической форме в виде амида карбаминовой кислоты. Мочевина биологически кислое удобрение. По величине потенциальной кислотности она близка к аммиачной селитре. Выпускается в гранулированном виде (диаметр гранул 0,2-2,5 мм их покрывают жировой добавкой), обладает хорошими свойствами, слабо слеживается при хранении. Хорошо растворима в воде, спиртах, аммиаке, плохо - в эфире. [5]
Мочевина конечный продукт обмена белков у многих беспозвоночных, рыб, земноводных, млекопитающих, человека. Открыта французским химиком И. Руэлем в 1773 году. Мочевина входит в состав многих гигиенических и косметических средств. [9]
Мочевину эффективно применять во всех почвенных зонах страны. Особенно перспективно применение ее в районах орошения (хлопчатник) и во влажных субтропиках. Лучше ее вносить за 10-15 дней до посева, после разложения биурета. В почве она растворяется и под действием фермента уреазы превращается в углекислый аммоний. При использовании в качестве некорневой подкормки концентрация раствора до 5% не вызывает ожога листьев. [7]
Мочевина получается в результате взаимодействия углекислого газа и аммиака при высоком давлении и температуре.
CO2+2NH3= (NH2) 2+H2O [3]
Производственный потенциал химической индустрии в России размещен на 58 предприятиях, расположенных практически во всех регионах России, кроме Дальнего Востока. Их общая мощность - 19,6 млн. т в 100% питательных веществ, объем действующих мощностей на 1 января 2001 г составил 18,1 млн. т. Четырнадцать предприятий имеют ежегодный выпуск свыше 300 тыс. т. (в 100% питательных веществ). Основными из них являются: ОАО "Уралкалий", ОАО "Сильвинит", ОАО "Аммофос", ОАО "Кирово-Чепецкий ХК", ОАО "Воскресенские минудобрения" и ОАО "Акрон" (г. Новгород), которые успешно действуют не только на внутреннем рынке, но и на внешнем. В современных условиях их производственный потенциал используется на 70 - 88% против среднеотраслевого показателя 59,1%. [14]
Натриевая селитра
Натриевая селитра NaNO3 - в химически чистом виде бесцветные кристаллы, хорошо растворимые в воде. В сельском хозяйстве применяют техническую натриевую селитру представляющую собой кристаллы сероватого или желтоватого цвета. В первом сорте должно содержатся NaNO 3 - не менее 99%, влаги не более 1%, во втором соответственно 98% и 2%. Удобрение гигроскопично, при хранении слеживается, рассеиваемость удовлетворительная лишь в сухом состоянии. [5]
Впервые это вещество стало использоваться как удобрение в 1825 г в Гамбурге. [4]
Удобрение физиологически щелочное, поэтому целесообразно применять на кислых почвах. Входящие в состав Катины натрия обуславливают положительное действие на урожай сахарной и кормовой свеклы. Натриевую селитру также применяют в пищевой промышленности для консервирования, в металлургии, в стекольной промышленности. [7]
Добывается из природных залежей в Чили, известна под названием чилийской селитры. В промышленности получают путем адсорбции оксилов азота раствором щелочи с последующим окислением образовавшихся нитратов натрия азотной кислотой. Другой способ получения основан на обменной реакции между нитратами кальция и аммония с натриевыми солями. [2]
2CaNO3+2NaNO3=2NaNO3+CaCl2
Сульфат аммонияСульфат аммония [ (NH4) 2SO4] - сернокислый аммоний содержит 20,5% азота. И до 24% серы. Представляет собой кристаллический продукт белого или серого цвета. В нем могут присутствовать небольшие примеси серной кислоты, что придает удобрению слабокислую реакцию. Технический сульфат аммония, выпускаемый на удобрение, может иметь примеси Ca, Mg, SiO2, следы родананистого аммония и некоторое количество органических веществ, смоляных кислот, фенола. [1]
В сухом состоянии обладает хорошими физическими свойствами и при хранении сохраняет рассыпчатость. Производится в крупнокристаллическом виде. [5]
Растения из сернокислого аммония быстрее поглощают катион, чем анион, так как потребность их в азоте больше по сравнению с серой. Находясь в поглощенном состоянии, ионы аммония приобретают меньшую подвижность. Поэтому устраняется опасность вымывания азота в сильно влажную почву. Сульфат аммония наиболее эффективен в условиях орошения или избыточного увлажнения. [7]
До ХХ века растительность на Земле существовала за счет почвенного азота, накопленного свободно живущими и симбиотическими азотфиксирующими микроорганизмами. Сто лет тому назад или чуть больше после открытия Габером способа химического восстановления молекулярного азота появился технический азот минеральных удобрений. В советское время за счет развития химической промышленности производилось много минеральных удобрений, им было отдано предпочтение в снабжении азотом сельскохозяйственных культур. [10]
Специально как удобрение в России не производится, но получается в больших количествах как побочный продукт коксогазового производства и капролактамовой промышленности. Получается при взаимодействии аммиака с серной кислотой. При выпаривании раствором сульфат аммония выпадает в виде кристаллов. [14]
По уровню концентрации производства отечественная промышленность минеральных удобрений занимает третье место в мире, уступая США и Китаю, единичные линии производства по своей мощности соответствуют зарубежным аналогам, в остальном уступая оборудованию современных зарубежных предприятий. Существенные различия наблюдаются в техническом состоянии основных фондов и эффективности их использования. [13]
2. Калийные удобрения
Калийная селитра (азотнокислый калий, нитрат калия) KNO 3 - хорошо усвояемое растениями высококонцентрированное азотно-калиевое удобрение. Содержит N-13,59% и К2О - 46,5%. По стандарту различают 3 сорта (в промышленном продукте должно быть не менее 98% KNO3). Калиевая селитра обладает хорошими физическими свойствами. Гигроскопичность ее незначительная, хорошо рассеивается. Растворимость ее в воде высокая (в 1 л при10 С0-212г соли). Типичное физиологически щелочное удобрение. Представляет собой мелкие сухие на ощупь кристаллы белого цвета, на раскаленном угле вспыхивают, окрашивая пламя в фиолетовый цвет. [5]
Среди ученых внесших вклад в разработку применения калийных удобрений достойное место занимает выдающийся ученый А.Т. Кирсанов. Он уделял немало внимания проблеме эффективного использования калийных удобрений и взаимосвязью калийных и азотных удобрений. В связи с этим опубликовал серию работ. Изучая взаимодействия различных видов удобрений, А.Т. Кирсанов еще в 1934 г пришел к выводу, что при сильном недостатке калия азотные удобрения не только не повышают урожай, но и даже губят его. [4]
Калийная селитра может с успехом применятся под все сельскохозяйственные культуры, особенно эффективна под лен, овощные, табак, виноград, цитрусовые. Используется в качестве основного удобрения. При достаточном содержании уровня калия в почве растения более экономно расходуют влагу и такие элементы как азот, фосфор. [7]
Получают несколькими способами: взаимодействием растворов нитрата натрия и хлорида калия
NaNO3+KCl= KNO3 +NaCl
Поглощением NO2 щелочью KOH.
Нейтрализацией HNO3+KOH = KNO3+H2O.
В небольших количествах в России встречается в виде маломощных природных скоплениях, приуроченных к сухим бессточным котловинам в районах с жарким климатом. За рубежом природные месторождения имеются в Индии (бенгальская селитра), Египте, Чили, Иране и некоторых других странах. [8]
ПоташПоташ - K2CO3 (углекислый калий). В кальцинированном поташе должно содержаться 63-66,7% оксида калия. Кальцинирование осуществляют для уменьшения гигроскопичности. Поташ и бикарбонат калия (KHCO3) содержатся также в печной золе (при сжигании дров или соломы), в цементной пыли и отходах алюминиевого производства. Их тоже следует использовать как удобрение. Теоретическое содержание оксида калия в отходах - 47%, но на практике оно гораздо ниже из-за примесей. [1]
Поташ представляет собой бесцветные кристаллы. Растворимость - 113,5 г на 100 г воды при 200С. [5]
Поташ является хорошим источником калия для культур, чувствительных к хлоридам, а также на кислых почвах, так как он частично их нейтрализует.
Только свекла, а также некоторые овощные культуры положительно реагируют на хлористый натрий, присутствующий в калийных солях. Однако на кислых дерново-подзолистых почвах хлористый калий активирует подвижность алюминия и марганца, что депрессирует рост свеклы, клевера и других культур. Такие почвы необходимо периодически известковать [7]. Физиологически роль калия в растении весьма многогранна. Над этой проблемой работало немало ученых-агрохимиков: С.И. Вольфкович, А.Т. Кирсанов, И.П. Малеченков [9]. Калий сосредотачивается в наиболее молодых частях растений, много его содержится в пыльце. Он способствует нормальному ходу фотосинтеза, передвижению углеводов (сахара, крахмала) их накоплению в продуктивной части урожая, а также синтезу белков. Культуры, обеспеченные калием лучше переносят недостаток воды при кратковременных засухах, он повышает прочность стеблей, увеличивает устойчивость растений к некоторым болезням.
Основным сырьем для производства всех калийных удобрений служат различные калийсодержащие минералы (руды) природных месторождений. Для производства хлоридных удобрений (хлористый калий) служат сильвинитовые руды, а для производства поташа идет нефелиновый концентрат. Из этого концентрата кроме поташа в результате комплексной переработки получают еще окись алюминия, цемент и соду. Поташ хотя и является хорошим бесхлорным калийным удобрением, но в больших хозяйствах его в качестве удобрения почти не применяют из-за его плохих физических свойств. Поташ содержится и в печной золе от сжигания дров и особенно соломы. Вот почему золу тоже надо всегда хранить в герметично закрытой таре, предохраняя от попадания в нее влаги. Отсыревая, зола тоже теряет свои качества калийного удобрения [10].
Сульфат калияСульфат калия (сернокислый калий, K2SO4). Ценнейшее удобрение, особенно для культур, страдающих от хлоридов, содержащее К2О до 48%, не более 1% MgO и не выше 10% влаги. Удобрение негигроскопично, хорошо рассеивается, предназначено для подкисления почвы. Сульфат калия представляет собой бесцветные кристаллы. Растворимость - 10 г на 100 г воды [5].
В 1865 г. началась добыча калийных солей в Стассфурте. В дореволюционной России калийные удобрения не производились вследствие слаборазвитой промышленности. В СССР за годы довоенных пятилеток на базе открытых советскими учёными месторождений калия создана мощная калийная промышленность, удовлетворяющая возрастающую потребность сельского хозяйства в калийных удобрениях [7].
Больше всего калия потребляют корне - и клубнеплоды - подсолнечник, бобовые культуры и гречиха. Менее всего растения обеспечены калием на торфяных, супесчаных и пойменных почвах. Нередко даже внесение одного калия значительно повышает урожай.
Один из способов производства сульфата калия сводится к обменному разложению хлорида калия и сульфата магния:
2KCL + 2MgSO4 = K2SO4 • MgSO4 + MgCL2
K2SO4 • MgSO4 + 2KCL = 2K2SO4 + MgCL2
Производство и применение минеральных удобрений в некоторых странах мира на 2001г [13]:
| Страна | Площадь пашни, млн. га | производство минудобрений млн. т | применение минудобрений млн. т | импорт удобрений млн. т | экспорт удобрений млн. т | валовое производство зерна и бобовых млн т |
| Китай | 124 | 29,2 | 34,6 | 6,9 | 1,3 | 462 |
| США | 177 | 16,5 | 28,5 | 14 | 7,4 | 338 |
| Канада | 45,6 | 13 | 2,5 | 6,7 | 10,1 | 57 |
| Россия | 84,8 | 11,5 | 1,4 | --- | 9,6 | 65,4 |
| Германия | 11,8 | 4,3 | 2,7 | 1,7 | 3,3 | 45,1 |
| Франция | 18,3 | 1,6 | 4,1 | 3,3 | --- | 67,5 |
3. Фосфорные удобрения
Хлористый калий (KCl) - основное калийное удобрение во всем мире. Содержание оксида калия составляет: в химически чистой соли - 63,2%, в технической соли, в том числе идущей на удобрения - 52,4 - 61,9%. Он отличается повышенной гигроскопичностью, особенно если кристаллы его мелкие. Поэтому современная технология производства дает продукт крупнокристаллический в результате обработки аминами. По внешнему виду его кристаллы розовой или оранжевой окраски. В удобрении 1 сорта содержится 60% оксида калия; 2 сорта - 58%. Влажность обоих сортов - не более 1% [5].
Хлористый калий - самое концентрированное калийное удобрение. В нем минимальное содержание хлора на единицу калия в сравнении со смешанной калийной солью и сильвинитом. Вследствие этого при отсутствии сульфатов его применяют под чувствительные к хлоридам культуры, но вносят его заблаговременно, чтобы по возможностям Cl - удалился за пределы пахотного слоя почвы.
Калий не только повышают урожай, но и обычно улучшает качество товарной продукции, если форма и дозы выбраны правильно. В урожае возрастает содержание углеводов и белковых веществ, прочнее становиться волокно. Большие заслуги в изучении действия калийных удобрений принадлежат Петербургскому А. В [7].
Многие калийные удобрения представляют собой природные калийные соли, ис - пользуемые в сельском хозяйстве в размолотом виде. Большие разработки их находятся в Соликамске, на Западной Украине, в Туркмении. Открыты залежи калийных руд в Казахстане, Сибири [5].
Удобрение получают из сильвинита (KCl*NaCl).
Наиболее распространены 2 метода для осуществления этого технологического процесса. Самый старый из них основан на различном изменении растворимости хлористых калия и натрия при повышении температуры с 20 до 1000С. Второй метод основан на различии удельных весов хлористых калия и натрия (1,987 и 2,17 г/см3 соответственно) [10]. До сих пор крупнейшей отраслью химического комплекса России является производство минеральных удобрений. Его доля составляет более 21% товарной продукции химической и нефтехимической промышленности, 35% экспорта химических товаров. От уровня и направлений развития этого крупного блока химической индустрии зависит решение очень многих важных проблем в экономике России и, в первую очередь, насыщение рынка продуктами питания и товарами первой необходимости, создание необходимых условий для обеспечения независимости внутреннего рынка России от импорта сельскохозяйственной продукции [13].
Двойной суперфосфатДвойной суперфосфат Ca (H2PO4) 2 - содержит 45% P2O5 и 3-5% свободной фосфорной кислоты. Это - аморфное вещество светло-серого цвета, растворимое в воде и подкисляющее почву. Выпускается в гранулированном виде [5].
Фосфор - один из важнейших элементов питания растений, так как входит в состав белков. Если азот в почве может пополняться путем фиксации его из воздуха, то фосфаты - только внесением в почву в виде удобрений. Главные источники фосфора - фосфориты, апатиты, вивианит и отходы металлургической промышленности - томасшлак, фосфатшлак.
Д.Н. Прянишников поставил фосфор в один ряд с азотом и калием - элементами, которые больше всего выносятся растениями из почвы и потерю которых надо компенсировать, внося в землю минеральные удобрения [2].
Значит, растению, прежде всего, необходимы фосфорные, азотные и калийные удобрения.
Двойной суперфосфат применяют на кислых подзолистых, торфяных, серых лесных почвах, а также на деградированных и выщелоченных черноземах и красноземах. По применению не отличается от простого суперфосфата, но более транспортабелен и требует меньших затрат на упаковку, перевозку, хранение. Используется для локального внесения под наиболее ценные технические и зерновые культуры [7].
Для получения двойного суперфосфата из природного фосфата выделяют сначала фосфорную кислоту:
Ca3 (PO4) 2 + 3H2SO4 = 2H3PO4 + 3CaSO4 ¯
Отделив осадок, полученной кислотой, затем обрабатывают новую порцию фосфорита:
Ca3 (PO4) 2 + 4H3PO4 = 3Ca (H2PO4) 2.
Производство минеральных удобрений является одной из важных отраслей химической промышленности. Ко всем минеральным удобрениям предъявляется требование, чтобы питательные элементы были в водорастворимой форме.
Это соли азотной, фосфорной и других кислот. Желательно, чтобы других компонентов удобрений, примесей, было как можно меньше, так как это "балласт". Удобрения при транспортировке и хранении должны быть стойкими к влаге, не слёживаться, сохранять сыпучесть. Для этого их выпускают гранулированными. Удобрения не должны содержать вредных попутных для растений, людей и животных веществ: фтора, радиоактивных веществ, тяжелых металлов [2].
СуперфосфатСуперфосфат - Сa (H2PO4) 2*H2O содержит 19,5% фосфора из апатитового концентрата и 14% из фосфоритов, а также некоторое количество свободной фосфорной кислоты (до 5,5%), что значительно ухудшает его качества. Для устранения этого недостатка применяют нейтрализацию твердыми добавками: известь, мел, доломит, аммиак. Простой суперфосфат - рассыпчатый продукт темно-серого цвета с характерным запахом фосфорной кислоты.
В удобрении первого сорта содержится не менее 19,5% Р2О5, 2-го сорта-19%, 3-го сорта - 14%, содержание воды 15-16%, гипса-до 40%.
Для лучшего рассеивания его часто вносят в смеси с перегноем, торфом, фосфоритной мукой для улучшения физических свойств удобрение увлажняют и окатывают в гранулы.
Гранулированный суперфосфат обладает лучшей сыпучестью и рассеиваемостью. (Диаметр гранул 1-4 мм) [5].
Английский ученый Лооз в 1843 г. полевыми опытами на Ротамстедской опытной станции доказал, что наряду с зольными элементами в состав удобрений должен входить фосфор.
В том же году на этой станции впервые было изготовлено заводским путем минеральное удобрение _ суперфосфат [6].
Гранулированный суперфосфат рекомендуется для предпосевного внесения под различные сельскохозяйственные культуры в дозе 7,5 - 20 кг/га P2O5: кукурузу, подсолнечник, хлопчатник, свекла.
Его можно применять на любых почвах, любым способом, под все культуры. По многочисленным опытам, проведенным в нашей стране, 0,5ц гранулированного суперфосфата на 1 га дает прибавление 2,5-3 ц зерна [7].
Получение суперфосфата производят следующим образом:
[Ca3 (PO4) 2] 3*CaF2 + 7H2SO4 + 3H2O - > 3Ca (H2PO4) 2*H2O + 7CaSO4 + 2HF
А также изготовляется из высокопроцентного (39-40% Р2О5) апатитового концентрата или из природных фосфатов - апатитов и фосфоритов разложением их с 61-67% серной кислотой.
Ca3 (PO4) 2 + 2H2SO4= Ca (H2PO4) 2 + 2CaSO4
Жидкая смесь при выходе затвердевает вследствие кристаллизации монокальцийфосфата [14].
| Производство и поставка фосфорсодержащих удобрений и кормовых добавок в РФ, млн. т. P2O5. | |||||||||
| Годы | 1995 | 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 |
| Производство | 4,2 | 3,7 | 2,7 | 2,3 | 1,6 | 1,74 | 1,49 | 1,80 | 1,8 |
| Поставки сельскому хозяйству | 3,6 | 3,6 | 1,4 | 0,7 | 0,3 | 0,38 | 0,36 | 0,4 | 0,4 |
| Экспорт | 0,7 | 0,7 | 1,3 | 1,6 | 1,3 | 1,36 | 1,13 | 1,4 | 1,4 |
Фосфоритная мука - самое дешевое из фосфорных удобрений. По объему производства и применения она занимает второе место в мире. В настоящее время выпускается фосфоритная мука со следующим содержанием P2O5-высший сорт-25%,1 сорт-22%,2 сорт-19%, диаметр крупинок муки - 0,17 мм. Это тонкий порошок серого или бурого цвета [5].
Большой след в агрохимии оставил профессор Петербургского земледельческого института А.Н. Энгельгардт (1832-1893) Ему принадлежит приоритет в применении фосфоритной муки в качестве удобрения. Он впервые доказал хорошее действие и последействие этого удобрения на малоплодородных пустошах. Следует отметить, что никакая другая страна не использует фосфоритную муку в таком количестве и с таким успехом как наша. В этом немалая заслуга А.Н. Энгельгардта [4].
Фосфорные удобрения необходимы растению с начального периода их жизни. Сильный эффект действия такого удобрения обуславливается способностью отдельных растений усваивать фосфорную кислоту труднорастворимых соединений. Она не только увеличивает урожаи, но и улучшает его качество, повышает зимостойкость озимых культур, ускоряет созревание [3].
Эффективность применения фосфоритной муки зависит от контакта с почвой, она усиливается при наибольшем контакте, что зависит от тонины помола. Также эффект зависит от геологического возраста и минералогического состава фосфорита. Более древние хуже усваиваются растениями, чем молодые.
Приготовление муки весьма просто. Фосфорит освобождается от примесей (гипса, песка), дробится и размалывается до состояния тонкой муки (80% -с диаметром 0,17 мм). количество выпуска фосфорных удобрений падает с каждым годом. За пять лет (1990-1994гг.) в три раза сократилось производство апатитового концентрата с 19,3 млн. т.д.о 6,48 млн. т [9].
4. Комплексные удобрения Аммофос
Аммофос - это смесь NH4H2PO4 и (NH4) 2HPO4. Представляет собой двойное комплексное удобрение для различных почв под различные сельскохозяйственные культуры. Содержит 45-52% P2O5 и 10-12% азота. Растворимо в воде. Обладает хорошими физико-химическими и свойствами, не нуждается в гранулировки и применении конденсирующих добавок. В его составе не имеется балластных компонентов, не гигроскопичен, легко рассеивается. Физиологически кислое удобрение, при внесении несколько подкисляет почву [5].
В 1761 шведский ученый Валериус высказал гипотезу о том, что растения питаются гумусом. Этот ошибочный взгляда под названием "гумусовая теория" был достаточно распространен. Эта гипотеза была высказана на основе наблюдений, что растения лучше росли на почвах, богатых гумусом; Но ошибочность этой теории уже тогда была очевидной. Со времен М.В. Ломоносова известно, что гумус появляется в почве только в результат гниения растений, т.е. является образованием вторичным. И только с1859г., когда ученые Кноп и Сакс впервые доказали возможность выращивания растений на растворах минеральных солей, теория минерального питания растений стала безраздельно господствующей. Именно она дала толчок к развитию производства минеральных удобрений. Подтвердилась мысль о том, что нет ничего лучше для практики, чем хорошая теория [7].
Аммофос преимущественно применяется в качестве рядкового удобрения под различные сельскохозяйственные культуры, можно использовать и как основное удобрение (напр. под хлопчатник). Является хорошим компонентом для смешивания со всеми стандартными удобрениями. Недостаток в том, что в нем неуравновешенное содержание N и P (1: 4), что ограничивает его самостоятельное применение.
Аммофос получается путем взаимодействия фосфорной кислоты с аммиаком. В зависимости от степени нейтрализации образуется моноаммонийфосфат NH4H2PO4 и диаммонийфосфат (NH4) 2HPO4
NH3+H3PO4=NH4H2PO4
По итогам І полугодия 2005 года общее производство аммофоса составило 206 тыс. т [13]
Кали-магнезияКали-магнезия (сульфат калия магния) K2SO4* MgSO4 - серые кристаллы, легко растворимые в воде. Содержит 28-30% К, в расчете на К2О и 8-10% Mg в MgO. Обладает хорошей рассеиваемостью и малой гигроскопичностью. Слеживается лишь при длительном хранении. Можно смешивать со всеми удобрениями кроме мочевины [5].
Большой вклад в изучение роли калийных удобрений в питании растений сделал выдающийся ученый-агрохимик Ф.В. Турчин. Им внесено новое представление о значении К в азотном и углеводном обмене, в синтезе азотных органических соединениях, установлена специфическая роль К в нитратном и аммиачном питании растений. Ф.В. Турчин доказал, что недостаток К в условиях NH4 питания вызывает обильное накопление NH4+, приводящее к аммиачному отравлению. Поэтому при недостатке К в растениях скорость синтеза аминокислот и обновление белков замедляется. Применяют кали-магнезию как основное удобрение при посеве и в подкормках. Оно является одним из лучших удобрений для чувствительных к хлору культур [6]. Особенно эффективно на легких (песчаных и субпесчаных) почвах под картофель, горох, люпин, клевер, гречиху, ягодные и плодовые растения.
Получают из минералов и руд, содержащих К и Mg в сульфатной форме и других калийных солей смешиванием с K2SO4, а также образуется как побочный продукт при производстве сернокислого калия. Кроме России производят в Германии и Англии [4].
НитроаммофоскаНитроаммофоска (азофоска) - комплексное азотно-фосфорное удобрение. Гранулы состоят из аммиачной селитры, аммофоса, частично диаммофоса, NH4Cl, NH4NO3, KNO3-водорастворимых солей доступных растениям. Азофоска содержит 18,2% N, 14,6% Р2О5, 14,6% К2О. Для придания лучших физических свойств гранулы обрабатывают с поверхности гидрофобными веществами [5].
Удобрение используют как основное, но особенно ценно оно для предпосевного внесения, вследствие высокого содержания водорастворимого Р2О5. На посевах зерновых культур дает ту же прибавку урожая, что и смесь простых удобрений аммиачной селитра, суперфосфата и хлористого калия. Использование нитроаммофоски экономически более выгодно, так как избавляет хозяйства от приготовления смесей в период напряженных работ, кроме того 1 т азофоски заменяет более чем 1,5 т простых удобрений, поэтому уменьшаются затраты на упаковку и перевозку [3].
Получают ее при взаимодействии аммиака, азотной и фосфорной кислот с добавлением хлористого или сернокислого калия. Аммиак и азотную кислоту можно заменить твердым нитратом аммония и фосфорной кислотой [5].
Одно из крупнейших предприятий России по выпуску новых видов минеральных удобрений, в том числе и азофоски - Буйский химический завод (Костромская область). Но в ассортименте нашей страны преобладает аммофос [1].
Производство сложных удобрений в нашей стране организовано в 60-ых годах. Удельный вес их в общих поставках земледельного фонда страны уже в 1980г составил 20,2% [12].
НитрофоскаНитрофоска - это смесь аммофоса с калийной селитрой, нитратом калия, KNO3. Она особенно удобна для пользования, так как одновременно содержит всё наиболее необходимые растениям элементы - азот, фосфор, калий. Нитрофоска представляет собой тройное комплексное удобрение для различных почв под различные сельскохозяйственные культуры. Содержит 35-52% N, P2O5 и K2O. Удобрение растворимо в воде [5].
До революции производства минеральных удобрений в России практически не было; вся продукция нескольких мелких заводов составляла в 1913 г. только 89 тыс. т. Строительство новых заводов началось лишь в 1925-1926 гг. и приобрело в дальнейшем большой размах.
Особенно выросло производство минеральных удобрений после окончания второй мировой войны. Если в 1940 г. было произведено всех минеральных удобрений только 3,2 млн. т, то в 1954 г. выработка удобрений составила почти 8 млн. т, а через 10 лет - уже 25,6 млн. т. [12]
Сложно-смешанные удобрения характеризуются высокой концентрацией питательных веществ, поэтому применение таких удобрений обеспечивает значительное сокращение расходов хозяйства на их транспортировку, смешивание, хранение и внесение
К числу недостатков комплексных удобрений относится то, что при внесении, например, необходимого количества азота, других питательных элементов вносится меньше или больше, чем требуется [7].
Получают нитрофоску сплавлением фосфата аммония (NH4) 2HPO4, азотнокислого аммония NH4NO3 и хлористого или сернокислотного калия [3].
Вывод
В настоящее время трудно найти издание, в котором в полном объеме подробно описывался бы весь ряд минеральных удобрений. В этой курсовой работе проведен анализ литературы и справочных материалов по минеральным удобрениям, что может быть использовано в. электронных изданиях и в курсе изучения химии в средних школах. Приведенный материал использовался при проведении уроков и подготовки тематических пособий по химии в средней школе №5 г. Калуга.
Приложения
Приложение 1
ИЛЛЮСТРАТИВНЫЙ МАТЕРИАЛ
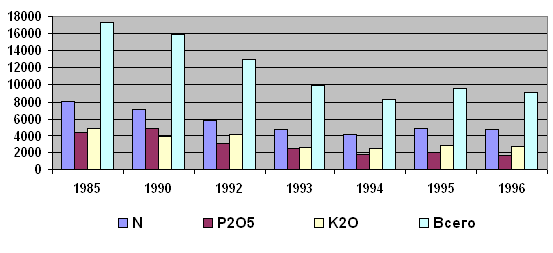
Таблица 1 Производство минеральных удобрений в России (тыс. т питательных веществ).
| Удобрения | 1985 | 1990 | 1992 | 1993 | 1994 | 1995 | 1996 |
| В том числе Россия | |||||||
| Всего | 17304 | 15979 | 12300 | 9917 | 8266 | 9639 | 9076 |
| Из них | |||||||
| Азотные | 8013 | 7186 | 5815 | 4777 | 4050 | 4879 | 4807 |
| Фосфорные | 4437 | 4943 | 3015 | 2512 | 1718 | 1929 | 1584 |
| Калийные | 4852 | 3848 | 4086 | 2628 | 2498 | 2831 | 2685 |
| % от общего производства по СССР | 52,1 | 50,4 | - | - | - | - | - |
Таблица 2. Поставка минеральных удобрений сельскому хозяйству России (тыс. т питательных веществ).
| Удобрения | 1985 | 1990 | 1992 | 1993 | 1994 | 1995 | 1996 |
| Всего по России | 17304 | 15979 | 12300 | 9917 | 8266 | 9639 | 9076 |
| Из них | |||||||
| Азотные | 8013 | 7186 | 5815 | 4777 | 4050 | 4879 | 4807 |
| Фосфорные | 4437 | 4943 | 3015 | 2512 | 1718 | 1929 | 1584 |
| Калийные | 4852 | 3848 | 4086 | 2628 | 2498 | 2831 | 2685 |
| % от общего производства по СССР | 52,1 | 50,4 | - | - | - | - | - |
Таблица 3. Поставка минеральных удобрений на 1 гектар, кг (100% питательных веществ).
| Удобрения | 1985 | 1990 | 1992 | 1993 | 1994 | 1995 | 1996 |
| Россия всего | 96,5 | 83,4 | 44,2 | 31,8 | 12,1 | 14,1 | 14,2 |
| В том числе | |||||||
| Азотные | 40,4 | 32,5 | 21,0 | 17,8 | 8,5 | 8,8 | 8,9 |
| Фосфорные | 30,6 | 33,4 | 12,4 | 7,8 | 2,3 | 3,9 | 3,4 |
| Калийные | 25,5 | 17,5 | 10,8 | 6,2 | 1,3 | 1,4 | 2,0 |
| % от общих поставок по СССР | 84,8 | - | - | - | - | - | - |
Диаграмма 1: Производство минеральных удобрений в России (в тыс. т/год питательных веществ).
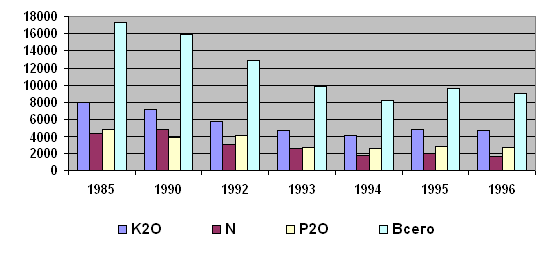
Диаграмма 2: Поставка минеральных удобрений сельскому хозяйству России (в тыс. т в год питательных веществ).
Литература
1. Минеев В.Г. Агрохимия. Учебник - М.: Изд-во МГУ, 1990. - 486 с.
2. Петухов М.П. Агрохимия и система удобрения - М.: КолосС, 1979 - 392 с.
3. Минеев В.Г., Грызлов В.П., Р.И. Синдяшкин и др. Агрохимия. Под ред. Минеева В.Г. - 2-е изд., перераб. и доп. - М.: агропромиздат, 1986. - 252 с.
4. Муравин Э.А. Агрохимия. - М.: КолосС 2003. - 384 с.
5. Сельскохозяйственная энциклопедия. В 5 т. Т.1,2,3,4,5 /: Редкол.: Аверьянов С.Ф., Бараев А.И. и др. (Гл. ред. Мацкевич В.В. И Лобанов П. П) - М.: Сов. Энциклопедия. 1969.
6. Смирнов П.М. Муравин З.А. Агрохимия. - 3-е изд., перераб. и доп. - М: Агропромиздат, 1991. - 288 с.
7. Кореньков Д.А., Синягин И.И. и др. Удобрения и их способы использования/Под ред. Коренькова. - М.: Колос, 1982. - 415 с.
8. Сельскохозяйственный энциклопедический словарь/: Редкол.: Голышин Е.Р., Гребцова В.Г., Каштанов А.Н., Скорбут А.А. и др.М. - советская энциклопедия - 1989. - 665 с.
9. Дудина Н.Х. и др. Агрохимия и система удобрения. - 3-е изд-е., перераб. и доп. - М.: Агропромиздат, 1991. - 400 с.
10 Минеев В.Г. Агрохимия: учебник - 2-е изд., перераб. И доп. - М.: Изд-во МГУ, изд-во Колоса 2004. - 720 с.
11. Журнал агрохимия, гл. ред. Мельников Н. Н.,№4, апр. 1999
12. http://www.erudition.ru/
14. http://www/eurochem.ru
15. http://www.fertilizers-rus/info/modules/myarticles
Похожие работы
... формирования ботвы интенсивно поступает калий. Отношение питательных веществ N : Р2О5 : К2О в урожаи составляет 1 : 0.3 : 1.4. И того соотношения видно , что картофель - калиелюбивая культура. [5] 1.4. Влияние удобрений на урожай и качество картофеля Картофель - культура, высокотребовательная к органическим и минеральным удобрениям. Высокие урожаи картофеля получают при внесении органических ...
... материале на всю площадь поля, т. 200 114 109 107 100 107 100 Фактически в данном хозяйстве требуется внесение извести, для устранения окисления почв при применении минеральных удобрений. При расчете использованы формула: СаСО3=Нr х 1,5 По которой мы вычисляем норму известкового удобрения по величине Нr, либо рНСl, умноженную на 1,5. Получившая сумма является нормой чистого и ...
... марганца. Микроудобрения применяют также в виде некорневых подкормок, опрыскивая растения соответствующим раствором или замачивая в нем семена перед посевом. Глава 3. Применение удобрений Применение минеральных удобрений – один из основных приемов интенсивного земледелия. При высоком уровне агротехники и применении удобрений можно управлять урожайностью, повысить ее в несколько ...
... Костюк, 1998). Исходя из этого, было решено провести ряд исследований о влиянии макро элементов на урожай семенного картофеля в условиях сухостепной зоны Бурятии. В опыте использованы следующие макроэлементы: NH4NO3 - аммиачная селитра, Н3 РО4 - суперфосфат, КС - калий хлористый. Удобрения вносились под вспашку. Известно, что с удобрениями в почву могут поступать большие количества загрязняющих ...

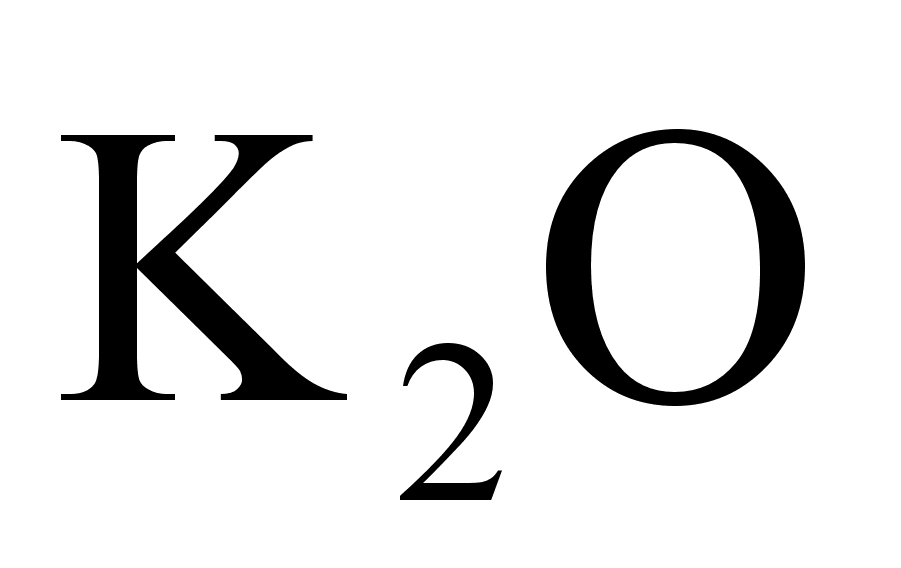
0 комментариев