Прогнозирование ![]() органических соединений
органических соединений
В целом использование метода Бенсона для расчета энтропий органических соединений в состоянии идеального газа аналогично подходу, рассмотренному при прогнозировании энтальпий образования. Однако имеются и существенные отличия: необходимо вводить поправки на симметрию молекул и пространственную изомерию; причиной тому служит сама природа этого свойства.
Статистическая термодинамика показывает, что энтропию газа можно рассматривать как сумму составляющих, относящихся к различным формам движения молекулы в целом и движения частиц, ее образующих. Сгруппировав их по характеру движения частиц, получим
![]() , (2.6)
, (2.6)
где ![]() - абсолютная энтропия всей молекулы,
- абсолютная энтропия всей молекулы, ![]() - энтропия поступательного движения молекулы,
- энтропия поступательного движения молекулы, ![]() - энтропия вращательного движения молекулы,
- энтропия вращательного движения молекулы, ![]() - энтропия вращательного движения атомов и атомных групп, составляющих молекулу (энтропия внутреннего вращения),
- энтропия вращательного движения атомов и атомных групп, составляющих молекулу (энтропия внутреннего вращения), ![]() - энтропия колебательного движения атомов и атомных групп в молекуле,
- энтропия колебательного движения атомов и атомных групп в молекуле, ![]() - энтропия движения электронов. Некоторые из вкладов в энтропию являются суммой более частных составляющих.
- энтропия движения электронов. Некоторые из вкладов в энтропию являются суммой более частных составляющих.
Каждая из этих форм движения материи усиливается при повышении температуры, что приводит к увеличению энтропии. Причем характер изменений вкладов в энтропию, зависящий от температуры, неодинаков для различных форм движения. Из сказанного ясно, что энтропия вещества весьма чувствительна к строению молекул. В случае органических соединений нередки ситуации, когда различие в энтропиях изомеров превосходит различие в энтропиях ближайших гомологов, и основной из причин этого оказывается статистический фактор.
Одной из статистических поправок, которые необходимо учитывать при расчете энтропии вещества методом Бенсона, является поправка к вращательной энтропии на симметрию молекул. При этом полное число симметрии молекулы![]() (total - общий) разбивают на два слагаемых:
(total - общий) разбивают на два слагаемых:
* на число симметрии наружного вращения молекулы в целом -![]() (наружное - external) и
(наружное - external) и
* число симметрии вращающейся части молекулы или число симметрии внутреннего вращения ![]() (внутреннее - internal). Полное число симметрии (
(внутреннее - internal). Полное число симметрии (![]() ) является произведением всех чисел симметрии молекулы:
) является произведением всех чисел симметрии молекулы:
![]() . (2.7)
. (2.7)
Число симметрии наружного вращения можно определить как число положений, которые может занимать жесткая многоатомная молекула (“жесткий ротатор”), совпадая при вращении со своей первоначальной конфигурацией.
Например, в двухатомных молекулах, состоящих из двух одинаковых атомов, последние могут поменяться местами при повороте молекулы на 180 градусов. Число симметрии наружного вращения таких молекул равно 2. Молекула CH4 представляет собой тетраэдр с атомами водорода в вершинах. Простым вращением молекулы вокруг каждой из связей “углерод-водород” можно получить 12 идентичных конфигураций, т.е. число симметрии наружного вращения молекулы метана равно 12.
Простой способ расчета числа симметрии для наружного вращения молекулы состоит в перемножении чисел, определяющих степень симметрии всех независимых осей, на количество этих осей. Так, для рассмотренной молекулы метана имеем четыре независимые оси третьего порядка, каждая из которых совпадает со связью С–Н. Вокруг этих осей происходит вращение молекулы. Таким образом, число симметрии наружного вращения молекулы метана равно 12 (![]() = 4·3 = 12). Молекула бензола имеет шесть осей второго порядка: три из них проходят через углеродные атомы, расположенные напротив друг друга,
= 4·3 = 12). Молекула бензола имеет шесть осей второго порядка: три из них проходят через углеродные атомы, расположенные напротив друг друга,
![]()
а три делят пополам углерод-углеродные связи. Все оси симметрии проходят через центр симметрии молекулы бензола. Таким образом, число симметрии наружного вращения молекулы бензола равно 12 (![]() = 6·2 = 12).
= 6·2 = 12).
Если часть молекулы способна вращаться относительно остальной ее части, то симметрия вращающейся части вносит дополнительные нефиксированные положения. Это приводит к необходимости введения второго числа симметрии - ![]() .
.
Так, полное число симметрии молекул нормальных алканов равно 18 (![]() = = 2·9 = 18), где 2 - число симметрии наружного вращения молекулы по оси второго порядка, перпендикулярной основной цепи углерод-углеродных связей, а 9 - произведение чисел симметрии двух концевых метильных групп, каждая из которых имеет ось вращения третьего порядка.
= = 2·9 = 18), где 2 - число симметрии наружного вращения молекулы по оси второго порядка, перпендикулярной основной цепи углерод-углеродных связей, а 9 - произведение чисел симметрии двух концевых метильных групп, каждая из которых имеет ось вращения третьего порядка.
Для молекул разветвленных углеводородов с количеством метильных групп, равным “n”, число симметрии внутреннего вращения составляет ![]() , а общее число симметрии будет равно
, а общее число симметрии будет равно ![]() и может принимать весьма большие значения. Например, для неопентана (2,2-диметилпропана)
и может принимать весьма большие значения. Например, для неопентана (2,2-диметилпропана) ![]() где 12 - число симметрии наружного вращения молекулы, 3 - ось симметрии третьего порядка в метильных группах, 4 - количество метильных групп в молекуле.
где 12 - число симметрии наружного вращения молекулы, 3 - ось симметрии третьего порядка в метильных группах, 4 - количество метильных групп в молекуле.
При расчете энтропии органических соединений других классов необходимо учитывать возможность заторможенного вращения прочих структурных фрагментов. Например, в молекулах ароматических углеводородов ось симметрии второго порядка имеют незамещенный фенил (C6H5 -) и пара-фенилен (-С6H4-).
Числа симметрии молекул некоторых ароматических углеводородов приведены в табл. 2.1, а для большой выборки алканов представлены в табл. 2.5.
Таблица 2.1
| Соединение | Формула |
|
|
|
| Толуол | С7H8 | 1 | 3·2 = 6 | 6 |
| Этилбензол | С8H10 | 1 | 3·2 = 6 | 6 |
| о-Ксилол | С8H10 | 2 | 32 = 9 | 18 |
| м-Ксилол | С8H10 | 2 | 32 = 9 | 18 |
| п-Ксилол | С8H10 | 2 | 2·32 = 18 | 36 |
| 1,3,5-Триметилбензол | С9H12 | 3·2 = 6 | 33 = 27 | 162 |
| Гексаметилбензол | С12H18 | 6·2 = 12 | 36 = 729 | 8748 |
| 1,1-Дихлорэтилен | С2Н2Сl2 | 1·2 = 2 | 1 | 2 |
| 2,2-Диметилпропан | С5Н12 | 4·3 = 12 | 34 = 81 | 972 |
| 1,4-Дитретбутилбензол | С14Н32 | 1·2 = 2 | 36·32·2 = 13122 | 26244 |
| 2-[3,5-бис(3-Трихлорме-тилфенил)]-Фенилбутан | С24Н20Cl6 | 1 | 32·32·2 = 162 | 162 |
Для соединений, имеющих гетероатомы, необходимо также рассматривать пространственное строение структурных фрагментов, в которые входят эти атомы. Например, аминогруппа вместе с ближайшим углеродным атомом обладает структурой пирамиды, поэтому для группы CNH2 число симметрии внутреннего вращения равно единице.
Итак, с вопросом определения чисел симметрии молекул мы в общих чертах познакомились. Наличие в молекуле осей симметрии внутреннего вращения понижает энтропию вещества. Чтобы ввести поправку на симметрию, необходимо из вращательной энтропии вычесть ![]() , т.е.
, т.е.
![]() . (2.8)
. (2.8)
Иной тип поправок приходится вводить в случае, когда интересующее нас вещество имеет хиральные центры и вследствие этого представлено смесью устойчивых форм вращательных изомеров (возможны и другие ситуации). Поскольку энтропия отражает степень упорядоченности системы, то для смеси изомеров необходимо учитывать энтропию смешения
![]() , (2.9)
, (2.9)
где ni - мольная доля i-того изомера в равновесной смеси. Если все изомеры имеют равную энергию, то ni = 1/n и
![]() . (2.10)
. (2.10)
Следовательно, для бинарной смеси с концентрацией каждого изомера 50% или 0,5 мол. долей имеем ![]() = 5,76 Дж/(моль×К).
= 5,76 Дж/(моль×К).
Количество пространственных изомеров органического соединения может быть весьма значительным и зависит от количества элементов хиральности в молекуле, которыми могут быть [31]:
· асимметрические углеродные атомы, т.е. атомы, у которых все четыре заместителя разные, например, центральный атом углерода в молочной кислоте
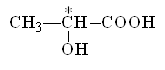 ;
;
· атомы кремния с четырьмя различными заместителями, например, в молекуле метил-(1-нафтил)фенилсилана;
· атомы трехвалентного фосфора в фосфинах или четырехвалентной серы в сульфоксидах с набором различных заместителей при фосфоре или сере, в соединениях которых заместители расположены пирамидально, но структуры являются фактически тетраэдрическими с учетом свободной электронной пары;
· центр молекулы адамантанового ядра с различными заместителями в 1,3,5,7-положениях адамантана;
· оси хиральности, например, для молекул алленов с различными заместителями при крайних углеродных атомах или для 2,2',6,6'-тетра-замещенных бифенилов, размеры заместителей в молекулах которых препятствуют вращению вокруг простой углерод-углеродной связи между ароматическими ядрами, если сумма ван-дер-ваальсовых радиусов орто-заместителей превосходит 0,290 нм; таким соединениям свойственна пространственная изомерия (атропоизомерия - где тропос - поворот (греч.), атропо- нет поворота);
· плоскости хиральности, например, в производных ферроцена;
· спиральность, например, в белках, нуклеиновых кислотах или гелиценах (простейшая модель спиральности) с шестью и более орто-конденсированными бензольными ядрами, которые не могут расположиться в одной плоскости и образуют правую или левую спираль.
Из перечисленных элементов хиральности для относительно несложных структур наиболее часто встречающимися являются асимметрические углеродные атомы. В этом случае максимальное количество оптических изомеров равно ![]() , где “m” - число асимметрических атомов углерода.
, где “m” - число асимметрических атомов углерода.
Если набор заместителей при различных асимметрических углеродных атомах одинаков, то количество оптических изомеров уменьшается вследствие образования мезо-формы. При расчете величины поправки на смешение оптических изомеров в этом случае концентрация мезо-формы в первом приближении может быть принята равной суммарной концентрации равновесной с ней dl-формы. Таким образом, для структур с двумя асимметрическими атомами в молекуле имеем поправку на смешение оптических изомеров, равную
![]() = –8,3147·(0,5·ln(0,5)+0,25·ln(0,25)+0,25·ln(0,25)) =
= –8,3147·(0,5·ln(0,5)+0,25·ln(0,25)+0,25·ln(0,25)) =
= 8,64 Дж/(моль×К).
Если центры асимметрии находятся не при соседних атомах, то весь соединяющий их фрагмент считают за одну связь.
Наличие асимметрических углеродных атомов в циклических соединениях также требует при прогнозировании энтропии учета вклада на смешение оптических изомеров. Однако при этом необходимо учитывать специфику строения молекул интересующего циклического соединения.
Так, например, в молекулах монозамещенных циклогексанов (ЦГ) заместитель может находиться в двух различных положениях - экваториальном и аксиальном. Однако при этом не возникает никаких изомеров, поскольку в результате инверсии цикла аксиальный заместитель становится экваториальным, и наоборот.
В случае дизамещенных циклогексанов с заместителями у разных атомов цикла молекула имеет два асимметрических атома углерода и, по аналогии с нециклическими структурами, должна бы существовать в виде смеси четырех оптических изомеров, если заместители различны. Тем не менее, в сопоставимых концентрациях реализуются в большинстве случаев два изомера - например, экваториально-аксиальный (еа) для цис-1,2-дизамещенного-ЦГ и экваториально-экваториальный (ее) для транс-1,2-ЦГ.
Неоднозначность учета вклада на смешение пространственных изомеров становится еще большей при переходе от моноциклических структур к полициклическим. В качестве примера можно привести монозамещенные (в любом из метиленовых фрагментов) производные норборнана - бицикло[2.2.1]гептана и гидриндана - бицикло[4.3.0]нонана. Каждое из них имеет три асимметрических углеродных атома: два узловых и один - с заместителем. Однако для производных норборнана количество стереоизомеров равно четырем, а для гидриндана, как и положено, восьми. Объясняется такое различие тем, что конфигурацию узловых атомов в молекуле норборнана можно изменить только одновременно по причине жесткости структуры. Ясно, что при таком различии в количестве стереоизомеров вклады в энтропию, обусловленные их смешением, будут различны. Ясно также и то, что введение поправки на смешение изомеров для циклических структур требует дополнительных экспериментальных или расчетных сведений о соотношении равновесных концентраций всех возможных стереоизомеров.
Прочие вопросы прогнозирования ![]() органических соединений методом Бенсона решаются в той же последовательности, что и прогнозирование
органических соединений методом Бенсона решаются в той же последовательности, что и прогнозирование ![]() (разд. 1.), т.е. вычисляется аддитивная составляющая энтропии (табл. 1.2.) и вводятся необходимые поправки. Последние включают в себя поправки, обусловленные специфическими особенностями строения молекул данного класса соединений и включенные в таблицу парциальных вкладов метода Бенсона (табл. 1.2), а также упомянутые выше статистические поправки - на симметрию молекулы рассматриваемого вещества и число оптических изомеров, его представляющих. Сказанное иллюстрируется примерами 2.1-2.3.
(разд. 1.), т.е. вычисляется аддитивная составляющая энтропии (табл. 1.2.) и вводятся необходимые поправки. Последние включают в себя поправки, обусловленные специфическими особенностями строения молекул данного класса соединений и включенные в таблицу парциальных вкладов метода Бенсона (табл. 1.2), а также упомянутые выше статистические поправки - на симметрию молекулы рассматриваемого вещества и число оптических изомеров, его представляющих. Сказанное иллюстрируется примерами 2.1-2.3.
Пример 2.1
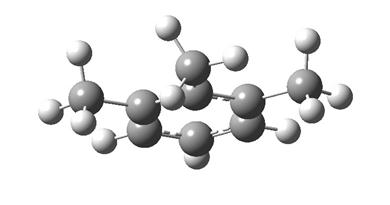
Методом Бенсона рассчитать ![]() 2-метил-3-этилгексана.
2-метил-3-этилгексана.
Решение
1. Структурная формула молекулы рассматриваемого вещества такова:

2. Расчет энтропии включает в себя:
· вычисление аддитивной составляющей свойства по данным табл. 1.2. - число парциальных вкладов в свойство для алканов равно числу углеродных атомов в молекуле, т.е. девяти для 2-метил-3-этилгексана;
· вычисление поправки на симметрию молекулы в целом и ее вращающихся симметричных групп: молекула в целом несимметрична (![]() ), но содержит четыре симметричных метильных группы, каждая из которых обладает осью симметрии третьего порядка (
), но содержит четыре симметричных метильных группы, каждая из которых обладает осью симметрии третьего порядка (![]() ), т.е. полное число симметрии молекулы 2-метил-3-этилгексана составляет
), т.е. полное число симметрии молекулы 2-метил-3-этилгексана составляет ![]() ;
;
· вычисление поправки на смешение оптических изомеров: молекула содержит один асимметрический атом углерода (отмечен в структурной формуле звездочкой), т.е. представлена двумя оптическими изомерами (d и l) с равными концентрациями, а значит,
![]() = 5,76 Дж/(моль×К).
= 5,76 Дж/(моль×К).
Поскольку прочие поправки, обусловленные структурными особенностями строения молекул, для алканов отсутствуют, расчет закончен. Результаты его приведены в табл. 2.2.
Для этого соединения рекомендовано [1] значение энтропии 488,65 Дж/(моль×К). Ошибка расчета по методу Бенсона составляет, таким образом, 1,4 % отн.
Таблица 2.2
| Тип атома | Количество атомов данного типа | Парциальный вклад, Дж/(моль·К) | Вклад в свойство, кДж/моль |
| CH3–(C) | 4 | 127,24 | 508,96 |
| CH2–(2C) | 3 | 39,41 | 118,23 |
| CH–(3C) | 2 | -50,50 | -101,00 |
| Поправка на симметрию молекулы, –R·ln81 | -36,54 | ||
| Поправка на оптическую изомерию, R·ln2 | 5,76 | ||
| Итого: | 9 | 495,41 |
Пример 2.2
Методом Бенсона рассчитать ![]() 2,2,4-триметилпентана.
2,2,4-триметилпентана.
Решение
1. Структурная формула молекулы рассматриваемого вещества такова:
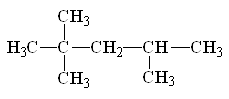
2. Расчет энтропии выполнен аналогично примеру 2.1. и приведен в табл. 2.3. Комментария требует только поправка на симметрию молекулы, –R×ln(3·35), учитывающая пять метильных волчков и один третбутильный, каждый из которых имеет ось симметрии третьего порядка.
Для этого соединения рекомендовано [1] значение энтропии 423,21 Дж/(моль×К). Ошибка расчета по методу Бенсона составляет, таким образом, 0,05 % отн.
Таблица 2.3
| Тип атома | Количество атомов данного типа | Парциальный вклад, Дж/(моль·К) | Вклад в свойство, кДж/моль |
| CH3–(C) | 5 | 127,24 | 636,2 |
| CH2–(2C) | 1 | 39,41 | 39,41 |
| CH–(3C) | 1 | -50,50 | -50,50 |
| C–(4C) | 1 | -146,86 | -146,86 |
| Поправка на симметрию молекулы, –R·ln(36) | -54,81 | ||
| Поправка на оптическую изомерию, R·ln2 | |||
| Итого: | 8 | 423,44 |
Пример 2.3
Методом Бенсона рассчитать ![]() окиси этилена.
окиси этилена.
Решение
1. Структурная формула молекулы рассматриваемого вещества такова:
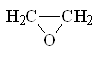
2. Расчет энтропии выполнен аналогично примеру 2.1 и приведен в табл. 2.4.
Для этого соединения рекомендовано [1] значение энтропии 242,4 Дж/(моль×К). Ошибка расчета по методу Бенсона составляет, таким образом, –0,6 % отн.
Таблица 2.4
| Тип атома | Количество атомов данного типа | Парциальный вклад, Дж/(моль·К) | Вклад в свойство, кДж/моль |
| CH2–(С,O) | 2 | 41,0 | 82,0 |
| O–(2C) | 1 | 36,30 | 36,30 |
| Поправка на напряжение цикла | 131,4 | ||
| Поправка на симметрию молекулы, –R·ln2 | -5,76 | ||
| Итого: | 8 | 243,9 |
Приведенные примеры показывают достаточно высокие прогностические возможности метода Бенсона для ![]() соединений различных классов. Тем не менее, более широкая апробация метода свидетельствует о том, что иногда для относительно несложных структур погрешности расчета оказываются значительными. Примером тому служит материал (табл. 2.5), который показывает, что среднее абсолютное отклонение расчетных величин от экспериментальных
соединений различных классов. Тем не менее, более широкая апробация метода свидетельствует о том, что иногда для относительно несложных структур погрешности расчета оказываются значительными. Примером тому служит материал (табл. 2.5), который показывает, что среднее абсолютное отклонение расчетных величин от экспериментальных ![]() составляет для рассмотренных алканов 7,9 Дж/(моль×К), а для 30% всей выборки превышает 10 Дж/(моль×К). При этом средняя относительная погрешность в 1,6%, представляющаяся, на первый взгляд, невысокой, не должна вводить в заблуждение, поскольку погрешности в оценках такого уровня искажают значение, например, константы равновесия для химического превращения более чем вдвое.
составляет для рассмотренных алканов 7,9 Дж/(моль×К), а для 30% всей выборки превышает 10 Дж/(моль×К). При этом средняя относительная погрешность в 1,6%, представляющаяся, на первый взгляд, невысокой, не должна вводить в заблуждение, поскольку погрешности в оценках такого уровня искажают значение, например, константы равновесия для химического превращения более чем вдвое.
На основании материала, рассмотренного выше, можно сделать вывод, что применение аддитивных методов к прогнозированию энтропий веществ в отличие от энтальпий образования менее аргументированно, поскольку ряд вкладов в энтропию имеет явно неаддитивную природу. Это, в первую очередь, вклады, обусловленные симметрией молекулы как целого и вращающихся в молекуле структурных фрагментов. Неаддитивное происхождение имеют и вклады в свойство, обусловленные наличием хиральности для ряда молекул. Аддитивность прочих вкладов в энтропию веществ также может рассматриваться лишь в качестве первого приближения. Однако даже при выполнении расчетов методами статистической термодинамики до сих пор во многих случаях отдается предпочтение [1, 29] геометрическим параметрам молекул, вычисленным аддитивно. Привлекательность же аддитивных методов прогнозирования энтропии органических веществ, обусловленная несравнимо большей легкостью и доступностью их применения по сравнению с другими методами, является стимулом к их совершенствованию. Поэтому нами сделана попытка использования дополнительных по сравнению с методом Бенсона возможностей метода Татевского по связям. Некоторые детали работы с методом иллюстрируются на примере алканов.
Фактическая информация, использованная в расчете, заимствована из [29] и приведена в табл. 2.5. Для представленной выборки веществ метод Татевского по связям в редакции [11] дает среднее абсолютное отклонение 8,4 Дж/(моль×К). Метод Бенсона в редакции [5] дает несколько лучшее описание, погрешность расчета составляет 7,9 Дж/(моль×К). Опыт нашей работы с методом Татевского позволяет заключить, что в [11] не удалось полностью реализовать возможности метода по причине расчета его параметров без предварительного исключения указанных выше неаддитивных вкладов. Методом Бенсона подобная процедура предусмотрена.
Таблица 2.5
Результаты прогнозирования| Соединение | stotal | n | Дж/(моль×К) | ||||||
| S0g, 298 (эксп.) | S0g, 298 (расч.)-S0g, 298 (эксп.) | ||||||||
| По [11] | По Бенсону | 1 уровень | 2 уровень | 3 уровень | Разветвленные | ||||
| 2-Метилбутан | 27 | 1 | 343,74 | -5,8 | -0,4 | -0,8 | 2,0 | 1,7 | 1,1 |
| 2-Метилпентан | 27 | 1 | 380,98 | -4,0 | 1,8 | 0,9 | 1,9 | 1,5 | 1,4 |
| 3-Метилпентан | 27 | 1 | 383,00 | -3,0 | -0,2 | -3,0 | 1,4 | 1,5 | -0,1 |
| 2,3-Диметилбутан | 162 | 1 | 365,93 | -1,3 | -0,1 | -3,8 | 1,1 | 0,3 | 1,7 |
| 2,2-Диметилбутан | 243 | 1 | 358,40 | -3,8 | -2,4 | -1,9 | 0,6 | -0,1 | 1,8 |
| 2-Метилгексан | 27 | 1 | 420,50 | -4,5 | 1,7 | 0,5 | 1,3 | 0,9 | 0,9 |
| 3-Метилгексан | 27 | 2 | 426,10 | -7,1 | 1,9 | -1,3 | 1,2 | 1,5 | 0,0 |
| 3-Этилпентан | 81 | 1 | 411,60 | 10,4 | 1,5 | -3,7 | 0,2 | -0,1 | 0,2 |
| 2,3-Диметилпентан | 81 | 2 | 414,68 | -8,0 | 2,1 | -3,9 | 0,8 | 0,6 | 0,4 |
| 2,4-Диметилпентан | 162 | 1 | 397,02 | 6,7 | 8,2 | 5,8 | 1,5 | 0,6 | 1,5 |
| 2,2-Диметилпентан | 243 | 1 | 392,70 | 0,9 | 2,7 | 2,9 | 2,1 | 0,6 | 2,1 |
| 3,3-Диметилпентан | 162 | 1 | 398,30 | -2,6 | 0,5 | -6,0 | -1,7 | -1,2 | 0,8 |
| 2,2,3-Триметилбутан | 729 | 1 | 383,40 | 15,7 | 0,8 | -1,7 | 0,1 | -0,7 | -0,4 |
| 3-Метилгептан | 27 | 2 | 465,60 | -7,6 | 1,8 | -1,8 | 0,7 | 0,9 | -0,4 |
| 4-Метилгептан | 27 | 1 | 457,52 | 0,5 | 4,1 | 0,5 | 1,2 | 1,4 | 0,3 |
| 3-Этилгексан | 27 | 1 | 457,98 | 3,1 | 3,7 | -1,9 | 0,1 | -0,2 | 0,4 |
| 2,3-Диметилгексан | 81 | 2 | 452,08 | -6,4 | 4,1 | -2,3 | 0,5 | 0,3 | 0,5 |
| 2,4-Диметилгексан | 81 | 2 | 447,73 | -2,0 | 8,5 | 3,7 | 1,0 | 0,7 | 0,3 |
| 2,5-Диметилгексан | 162 | 1 | 442,46 | 0,3 | 2,2 | -0,6 | 0,8 | 1,2 | 1,0 |
| 3,4-Диметилгексан | 162 | 4 | 451,70 | -3,1 | 4,5 | -3,9 | 0,6 | 1,0 | -0,7 |
| 3-Этил-2-метилпентан | 81 | 1 | 443,88 | 4,8 | 6,6 | -1,8 | 0,6 | -0,3 | 1,4 |
| 2,3,4-триметилпентан | 243 | 1 | 428,53 | 4,7 | 10,7 | 1,4 | 0,7 | 0,0 | 1,3 |
| 2,2-Диметилгексан | 243 | 1 | 432,80 | -0,2 | 2,1 | 1,8 | 0,9 | 0,4 | 1,1 |
| 3,3-Диметилгексан | 81 | 1 | 438,36 | -3,6 | 5,6 | -1,3 | -0,2 | -0,5 | 1,2 |
| 3-Метил-3-этилпентан | 243 | 1 | 424,72 | 12,2 | 10,1 | -3,4 | 0,7 | 1,0 | 0,2 |
| 2,2,3-Триметилпентан | 729 | 2 | 424,01 | 17,1 | 5,4 | 0,5 | 0,8 | -0,1 | 0,7 |
| 2,2,4-Триметилпентан | 729 | 1 | 423,09 | -2,8 | 0,5 | -0,9 | 0,7 | -0,9 | 0,7 |
| 2,3,3-Триметилпентан | 243 | 1 | 427,14 | 13,1 | 5,6 | -3,9 | -2,0 | -1,8 | -0,7 |
| 2,2,3,3-Тетраметилбутан | 13122 | 1 | 389,49 | 0,0 | 1,6 | 8,2 | 0,5 | 0,1 | 0,0 |
| 2-Метилоктан | 27 | 1 | 498,9 | -4,8 | 2,2 | 0,1 | 0,8 | 0,4 | 0,5 |
| 3-Метилоктан | 27 | 2 | 504,8 | -7,7 | 2,1 | -2,0 | 0,4 | 0,6 | -0,6 |
| 4-Метилоктан | 27 | 2 | 502,8 | -5,7 | 4,1 | 0,0 | 0,6 | 0,8 | -0,1 |
| 2,3-Диметилгептан | 81 | 2 | 492,4 | -7,7 | 3,3 | -3,6 | -0,8 | -1,1 | -0,8 |
| 2,4-Диметилгептан | 81 | 2 | 484,6 | 0,2 | 11,1 | 5,9 | 1,3 | 1,0 | 1,0 |
| 2,5-Диметилгептан | 81 | 2 | 493,9 | -9,1 | 1,7 | -3,5 | -0,5 | 0,6 | -0,9 |
| 2,6-Диметилгептан | 162 | 1 | 481,6 | 0,2 | 2,5 | -0,7 | 0,6 | -0,4 | 0,9 |
| 3,4-Диметилгептан | 81 | 4 | 494,9 | -7,2 | 6,5 | -2,3 | 0,3 | 0,7 | -0,6 |
| 3,5-Диметилгептан | 162 | 4 | 487,7 | 0,1 | 7,9 | 0,8 | -0,3 | 0,0 | -1,7 |
| 2,2-Диметилгептан | 243 | 1 | 471,9 | -0,3 | 2,4 | 1,7 | 0,8 | 0,2 | 1,0 |
| 3,3-Диметилгептан | 81 | 1 | 478,6 | -4,8 | 4,8 | -2,5 | -1,4 | -0,9 | 0,0 |
| 4,4-Диметилгептан | 162 | 1 | 466,9 | 6,9 | 10,8 | 3,5 | 1,4 | 0,2 | 1,5 |
| 3-Этилгептан | 27 | 1 | 497,5 | 2,6 | 3,6 | -2,4 | -0,4 | -0,8 | -0,1 |
| 4-Этилгептан | 27 | 1 | 495,1 | 5,0 | 6,0 | 0,0 | 0,2 | -0,2 | 0,8 |
| 2,3,4-Триметилгексан | 243 | 4 | 477,4 | -2,1 | 12,8 | 1,2 | 0,3 | 0,2 | -0,1 |
| 2,3,5-Триметилгексан | 243 | 2 | 476,4 | -4,0 | 8,0 | 0,0 | -2,4 | -1,7 | -1,9 |
| 2,4,4-Триметилгексан | 243 | 1 | 468,5 | -7,0 | 3,7 | -4,8 | -1,3 | -1,8 | 0,0 |
| 3,3,4-Триметилгексан | 243 | 2 | 467,7 | 14,6 | 10,3 | -1,7 | -1,3 | -1,1 | 0,5 |
| 3-Этил-2-метилгексан | 81 | 2 | 486,8 | 0,9 | 8,8 | 0,0 | 0,6 | -0,3 | 1,7 |
| 3-Этил-3-метилгексан | 81 | 1 | 468,1 | 7,9 | 15,3 | 1,4 | 2,3 | 1,8 | 0,6 |
| 3-Этил-4-метилгексан | 81 | 2 | 486,5 | 4,2 | 9,1 | -1,6 | 0,6 | 0,4 | 0,5 |
| 4-Этил-2-метилгексан | 81 | 1 | 479,5 | 8,3 | 10,4 | 3,2 | 0,0 | -0,9 | 0,8 |
| 3-Этил-2,3-диметилпентан | 243 | 1 | 454,9 | 26,5 | 17,3 | 0,7 | 0,6 | 0,7 | -0,5 |
| 2,2,3-Триметилгексан | 729 | 2 | 461,6 | 18,5 | 7,2 | 1,9 | 0,4 | 0,3 | 0,6 |
| 2,3,3-Триметилгексан | 243 | 1 | 461,3 | 18,0 | 10,9 | 0,9 | -0,3 | -0,9 | -0,2 |
| 2,2,4-Триметилгексан | 729 | 2 | 467,7 | -5,4 | 1,1 | -2,6 | 0,5 | 0,5 | -0,1 |
| 2,2,5-Триметилгексан | 729 | 1 | 461,8 | -2,5 | 1,3 | -0,5 | -0,9 | 0,2 | -0,1 |
| 3,3-Диэтилпентан | 972 | 1 | 436,6 | 41,5 | 26,1 | 5,5 | 7,4 | 6,2 | -0,6 |
| 2,2,3,3-Тетраметилпентан | 2187 | 1 | 436,7 | -6,0 | 8,7 | 8,3 | -0,6 | -0,7 | 0,0 |
| 2,2,3,4-Тетраметилпентан | 2187 | 2 | 451,3 | 16,4 | 6,3 | -1,8 | 0,7 | -0,3 | -1,0 |
| 2,2,4,4-Тетраметилпентан | 13122 | 1 | 430,7 | 6,2 | -0,2 | -0,6 | 0,1 | -0,9 | -1,3 |
| 2,3,3,4-Тетраметилпентан | 1458 | 1 | 437,0 | 47,7 | 18,2 | 5,6 | -0,6 | -0,5 | -0,7 |
| 2-Methylnonane | 27 | 1 | 538,1 | -5,0 | 2,4 | -0,1 | 0,6 | 0,1 | 0,3 |
| 3-Methylnonane | 27 | 2 | 544,0 | -7,9 | 2,3 | -2,2 | 0,2 | 0,4 | -0,8 |
| 4-Methylnonane | 27 | 2 | 542,0 | -5,9 | 4,3 | -0,2 | 0,4 | 0,6 | -0,3 |
| 5-Methylnonane | 27 | 1 | 536,6 | -0,5 | 3,9 | -0,5 | 0,0 | 0,2 | -0,7 |
| 3,3-Диэтилгексан | 243 | 1 | 482,3 | 34,8 | 31,4 | 10,4 | 9,0 | 7,1 | -0,1 |
| 3,4-Диэтилгексан | 162 | 1 | 509,8 | 22,9 | 13,7 | 0,6 | 0,5 | -0,3 | 1,6 |
| 2,2-Диметилоктан | 243 | 1 | 511,2 | -0,6 | 2,5 | 1,5 | 0,4 | -0,1 | 0,7 |
| 2,3-Диметилоктан | 81 | 2 | 531,5 | -7,8 | 3,5 | -3,7 | -1,0 | -1,3 | -0,9 |
| 2,4-Диметилоктан | 81 | 2 | 524,1 | -0,3 | 11,0 | 5,4 | 0,8 | 0,4 | 0,4 |
| 2,5-Диметилоктан | 81 | 2 | 531,1 | -7,3 | 4,0 | -1,6 | -0,5 | 0,5 | 0,9 |
| 2,6-Диметилоктан | 81 | 2 | 532,5 | -8,7 | 2,6 | -3,0 | -0,1 | -0,5 | -0,5 |
| 2,7-Диметилоктан | 162 | 1 | 520,8 | 0,0 | 2,7 | -0,9 | 0,3 | -0,7 | 0,7 |
| 3,3-Диметилоктан | 81 | 1 | 517,7 | -4,9 | 5,2 | -2,5 | -1,6 | -1,0 | -0,1 |
| 3,4-Диметилоктан | 81 | 4 | 535,2 | -8,5 | 5,6 | -3,6 | -1,0 | -0,7 | -1,9 |
| 3,5-Диметилоктан | 81 | 4 | 530,2 | -3,4 | 10,6 | 3,1 | 0,1 | 0,4 | -0,9 |
| 3,6-Диметилоктан | 162 | 4 | 533,2 | -6,4 | 1,9 | -5,7 | -1,1 | 0,6 | -2,2 |
| 4,4-Диметилоктан | 81 | 1 | 513,0 | -0,2 | 9,9 | 2,2 | 0,0 | -0,2 | 0,2 |
| 4,5-Диметилоктан | 162 | 4 | 526,6 | 0,1 | 8,5 | -0,7 | 0,0 | 0,3 | -0,6 |
| 3-Этил-2,3-диметилгексан | 243 | 2 | 494,9 | 25,6 | 22,5 | 5,5 | 2,2 | 1,5 | 1,1 |
| 3-Этил-2,5-диметилгексан | 243 | 2 | 509,0 | 5,4 | 14,8 | 4,5 | -0,2 | -0,2 | 1,4 |
| 3-Этил-3,4-диметилгексан | 243 | 2 | 495,5 | 27,9 | 21,9 | 2,9 | 1,3 | 1,3 | 0,6 |
| 4-Этил-2,2-диметилгексан | 729 | 1 | 495,5 | 6,0 | 7,0 | 0,9 | 0,7 | 1,1 | 1,6 |
| 4-Этил-2,3-диметилгексан | 243 | 2 | 506,7 | 10,6 | 17,1 | 3,2 | -0,1 | -0,8 | 0,8 |
| 4-Этил-2,4-диметилгексан | 243 | 1 | 497,7 | 5,0 | 13,9 | -1,6 | 1,7 | 1,0 | 0,0 |
| 3-Этил-2-метилгептан | 81 | 2 | 526,3 | 0,4 | 8,8 | -0,4 | 0,0 | -0,9 | -2,9 |
| 3-Этил-3-метилгептан | 81 | 1 | 508,4 | 6,6 | 14,5 | 0,1 | 1,0 | 0,4 | -0,7 |
| 3-Этил-4-метилгептан | 81 | 2 | 523,9 | 5,8 | 11,2 | 0,0 | 0,3 | 0,1 | 0,6 |
| 3-Этил-5-метилгептан | 81 | 2 | 525,2 | 4,6 | 9,9 | 0,3 | -1,2 | -1,5 | -1,2 |
| 4-Этил-2-метилгептан | 81 | 2 | 522,1 | 4,7 | 13,0 | 5,4 | 0,4 | -0,6 | 1,4 |
| 4-Этил-3-метилгептан | 81 | 4 | 529,5 | 0,2 | 11,3 | 0,2 | 0,5 | 0,2 | 0,7 |
| 4-Этил-4-метилгептан | 81 | 1 | 502,4 | 12,6 | 20,5 | 6,1 | 3,8 | 2,5 | 0,9 |
| 5-Этил-2-метилгептан | 81 | 1 | 525,7 | 1,1 | 3,6 | -4,0 | -1,5 | -1,0 | -0,5 |
| 3-Этилоктан | 27 | 1 | 536,7 | 2,4 | 3,8 | -2,6 | -0,7 | -1,1 | -0,3 |
| 4-Этилоктан | 27 | 2 | 540,5 | -1,4 | 5,8 | -0,6 | -0,5 | -0,9 | 0,2 |
| 4-(1-Метилэтил)гептан | 81 | 1 | 518,2 | 8,5 | 11,1 | 1,9 | 0,5 | -0,4 | 2,0 |
| 2-Метил-3-(1-Метил-этил)гексан | 243 | 1 | 508,1 | 6,2 | 10,0 | 3,7 | -3,0 | -4,4 | -1,2 |
| 2,2,3,3,4-Пентаметилпентан | 6561 | 2 | 459,8 | 15,4 | -34,5 | -38,0 | 0,9 | 1,1 | -0,4 |
| 2,2,3,4,4-Пентаметилпентан | 19683 | 1 | 455,0 | 47,1 | 9,5 | 2,5 | 1,5 | 1,4 | 0,0 |
| 4-Пропилгептан | 81 | 1 | 523,3 | 15,8 | 8,1 | 1,7 | 0,0 | -0,4 | 0,9 |
| 2,2,3-Триметилгептан | 729 | 2 | 501,1 | 18,0 | 7,2 | 1,5 | -0,2 | -0,2 | 0,1 |
| 2,2,4-Триметилгептан | 729 | 2 | 504,8 | -3,4 | 3,5 | -0,7 | 0,5 | 0,5 | 0,3 |
| 2,2,5-Триметилгептан | 729 | 2 | 506,8 | -5,4 | 1,5 | -2,7 | -1,5 | 0,3 | -1,4 |
| 2,2,6-Триметилгептан | 729 | 1 | 499,5 | -1,1 | 3,0 | 0,8 | 0,3 | -0,8 | 1,2 |
| 2,3,3-Триметилгептан | 243 | 1 | 501,4 | 16,9 | 10,2 | -0,1 | -1,5 | -1,1 | -1,3 |
| 2,3,4-Триметилгептан | 243 | 4 | 514,5 | -0,2 | 15,1 | 3,1 | 0,3 | 0,2 | 0,3 |
| 2,3,5-Триметилгептан | 243 | 4 | 519,8 | -5,4 | 9,8 | -0,6 | -1,3 | -0,1 | -1,6 |
| 2,3,6-Триметилгептан | 243 | 2 | 519,9 | -8,5 | 3,9 | -4,5 | -1,2 | -0,6 | -0,5 |
| 2,4,4-Триметилгептан | 243 | 1 | 502,7 | -2,2 | 8,9 | 0,1 | 0,3 | -1,0 | 0,5 |
| 2,4,5-Триметилгептан | 243 | 4 | 517,3 | -2,9 | 12,3 | 1,9 | -0,6 | 0,6 | -1,1 |
| 2,4,6-Триметилгептан | 243 | 1 | 501,0 | 10,5 | 17,1 | 10,3 | 0,6 | -0,4 | 0,6 |
| 2,5,5-Триметилгептан | 243 | 1 | 508,7 | -8,2 | 2,9 | -5,9 | -4,4 | -2,2 | -2,3 |
| 3,3,4-Триметилгептан | 243 | 2 | 505,4 | 15,9 | 12,0 | -0,3 | -1,8 | -0,8 | 0,3 |
| 3,4,4-Триметилгептан | 243 | 2 | 501,9 | 19,4 | 15,5 | 3,2 | 0,4 | -0,3 | 0,9 |
| 3,4,5-Триметилгептан | 243 | 4 | 514,7 | 2,6 | 14,9 | 0,9 | -0,2 | 0,3 | -1,5 |
| 3,3,5-Триметилгептан | 243 | 2 | 513,5 | -10,0 | 3,9 | -6,9 | -1,9 | -0,8 | -1,2 |
| 2,2,3,3-Тетраметилгексан | 2187 | 1 | 470,9 | -1,2 | 13,9 | 13,1 | 1,0 | 1,0 | 0,4 |
| 2,2,3,4-Тетраметилгексан | 2187 | 4 | 493,8 | 15,9 | 9,0 | -1,4 | 0,8 | 1,4 | 0,2 |
| 2,2,3,5-Тетраметилгексан | 2187 | 2 | 484,4 | 22,4 | 12,6 | 5,8 | -1,0 | 0,6 | -0,3 |
| 2,2,4,4-Тетраметилгексан | 2187 | 1 | 481,6 | -3,5 | 3,2 | -4,2 | -1,6 | -0,5 | -1,8 |
| 2,2,4,5-Тетраметилгексан | 2187 | 2 | 494,3 | -5,3 | 2,7 | -4,2 | -0,8 | 1,0 | -0,3 |
| 2,3,3,4-Тетраметилгексан | 729 | 2 | 483,1 | 43,7 | 23,1 | 8,1 | 0,4 | 0,3 | 0,7 |
| 2,3,3,5-Тетраметилгексан | 729 | 1 | 491,6 | 14,4 | 8,8 | -2,7 | -1,6 | -0,9 | -1,5 |
| 2,2,5,5-Тетраметилгексан | 13122 | 1 | 470,1 | 5,8 | -0,2 | -0,9 | -3,1 | 0,0 | -1,7 |
| 2,3,4,4-Тетраметилгексан | 729 | 2 | 494,6 | 14,3 | 11,6 | -3,6 | -1,0 | -1,0 | 1,2 |
| 2,3,4,5-Тетраметилгексан | 1458 | 4 | 491,5 | 10,4 | 21,1 | 6,3 | 0,0 | 0,8 | 0,5 |
| 3,3,4,4-Тетраметилгексан | 1458 | 1 | 472,3 | -0,4 | 15,9 | 8,4 | -1,7 | -1,5 | 0,0 |
| Среднее относительное отклонение, % отн. | 1,8 | 1,6 | 0,6 | 0,2 | 0,2 | 0,2 | |||
| Среднее абсолютное отклонение, Дж/(моль×К) | 8,4 | 7,9 | 3,0 | 1,0 | 0,8 | 0,8 | |||
При определении параметров аддитивной схемы были использованы значения энтропий веществ после исключения из них вкладов, учитывающих симметрию молекул (-Rlnsобщ., где sобщ.=sнаружное×sвнутреннее) и наличие в молекуле элементов хиральности (![]() ). Как и при прогнозировании
). Как и при прогнозировании ![]() , рассмотрена различная глубина детализации расчетного метода. Значения параметров для всех уровней детализации приведены в табл. 1.10. Результаты прогнозирования
, рассмотрена различная глубина детализации расчетного метода. Значения параметров для всех уровней детализации приведены в табл. 1.10. Результаты прогнозирования ![]() с использованием этих параметров даны в табл. 2.5 и показывают следующее.
с использованием этих параметров даны в табл. 2.5 и показывают следующее.
Среднее абсолютное отклонение при использовании только парциальных вкладов, характеризующих углерод-углеродные связи (уровень 1), составляет 3,0 Дж/(моль×К), что в 2,6 раза меньше, чем в методе Бенсона. Учет неполного второго окружения атомов (уровень 2) позволяет уменьшить погрешность прогноза до 1 Дж/(моль×К). Введение некоторых поправок, учитывающих взаимное влияние атомов углерода, разделенных тремя связями (уровень 3), еще несколько корректирует получаемый результат - среднее абсолютное отклонение составляет 0,8 Дж/(моль×К).
Обращает на себя внимание тот факт, что в отличие от энтальпии образования набор параметров для энтропии является носителем информации о группах, не обладающих значительным эффективным объемом. Это обстоятельство стимулировало рассмотрение расчетной схемы с параметрами, отвечающими за взаимодействие трех последовательно расположенных атомов углерода. При оптимизации рассмотрен полный набор параметров, отвечающих за подобные взаимодействия. Значения, превышающие по абсолютной величине 1 Дж/(моль×К), имеют только те параметры, которые приведены в табл. 1.10 (колонка – “разветвленные”). Их набор весьма интересен, особенно в сопоставлении с набором аналогичных параметров для энтальпий образования (табл. 1.10, колонка – “напряженные”). Результат сопоставления мы попытались отразить названиями указанных наборов параметров – “напряженные” и “разветвленные”. Действительно, при прогнозировании энтальпий образования важен учет степени напряжения молекулы, обусловленной взаимодействием удаленных друг от друга групп, - поправки типа С4-С2-С4, С3-С4-С4, С4-С3-С4, С4-С4-С4 достигают 20-50 кДж/моль. Для энтропий значимыми оказались совершенно иные вклады (см. табл. 1.10), которые не оказывают влияния на энтальпию образования, по крайней мере, на уровне точности современного калориметрического эксперимента.
Результаты приведенного анализа показывают, что путем реализации возможностей метода Татевского по связям можно обеспечить достаточно высокий уровень прогноза даже такого неаддитивного по своей природе свойства, как энтропия веществ.
Похожие работы
... по связям. Прогнозирование органических соединений методом Бенсона по атомам с их первым окружением Следует признать, что из всего многообразия аддитивных схем для прогнозирования энтальпий образования органических веществ метод Бенсона в течение продолжительного периода применяется наиболее широко. Объясняется это, вероятно, тем, что этим методом охвачен наиболее широкий круг соединений. Для ...
... идеально-газовым энтальпиям образования при других температурах или к , т.е. к свойству вещества в реальном состоянии. Следует признать, что из всего многообразия аддитивных схем для прогнозирования энтальпий образования органических веществ метод Бенсона в течение продолжительного периода применяется наиболее широко. Объясняется это, вероятно, тем, что этим методом охвачен наиболее широкий круг ...
ческих соединений при повышенных давлениях При прогнозировании энтропий веществ при повышенных давлениях широко используется подход, аналогичный рассмотренному выше для энтальпий образования (разд. 1) и основанный на принципе соответственных состояний и разложении Питцера для энтропии: (2.11) и таблицах Ли-Кеслера (табл. 2.7, 2.8) для энтропии. В уравнении (2.11) - ацентрический ...
... значений теплоемкостей при температурах, кратных 100 К, так и на основе аппроксимирующего их уравнения. 3.2. Теплоемкость органических веществ, находящихся при повышенных давлениях [6] Экспериментальные сведения о теплоемкости при высоких давлениях являются ограниченными. Поэтому прогнозирование теплоемкости оказывается неизбежным в большинстве практических расчетов. Поскольку речь идет о ...
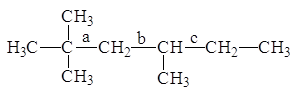


0 комментариев