Содержание
Введение
Глава 1. Пути синтеза и биологическая активность ядра изохинолина и его производных, методики анализа ассортимента лекарственных средств
1.1 Методы формирования ядра изохинолина
1.1.1 Реакция Бишлера – Напиральского
1.1.2 Реакция Пикте – Шпенглера
1.1.3 Реакция Померанца – Фрича
1.1.4 Новые методы формирования ядра изохинолина
Глава 2. Методы синтеза производных изохинолина
2.1. Биологическая активность производных изохинолина и изохинолона-3
Глава 3. Прогноз биологической активности новых N-арилроизводных 6,7-диметоксиизохинолинона-3
3.1 Использование логико-структурного подхода в прогнозе активности целевых соединений
3.2 Прогнозирование активности целевых соединений с использованием компьютерной программы PASS
Глава 4. Получение новых производных изохинолона–3
4.1. Качественный анализ 4-[1-(4-этоксифенил)-6,7-диметокси-3-оксо-3,4-дигидро-1Н-изохинолин-2-ил]-бензойной кислоты
Выводы
Список литературы
Введение
Целенаправленный поиск биологически активных соединений, базирующийся на современных представлениях о закономерностях взаимосвязи «структура–активность», является актуальной задачей современного здравоохранения. В медицинской практике находят широкое применение биологически активные соединения, содержащие ядро изохинолина. Представляется интересным исследование новых биологически активных веществ синтетической природы, относящихся к группе изохинолинов.
Ядро изохинолина вносит существенный вклад в следующие виды активности: спазмолитическую, антигипоксическую, кардиотропную и гипотензивную. Разработка антигипоксантов, как новая область фармакологии была впервые начата в начале 60-х годов. Известно, что антигипоксическая активность в определённой мере взаимосвязана с антиаллергической и иммунотропной активностью и реализуется с помощью каскадов биохимических реакций в организме.
Целесообразно использовать компьютерный прогноз биологической активности для обоснования и последующего синтеза целевых структур.
Сочетание широкого спектра фармакологических свойств, влияние на многие биохимические процессы, а также практическое отсутствие токсического воздействия на организм открывают широкие возможности для дальнейших исследований соединений, содержащих ядро изохинолина, что является общим структурным признаком с папаверином и его аналогами.
Целью наших исследований явилось осуществление целенаправленного синтеза новых 6,7-диметоксиизохинолонов-3 на основании прогноза биологической активности, проведение первичного биологического скрининга, разработка оптимальных способов анализа целевых соединений и анализ ассортимента лекарственных средств (ЛС), обладающих антигипертензивной активностью. Для цели исследования были поставлены и последовательно решены следующие задачи:
- с использованием отечественных и зарубежных источников литературы изучить и обобщить способы синтеза, биологическую активность производных изохинолина и изохинолона-3, а также провести анализ ассортимента ЛС;
- осуществить логико-структурный прогноз и провести компьютерные расчеты биологической активности целевых соединений;
- разработать оптимальные способы качественного и количественного определения соединения-лидера.
С использованием отечественных и зарубежных источников литературы будут изучены и обобщены методологические подходы к синтезу и определению биологической активности производных изохинолина и изохинолона-3.
Глава 1. Пути синтеза и биологическая активность ядра изохинолина и его производных
Алкалоиды изохинолинового ряда представляют собой один из обширнейших классов природных продуктов, уступающих по распространенности только индольным алкалоидам [1-6]. Интересно, что высокая биологическая активность, присущая производным изохинолина, проявляется практически для всех вариантов аннелированного пиридинового кольца - ароматические изохинолины (например, адаптамин, эллиптицин, бензо[c]фенантридины), дигидроизохинолины (но-шпа) и тетрагидроизохинолины (леморан) нашли широкое применение в медицинской и исследовательской практике.
В общем, следует заметить, что работы в области химии изохинолиновых алкалоидов и, шире, в области химии изохинолина и родственных систем, в основном сводятся к трансформации готового гетероциклического кольца в необходимом направлении, тогда как синтезу собственно исходного изохинолина уделяется гораздо меньше внимания. Несмотря на это, работы по синтезу алкалоидов реакциями замыкания, условно говоря, пиридинового кольца, особенно в случае полного синтеза алкалоидов, довольно не редки и составляют более 60% всех работ по синтезу изохинолинов [7,8].
1.1 Методы формирования ядра изохинолина
Большинство изохинолинов синтезировано по одному из трёх главных методов построения кольца [14, 34].
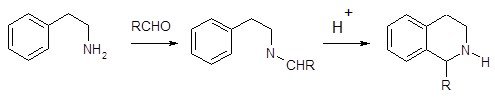
1.1.1 Реакция Бишлера–Напиральского
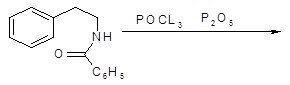
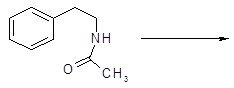
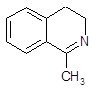
Наиболее часто используемый метод синтеза изохинолинов носит название реакции Бишлера-Напиральского. Схема синтеза заключается в циклизации b-фенилэтиламидов под действием кислотного катализатора, в качестве которого используют фосфорный ангидрид с хлорокисью фосфора или полифосфорную кислоту. Эта реакция получения изохинолинов носит общий характер [9]. Обычно образующийся дигидроизохинолин превращают в изохинолин каталитическим дегидрированием – нагреванием в присутствии платинового катализатора.
Схема 1
|
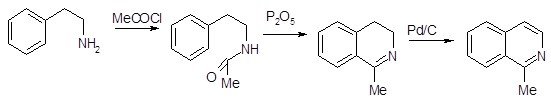
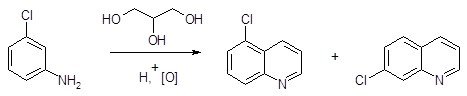
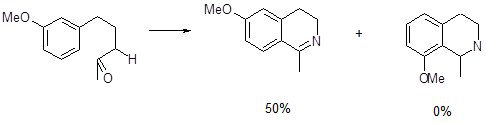
Циклизация по Бишлеру-Напиральскому, как и стадия циклизации в синтезе Скраупа, является ароматическим электрофильным замещением, в котором электрофилом является атом углерода протонированной карбонильной группы. Этим определяется характер влияния заместителя, находящегося в бензольном кольце, на скорость реакции, ее направление и выход целевого продукта. При взаимодействии мета-хлоранилина с глицерином в присутствии серной кислоты и мета-нитробензолсульфокислоты в качестве окислителя образуется примерно одинаковое количество 5-хлор- и 7-хлорхинолинов. В то же время, конденсация по Бишлеру-Напиральскому β-мета-метоксифенилацетамида приводит исключительно к 6-метоксипроизводному (выход 50%), 8-метоксипроизводное не образуется.
Схема 2
Протеканию циклизации по Бишлеру-Напиральскому не препятствует и введение в бензольное кольцо электроноакцепторной нитрогруппы, правда выход продукта циклизации при этом заметно снижается (< 10%). Следует отметить, что и не содержащий заместителя в бензольном кольце β-фенилацетамид циклизуется в соответствующее дигидропроизводное с выходом всего 23%. Низкий выход производных изохинолина компенсируется доступностью исходных соединений [10].
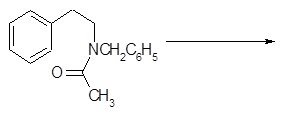
Механизм превращения ацилпроизводных β-фенилэтиламинов в дигидроизохинолины представлен на примере циклоконденсации соединения 1 [11].
Схема 3
|
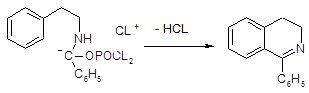
|
|
|
|
|
|
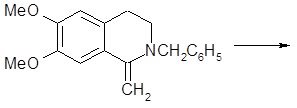
|
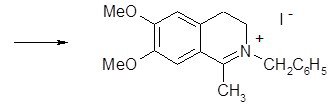
Лучше всего идёт реакция, если ароматическое кольцо активизировано, и наоборот, низкий выход 7-нитро-3,4-дигидроизохинолина наглядно иллюстрирует отрицательное влияние дезактивирующих групп. Фенилэтиламины, замещённые в мета-положении, образуют только 6-изомеры изохинолинов, так как замыкание цикла идёт в пара-, а не в орто-положение по отношению к активирующей группе.
Модификация Пикте–Гамса. Если исходить из потенциально ненасыщенных фенилэтиламинов, то по методу Бишлера–Напиральского можно непосредственно получать ароматические изохинолины. С этой целью β-метокси- или β-окси-β-фенилэтиламиды нагревают с обычно применяемыми конденсирующими агентами. Надо думать, что при этом сначала отщепляется метанол (или вода), а затем происходит циклизация образовавшегося ненасыщенного амида в изохинолин [4, 12].
Схема 4
|
|
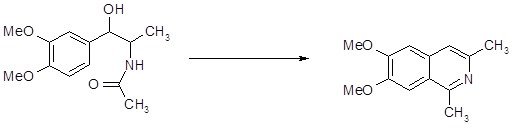
Пример изохинолинового синтеза
Схема 5
|
|
|
|
|
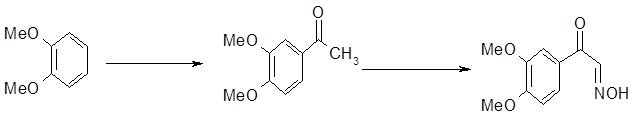
|
|
|
|
|
|
|
|
1.1.2 Реакция Пикте–Шпенглера
Большое значение в синтезе алкалоидов, являющихся производными изохинолина, имеет методПикте-Шпенглера, в котором в циклизацию вводят не ацетамидные производные, как в методе Бишлера-Напиральского, а имины, образующиеся при взаимодействии альдегидов с β-фенилэтиламинами в кислой среде [16, 12]. Синтез тетрагидроизохинолинов по методу Пикте–Шпенглера можно рассматривать как частный случай реакции Манниха. Процесс протекает в равной степени хорошо как с первичными, так и с вторичными аминами. В соответствии с условиями реакции первоначально образуется имин (в случае вторичного амина – енамин), который далее под влиянием кислоты протонируется, и возникающее положительно заряженное промежуточное соединение подвергается внутримолекулярному электрофильному замещению. Механизм этого процесса весьма сходен с механизмом реакции Бишлера–Напиральского, за исключением того, что конденсирующий агент не регенерируется на последней стадии. Благодаря такому сходству влияние заместителей в ароматическом кольце на скорость и направление циклизации в обоих случаях аналогично [13]. При протонировании атома азота образуется иммониевое соединение – сравнительно слабый электрофил, для успешной циклизации которого необходимо присутствие мощных активирующих группировок в ароматическом кольце. Влияние метоксигруппы оказывается достаточным только в том случае, если она находится в пара-положении к месту, по которому происходит замыкание; при наличии этой группы в других положениях кольца циклизация не идёт. В том случае, когда в бензольном кольце присутствуют активирующие заместители, реакция циклизации происходит в очень мягких, иногда даже в физиологических условиях (рН среды, температура, концентрации реагентов), и приводит к гидрированным производным изохинолина с высоким выходом [14, 7]. Это напомнило о высказанных ранее предположениях о биогенезе тетрагидроизохинолиновых алкалоидов, согласно которым лабораторные синтезы по методу Пикте–Шпенглера воспроизводят условия биосинтеза алкалоидов в клетках растений. Однако впоследствии такая точка зрения не подтвердилась: теперь стало известно, что в природных условиях биосинтез изохинолиновых алкалоидов катализируется ферментами и осуществляется по более сложной схеме, чем это предполагалось ранее.
Схема 6
|
|
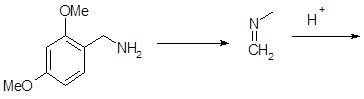
Таким образом, направление этой реакции замыкания гетероцикла совпадает с направлением синтеза Бишлера–Напиральского: она осуществляется благодаря электрофильной атаке по пара-, а не орто-положению к активирующей групперовке.
Два этих метода (1.1.1) и (1.1.2) основаны на конденсации фенилэтиламина с альдегидом или кислотой с последующей циклизацией в присутствии кислот. По такой общей схеме можно получать ди- и тетрагидроизохинолины. И те и другие легко дегидрируются до ароматических соединений. Из мета-замещённых фениламинов этими двумя методами можно синтезировать изохинолины с заместителями только в положении 6. Кроме того, они позволяют синтезировать изохинолины, замещённые любыми алкильными и арильными группами по положению 1. Но если у бензольного кольца исходного фенилэтиламина имеются электроноакцепторные группировки, то оба эти метода непригодны для синтеза изохинолинов [15].
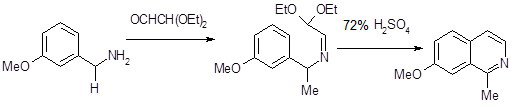
1.1.3. Рекция Померанца-Фрича
Синтез Померанца-Фрича обычно проводят в две стадии. На первой происходит образование альдимина в результате конденсации бензальдегида с аминоацеталем. На второй стадии альдимин циклизуется под действием сильных кислот. С циклизацией конкурирует процесс гидролиза имина, что приводит к снижению выхода продукта циклизации [9]. Если реакцию проводить в мягких условиях, то альдимин получается с высоким выходом. На второй стадии альдимин циклизуется под действием сильных кислот. Последняя стадия синтеза – это обычная реакция, катализируемая кислотами: кислота в первую очередь вызывает отщепление одной молекулы этанола с образованием частицы, способной атаковать кольцо в качестве электрофила; процесс завершается отщеплением второй молекулы этанола.
Схема 7
|
|
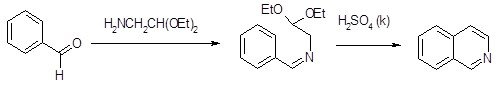
Электрофильный характер циклизации объясняет тот факт, что присутствие электронодонорных заместителей у ароматического кольца бензальдегида благоприятным образом сказывается на результатах синтеза, а наличие электроноакцепторных дезактивирующих групп у бензальдегида наименее благоприятствует циклизации. Когда активирующие группы занимают мета-положение по отношению к альдегидной группе, они способствуют реакции в большей степени, чем в остальных положениях кольца. мета-Ориентация этих групп содействует мезомерной подаче электронов к месту электрофильной атаки, при этом активируются как орто-, так и пара-положения, по которым возможна циклизация. Таким образом, атака электрофильного иона карбония может быть направлена по одному из этих положений. Фактически замыкание кольца всегда идёт по пара-положению к активирующей группе с образованием изохинолинов, замещённых по С7-атому. Вероятно, такое предпочтение для атаки по пара-положению вызвано тем, что замыкание по орто-положению затруднено по стерическим причинам [16].
Этот способ удачно дополняет два рассмотренных ранее метода синтеза изохинолинов, поскольку при его применении образуются замещённые изохинолины, которые не удаётся синтезировать другими путями. При замене ароматических альдегидов кетонами процесс протекает менее гладко. Ниже представлена схема, устраняющая этот недостаток:
Схема 8
|
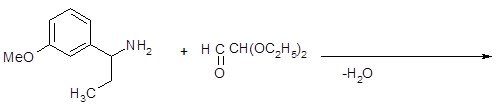
|
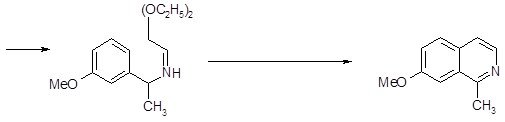
Изохинолины, замещённые по С1-атому, трудно синтезировать по методу Померанца-Фрича. Первая стадия синтеза – образование кетамина из аминоацеталя и кетона идёт далеко не так гладко, как аналогичная реакция с бензальдегидом. Чтобы устранить это затруднение, предложен другой способ проведения синтеза: замещенный бензиламин конденсируют с полуацеталем глиоксаля; образовавшийся имин циклизуют обычным способом [17].
Схема 9
|
|
1.1.4 Новые методы формирования ядра изохинолина
Соединения, включающие в свою структуру изохромоновый или изохинолоновый фрагмент, представляют собой обширный ряд природных и синтетических веществ, обладающих биологической активностью. Именно поэтому высок интерес к разработке новых методов получения этих соединений [18].
Гетероциклические системы изохинолина и индоло[2,3-с]пиридина (β-карболина) служат структурными компонентами большого числа алкалоидов. Именно это стимулирует интерес к этим классам соединений, среди которых найдены и с успехом применяются многие лекарственные средства [19]. Работы по установлению структуры, синтез природных аналогов, поиск новых биологически активных соединений на основе изохинолина и индоло[2,3-с]пиридина оказали существенное влияние на развитие химии гетероциклических соединений и органической химии в целом [17].
Классические методы синтеза - реакции Пикте-Шпенглера, Померанца-Фрича и Бишлера-Напиральского сейчас почти не используются для синтеза ахиральных изохинолинов [20]. Каждому из этих методов присущи определенные недостатки: невысокие выходы (Померанц-Фрич), необходимость дегидрирования промежуточных дигидроизохинолинов (Бишлер-Напиральский) и т.д. В связи с этим актуальным является поиск новых путей синтеза этих соединений на основе доступных реагентов.
Из новых методов, вошедших в практику сравнительно недавно, нужно упомянуть синтез 3-карбокси-тетрагидроизохинолина [30] исходя из орто-галогенметильных производных бензола 1 напрямую или через стадии получения эфира 2и кислоты 3.
Схема 10
|
|
|
|
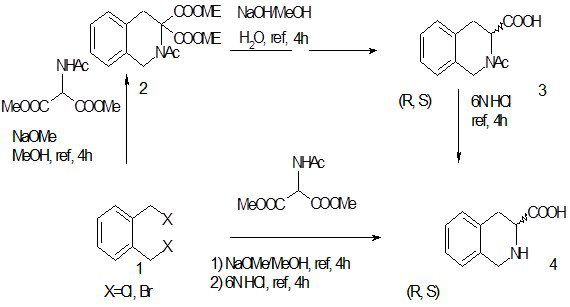
Дальнейшая обработка (-)-ментолом в присутствии TsOH, нагревание, нейтрализация и колоночная хроматография приводят к соответствующим эфирам с выходом 75-91%, которые легко перевести в свободные (R) или (S) кислоты c выходом 90-100%. Важность этой методики не только в возможности синтеза хиральных изохинолинов, но и в вовлечении в реакцию неактивированного бензольного ядра, т.к. реакция Пикте-Шпенглера в своем классическом варианте требует донорных заместителей в ароматической части исходного амина.
Ряд синтезов изохинолинов осуществлён присоединением иминов к литийорганическим соединениям. Так, Дэвис [21] описал синтез замещённых дигидроизокарбостирилов присоединением иминов к литированному диалкиламиду орто-толилбензойной кислоты [22].
Схема 11
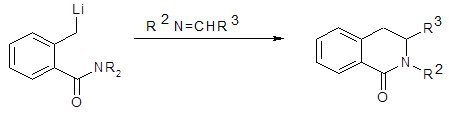
Выводы по главе
1. Обширный массив информации, посвященной синтезу и изучению биологической активности производных изохинолина и изохинолона-3, свидетельствует о целесообразности синтеза новых биологически активных соединений.
2. Наиболее простым и доступным методом формирования ядра изохинолина является реакция Бишлера–Напиральского.
3. Из обзора следует, что актуальным является вопрос об использовании орто-галогенметильных производных бензола и литийорганических соединений, а также гомофталевой кислоты в качестве исходных компонентов для формирования гетероциклического ядра изохинолина.
4. Производные изохинолина и изохинолона-3 характеризуются широким спектром фармакологических свойств.
Глава 2. Методы синтеза производных изохинолина
Синтез изохинолинов, спиросочленённых по положению 4 с карбо- или гетероциклами
Среди всего многообразия гетероциклов можно выделить ряд таких, для которых вероятность обнаружения полезных биологических свойств столь высока, что позволяет даже говорить о фармакофорности их гетероциклических ядер [23]. В качестве примера можно упомянуть об интенсивно развивающейся химии 4-спиропиперидинов. То же самое можно сказать и о спироизохинолинах, химии которых посвящено более 600 оригинальных работ, причём во многих из них рассматриваются также те или иные аспекты биологического действия этих соединений [13].
Существует два известных метода синтеза 4-спироизохинолинов. Первый состоит в формировании изохинолинового фрагмента путём внутримолекулярной циклизации соединения, представляющего собой соответствующим образом функционализированный арилзамещённый карбо(гетеро)цикл. Второй подход предполагает использование изохинолиновых интермедиатов, в которых созданы предпосылки для сочленения по положению 4 с карбо(гетеро)циклом.
Для синтеза широко используются обычные пути построения изохинолиновой системы [13, 24]. Так, один из ключевых методов основан на конденсации в условиях реакции Пикте-Шпенглера β-арилэтиламинов с формалином. Исходные амины получают взаимодействием соответствующих арилацетонитрилов с α,ω-дигалогенидами и дальнейшим восстановлением нитрильной группы до аминной стандартными способами. Например, взаимодействием 3,4-диметоксифенилацетонитрила с 1,4-дибромбутаном, 1,5-дибромпентаном или бис-2-хлорэтиловым эфиром в толуоле при использовании NaNH2 в качестве основания были получены соответствующие циклоалкилированные нитрилы, которые подвергались гидридному восстановлению алюмогидридом лития либо каталитическому гидрированию в амины 1. Дальнейшая конденсация последних с формалином через основания Шиффа по Пикте-Шпенглеру привела к тетерагидро-4-спироизохинолинам 2 (Х=связь, -СН2-, -СН(ОН)-) с высокими выходами [1, 25].
Схема 12
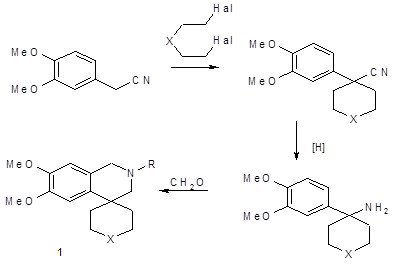
Широко используется в синтезе 4-спироизохинолинов ещё один классический способ построения системы изохинолина – реакция Бишлера-Напиральсткого. При этом N-ацилированые арил(аминометил)(карбо)- или гетероциклы 3 подвергают катализируемой кислотными катализирующими агентами (РОCl3, H3PO4, ПФК и др.) циклизации в соответствующие 2,3-дигидро-4-спироизихинолины 4. Этим способом получены производные спиро[изохинолин-4,1´-циклопентан]а 4 (Х=связь) [25, 26], спиро-[изохинолин-4,1´-циклогексан]а 4 (Х=-СН2-) [35], спиро[изохинолин-4,4´-пиперидин]а 4 (Х=-NМе-) [26, 33].
Схема13
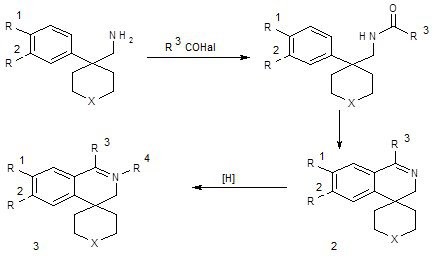
Характер заместителя R3 в соединениях 2 определяется строением исходного амида и может варьироваться в широких пределах. Выходы целевых спиранов 2 при этом колеблются в широком диапазоне от 30 до 80%.
Использование реакции Бишлера-Напиральского позволяет варьировать заместитель R3 в положении 1 изохинолинового цикла в широких пределах, ограниченных по сути, только доступностью (галоген)ангидридов соответствующих карбоновых кислот, что выгодно отличает этот способ от синтеза 4-спироизохинолонов по Пикте-Шпенглеру, который применяется лишь для получения 1-незамещнных тетрагидро-4-спироизохинолинов. Особые требования предъявляются к электронодонорности ароматического ядра в исходных β-фенетиламинах. Не случайно большинство синтезированных этими методами 4-спироизохинолинов содержит в положении 6 и, дополнительно, 7 электронодонорные заместители (R1, R2=OH,OAlk; R1,R2= -O(CH2)2O-). Использование Ar-незамещённых β-фенетиламинов возможно, но выходы при этом ниже.
Кислотно-катализируемая циклоконденсация 1-фенилциклоалкан-карбоксамидов с параформальдегидом демонстрирует расширение возможностей реакции Пикте-Шпенглера для получения спиро[изохинолин-4,1´-циклоалкан]-3-онов 4 (n=1,2; R=аминоалкил).
Схема 14
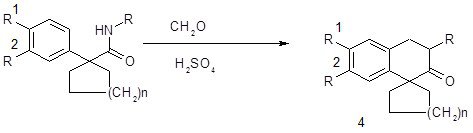
Как вариант синтеза по Пикте-Шпенглеру можно рассматривать циклоконденсацию тиоамидов 9 (Х=СSNH2) c (гетеро)ароматическими альдегидами под действием Р2О5 в полифосфорной кислоте, приводящую к спиро[изохинолин-4,4´-пиперидин]-3-тионам 10 (Z=S; R1=R2=H, OMe; R3=H, Me; R4=y, Ar, 4-пиридил) [22, 31]. В тех же условиях возможна циклизация нитрилов (Х=CN), приводящая к спиро[изохинолин-4,4´-пиперидин]-3-онам № (Z=O).
Схема 15
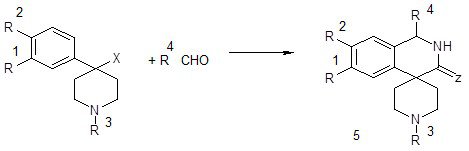
Гомофталевая кислота и её производные широко используются в синтезе изохинолинов, как и её циклоалкилированные аналоги. Так, при обработке 1-(2-цианофенил)циклоалканкарбонитрилов 90% серной кислотой были получены спиро[изохинолин 4,1´-циклобутан]-, спиро[изохинолин 4,1´-циклопентан]-, спиро[изохинолин 4,1´-циклогексан]-1,3-дионы 6 (n=1-3) [32, 26].
Схема 16
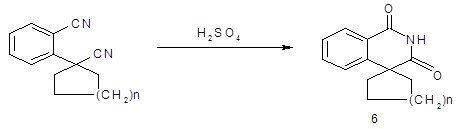
2.1. Биологическая активность производных изохинолина
Представленные в пункте 1.2. соединения проявляют широкий спектр биологической активности.
Свойство угнетать психомоторную активность описано для спиро[изохинолин-4,1´-циклопентан]-1,3(2р, 4Н)-диона. На основании анализа результатов тестирования 4-спироизохинолинов 1 (Х = связь, -О-; R = ω-амино- и ω(диалкиламино)алкил) сделан вывод о том, что введение спиросочленённых с системой изохинолина циклов усиливает угнетающее действие на нервную систему [30]. Cоединения общей структуры 1 проявили себя также как потенциальные антипаркинсонические средства (центральные холинолитики) и агонисты дофаминовых рецепторов.
Рис. 1
По результатам ряда тестов спиро-3,4-дигидроизохинолины 2 были классифицированы как потенциальные нейролептики [27].
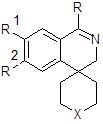
Рис. 2
Гипотензивное действие характерно для спироизохинолинов 3 (Х = связь, R1 = H, Alk; R2 = R4 = H; R3 = арил, аралкил) [35, 36]. Гипнотические свойства описаны у спиро[изохинолин-4,1-циклопентан]ов 3 (Х = связь; R1 = OAlk; R1 = R4 =H; R3 = CH2C6H3(OMe)2-3,4).Тесты на животных показали противосудорожное действие соединений типа 3 (Х = связь, -(СН2)-, -О-; R1 = R2 = OMe; R3,R4 = H, Me) [26].
Действие на периферическую нервную систему характерно для большого числа спироизохинолинов.
Значительное внимание уделялось выявлению влияния на эфферентную иннервацию: наряду с констатацией слобого адрено- и холинолитического действия для спиротетрагидроизохинолинов 3 (Х = -(CH2)-; R1 =R2 = OMe; R3 = арил, аралкил; R4 = H) зафиксирован чёткий спазмолитический эффект для соединений 3 (Х = связь; R1 = R2 = R4 = Н, R3 = Ar) (Х = связь, -(CH2)-, -О-; R3, R4 = Н, Me; R1 = R2 = OMe)и 3,4-дигидроизохинолинов 2 (Х связь, -О-; R1 = R2 = ОМе; R3 = -СН=СНAr) [28].
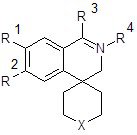
Рис. 3
Соединения типа 4 находят применение в качестве препаратов для лечения психических и психосоматических заболеваний [29].
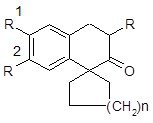
Рис. 4
Спиро[изохинолин-4,4´-пиперидин]ы 5 и их структурные аналоги – изохинолин-3-(ти)оны с β-аминоэтильными заместителями в положении 4 – заявлены как антиаритмические агенты [38] и антиконвульсанты [39]. Гипотензивное действие характерно для ряда спироциклических изохинолинов 5 (Х = связь; R1 = H, OAlk; R2 = R4 = H; R3 = арил, аралкил) [30, 32].
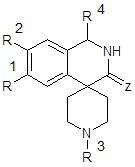
Рис. 5
Вещества общей структурой 6 использованы в качестве полупродуктов в синтезе кардиотонических и антигипертензивных препаратов [33].
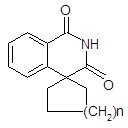
Рис. 6
Кардиотоническими свойствами обладают синтезированные на основе спиранов 6 (n=1-3) спироциклические имидазоизохинолины (рис.7) [3,4].
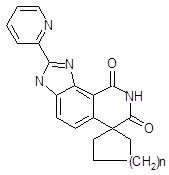
Рис. 7
Выводы по главе
1. Обширный массив информации, посвященной синтезу и изучению биологической активности производных изохинолина и изохинолона-3, свидетельствует о целесообразности синтеза новых биологически активных соединений.
2. Наиболее простым и доступным методом формирования ядра изохинолина является реакция Бишлера–Напиральского.
3. Из обзора следует, что актуальным является вопрос об использовании орто-галогенметильных производных бензола и литийорганических соединений, а также гомофталевой кислоты в качестве исходных компонентов для формирования гетероциклического ядра изохинолина.
4. Производные изохинолина и изохинолона-3 характеризуются широким спектром фармакологических свойств.
Глава. 3. Прогноз биологической активности новых
N-арилпроизводных 6,7-диметоксиизохинолинона-3
3.1 Использование логико–структурного анализа в прогнозе активности целевых соединений
Для выявления зависимости между структурой и биологической активностью в репрезентативных рядах родственных соединений обычно пользуются сопоставлением природы и положения отдельных заместителей по отношению к родоначальной структуре и результатами анализа количественных соотношений «структура-активность».
Перспективным направлением поиска БАС обладающих высокой биологической активностью и минимальной токсичностью является молекулярное конструирование на основе эндогенных соединений организма, или достаточно близких к ним по строению структур. Для таких соединений в организме предусмотрены каскады биохимических процессов, позволяющие метаболизировать эти вещества наиболее безопасным путем, что позволяет предположить уменьшение вероятности проявления побочных эффектов и снижение токсических свойств [17].
Препараты, обладающие спазмолитической и антигипоксической активностью, представляют значительный интерес в качестве антигипертензивных средств, снижающих периферическое сосудистое сопротивление [18].
Вазодилатирующее действие миотропных спазмолитиков реализуется путём изменения ионного баланса в стенке сосудов, ингибирования фосфодиэстеразы или активацией аденилатциклазы, а также блокады аденозиновых рецепторов.
Однако применение этих средств при гипертонической болезни ограничивает выраженная симпатическая стимуляция сердца (компенсаторная тахикардия) и клеток юкстагломерулярного аппарата (выброс ренина с повышением АД) [24].
Известно, что ангиотензин ΙΙ относится к наиболее активным эндогенным вазопрессорным веществам и, кроме того, принимает участие в регуляции продукции альдостерона [20]. Исходя из этого, поиск перспективных антигипертензивных веществ осуществляли среди соединений, угнетающих ренин-ангиотензиновую систему.
Биологическое действие этих соединений реализуется путём снижения содержания в плазме протеолитического фермента ренина, который обеспечивает превращение ангиотензиногена в ангиотензин Ι (оба вещества не обладают активностью). В дальнейшем из ангиотензина Ι образуется вазоактивный ангиотензин ΙΙ.
С другой стороны образование ренина можно снизить, понижая тонус адренергической иннервации. Уменьшение количества ренина наблюдается и в случае угнетения синтеза простагландинов (простациклина, ПГЕ2), которые стимулируют образование и высвобождение ренина. Соответственный механизм биологического действия характерен для нестероидных противовоспалительных средств [20].
Современный подход к лечению гипертонической болезни основан на комбинированной терапии миотропными спазмолитиками и блокаторами ангиотензинпревращающего фермента (иАПФ), а также высокоэффективными антиадренэргическими средствами [24].
Исходя из выше изложенного, представляется интересным молекулярное конструирование структур, влияющих одновременно на несколько механизмов проявления антигипертензивного действия. Следует подчеркнуть, что таким влиянием могут характеризоваться не только прогнозируемые вещества, но и их ближайшие метаболиты.
Фрагмент –N–C=O является общим фармакофорным признаком в лекарственных веществах, относящихся к группе ингибиторов АПФ. Выделенный фармакофорный фрагмент в виде экзоциклической карбонильной группы, связанной с гетероатомом азота, содержится во всех соединениях этого фармакологического класса, кроме препаратов бензапирил и цилазоприл (Рис. 8), карбонильную группу в которых следует отнести к гетероциклической.
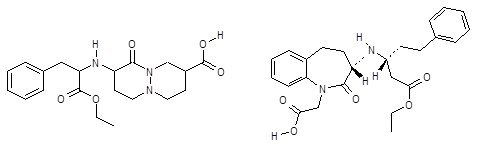
Рис. 8 - Препараты группы иАПФ, содержащие гетероциклическую карбонильную группу
Логико-структурный анализ выявил качественное соотношение между природой карбонильной группы, непосредственно связанной с гетероатомом азота, и количеством негативных фармакологических свойств лекарственных веществ группы иАПФ.
Так, наиболее часто назначаемый препарат эналаприл наряду с моэксиприлом, рамиприлом, спираприлом и энаприлатом содержит карбонильную группу амидной природы и характеризуется наибольшим числом отрицательных побочных свойств, таких как тахикардия, аритмии, головная боль, потеря аппетита, нарушение вкусовых ощущений, кожные аллергические реакции, астения, нейропения. В то же время для цилазоприла, в строении которого выделенный фармакофорный фрагмент входит в гетероциклическую систему, количество побочных эффектов выражено в меньшей степени. Цилазоприл превосходит эналаприл по силе фармакологического действия (суточная доза 0,25–0,5 мг, в отличие от суточной дозы эналаприла – 5-1 мг). Бензапирил также выгодно отличается тяжестью побочных действий от препаратов, содержащих экзоциклическую карбонильную группу.
В последнее время создан целый ряд синтетических (непептидных) препаратов, относящихся к специфическим блокаторам АТ1-ангиотензиновых рецепторов, ингибиторы АПФ и блокаторы АТ1-ангиотензиновых рецепторов «выключают» действие ангиотензина ΙΙ на сердечно-сосудистую и нейроэндокринную системы. Однако блокаторы АТ1-ангиотензиновых рецепторов более эффективно воздействуют на ренин-ангиотензиновую систему, чем ингибиторы АПФ [32].
Вещества группы блокаторов АТ1-ангиотензиновых рецепторов, также как иАПФ, могут быть отнесены к азотсодержащим гетероциклам. В первую очередь выделенный фрагмент содержится в таких представителях блокаторов АТ1-ангиотензиновых рецепторов, как эпросартан и ирбесартан.
Классическим представителем миотропных спазмолитиков является препарат папаверин, в основе которого лежит ядро 6,7-диметоксиизохинолина. Введение гетероциклического карбонила в положение 3 ядра изохинолина формирует общую фармакофорную группу, выделенную в строении препаратов ингибиторов АПФ, а также блокаторов АТ1-ангиотензиновых рецепторов.
Исходя из этого, мы прогнозируем для соединений ряда изохинолонов-3 сохранение спазмолитических свойств, присущих миотропным спазмолитикам, и приобретение возможности влиять на активность ренин-ангиотензин-альдостероновой системы.
3.2 Прогноз активности целевых соединений с использованием компьютерной программы PASS
Разработка нового соединения связана с высоким риском получения отрицательного результата из-за возможного выявления побочных фармакологических эффектов, токсичности и т.п. Предсказание основного и побочных эффектов на ранней стадии исследований позволяет значительно снизить издержки и риск проведения исследований.
Для предварительной оценки спектра биологической активности прогнозируемых соединений на основе структурных формул была использована компьютерная система РАSS (Prediction of Activity Spectra for Substance), которая предоставляет возможность оценивать фармакологические эффекты, механизмы действия и специфическую токсичность вещества [18].
Система PASS отличается от аналогичных разработок: расширенным списком прогнозируемых видов биологической активности; вводом химической информации в виде привычной для химика структурной формулы; автоматическим кодированием химической структуры фрагментарными кодами суперпозиции подструктур ФКСП, новыми, существенно более устойчивыми, алгоритмами установления зависимости "структура - активность" [5, 36].
Прогноз осуществляется путем "сравнения" структуры предполагаемого химического соединения с базой данных, имеющейся в пакете самой программы.
Совместное применение логико-структурного подхода к формированию структур компьютерным прогнозом программы PASS обеспечивает более высокую точность и достоверность предварительных данных [33].
Программа PASS имеет большое значение на начальном этапе молекулярного конструирования БАС, поскольку позволяет оценить целесообразность синтеза целевых соединений с точки зрения их возможной фармакологической активности [2].
Анализ вероятности проявления кардиотропной активности показал, что все исследуемые соединения, предположительно обладают достаточно высокой кардиотропной активностью за исключением вещества S4. Это предположение хорошо согласовывается со структурой данного соединения, содержащего в отличие от других синтезированных соединений N–амидный фрагмент.
Компьютерный прогноз вещества S3 показывает высокую вероятность проявления как кардиотропной, так и антиангинальной и антигипоксической активностей. Этот факт позволяет предположить наличие позитивных кардиотонических свойств.
Вазодилатирующее центральное и периферическое действие, а также ионотропная активность с высокой долей вероятности прогнозируются для всех гипотетических соединений, кроме S4. Этот факт можно объяснить наличием изохинолинового гетероцикла, а также двух метоксигрупп в положениях 6 и 7, что является объединяющим признаком с родоначальником миотропных спазмолитиков папаверином.
Наиболее ожидаемые проявления видов активности для синтезированных соединений, полученных с помощью анализа в программе PASS, представлены в табл. 1.
Таблица 1 - Потенциальная активность синтезированных соединений на основании прогноза PASS
|
Прогнозируемый вид биологической активности |
Потенциальная активность синтезированных соединений, Pa, % |
||||||
|
S1 |
S2 |
S3 |
S4 |
S5 |
S6 |
S7 |
|
|
Кардиопротекторная |
78,6 |
78,2 |
70,2 |
- |
68,9 |
68,1 |
68,6 |
|
Коронарорасширяющая |
63,2 |
58,3 |
77,5 |
- |
73,6 |
72,2 |
67,8 |
|
Лечение инфаркта миокарда |
59,8 |
58,4 |
52,4 |
38,7 |
49,7 |
47,6 |
46,1 |
|
Вазодилатирующая периферическая |
69,2 |
67,2 |
60,4 |
- |
65,6 |
65,2 |
46,8 |
|
Вазодилатирующая центральная |
46,5 |
46,3 |
37,3 |
52,1 |
43,9 |
43,7 |
33,2 |
|
Ионотропная |
51,2 |
51,1 |
50,4 |
- |
58,6 |
58,8 |
46,2 |
|
Ноотропная |
53,0 |
54,4 |
64,4 |
42,2 |
65,4 |
65,6 |
62,1 |
|
Антинейротоксическая |
58,4 |
63,5 |
35,8 |
- |
44,2 |
48,3 |
44,6 |
|
Противовоспалительная |
36,8 |
36,2 |
30,8 |
- |
40,1 |
39,2 |
- |
|
Антиангинальная |
64,2 |
62,3 |
61,3 |
44,2 |
53,1 |
52,1 |
73,2 |
|
Антигипоксическая |
- |
- |
53,7 |
- |
56,6 |
55,8 |
42,6 |
|
Антиишемическая |
35,5 |
36,8 |
41,9 |
- |
45,3 |
44,1 |
40,9 |
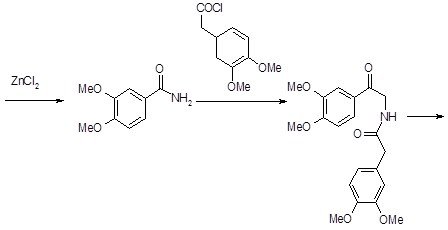
Глава 4. Получение новых производных изохинолона–3
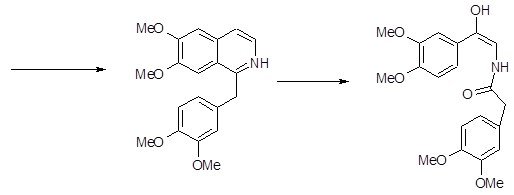
На основе логико-стуктурного анализа можно предложить синтез 7 соединений N-арилзамещённых изохинолона-3 общей структурой, изображённой на рис. 9 (Рис. №10).
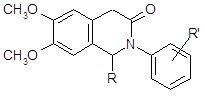
Рис. 9 - Общая структурная формула новых производных изохинолона-3
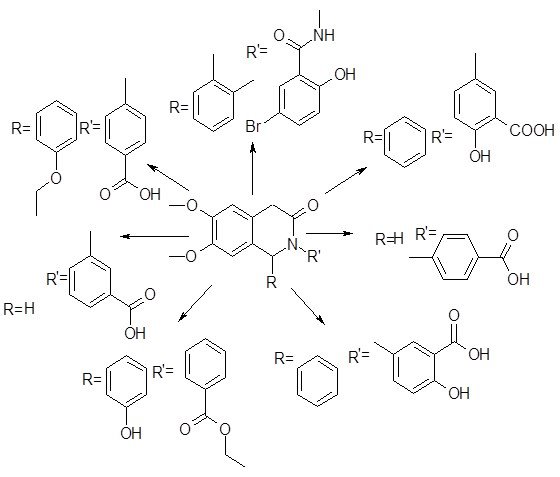
Рис. 10 -Схема структурных формул производных изохинолона-3
Из многочисленных методов получения производных изохинолина был выбран метод двухэтапного синтеза целевых соединений путём получения 6,7-диметокси-1-фенилизохроманона-3 с дальнейшим замещением гетероциклического атома кислорода на азот.
Получение изохроманона осуществлялось путём взаимодействия эквимолярных количеств гомовератровой кислоты и соответствующего ароматического альдегида в среде уксусного ангидрида с использованием концентрированной серной кислоты. Серная кислота применяется как дегидратирующее средство и для создания протонной реакционной среды, так как реакция протекает в условиях кислотного катализа.
В случае получения 1-фенилнезамещённых изохромонов-3 в формировании гетероциклической системы в качестве альдегидного компонента реакции следует использовать формальдегид.
Получение целевых соединений осуществлялось взаимодействием изохроманонов-3 с соответствующими аминами, содержащими первичную ароматическую аминогруппу. Замена гетероатома кислорода на азот осуществлялась путём кипячения эквимолярных количеств исходных соединений в среде ледяной уксусной кислоты.
Выход продуктов реакции варьировал от 65 до 80%.
Получение 5-бром-N-[1-(3,4-диметил-фенил)-6,7-диметокси-3-оксо-3,4-дигидро-1Н-изохинолин-2-ил]-2-гидрокси-бензамида (S4) проводилось с использованием гидразида 5-бром-2-гидроксибензойной кислоты. Реакция протекала в среде ледяной уксусной кислоты с практически количественным выходом.
Методика: к раствору 0,1 м гомовератровой кислоты и 0,1 м соответствующего ароматического альдегида (в случае получения соединений, не содержащих заместителей в положении 1, использовали формальдегид) в 50 мл уксусного ангидрида при перемешивании и охлаждении приливали 5-10 капель концентрированной серной кислоты. Спустя сутки разбавляли 50 мл этилацетата и выливали в 200 мл холодной воды. Образовавшиеся на границе фаз кристаллы отфильтровывали и перекристаллизовывали из этилацетата (Рис. 11).
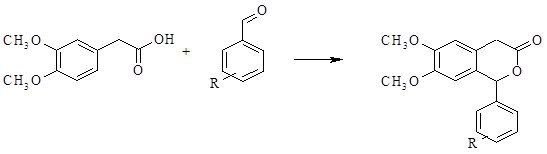
Рис. 11. Схема 1-ой стадии реакции получения производных
изохинолона-3
При кипячении изохроманонов-3 с гидразидами кислот в уксусной кислоте происходит рециклизация (Рис. 12):
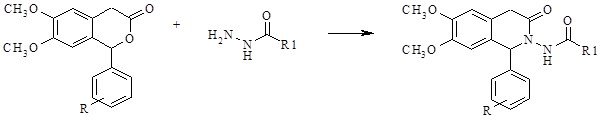
Рис. 12. Схема 2-ой стадии реакции получения производных
изохинолона-3
4.1. Качественный анализ 4-[1-(4-этоксифенил)-6,7-диметокси-3-оксо-3,4-дигидро-1Н-изохинолин-2-ил]-бензойной кислоты
С целью идентификации исследуемого вещества были использованы методы ИК- и УФ-спектроскопии, а также метод ЯМР-Н1.
УФ-спектроскопия.
Для подтверждения подлинности исследуемого вещества использовали УФ-спектр спиртового раствора S3. Для этого готовили раствор по методике: точную навеску лекарственного вещества (0,05г) растворяли в спирте этиловом при нагревании на водяной бане в мерной колбе вместимостью 100 мл. Раствор охлаждали и доводили растворителем до метки (раствор А).
1мл раствора А переносили в мерную колбу вместимостью 5мл и доводили этанолом до метки (раствор Б).
Измеряли оптическую плотность полученного раствора на спектрофотометре марки «СФ - 101» в кварцевых кюветах толщиной 1 см, раствор сравнения – этанол, в диапазоне длин волн от 240 до 310 нм. Спектр поглощения представлен на рисунке 13.
|
|
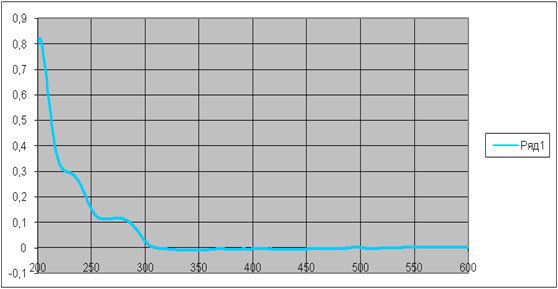
Рисунок 13 - УФ-спектр 0,001% спиртового раствора S3
Наблюдается одна полоса поглощения с максимумом в области 276 нм.
В связи с тем, что электронные спектры не дают полной качественной характеристики, следующим этапом явилось подтверждение подлинности S3 с помощью ИК- спектрофотометрии (рисунок 14 ).
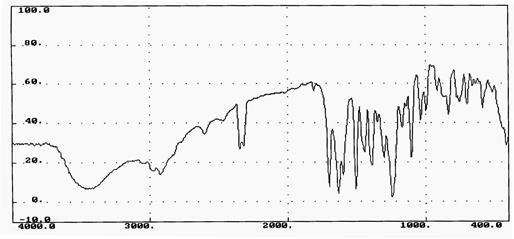
Рисунок 14 - ИК-спектр S3.
ИК-спектр, снятый в таблетках калия бромида (KBr), позволил обнаружить в молекуле S3 следующие полосы поглощения соответствующие определенным функциональным группам: 1693 см-1 (C=О связь в СООН группе), 1590 см-1 (С=О связь в >N-C=O группе).
Таким образом на основании данных спектров (ИК-, УФ-) подтверждается структура 4-[1-(4-этоксифенил)-6,7-диметокси-3-оксо-3,4-дигидро-1Н-изохино-лин-2-ил]-бензойной кислоты. В табл. 2 приведены данные физических и физико-химических свойства вещества S3.
Таблица 2 - Некоторые характеристики вещества S3
|
Характеристика |
Числовые показатели |
|
|
Описание |
Белый кристаллический порошок, без запаха |
|
|
Растворимость |
Вода |
Практически нерастворим |
|
Этанол |
Растворим |
|
|
Температура плавления |
258 - 260 |
|
|
рН раствора (рН 5% спиртового раствора) |
5,5 |
|
|
Тонкослойная хроматография, этанол |
Rf = 0,53 |
|
|
УФ-спектроскопия (этанол) |
276 нм(max); |
|
Использование качественных реакций для определения подлинности вещества S3.
а) Идентификация кето-группы.
Реакции конденсации с аминами в щелочной и кислой среде с образованием оксимов и гидразонов. Методика: 0,01 г вещества S3 растворяли в 1 мл спирта этилового при нагревании на водяной бане в течение 10 минут. Добавляли 1 мл щёлочи и 1 мл раствора 2,4-динитрофенилгидразина. К такому же раствору вещества добавляли 1 мл щёлочи и 1 мл раствора гидроксиламина. Наблюдали образование оксимов и гидразонов (Схема 1).
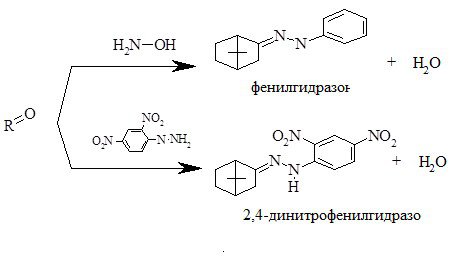
Схема 1. - Схема реакции идентификации кетогруппы
б) Идентификация третичной аминогруппы.
Реакции комплексообразования с общими и частными осадительными реактивами за счёт образования координационной связи (неподелённая пара электронов). Методика: на предметные стёкла помещали по 0,01 г исследуемого вещества. К пробам добавляли по несколько капель реактивов Драгендорфа, Майера, Мерме, Бушарда, Зонненштейна, Эрдмана, Марки, Фреде и серной кислоты концентрированной. Наблюдали появление жёлтой, розовой и фиолетовой окраски. При добавлении реактивов Майера, Марки, Зонненштейна, Бушарда и Мерме окраска не менялась. Те же реакции проводили со спиртовыми растворами вещества S3. Методика: по 0,01 г вещества растворяли при нагревании на водяной бане в течение 10 минут в этаноле в пробирках. В пробирки добавляли по несколько капель перечисленных реактивов. Наблюдали за изменением окраски растворов. При добавлении реактивов Эрдмана и Фреде окраска оставалась неизменной.
в) Идентификация этоксигруппы -
йодоформная проба. Методика: 0,01 г исследуемого вещества помещали в 1 мл воды очищенной и кипятили в пламени горелки в течение 10 минут для разрушения простой эфирной связи, фильтровали. Далее исследование проводили по известной методике идентификации спиртового гидроксила: к фильтрату добавляли 5 мл раствора натрия гидроксида, 2 мл 0,1 М раствора йода и наблюдали постепенное выпадение жёлтого осадка йодоформа, который обнаруживали также по характерному запаху.
г) Идентификация карбоксильной группы.
Реакции соле- и комплексообразования.
Реакции с растворами хлорида окисного железа, сульфата меди (ΙΙ), нитрата кобальта, нитрата свинца, сульфата бария и нитрата серебра. Методика: в пробирки помещали по 0,01 г исследуемого вещества и растворяли в 1 мл этилового спирта при нагревании на водяной бане в течение 10 минут, охлаждали, фильтровали. В каждую пробирку добавляли по 1 мл соответствующих реактивов. Наблюдали образование осадков жёлтого, голубого и белого цветов. В пробирках с растворами нитрата свинца и сульфата бария осадков не выпадало. Результаты физико-химических исследований 4-[1-(4-этоксифенил)-6,7-диметокси-3-оксо-3,4-дигидро-1Н-изохинолин-2-ил]-бензойной кислоты в таблице 3.
Таблица 3
Результаты качественного анализа вещества S3
|
Функциональная группа |
Проводимые реакции |
Аналитический эффект |
Примечание |
|
|
1 |
2 |
3 |
4 |
|
|
1. Кетонная группа: >C=O |
Реакции конденсации с аминами в щелочной и кислой среде с образованием оксимов и гидразонов: а) с 2,4-динитро-фенилгидразином; б) с гидроксиламином. |
Оранжевое окрашивание Светло-жёлтое окрашивание |
Растворитель – спирт этиловый 96%, при нагревании |
|
|
2. Третичная аминогруппа: >N- |
а) Реакция комплексо-образования за счёт образования координа-ционной связи (непо-делённая пара электро-нов) – осадки с общеалкалоидными реактивами: - с реактивом Драген-дорфа; б) Реакция окисления – окрашенные продукты со специальными алкалоидными реактивами: - с серной кислотой концентрированной; - с реактивом Эрдмана; - с рективом Фреде. |
Жёлтое окрашивание Розовое окрашивание Розовое окрашивание Фиолетовое окрашивание |
Растворитель – спирт этиловый 96%, при нагревании На предметном стекле На предметном стекле |
|
|
3. Этокси-группа: -O-CH2-CH3 |
Обнаружение спиртового гидроксила в щелочной среде с раствором йода (йодоформная проба) |
Характерный запах йодоформа, выпадение жёлтого осадка |
Растворитель – вода очищенная, при кипячении в пламени горелки в течение 10 минут, осадок выпадает постепенно |
|
|
4. Карбоксильная группа: >COOH |
Реакции соле- и комплексообразования: - с раствором хлорида железа (ΙΙΙ); - с раствором сульфата меди (ΙΙ); - с раствором нитрата свинца; - с раствором сульфата бария; - с раствором нитрата серебра. |
Осадок жёлтого цвета Осадок голубого цвета Осадок белого цвета |
Растворитель – спирт этиловый 96%, при нагревании |
|
Выводы по главе
1. На основании литературных данных рассмотрен синтез 7-ми новых производных N-арилпроизводных 6,7-диметоксиизохинолона-3 путём взаимодействия гомовератровой кислоты и соответствующего альдегида.
2. На основе данных спекторофотометрии, ТСХ и элементного анализа доказано строение целевых соединений.
3. Определены физические и физико-химические свойства анализируемых соединений.
Выводы
1. С использованием отечественных и зарубежных источников литературы изучены и обобщены методологические подходы к синтезу и определению биологической активности производных изохинолина и изохинолона-3, а также анализу ассортимента ЛС;
2. Выполнен логико-структурный прогноз и проведены компьютерные расчеты биологической активности целевых соединений;
3. Рассмотрены методики синтеза 7 арилзамещённых производных 6,7-диметоксиизохинолона-3, проанализированы их физико-химические свойства;
4. На примере модельной структуры рассмотрены оптимальные способы качественного и количественного определения.
Список использованных источников
1. Агекян, А.А. А. с. СССР 1104825 Изобретения, , 320 (2005) / А.А. Агекян // Chem. Abstr. – 2006.- №29 С. 124
2. Алькаф, А. Дж. Ахм. Синтез и биологическая активность производных 4?оксопиримидина и хиназолинона-4 с фрагментами арилсульфамидов в нуклеозидном положении: дис. … канд. фармац. наук: 15.00.02 / Али Джамал Ахмед Алькаф. – Пятигорск, 2006.- 104 с.
3. Биология человека: содержание [Электронный ресурс]. - Режим доступа: http://humbio.ru/humbio/diabethes/00022273.htm. - Загл. с экрана.
4. Битерякова, А.М. Формирование и оценка рентабельности фармацевтических организаций / А.М. Битерякова // Новая аптека. – 2001.-№1. – С. 27-33.
5. Бородина, Ю.В. Предсказание активности пролекарств с помощью компьютерной системы PASS / Бородина Ю.В. [и др.] / Хим.-фармац. журн. – 2007. - Т.30 , N 12. – С. 39-42
6. Джилкрист, Т. Химия гетероциклических соединений: пер. с англ. / Т. Джилкрист. - М: Мир, 1996.- 464 с.
7. Джоуль, Дж. Основы химии гетероциклических соединений: перевод с англ. / Дж. Джоуль, Г. Смит - М.: Мир, 2000. - 398 с.
8. Иванский В.И. Химия гетероциклических соединений: учеб. пособие для ун-тов / В.И. Иванский. – М.: Высш. шк., 2000. – 559 с.
9. Использование производных изохинолина в качестве лекарственных средств [Электронный ресурс]. – Электронные дан. (1 файл) – М., 2009. - Режим доступа: http://www.pharmasvit.com/v3/Spravochniki/2134.html. – Загл. с экрана.
10. Качественный анализ органических лекарственных средств: учеб. пособие / Т.Ю. Арчинова [и др.]; под. ред. М.В. Гаврилина.- Пятигорск: ГОУ ВПО Пятигорская ГФА Рсздрава, 2009.- 181 с.
11. Кисель, В.М. Синтез новых производных гетероциклических систем, содержащих структурный фрагмент частично гидрированной системы спиро[изохинолин-4,4'-(2Н)-пирона] / В.М. Кисель, Е.О. Костырко, М.О. Платонов, В.А. Ковтуненко // Химия гетероциклических соединений - 2008.- С.- 335.
12. Кисель, В.М. Спироциклические системы, содержащие бензо[5,6][1,2,4]тиадиазино[4,3-b] изохинолиновое ядро / В.М. Кисель, Е.О. Костырко, В.А. Ковтуненко // Химия гетероциклических соединений - 2002.- С.- 1289.
13. Куроян, Р.А. Успехи химии / Р.А. Куроян – М.: Академия, 2001. – 655 с.
14. Лабораторные работы по фармацевтической химии: учеб. пособие / В.Г. Беликов [и др.]. – 2-е изд., перераб. и доп. – Пятигорск, 2003.- 382 с.
15. Маркарян, Э.А. Синтез 2-аралкил-1,2,3,4-тетрагидро-изохинолинов. / Э.А. Маркарян, Ж.С. Арустамян, С.С. Василян // Химия гетероциклических соединений - 2003.- С.679.
16. Машковский, М.Д. Лекарственные средства: В 2 ч. / Машковский М.Д.- 14-е изд., перераб. и доп. – М.: Новая волна, 2004. – Т2. – 520с.
17. Методы получения хинолина и изохинолина [Электронный ресурс]. – Электронные дан. (1 файл) – М., 2009. - Режим доступа: http://www.pharmasvit.com/v3/Spravochniki/2134.html. – Загл. с экрана.
18. Оптимизация синтеза и фармакологического исследования веществ на основе компьютерного прогнозирования их спектров биологической активности / В.В. Поройков [и др.] // Хим. - фармац. журн. – 1996.-Т. 30, N .9 – С.20-23.
19. Орехов, А.П. Химия алкалоидов / А.П. Орехов. М.: Высшая шк., 1954. - 859 c.
20. Паккет, Л. Основы современной химии гетероциклических соединений: перевод с англ. / Л. Паккет – М.: Мир,1971. – 344 с.
21. Пожарский, А.Ф. Теоретические основы химии гетероциклов / А.Ф. Пожарский. - М.: Химия, 1985.- 276 с.
22. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. Под редакцией В.П. Фисенко. – Москва. – 2000. – С. 18 – 22.
23. Семенов, А.А. Очерк химии природных соединений / А.А. Семенов Новосибирск, - 2000.- 664 c.
24. Сернов, А.Н., / Элементы экспериментальной фармакологии / А.Н. Сернов, В.В. Гацура. - М., 2000. - С.352.
25. Филимонов Д.А. Компьютерное прогнозирование спектра биологической активности химических соединений по их структурной формуле: система PASS / Филимонов Д.А., Поройков В.В., Караичеева Е.И. и др. // Эксперим. клинич. фармакология.-1995. - Т. 58, N 2. - С. 56
26. Шкляев Ю.В. Синтез алкалоидов изохинолинового ряда. / Ю.В. Шкляев // Химия и компьютерное моделирование. Бутлеровские сообщения – 2012. - №7. – С.21-33.
27. Bantick, J., Bonnert R., Cage P., Donald D Pharmaceutically useful compounds / Bantick, J. [et al.] // PCT Int. Appl. - 1997 – P. 77
28. Commins, D.L., Badavi M.M. Tetrahedron Letters / Commins, D.L., Badavi M.M. // Chemistry and Computational Simulations. Butlerov Comunications. – 1991. Vol. 26.- P.2995.
29. Devis, F.A., Andemichael, Y.W. Tetrahedron Letters / Devis, F.A., Andemichael, Y.W. // Chemistry and Computational Simulations. Butlerov Comunications.– 2000.- Vol. 39.- P.3099.
30. Kammermeier, B.O.T, Lerch, U., Sommer, Chr. Synthesis. / Kammermeier [et al.] // Chem. Abstr., 2002. Vol. 11.- P.1157.
31. Kang-Chien, L. Synthesis and antihypertensive activity of some fused quinazoline derivatives / Kang-Chien L., Ji-Wang C. // Heterocyles.- 2004.-N. 21.-Р. 503.
32. Surrenti C. Coionic vasoactive intestinal peptide in ulcerative colits. // J.Physiol.Paris 2003, Vol. 87, P.307.
33. Weissberger, A. The Chemistry Heterocyclic Compounds, Isoquinolines / Weissberger, A., E. Teylor // Wiley, New York, Vol. 1. - №4.- 2010. -P.38.
Выполнила - студентка 3 курса,
Бестаева Карина
Научный руководитель:
Чигорина Татьяна Михайловна
кандидат хим. наук, доцент
Владикавказ - 2014 г.
0 комментариев