СОДЕРЖАНИЕ
ВВЕДЕНИЕ……………………………………………………………………………..3
Глава 1. Олиго-, полиметаллорганоносилоксаны. Синтетические методы в химии металлоорганосилоксанов…………………………………………………….6
1.1. Особенности строения каркасных и полимерных МОС…………………………7
1.2. Структура каркасных металлоорганосилоксанов……………………………........8
1.3. Физико-химические свойства каркасных и полимерных МОС………………...11
1.4. Гибридные органо-неорганические нанокомпозиционные покрытия, формируемые методами золь – гель технологии…………………………………….14
1.5. Каркасные металлоорганосилоксаны. Особенности строения, синтеза, возможности практического применения…………………………………………….16
Глава 2. Получение полимерных композиций на основе кремнийорганического блок-сополимера «Блоксил» в смеси с полиметилметакрилатом (ПММА)………..21
2.1. Физико-химические методы исследования и аппаратура…………………....23
2.2. Определение электроизоляционных свойств композиций……………………...25
Глава 3. Исследование химических превращений каркасных и полимерных металлоорганосилоксанов (МОС)……………………………………………………..26
3.1. Создание нового метода синтеза каркасных и полимерных МОС……………..26
3.2. Деструктивное сульфидирование металлоорганосилоксанов (МОС)…….........30
3.3. Полимерные композиции на основе силоксановых блоксополимеров, структурированных сульфидами переходных металлов (ZnS, CuS)………………..31
3.4. Металлорганосилоксаны в катализе………………………………………….......33
ВЫВОДЫ……………………………………………………………………………....40
СПИСОК ЛИТЕРАТУРЫ……………………………………………………….......42
ВВЕДЕНИЕ
Химия металлоорганосилоксанов (МОС) – соединений, содержащих фрагмент >Si(R)OM, где M – металл – возникла как область химии кремнийорганических соединений и постепенно превратилась в самостоятельное научное направление. Большинство превращений МОС протекает с участием фрагмента SiOM, а в формировании их структуры решающую роль играют координационные свойства входящих в них металлов.
Металлоорганосилоксаны (МОС) - особый класс элементоорганических соединений, в структуре которых наряду с силоксановыми связями Si-0-Si присутствуют металлосилоксановые звенья Si-O-М. Подобно тому, как низко- и высокомолекулярные органосилоксаны можно рассматривать как органические производные кремнезема, МОС можно представить, как органические аналоги металлосиликатов. Развитие химии полиорганосилоксанов (ПОС) и их широкое практическое применение стимулировало также развитие исследований в области МОС, главным образом их полимерных производных - полиметаллоорганосилоксанов (ПМОС). Введение металла в полисилоксановую цепь рассматривалось как особый тип «легирования» ПОС с целью модификации их свойств, преимущественно термостабильности. Было установлено, что введение атомов металлов позволяет не только повышать термическую и термоокислительную стабильность ПОС, но и положительно сказываться на других свойствах (адгезионных и прочностных). Как следствие ПМОС нашли разнообразное практическое применение (например, для получения термостойких лаков и термостабилизации силоксановых каучуков). Оказалось также, что МОС как в исходном состоянии, так и после термообработки способны проявлять каталитические свойства в различных процессах органического синтеза и полимеризации олефинов. Успехи, достигнутые в синтезе и практическом применении МОС, привели к тому, что 60-х годах ПМОС стали рассматривать как особую область химии кремнийорганических полимеров. Каркасные МОС в силу их строения можно, в принципе, рассматривать как удачные прекурсоры для получения металл-кремниевой керамики с кластерным распределением восстановленных металлов или их оксидов.
Новый, качественно отличный этап развития исследований МОС относится к середине 80-х годов, когда в ИНЭОС АН СССР впервые был синтезирован новый тип МОС - каркасных. Тогда же начались подробные исследования их структуры.
Каркасные МОС представляют большой научный интерес, т.к. их молекулы имеют уникальное строение - в них атомы металла объединены в циклическую металлооксановую систему посредством координационных связей, а валентно-связанные с этой системой силоксановые циклы, выполняют фиксирующую роль. По-видимому, именно эти МОС в наибольшей степени отвечают представлениям об органических производных металлосиликатов с регулярной структурой.
Каркасные МОС привлекают растущий интерес и в аспекте полимерной химии, в частности, как исходные соединения для получения стереорегулярных циклосилоксанов и для синтеза новых элементоорганических полимеров регулярной структуры, а также как основа для получения разнообразных металлосодержащих полимерных композиционных материалов.
К настоящему времени, объем исследований, направленных на установление основных подходов к синтезу МОС каркасного типа и выявлению принципиальных черт их структурной организации не соответствует тому большому научному и практическому потенциалу, который заложен в уникальной структуре МОС. Очевидна необходимость дальнейшего всестороннего изучения этого класса элементоорганических соединений. Более широкое вовлечение МОС в практику полимерного и элементоорганического синтеза требует разработки более совершенного метода синтеза, позволяющего получать с высокими выходами разнообразные каркасные и полимерные МОС регулярной структуры, в частности, МОС с малым объемом заместителя у атома кремния, а также МОС с функциональными группами. Разработка такого метода - важный шаг к детальному исследованию химических превращений МОС, которые пока находятся в начальном состоянии.
Металлополимерные композиции, обладающие специальными электрофизическими свойствами, представляют значительный интерес для микроэлектроники, для различных областей информационных технологий и электронной техники.
Анализ литературных данных указывает, что синтетические подходы к созданию гибридных органо-неорганических наноразмерных систем в настоящее время изучены недостаточно. Поиск решения вышеуказанных проблем является актуальной и перспективной задачей.
Цель данной работы – обзор литературных данных отечественных и зарубежных публикаций, посвященных рассмотрению вопросов физико-химии металлоорганосилоксанов, а именно:
- синтетические возможности получения ряда новых МОС, например, соединений с малым объемом заместителей у атомов кремния или соединений, содержащих функциональные группы в органическом заместителе у атома кремния;
- химические превращения, происходящие в металлосилоксановом каркасе при действии на него разнообразных химических реагентов;
-исследования физико-химических, каталитических свойств поли-, олигометаллоорганосилоксанов.
Проведенный обзор открывает возможности направленного поиска для разработки новых полимерных композиций на основе металлоорганосилоксанов для создания на их основе оптически прозрачных диэлектрических материалов для изделий электронной техники.
Глава 1. Олиго-, полиметаллорганоносилоксаны. Синтетические методы в химии металлоорганосилоксанов
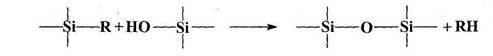
В 1947 году Андрианов К.А. показал, что кремнийорганические соединения, содержащие функциональные гидроксильные группы у атома кремния (диэтилсиландиол, 1,3-диокситетраэтилдисилоксан и полифенилсилоксановые смолы), помимо реакций гомоконденсации, ведущих к образованию силоксановых связей, способны также вступать в реакцию с металлами (Al, Mg) или гидратами окисей металлов с образованием продуктов, содержащих металлосилоксановые связи [1-4]:
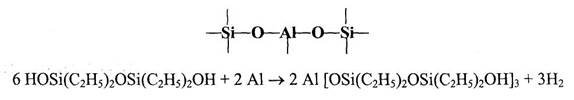
Впоследствии были разработаны различные методы синтеза полиметал-лоорганосилоксанов (ПМОС). Было показано, что ПМОС образуются при согидролизе в присутствии акцепторов хлористого водорода кремнийорганических мономеров с неорганическими (хлоридами, сульфатами) и металлоорганическими (R2SnCl2H др.) солями поливалентных металлов:
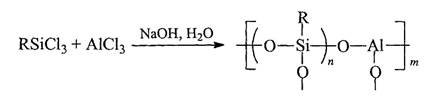
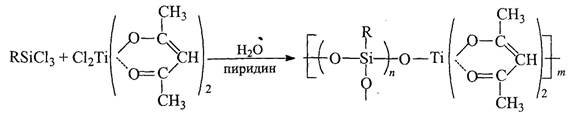
Таким способом были получены ПМОС, с различными заместителями R при атомах кремния и содержащие в своем составе атомы алюминия, олова, титана. К сожалению, этот метод обладает существенным недостатком, связанным с плохой воспроизводимостью реакции гидролиза и соответственно состава образующихся ПМОС (соотношение Si/M отличается от соотношения исходных соединений).
Металлосилоксановую группировку можно также ввести путем расщепления силоксановой связи в продуктах гидролиза кремнийорганических мономеров алкилокисями типа R2SnO. Взаимодействие диалкилокисей олова с полиорганосилсесквиоксанами легко протекает в среде кипящего толуола в течение 5-6 часов:
![]()
где а = 2; 4, R = Me, Et, Vi, Ph, R' - Et, Bu.
ПМОС образуются при взаимодействии продуктов гидролиза кремнийорганических мономеров с алкоксидами металлов (Ti, А1). Так при реакции продуктов гидролиза алкил(арил)хлорсиланов с бутилатом алюминия (титана) с последующей конденсацией (при 120°С в случае алюминия и 200°С в случае титана) образуются стеклоподобные полимеры, растворимые в органических растворителях (спирты, ацетон, толуол):
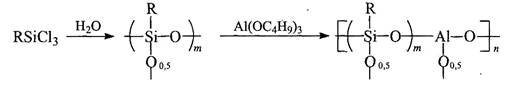
R – С6Н5-, С1С6Н4-
В работах [3, 4] был получен большой спектр полиметаллофенилсилоксанов (ПМФС) непосредственным взаимодействием фенилтрихлорсилана с ацетатами переходных (Сu, Mn, Ni, Cr, Zn, Hg и др.) и редкоземельных (La, Eu, Gd, и др.) металлов при 220°С. Во всех случаях продукты реакции представляют собой хрупкие стеклоподобные окрашенные вещества, хорошо растворимые в бензоле, толуоле, ацетоне, серном эфире, дихлорэтане, метилэтил кетоне и нерастворимые в спиртах, ненасыщенных углеводородах, воде. Молекулярная масса этих полимеров колеблется от 1710 до 5320, а содержание металла от 0,8 до 4,3%.
1.1. Особенности строения каркасных и полимерных МОС
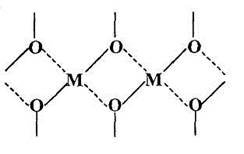
ПМОС - аморфные вещества, и поэтому однозначное определение их структуры является очень сложной задачей. Тем не менее, на основании анализа их химического состава и ряда физико-химических характеристик было предложено два типа циклолинейной структуры для этих элементоорганических полимеров:
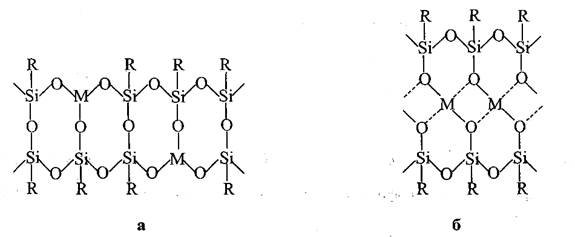
Рисунок 1. Типы структур ПМОС
Первые представители ПМОС, полученные на основе трифункциональных кремнийорганических соединений и солей трехвалентных металлов (полиалюмофенилсилоксан, полиферрофенилсилоксан и др.), обладают первым типом структуры (Рисунок 1а). ПМОС со вторым типом структуры (Рисунок 1б) были синтезированы из трифункциональных кремнийорганических соединений и солей двухвалентных металлов (полимедьфенилсилоксан и др). Такая лестничная структура с циклическими центрами ветвления подтверждается, с одной стороны, гидродинамическими характеристиками полимеров и термомеханическими свойствами, с другой стороны, низким содержанием гидроксильных групп при сохранении полной растворимости в органических растворителях. Синтез именно этих полимеров привел к обнаружению нового класса соединений - каркасных МОС.
1.2. Структура каркасных металлоорганосилоксанов
За последние десятилетия был синтезирован и охарактеризован сравнительно большой ряд разнообразных каркасных МОС. Каркасные МОС имеют удивительную структуру, что обусловило большой интерес к ее рентгенографическому исследованию [5-7].
Ряд каркасных МОС имеет сендвичевое строение (Рисунок 2): два силоксановых цикла цис-конфигурации (все органические радикалы расположены по одну, а все силоксанолятные атомы кислорода по другую сторону от плоскости цикла), образующие координационно-ионные связи с расположенными между ними ионами металлов, стянутые мостиковыми лигандами (Сl-, Br-, ОН-, О2-). Поскольку силоксановые циклы связаны с атомами металлов по хелатному типу, их часто рассматривают как макроциклические лиганды [RSiO2]n. Они имеют разный размер в зависимости от металла, включенного в структуру. Структуры, образованные щелочными металлами (Na, К) и лантанидами –K5 {[VinSiO2]8La4(µ4-OH)[O2SiVin]8}•5н-ВuОН•2Н2О, Na6{[PhSiO2]8M4(µ4-O)-[O2SiPh]8}•10EtOH•8H2O;M = Nd3+, Gd3+, Dy3+ - включают в себя два циклооктасилоксанолятных лиганда [RSiO2]8. Лиганды расположены коаксиально антипараллельно, координируя плоский слой из расположенных по вершинам квадрата четырех ионов лантанидов (Рисунок 2а). Катионы лантанидов координированы с центральным анионом ОН- или О2-, «олятными» атомами силоксановых циклов и не имеют «внешних» донорных сольватных лигандов. Катионы натрия или калия обеспечивают электронейтральность этих комплексов.
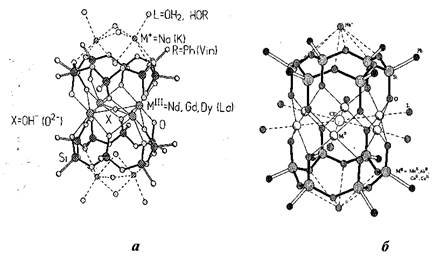
Рисунок 2. Структура «сендвичевых» каркасных МОС: а - образованная лантанидами, б - образованная двухвалентными переходными металлами.
В случае двухвалентных переходных металлов - Na{[PhSiO2]6(µ6-Cl) M6[O2SiPh]6}; M = Ni2+, Co2+, Mn2+ - структура образована двумя циклогексасилоксанолятными лигандами [RSiO2]6, между которыми находится металлический слой из не связанных друг с другом атомов металла, расположенных по вершинам плоского шестиугольника (Рисунок 26). При этом атомы металлов координированы атомами кислорода нейтральных сольватных молекул (спиртов, воды).
Для этих соединений, имеющих в своем составе металлы (Ni, Co, Мn), способные проявлять координационное число равное 6, характерно включение в металлический слой иона хлора (или брома), который обеспечивает завершенность октаэдрической координации. Противоионы Na+ находятся вне каркасов. Они координированы с атомами кислорода силоксановых связей и с сольватными молекулами спирта или воды.
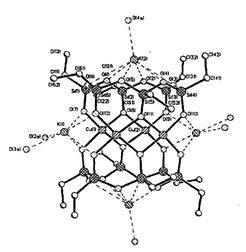
Рисунок 3. Структура каркасного медькалийэтилсилоксана
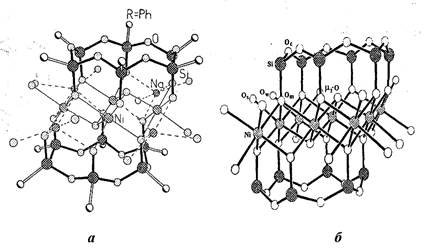
Рисунок 4. Структура каркасных МОС: а - никельнатрийфенилсилоксан, б - никельоксидфенилсилоксан (фенильные радикалы не показаны).
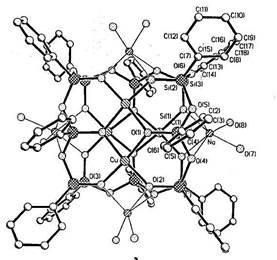
Рисунок 5. Структура медьнатрийфенилсилоксана
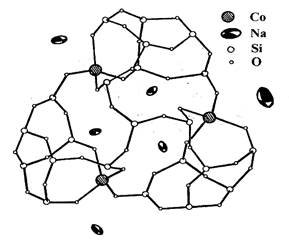
Рисунок 6. Структура кобальтфенилсилсесквиоксана (Ph-радикалы
не показаны).
Все вышеописанные соединения получены методом обменного разложения, в котором в качестве исходного соединения используется органосилоксанолят натрия, полученный щелочным расщеплением полиорганосилсесквиоксанов.
1.3. Физико-химические свойства каркасных и полимерных МОС
Интерес к ПМОС в немалой степени был вызван рядом практически полезных свойств, которыми они обладают: высокая термическая и термоокислительная стабильность, склонность к различным химическим превращениям. Все это позволяет использовать их для модификации других полимеров, а также для получения новых керамических материалов и др. Поэтому значительная часть работ была посвящена исследованию процессов термической и термоокислительной деструкции этих полимеров [8]. При нагревании в инертной атмосфере протекают следующие процессы:
1. Конденсация гидроксильных групп:
![]()
2. Конденсация, сопровождающаяся отрывом органических групп у атома кремния:
Конденсация с выделением воды начинается при более низкой температуре, чем отрыв органических радикалов, и природа металла не оказывает существенного влияния на данный процесс. В зависимости от природы органических заместителей температура начала дегидратации составляет от 80оС до 115°С. Скорость этого процесса возрастает в ряду СбН5<С2Н3<С2Н5<СН3. Отрыв органических заместителей начинается при более высокой температуре (160°С при R= СН3, 250°С при R = СбН5(СН2)2), причем при этих температурах все еще не завершен процесс дегидратации. В результате этих процессов образуются дополнительные силоксановые связи, увеличивается молекулярная масса, а затем образуются структурированные полимеры. Процесс образования структурированного полимера проходит в соответствии с закономерностями трехмерной поликонденсации. Процесс терморазложения ПМОС экзотермичен, особенно терморазложение винилсодержащих ПМОС. Тепловой эффект процесса составляет 542 кал/г для полиферрофенилсилоксана, 1662 кал/г для поликобальтфенилсилоксана. Было установлено, что наименее термостабильны ПМОС, в которых органические заместители обладают отрицательным индукционным эффектом (фенил или винил), и более термостабильны, если R алифатический или арилалифатический. Это связано с тем, что координация атома кислорода силоксановой связи с атомом металла соседней молекулы металлосилоксана вызывает смещение электронной пары связи Si-О к кислороду, что приводит к дополнительной ее поляризации. В случае алифатических или арилалифатических радикалов направление поляризации связи Si-0 совпадает с направлением поляризации связи Si-C, что увеличивает термическую стабильность этой связи. В случае винильного или фенильного радикала эти два процесса действуют в разных направлениях. Указанная закономерность была установлена на примере ПМОС, содержащих координационно-ненасыщенные металлы (алюминий, титан, олово). В случае магнийорганосилоксанов наблюдается некоторое снижение термической устойчивости, что авторами в [9] было связано именно с более низкой координационной ненасыщенностью магния по сравнению с алюминием или титаном. Влияние природы металла на термостабильность ПМОС подробно изучено на примере полиметаллофенилсилоксанов (ПМФС). Оно различно для элементов, принадлежащих к разным электронным семействам, т.е. характер влияния металла определяется его электронным строением. Эффективная энергия активации процесса термической деструкции ПМФС периодически изменяется в зависимости от атомного номера металла, введенного в структуру полимера. Показано, что зависимость содержания гель-фракции при температурах, близких к 300°С, от поляризующего действия катиона металла является линейной и падает в ряду Ni, Cu, Zn, Co, Мn.
ПМОС, содержащие в полимерной цепи атомы парамагнитных металлов (железо, кобальт и никель), представляют потенциальный интерес с точки зрения получения на их основе соединений с ферромагнитными свойствами. Исследование магнитных свойств этих полимеров показало, что они являются истинными парамагнетиками. Для ПМОС, с соотношением Si/M>l, весьма вероятно наличие металлосилоксановых фрагментов в цепи. При малых соотношениях (Si/M<l), молекулярные фрагменты -MO(SiOSiO)nM- с большими значениями п заменяются более короткими фрагментами с п = 1 и даже п = 0: -ОМ-О-МО-. Такие структуры появляются при дисмутации.
При высокотемпературной конденсации ПМФС (при нагревании ПМФС в инертной атмосфере при 800°С) по мере удаления органических заместителей содержание углерода в продуктах пиролиза падает до 11-13%. При этом соотношение Si/M практически не изменяется по ходу реакции. Участие атомов металла, входящих в силоксановую цепь, в пиролитических процессах приводит к изменению его степени окисления. Так, при пиролизе полиферрофенилсилоксана образуются восстановленные формы железа (Fe+2 и Fe°) и фазы SiO2. Присутствие кобальта катализирует восстановление формы Fe+2 до появления кластеров с размерами 300-350 А. Присутствие кобальта в полимере значительно изменяет количественное соотношение восстановленных форм железа: 11,1% Fe+3; 88,9% Fe. Появление ферромагнитных свойств обусловлено присутствием восстановленных форм металла. Удельная намагниченность насыщения линейно растет с увеличением Si/M и падает при снижении температуры пиролиза.
Строение каркасных МОС таково, что атомы металла объединены в металлооксановую систему посредством координационных связей, а силоксановые циклы выполняют "фиксирующую" роль. Тем не менее, нельзя сделать однозначный прогноз, о наличии магнитных свойств исходя из строения каркасных МОС. Так при исследовании магнитной восприимчивости каркасного кобальтфенилсилоксана и натрийникельфенилсилоксана было показано, что для них наблюдается ферромагнитное взаимодействие между атомами металла. Каркасный никельфенилсилоксан, несмотря на то, что имеет структуру, аналогичную структуре кобальтфенилсилоксана, проявляет иные магнитные свойства (в этом случае наблюдается антиферромагнитное взаимодействие между атомами металла).
1.4. Гибридные органо-неорганические нанокомпозиционные покрытия, формируемые методами золь – гель технологии
Синтез гибридных органо-неорганических нанокомпозиционных материалов — новое ответвление в золь-гель науке и технологии. Первые работы по синтезу гибридных органо-неорганических материалов и покрытий появились в связи с невозможностью использовать чисто полимерные материалы и были вызваны необходимостью улучшения адгезии полимерных материалов к стеклу и повышения абразивной прочности полимерных материалов. В настоящее время, используя приемы золь-гель синтеза, получают органо-неорганические гибридные нанокомпозиты, в том числе покрытия, обладающие следующими полезными свойствами: 1) высокой гибкостью, существенно более высокой, чем у керамических материалов и термостойкостью, большей, чем у полимерных материалов; 2) высокой пористостью, которая может варьироваться за счет изменения содержания и типа органических групп; 3) анизотропностью свойств, например двулучепреломлением и т.п. Последние два пункта непосредственно связаны с интенсивно развиваемой сейчас молекулярной инженерией и темплантным синтезом, в результате использования которых за счет специально подобранных или синтезированных органических прекурсоров, а также при определенных условиях проведения золь-гель процесса, можно управлять структурой синтезируемых гибридных органо-неорганических нанокомпозитов на мезоуровне 10-1000 нм.
Классификация, способы получения и особенности структуры
До настоящего времени не существует общепринятой классификации золь-гель гибридных нанокомпозитов. Можно перечислить некоторые наиболее часто используемые термины. Это —ORMOSIL—материалы, синтезируемые смешением расчетного количества тетраэтоксисилана (ТЭОС) или тетраметоксисилана с полиэтиленгликолем (ПЭГ) и его производными; ORMOCER — керамика, модифицированная органическими добавками; ORMOLYT — силановые электролиты, модифицированные органическими добавками и CERAMER— стекловидные или керамические материалы, содержащие сопоставимые количества органического и неорганического компонентов в объеме гибридного материала, в том числе IPN — гибридные материалы, образованные взаимопроникающими сетками неорганического и органического полимеров.
Обобщая литературные данные последних лет, можно выделить несколько путей получения гибридных органо-неорганических материалов и покрытий золь-гель методом:
1. Классический подход включает гидролиз и конденсацию алкоксисиланов и алкоксидов металлов, выполняемую в присутствии высокомолекулярных соединений, имеющих активные функциональные группы (типа ПЭГ). Используется также прием проведения гидролиза и конденсации алкоксидов в среде растворенного полимера.
2. Другой подход предполагает, что реакция гидролитической поликонденсации алкоксисоединений протекает одновременно с полимеризацией мономера.
3. К числу новейших относится синтез так называемых «силанизированных» материалов с использованием мономеров или олигомеров со специально привитыми фрагментами кремнийорганических соединений, для взаимодействия их с неорганической сеткой, образующейся в процессе гидролиза алкоксисоединений.
Золь-гель системы для формирования силикатных и гибридных
органо-неорганических пленок и покрытий
Особенность золь-гель систем, на которых более подробно остановимся в данной статье, состоит в том, что золи на основе ТЭОС, гидролизованного в кислой среде, допированы неорганическими соединениями (как правило, кислотами или солями неорганических кислот - допантами) и модифицированы органическими низко- или высокомолекулярными соединениями.
Синтез гибридных органо-неорганических материалов, в том числе пленок и покрытий, является новым, чрезвычайно актуальным направлением золь-гель технологии. Покрытия и пленки, получаемые этим методом, являются типичными нанокомпозиционными материалами и фрактальными объектами. Уникальность их свойств определяется, с одной стороны, высокой степенью дисперсности, которая присуща составляющим эти композиты фрагментам органической и неорганической фазы, а с другой - существенным улучшением ряда их характеристик за счет сочетания полезных свойств керамики и полимеров. Нанокомпозиционные покрытия, синтезированные из золей на основе ТЭОС, содержащих неорганические допанты и органические низко- и высокомолекулярные модифицирующие добавки с концевыми гидроксильными или уретановыми группами, обладают рядом новых и улучшенных физико-химических свойств, которые делают их перспективными для использования в микроэлектронике в качестве каталитических покрытий, или источников диффузантов, а также для целей электротехники и энергетики для формирования жаростойких гибких диэлектрических покрытий.
1.5. Каркасные металлоорганосилоксаны. Особенности строения, синтеза, возможности практического применения
Металлоорганосилоксаны (МОС) - достаточно распространенное семейство соединений, характеризующихся наличием структурной группировки кремний-кислород-металл, которая в основном и определяет химические свойства этих объектов.
Толчком к интенсивному исследованию химии МОС стало открытие в середине ХХ столетия разнообразных возможностей использования полиметаллоорганосилоксанов, ПМОС [10]. Фундаментальные исследования металлоорганосилоксанов, проводимые рядом научных коллективов по всему миру, привели к получению ряда интересных результатов. В частности, в середине 1980-х годов впервые были получены индивидуальные кристаллические металлоорганосилоксаны, обладающие полиэдрической структурой молекул. До настоящего времени эти соединения, получившие название каркасных, остаются одними из наиболее привлекательных объектов химии кремнийорганических соединений. Уникальная архитектура таких соединений привлекла к ним большое внимание и к настоящему времени были выделены и охарактеризованы разнообразные представители МОС, содержащие в своем составе широкий набор различных металлов. При этом, до последнего времени пространственные типы, известные для каркасных МОС, ограничивались достаточно узким набором структурных семейств:
А) «Сэндвичевые» МОС, сформированные на основе двух силоксановых колец, находящихся сверху и снизу от плоскости металлоксидного кольца, например:
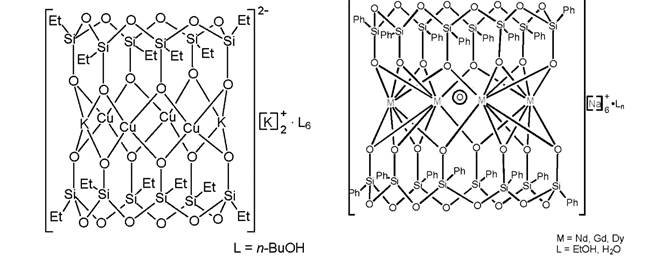
Рис. 7. Структуры медьэтилсилоксана, с шестизвенными силоксановыми циклами (слева) и структура фенилсилоксана, содержащего лантаниды, с восьмизвенными
силоксановыми циклами.
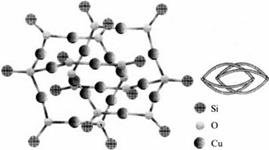
Б) «Глобулярные» МОС, с 12-членным силоксановым циклом:
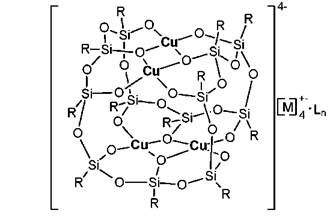
Рис. 8. Структура медьсилоксана с додекасилоксановым циклом, R=Ph [66]
В последнее время были синтезированы и охарактеризованы соединения, в определенном смысле выходящие за рамки привычных представлений о каркасных МОС. В частности, был выделен ферронатрийфенилсилоксан с не описанной ранее, «фонарообразной», структурой, включающей 6 атомов железа. При этом атомы железа, наряду с атомами натрия, объединены в каркас за счет двух 5-членных органосилоксановых циклов и одного 10-членного фрагмента.
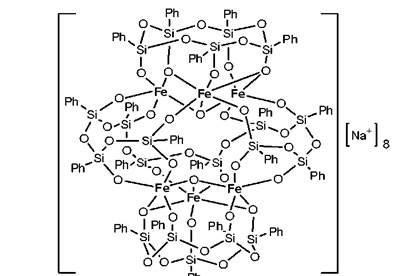
Рис. 9. Структура «лантерного» ферронатрийфенилсилоксана
Для некоторых ранее описанных каркасных металлоорганосилоксанов отмечался факт нахождения атома хлора в полости каркаса [11, 12], но присутствие во внутреннем объеме каркаса молекул воды является заметно более редкой особенностью строения металлоорганосилоксанов, и ранее было отмечено лишь однажды, для никельнатрийфенилсилоксана:
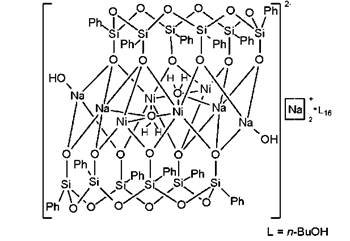
Рис. 10. Структура никельнатрийфенилсилоксана, с инкапсулированными молекулами воды
Таким образом, можно утверждать, что геометрия молекул полиэдрических металлоорганосилоксанов действительно позволяет им находиться в эпицентре исследований структурной химии. К сожалению, способы получения полиэдрических металлоорганосилоксанов до сих пор остаются не вполне совершенными и часто - очень трудоемкими. Основная сложность заключается в отсутствии общего и эффективного метода синтеза. Существующие не лишены определенных недостатков, в их числе, -невысокие выходы, необходимость индивидуального подбора условий синтеза в зависимости от природы вводимого металла и невозможность контролировать геометрические параметры каркасного продукта.
В самое последнее время возникла идея использовать для синтеза новых каркасных соединений ранее полученный каркасный силоксан, содержащий не только ионы поливалентных металлов (как правило - меди), но также ионы щелочных металлов. Замещение щелочных металлов поливалентными приводит к образованию новых биметаллических продуктов. Кроме того, использование такого подхода позволяет контролировать геометрию продукта, которая во многом задается геометрией исходного полиэдра. За счет такой методики в последнее время получены полиэдрические органосиланоляты с различными парными сочетаниями поливалентных металлов, не описанные ранее. Кроме того, показано, что обработка органосилоксана, содержащего 6 атомов меди, органосиланолятом натрия позволяет перевести его в каркас, содержащий и ионы меди, и ионы натрия. Последний, соответственно, может вновь выступать как «структурный синтон» в дальнейших синтезах полиэдрических органосиланолятов, включающих 2 типа поливалентных металлов.
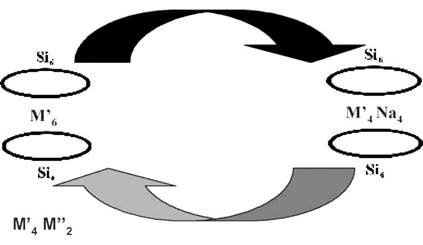
М' = Cu
М'' = Ni, Mn, Co
Рис. 11. Схема синтеза новых биметаллических каркасных органосилоксанов, исходя из медьнатрийфенилсилоксана.
Разнообразны и перспективы дальнейшего использования МОС. Каркасные металлосилоксаны могут быть источниками наноразмерных частиц металлов (например, халькогенидов или оксидов), диспергированных в полимерной матрице [13]. Строгая геометрия исходных металлсодержащих органосилоксановых полиэдров позволяет получать на их основе, направленно удаляя ионы металлов, стереорегулярные кремнийорганические и карбофункциональные циклосилоксаны, перспективные для конструирования макромолекул в синтезе полимеров.
Одним из наиболее привлекательных направлений химии каркасных МОС является возможность их применения для создания материалов, содержащих наряду с кремнием также и атомы металлов. Хорошо известны ценные свойства металлосиликатов (по существу - неорганических аналогов металлосилоксанов) как предкерамических материалов или микропористых ионно-обменных сит и каталитических систем. По литературным данным, каталитические свойства уже отмечены и для полиэдрических МОС. Например, они оказались перспективными гомогенными и гетерогенными катализаторами эпоксидирования олефинов, а также ионно-координационной полимеризации, причем в последнем случае не требуется участие сокатализатора А1R3. Кроме того, органосилоксановый каркас можно рассматривать как «встроенную» силикатную матрицу, в то время как обычно в ее качестве используют подложки - SiO2, ZrO2 и подобные.
Важно оговорить, что металлоорганосилоксаны, будучи столь же перспективными как металлосиликаты, обладают значительными преимуществами - их можно синтезировать, используя методы элементоорганического синтеза, управляя, например, процентным содержанием металла в составе. В случае полиэдрических продуктов - появляется возможность управления трехмерной структурой, определенным образом включающей в себя ионы металлов. Возможность управления структурой соединений и распределением в них металла (металлов) - важный аргумент в пользу каркасных металлосилоксанов, стимулирующий развитие исследований в области их получения. Важнейшим направлением работ по этой тематике, безусловно, должен быть поиск подходов к созданию новых материалов, которые необходимы для тех отраслей современной техники, где востребованы свойства соединений кремния и металлочастиц [14].
Глава 2. Получение полимерных композиций на основе кремнийорганического блок-сополимера «Блоксил» в смеси с полиметилметакрилатом (ПММА)
В работах авторов [16, 17] исследованы кремнийорганические полимерные композиции, структурированные сульфидами переходных металлов (Cu, Zn), обладающий высокими адгезионными, оптическими и электрическими свойствами, работающими в диапазоне температур от -600С до +2500С. Применение такого материала, например, позволит упростить технологию сборки схем, сократить технологический процесс сборки, стабилизировать параметры интегральных устройств при воздействии климатических факторов. Отвердители и модификаторы по составу – новые и предоставлены для исследований сотрудниками ГНИИХТЭОС, ИНЭОС РАН (г. Москва), НИИСК (г. Санкт-Петербург).
В качестве основы исследуемых композиций выбран и исследован, разработанный Санкт-Петербургским НИИ синтетического каучука им. Лебедева, блок-сополимер марки "Блоксил". "Блоксил" - полифенилсилсесквиоксановый блок-сополимер лестничного строения, включающий жесткие блоки полифенилсилсесквиоксан - высокостеклующиеся и эластичные - низкостеклующиеся термостойкие блоки. Т.о. такой сополимер сочетает в себе высокие прочностные свойства с хорошей эластичностью.
Компонентами предлагаемой авторами [17] кремнийорганической лаковой композиции являются следующие составляющие: блоксополимер "Блоксил"; полиметилметакрилат (ПММА), медьфенилсилоксан (МОС), отвердитель - диэтилдикаприлат олова (ДЭДКО).
Основа: силоксановый блок-сополимер "лестничной" структуры – «Блоксил»:
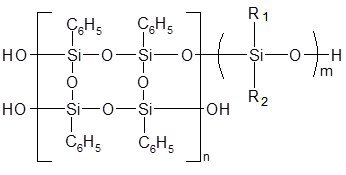
где: R1, R2 = – CH3; –C6H5;
n=5÷8;
m=25÷80
Отвердитель: диэтилдикаприлат олова (ДЭДКО):
(C2H5)2 Sn (C5H11COO)2;
Металлорганосилоксан (МОС) – медьэтилсилоксан
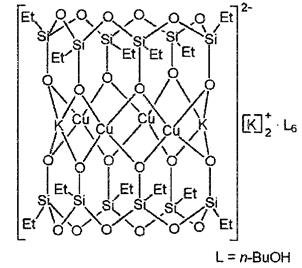
Для отверждения к полученной полимерной смеси прибавляли диэтилдикаприлат олова (ДЭДКО) (1 капля на 3 г композиции). Реакцию проводили при комнатной температуре.
Обработка полимерных образцов газообразным сероводородом.
Образцы полимерных пленок помещали на решетку эксикатора, на дне которого находится этилацетат и выдерживали сутки для набухания. Далее пленки выдерживаются в течение 24 часов в атмосфере сероводорода. После обработки образцы высушиваются до постоянного веса на воздухе.
Данные элементного анализа полученных полиолов приведены в Таблице 1.
………....Таблица 1.
Характеристика металлополимеров и нанокомпозитов, содержащих частицы сульфида меди и цинка
|
№№ пп |
Компоненты, Загрузка в масс. % |
Содержание Cu (Zn) в исходной композиции, % |
Шифр образца |
Примечание |
Шифр для испытаний |
||
|
Блоксил |
ПММА |
(МОС)Cu-силоксан |
|||||
|
1 |
нет |
80 |
20 |
2,95 |
ПММА 80 исх. |
Прозрачн., голубой |
CZ-1 |
|
2 |
нет |
70 |
30 |
4,42 |
ПММА 70 исх. |
То же |
CZ-2 |
|
3 |
70 |
15 |
15 |
2,21 |
1458-1 исх. |
То же |
CZ-3 |
|
4 |
78 |
11 |
11 |
1,62 |
1458-2 исх. |
То же |
CZ-4 |
|
5 |
82,3 |
нет |
17,7 |
2,6 |
1458-3 исх. |
То же |
CZ-5 |
|
6 |
нет |
ПММА |
CuS |
ПММА 80 |
Темно-кор. |
CZ-6 |
|
|
7 |
нет |
ПММА |
CuS |
ПММА 70 |
Темно-кор. |
CZ-7 |
|
|
8 |
Блоксил |
ПММА |
CuS |
1458-1 |
Коричн. |
CZ-8 |
|
|
9 |
Блоксил |
ПММА |
CuS |
1458-2 |
Коричн. |
CZ-9 |
|
|
10 |
Блоксил |
ПММА |
CuS |
1458-3 |
Темно-кор. |
CZ-10 |
|
2.2. Физико-химические методы исследования и аппаратура
Для проведения исследований физико-химических характеристик образцов применялся ряд физико-химических методов.
Молекулярно-массовое распределение циклосилоксанов с триметилсилильным обрамлением определяются методом гель-проникающей хроматографии на приборе Bruker LC21 в растворе толуола со скоростью 0,5 мл/мин. В качестве наполнителя используется Silasorb 600, обработанный ГМДС (N); прибор калибруется по стандартным полистирольным образцам. Используется детектор - дифференциальный рефрактометр RIDK-102.
Молекулярно-массовое распределение карбофункциональных циклосилоксанов определяется методом гель-проникающей хроматографии на приборе Waters-510 в растворе ТГФ со скоростью 1 мл/мин., снабженном УФ-детектором с колонками Ultrastyragel 102, 103, 104 А.
Термогравиметрические исследованияполимерных композиций проводятся на термическом анализаторе 9900 фирмы «Дюпон – Du Pont Thermal Analysis System» при скорости нагрева 5 град/мин и навесках массой образца - 10 мг.
Характеристические вязкости измеряются в капиллярном вискозиметре Убеллде при 20±0,050.
Инкременты показателей преломления измеряются с помощью рефрактометра типа Пульфриха с дифференциальной кюветой при температуре 25±0,050.
Измерения удельного электрического сопротивления pv, проводятся двухэлектродным методом на постоянном токе в полностью экранированной ячейке на воздухе в интервале температур 293-430 К с использованием тераомометра Е6-1 ЗА.
Механические испытания проводятся на разрывной машине фирмы Shimadzu со скоростью 9мм/мин при Т = 20°С.
Данные испытаний приведены в Таблице 3.
Исследованы следующие механические характеристики опытных образцов композиций: условная прочность при растяжении (σр) и относительное удлинение при разрыве (ε).
Образцы для определения σр и ε получают методом заливки композиций в формы, изготовленные из фторопласта-4 по ГОСТ 21000-81. Размеры форм могут меняться в соответствии с размерами, требующихся для испытания образцов. Предварительно обезжиренную ацетоном форму, помещают на уровень и в нее вливают лак. Композиция отверждается по ранее выбранному режиму полимеризации (ускоренная вулканизация). После охлаждения покрытие при помощи скальпеля вынимают из формы и ставят на дополнительное отверждение при температуре 700С, при которой происходило основное отверждение.
Образцы для определения относительного удлинения при разрыве и условной прочности при растяжении получают в виде пленки, толщиной 0,5-1 мм. Из пленки вырезают стандартные образцы в виде узкой полоски и проводят испытания по ГОСТ 270-75 на пяти образцах.
В процессе растяжения образца замеряют нагрузку и удлинение в момент достижения определяемых показателей. В расчет принимают результаты, полученные на образцах, разрушившихся в пределах рабочей части образца.
Метод предназначается для определения характеристик пленок и материалов при одноосном растяжении. Сущность метода состоит в испытании образца на растяжение, при котором определяют:
1) условную прочность при растяжении в МПа – отношение нагрузки, при которой разрушился образец, к начальной площади его поперечного сечения;
2) относительное удлинение при разрыве в процентах – относительное приращение длины базы образца, измеренного в момент разрушения, к начальной длине базы образца.
Условную прочность при растяжении в МПа вычисляют по формуле:
![]() ,
,
где Рр – нагрузка, при которой образец разрушился;
F – площадь начального поперечного сечения образца в см2.
Относительное удлинение при разрыве (εр) в процентах вычисляют по формуле:
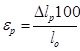 ,
,
где Δlp – приращение длины базы образца при разрыве в мм;
lо – начальная длина базы образца в мм.
2.2. Определение электроизоляционных свойств композиций
Определение тангенса (tg δ) диэлектрических потерь и диэлектрической проницаемости (ε) проводится на Q-метре фирмы "Тесла", при частоте 1000 Гц. Для этого изготавливаются образцы определенной формы – диски диаметром 50 мм и толщиной в пределах от 0,9 до 1,6 мм. Образцы шлифуются наждачной бумагой.
По результатам испытаний проведен расчет значений tg d и e.
Результаты измерений диэлектрических свойств композиций
Q0=135, С0=307
|
№ образца |
Толщина образца, мм |
С1 |
Q1 |
ΔC |
ΔQ |
|
1 |
0.92 |
290 |
105 |
17 |
30 |
|
2 |
1.22 |
296.5 |
118 |
10.5 |
17 |
|
3 |
1.56 |
297 |
119 |
10 |
16 |
ΔC=C0 – C n, ΔQ=QO – Q n
Значения tg d и e образцов композиции
|
№ образца |
e |
tg d |
|
1 |
3,6 |
3,8·10-2 |
|
2 |
2,95 |
3,1·10-2 |
|
3 |
3,59 |
3,1·10-2 |
e= 2,304×ΔС×d
tg d=C0/ ΔС × ΔQ/Qn ×Q0
Диэлектрические потери - это потери электроэнергии в диэлектрике, вследствие расхода ее на нагрев материала. Диэлектрические потери определяются тангенсом угла диэлектрических потерь, который характеризует способность диэлектрика рассеивать подведенную к нему электроэнергию.
В идеальном диэлектрике ток опережает напряжение на угол 900, в реальном- угол отклонения отличается от прямого на угол d, тангенс которого и характеризует диэлектрические потери. Чем меньше значения tg d, тем ниже диэлектрические потери, тем лучше электроизоляционные свойства материала.
Исследование термостойкости отвержденных композиций проводится термогравиметрическим (ТГА) методом на термическом анализаторе 9900 фирмы Дюпон – Du Pont Thermal Analysis System.
Термогравиметрия – измерение потери массы образца при повышенной температуре. Определяется в течение короткого времени с помощью записывающего устройства, которое регистрирует потери массы в зависимости от температуры.
Исследование проводили при скорости подъема температуры 50С/мин. в температурном интервале от -600С до 3500С. Результаты обрабатывались автоматически благодаря полному компьютерному обеспечению установки. Полученные кривые ТГА приведены в приложении.
Согласно данным ТГА, температурный интервал начала разрыва связей, сопровождающийся выделением определенного количества тепла, составляет 250-2800С до 0,1% потери массы образца, 0,3 % потери массы при 300-3500С. Таким образом, полученные композиции характеризуются высокой термостойкостью.
Глава 3. Исследование химических превращений каркасных и полимерных металлоорганосилоксанов (МОС)
Одним из наиболее актуальных направлений полимерной химии в настоящее время является создание новых композиционных материалов. С этой точки зрения каркасные МОС представляют несомненный интерес, т.к. высокая реакционная способность связи Si-O-М в МОС открывает новые подходы к таким материалам. В частности, при их регулируемом разложении можно ожидать одновременное получение полимерной матрицы с равномерно распределенным в ней тонкодисперсным наполнителем в виде различных соединений металлов. В этой связи представляется логичным изучение химических процессов разложения МОС под действием различных реагентов.
3.1. Создание нового метода синтеза каркасных и полимерных МОС
Детальные исследования в области каркасных и полимерных МОС предполагают наличие удобных методов их получения. Создание и разработка методов синтеза МОС, удобных в препаративном отношении, явилось первоочередной задачей нашего исследования.
До этого времени каркасные и полимерные МОС получали по трех-стадийной схеме, включающей в себя получение полиорганосилсесквиоксана, расщепление его щелочью с образованием органосилоксанолята натрия (калия) и заключительную стадию - взаимодействие полученного силоксанолята с галогенидом металла. Реакцию обменного разложения осуществляли, как правило, преимущественно в н-бутаноле. Однако этот метод имеет существенные недостатки. К ним относятся:
1. Неопределенность состава алкил-, арилсилсесквиоксанового полимера, получаемого на первой стадии. В этом полимере с общей формулой:
![]()
соотношение n и m может варьировать от синтеза к синтезу. Определение содержания силанольных групп требует специальных дополнительных анализов каждой новой партии полимера. Наличие этих групп, по существу, означает, что в системе содержится некоторое дополнительное количество воды в «скрытой» форме (в виде силанольных групп).
2. Метод имеет ограниченное применение. По этой схеме был получен ряд металлофенилсилоксанов (МФС). Ори синтезе МОС с другими заместителями (винил-, этил-) возникают трудности, связанные с ограниченной растворимостью соответствующих органосилоксанолятов натрия в бутаноле. В отличие от фенилсилоксанолята натрия, этил-, винил-, и метилсилоксаноляты натрия хуже растворяются в бутаноле, и замещение натрия на двухвалентный металл в гетерогенной среде практически не происходит. Винил-, и этил-замещенные МОС удалось получить только при замене органосилоксанолятов натрия органосилоксанолятами калия, которые имеют более высокую растворимость в бутаноле.
Разработанный авторами [12] новый метод синтеза каркасных и полимерных МОС позволяет преодолеть указанные недостатки. Основная идея этого метода заключается в использовании хорошо растворимых органосилоксанолятов натрия, образующихся в результате взаимодействия органотриалкоксисиланов со щелочами (ранее органосилоксаноляты получали щелочным расщеплением полиорганосилсесквиоксанов). Для этого иcходный органотриалкоксисилан обрабатывают водно-метанольным раствором гидроксида натрия или калия такого состава, чтобы содержащееся в растворе количество воды обеспечивало полный гидролиз алкоксигрупп:
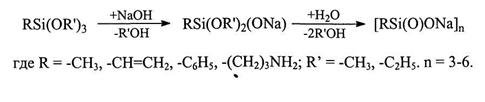
Предпосылкой такого подхода явились исследования A.M. Музафарова и Е.А. Реброва [13], которые впервые осуществили направленный синтез органоалкоксисилоксанолятов RSi(OR')2ONa и R2Si(OR')ONa:
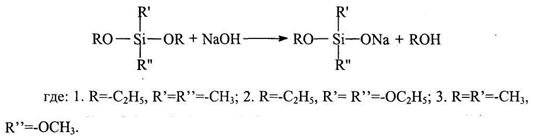
Образующиеся при этом силоксаноляты содержат функциональные группы Si-OR и Si-ONa, отличные по химической природе, что позволяет использовать эти соединения в реакциях с участием одной из этих групп, не затрагивая при этом другой.
Дальнейшим усовершенствованием этого метода является замена всего гидроксида натрия эквивалентным количеством металлического натрия. При использовании металлического натрия в реакцию вводится дополнительно расчетное количество воды, образующей в результате реакции необходимое количество NaOH. Синтез большинства МФС обычно проводят в бутаноле. Однако получение МОС с малыми заместителями (R= метил-, этил-, винил-) осложняется плохой растворимостью соответствующих силоксанолятов натрия. По этой причине при синтезе металлометил(винил)cилоксанов используется метанол или смесь метанол-этанол, в которых соответствующие органосилоксаноляты натрия полностью растворимы. В указанных средах обменная реакция органосилоксанолятов с хлоридами металлов протекает гладко.
В зависимости от используемого в реакции стехиометрического соотношения органосилоксанолят натрия: хлорид металла, образование МОС описывается одной из ниже приведенных схем:
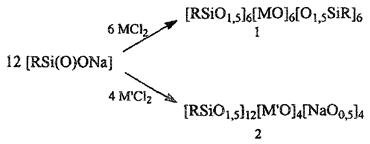
где М=Zn, Cu; M'=Cu
По реакции (1) образуются МОС сендвичевого типа. Такие структуры характерны для соединений, содержащих атомы меди. По реакции (2) образуются МОС седловидного типа. Характерным примером соединений такого типа являются биметаллические «щелочные» соединения, содержащие медь и натрий. Отметим, что при синтезе медьнатрийфенилсилоксана и медьнатрийвинилсилоксана по предложенной методике образуются соединения одинакового состава, но различные по структурной организации («сендвич» и «седло»). Интересно, что соотношение сендвичего и седловидного изомеров зависит от размеров органических заместителей при атомах кремния. Например, в случае медьнатрийфенилсилоксана соотношение «сендвич»:«седло» «1:4, а для медьнатрийвинилсилоксана оно составляет ≈1:20.
Поскольку образующийся NaCl заметно растворим в метаноле (1,4 г на 100 г метанола), по завершении реакции метанол в реакционной смеси частично или полностью заменяется на бутанол, этанол или толуол.
Образование медьфенилсилоксана (исходя из фенилтриэтоксисилана и СuС12) в соответствии с вышеуказанной схемой (1) описывается уравнением:
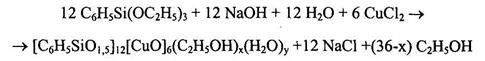
В отдельных случаях в качестве сорастворителя использовали 1,4-диоксан, что позволяет повысить выход кристаллического продукта. В частности, при синтезе медьфенилсилоксана наблюдается увеличение выхода в несколько раз - с 20 % до 64 %, а в случае марганецфенилсилоксана увеличение выхода было незначительным.
Кристаллическая структура каркасных металлофенил-, винилсилоксанов, такого состава описана в литературе [13-15].
Для исследования структуры синтезированных МОС используется метод деструктивного триметилсилилирования (взаимодействие с SiMe3Cl). Обработка триметилхлорсиланом МОС позволяет «мягко» извлекать из них металлы в виде хлоридов, не вызывая перестройки силоксанового скелета. Этот метод ранее хорошо зарекомендовал себя при изучении строения МОС. В случаях медьфенилсилоксана деструктивное триметилсилилирование описывается следующими уравнениями:
![]()
Аналогично реакция протекает и при действии триметилхлорсилана на металлометил- и металловинилсилоксаны. В отличие от кристаллических продуктов триметилсилилирования МФС, продукты триметилсилилирования металлометил- и металловинилсилоксанов представляют собой опалесцирующие, вязкие некристаллизующиеся слабоокрашенные (светло-желтые) жидкости.
3.2. Деструктивное сульфидирование металлоорганосилоксанов (МОС)
Для исследования процесса деструктивного сульфидирования МОС при их взаимодействии с сероводородом выбраются соединения с сендвичевым типом структуры: каркасные медьфенилсилоксан, марганецфенилсилоксан, никельфенилсилоксан, а также полимерные марганецметилсилоксан, марганецвинилсилоксан и марганецфенилсилоксан.
Взаимодействие каркасных МОС с сероводородом описывается следующей схемой:
![]()
Проведенные исследования показывают, что при действии газообразного сероводорода каркасные нейтральные МОС в твердой фазе или в виде суспензии в эфире легко разлагаются. Реакция приводит к образованию тонкодисперсного сульфида металла и (гексаоргано)[гекса(гидрокси)]циклогексасилоксанов и сопровождается выделением тепла.
Особенно легко реакция протекает при обработке H2S медьфенилсилоксана. При этом с высокими выходами образуется цис-(гексафенил)[гекса-(гидрокси)]циклогексасилоксан («гексол»). Полученный «гексол» представлял собой белые игольчатые кристаллы.
Отметим, что взаимодействие сероводорода с МОС является, в принципе, удобным способом получения циклосиланолов различной структуры. Дело в том, что гидроксильные группы при атоме кремния весьма неустойчивы, и могут подвергаться конденсации. Предотвращению этих процессов надо уделять большое внимание. Достоинством предлагаемого способа разложения МОС является то, что в результате реакции образуется инертный сульфид металла, не оказывающий каталитического действия на конденсацию образующихся циклосиланолов. Сероводород, будучи слишком слабой кислотой (рКа=7,05), также не оказывает никакого каталитического действия на конденсацию образующихся гидроксильных групп.
При обработке сероводородом полимерных медь(цинк)фенилсилоксана происходит образование сульфида меди(цинка) и полиолов. Анализ продуктов триметилсилилирования полимерных медьорганосилоксанов показал, что в их структуре присутствуют шестизвенные циклосилоксаны, содержание которых уменьшается при переходе от фенил-замещенных к метил-замещенным МОС. Однако выделить соответствующие (гексаоргано)-[гекса(гидрокси)]циклогексасилоксаны не удается.
3.3. Полимерные композиции на основе силоксановых блоксополимеров, структурированных сульфидами переходных металлов (ZnS, CuS)
МОС несомненно интересны в плане создания полимерных нанокомпозитов, представляющих собой полимерную матрицу с диспергированными в ней нанометровыми частицами металлов или их соединений. Дело в том, что структурная единица каркасных МОС представляет собой силоксановый каркас, связанный с ионами металлов, и соответственно такая структурная единица уже является, по сути, строительным модулем для создания нанокомпозитов. Введение МОС в полимерную матрицу можно осуществить различными способами - создавая полимерные смеси на основе МОС, либо вводя МОС в полимерную матрицу за счет реакций функциональных групп в органических заместителях при атоме кремния. В настоящей работе в качестве примера рассматриваются полимерные материалы, содержащие в своем составе металлосилоксановые фрагменты, которые были получены при реакции карбофункционального МОС.
Для того чтобы продемонстрировать возможность использования предложенного способа расщепления МОС газообразным сероводородом для создания композиционных материалов, ряд плёнок на основе силоксонового блоксополимера («Блоксил») и полиметилметакрилата (ПММА) обработываются сероводородом [16, 17]. Полученные композиты состояли из полимерной матрицы и наполнителя в виде тонкодисперсного сульфида меди. Реакция с сероводородом протекает по связям металл - кислород. Она приводит к образованию распределенного внутри полимерной матрицы в виде тонкодисперсного порошка сульфида меди (50-100 нм) и к возникновению силанольных групп при атомах кремния. Расщепление связи Si-O-М в пленках протекает продолжительное время (около суток) и сопровождается изменением цвета пленки с зеленого на коричневый.
Для плёнок, обработанных сероводородом, определяется содержание гель-фракции (путем экстрагирования в приборе Сокслета кипящим этилацетатом). Содержание гель-фракции составляет - 74% -79%. Высокие значения гель-фракции позволяют сделать вывод о том, что практически весь сульфид меди включается в структуру полимерной сетки.
Таким образом, использование МОС с функциональными группами в органических заместителях у атома кремния и метода деструктивного сульфидирования (расщепление связей Si-O-М с образованием сульфидов металлов), можно рассматривать как перспективный подход к созданию нового типа полимерных композиционных материалов, обладающих специфическими электрическими (а возможно и оптическими) свойствами.
В работе авторов [18] показано, что введение металлоорганосилоксанов и получение нанокомпозитов в полимерных матрицах на основе кремнийорганических блок-сополимеров и полиметилметакрилата изменяет оптические характеристики последних. Так, при показателе преломления, равном 1,48 для кремнийорганического полимера, и 1,49 для полиметилметакрилата, показатели преломления для нанокомпозитов составили 1,74.
Проведенный анализ физико-химических свойств композиций на основе металлоорганосилоксанов дает возможность предположить, что данные материалы перспективны для создания на их основе оптически прозрачных диэлектрических наноматериалов для электронной техники.
Результаты проведенного анализа литературных данных представляют исключительный интерес для получения полимерных сетчатых систем, обладающих экстремальными физико-механическими и электрофизическими свойствами. На основе металлоорганосилоксановых композиций возможно создание специальных материалы и устройства для электронной техники и информационных технологий, электротехники, медицины.
3.4. Металлорганосилоксаны в катализе
Традиционно органосиланоляты щелочных металлов использовали как катализаторы анионной полимеризации органоциклосилоксанов для получения линейных полимерных органосилоксанов. В дальнейшем было обнаружено, что применение смешанных силанолят-алкоголятов K4Li4(OSiMe3)6-8(OBut)1-2 позволяет синтезировать высокомолекулярные органосилоксаны с низкой полидисперсностью.
В большинстве случаев каталитические свойства МОС обусловлены природой металла, представляющего собой каталитический центр. Силоксигруппы, как правило, играют второстепенную роль, позволяя соответствующим образом сформировать каталитический центр; однако в некоторых случаях участие силоксановой матрицы становится определяющим.
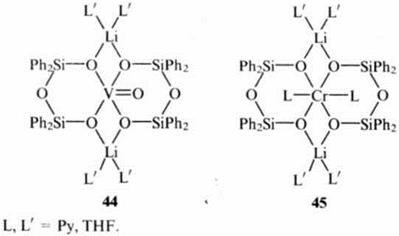
Ряд работ посвящен исследованию каталитических свойств МОС в реакции конверсии алкенов. Так, были созданы катализаторы, имитирующие катализаторы Циглера-Натты. В этих системах сочетается комплекс переходного металла с AlR3. Например, показано, что спироциклические V(IV)- и Cr(II)-органосилоксаны (соединения 44 и 45 соответственно) совместно с AlMe3 катализируют полимеризацию этилена и пропилена.
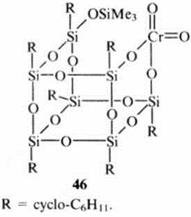
Более оригинальна идея использовать органосилоксановый каркас в роли силикатной матрицы, применяемой обычно в качестве неорганического носителя каталитически активных центров. Например, полиэдрический Cr(VI)-органосилоксан 46 по каталитической активности не уступает классическому катализатору Филлипса (Cr/SiO2).
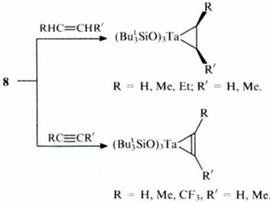
Современные исследования МОС-катализаторов для конверсии алкенов ориентированы в первую очередь на использование низкокоординационных комплексов. Некоторые триорганосилоксипроизводные металлов (особенно трехкоординационное соединение вольфрама 7) представляют интерес как перспективные катализаторы, активирующие алкены и алкины:
![]()
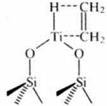
Диорганосилоксигидридотитан (активированный триметилфосфином) образует интермедиат с этиленом и катализирует превращение, приводящее к образованию бут-1-ена и высших олигомеров этилена.
В некоторых случаях генерирование алкена происходит при конверсии алкилсилоксипроизводного металла: так, при термолизе соединения вольфрама 47 получаются алкены в результате β-элиминирования алкильных групп, одновременно с этим образуются алкеновые комплексы.
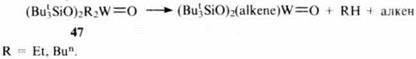
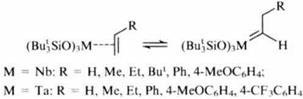
Наиболее отчетливо преимущество объемных триорганосилоксизаместителей у атомов металла проявилось при изучении каталитических свойств Nb- и Ta-органосилоксанов. Следует отметить, что именно с этих металлов Ричард Шрок (лауреат Нобелевской премии по химии 2005 г.) начинал поиски катализаторов реакции метатезиса, вводя в окружение металлического центра трет-бутоксигруппы, чтобы придать стабильность получаемым из них металлокарбенам. Более поздние исследования показали, что той же цели можно достичь иным путем – с помощью трет-бутилсилоксигрупп, причем с эффективным результатом, поскольку к каталитическому центру удается присоединить большее число объемных органических групп. Установлено, что триорганосилоксипроизводные ниобия и тантала способны присоединять алкены с образованием металлокарбенов, катализирующих реакции метатезиса.
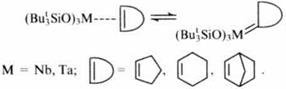
К другому типу катализаторов относятся триорганосилоксизамещенные гидриды тантала, способные присоединять СО, что позволяет рассматривать их как перспективные катализаторы реакции Фишера-Тропша.
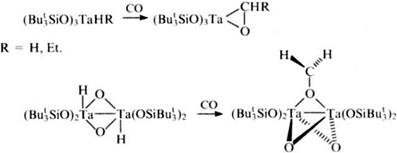
Полиэдрические TiIII- и TiIV-силсесквиоксаны, представляющие собой замкнутые (соединение 48) или частично замкнутые (соединение 1) полиэдры,
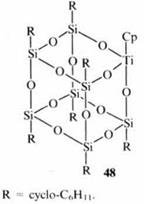
используют как гомогенные или гетерогенные катализаторы эпоксидирования алкенов.
Триорганосилоксипроизводные платиновых металлов находят традиционное применение, определяемое природой металлического центра. Роль органосилоксигрупп – повышение стабильности катализаторов при многократном использовании. Триорганосилоксипроизводное родия [Ph3SiORh(CO)2]2 – эффективный катализатор гидроформилирования.
![]()
В процессах гидрирования СО комплексы RMOSiPh3?2 L (M = Pt, Pd; R = Me, Et, Ph; L – циклоокта-1,5-диен) более эффективны по сравнению с соединениями R2M ? 2L или H2PtCl6/SiO2.
При каталитическом действии комплексов Pd в процессах кросс-сочетания с участием кремнийорганических реагентов постулируются 163 образование фрагмента Si-O-Pd в интермедиате.
Олигомерные МОС также применяют в катализе. Следует отметить, что использование их в качестве связующих для наполненных материалов малоперспективно, поскольку в большинстве случаев они образуют полимерные системы со сравнительно невысокой молекулярной массой (2000-5000), не обладающие конструктивной прочностью. В то же время изучение их каталитических свойств привело к интересным и в некоторых случаях неожиданным результатам.
Достаточно очевидная идея использовать эти соединения в качестве аналогов неорганических силикатов обусловила выбор катализируемых реакций, прежде всего процессов нефтехимического синтеза. Было установлено, что при высокотемпературной поликонденсации олиго-МОС постепенно теряют органические группы, превращаясь в неорганические силикаты, но при этом сохраняют особенности структуры исходных МОС. Такие соединения успешно конкурируют с близкими по составу катализаторами – неорганическими силикатами, - однако МОС обладают более высокой активностью и селективностью в процессах крекинга, галогенирования, дегидратации, алкилирования и др.
В дальнейшем олиго-МОС стали применять в таких каталитических реакциях, где металлосиликаты практически не используют. Примером может служить стереоселективное окисление углеводородов (в частности, 1,4-диметилциклогексана) в присутствии олигоферрофенилсилоксана.
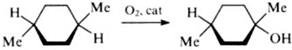
Наиболее важное применение олиго-МОС нашли в конверсии галогенуглеводородов. Эти процессы лежат в основе целого ряда многотоннажных производств (получение поливинилхлорида, дихлорэтана, хлорбензола, хлоралканов и т.д.). Своеобразие галогенуглеводородов заключается в низкой склонности к координации с большинством металлокомплексов, что затрудняет подбор катализаторов. Выбор был основан на следующем соображении: наиболее эффективный катализ следует ожидать в тех случаях, когда становится возможным радикально-цепной механизм с участием ионов металлов переменной валентности. Переходные металлы, входящие в структуру органосилоксановой матрицы, могут изменять степень окисления (ключевой момент катализа для указанного класса реакций), оставаясь в составе силоксанового скелета. Были приняты во внимание и некоторые дополнительные достоинства олиго-МОС: их растворимость в органических растворителях позволяла использовать из в гомогенном катализе, а в случае гетерогенного катализа их можно химически связать с широко применяемыми минеральными носителями (SiO2, Al2O3 и др.). Кроме того, доступны системы с участием почти любых переходных металлов или их сочетаний в заданном соотношении. Варьирование их свойств может быть реализовано также путем изменения параметров высокотемпературных конденсационных процессов, влияющих на формирование поверхности образующегося катализатора.
Были исследованы 166 каталитические свойства олигомерных Cu-, Co- и Fe- органосилоксанов в изомеризации несимметричного 3,4-дихлорбут-1-ена в симметричный 1,4-дихлорбут-2-ен (ключевая стадия в процессе производства хлоропропенового каучука). Наибольшую каталитическую активность показал Cu-содержащий МОС, что подтвердило существующие представления о частичном восстановлении ионов металла в ходе каталитической реакции – среди исследованных металлов наиболее легко восстанавливается ион меди. Тем не менее Co- и Fe-содержащие олиго-МОС также представляют интерес, поскольку их действие более селективно: в их присутствии не происходит образование цис-изомера 1,4-дихлорбут-2-ена. Главным отличием олиго-МОС от традиционных катализаторов (нафтената или галогенида меди) оказалась исключительно высокая стабильность: многократное их использование (6-10 раз) не приводит к заметному снижению активности, в то время как традиционные катализаторы практически полностью теряют активность после первого применения.
Были изучены каталитические свойства олиго-МОС в процессах обменного галогенирования, позволяющих получать галогенуглеводороды без использования галогенов в виде простых веществ.
![]()
В случае хлоруглеводородов данный метод позволяет осуществить экологически более предпочтительное производство. Это особенно актуально при получении бромпроизводных, поскольку прямое бромирование молекулярным бромом протекает с трудом и неселективно; кроме того, получение бромидов обычно представляет собой многостадийный процесс.
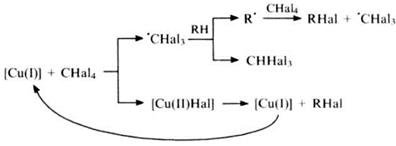
Детальное изучение 148,167,168 обменного галогенирования углеводородов n-C10H22, n-C12H26, cyclo-C6H12, p-Me2C6H4 и C6H5Me с участием CCl4 или CBr4 (в присутствии каталитических количеств олиго-Cu-фенилсилоксана) позволило выяснить механизм процесса. Реакция протекает по радикальному механизму: передача по цепочке радикального центра от радикала ?ССl3 к углеводороду показана в верхней ветви схемы, превращение каталитического центра показано в нижней ветви (согласно классическим представлениям, катализатор после участия в реакции возвращается в исходное состояние, что отмечено изогнутой стрелкой). Активность олиго-Cu-фенилсилоксана практически не снижается после пятикратного использования, в то время как стандартный катализатор CuCl2 ? (DMF)n теряет работоспособность в течение одного цикла.
Рассмотренная реакция обменного галогенирования приводит к смеси моногалогенпроизводных с различным расположением атома галогена. Процесс присоединения галогенуглеводородов к алкенам более селективен, поскольку в этом случае положение двойной связи указывает место присоединения атома Cl и фрагмента CCl3.
![]()
В качестве катализаторов этой реакции были исследованы монофенил- и дифенилсодержащие олигомерные Cu-органосилоксаны. Процесс протекает по радикальному механизму, подобному описанному выше. Отличие состоит в том, что образование радикального центра при участии двойной связи алкена облегчено. Показано, что у структурированных (содержащих каркасные фрагменты) монофенилпроизводных, включающих трифункциональные фрагменты RSiO1.5, доступность каталитических центров и, соответственно, каталитическая активность ниже, чем у дифенилпроизводных, построенных их линейных фрагментов.
Кинетическое изучение двух указанных типов процессов галогенирования позволило установить, что заметная часть каталитических центров оказывается «выключенной» из каталитического процесса из-за того, что значительная доля ионов металла связана в межцепные координационные кластеры. Металл стремится заполнить свою координационную сферу, привлекая атомы кислорода соседних фрагментов Si-O-M.
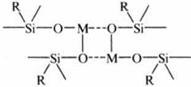
В результате ион металла оказывается координационно насыщенным и структурно малодоступным для взаимодействия с CCl4. Таким образом, основная задача – затруднить образование межцепных металлооксидных кластеров. Если блокировать металл каким-либо лигандом, то это затормозит межцепную координацию, но не поможет решить основную проблему – лиганд также станет затруднять приближение реагента. Было найдено решение, достаточно простое для реализации, - заменить связанную с кремнием фенильную группу нонильной. При этом ион Cu в составе олигононилсилоксана оказывается (по данным УФ-спектроскопии) координационно ненасыщенным.
Таким образом, объемная алифатическая группа эффективно затрудняет координационное взаимодействие атомов меди в соседних цепях, «укрывая» металлические центры, но в реакционной среде она обладает подвижностью полимерного сегмента и не препятствует приближению органического реагента (CCl4) к каталитическому центру (рис.1).
![]()
Результаты реализации этой идеи достаточно убедительны: при каталитическом присоединении CCl4 к окт-1-ену активность нонилсодержащих полимерных Cu-МОС вдвое выше, чем у медьфенилсилоксанов.
Рассмотренный в обзоре материал убедительно показывает, что металлоорганосилоксаны представляют собой класс соединений, чрезвычайно интересный и с теоретической, и с практической точек зрения.
ВЫВОДЫ
1. Проведен обзор, посвященный современным проблемам физико-химии олиго-, полиметаллоорганосилоксанов.
2. Значительным потенциалом в качестве каталитических систем обладают олигомерные МОС. В случае олигомерных МОС важную роль играет не только природа металла, но и тип силоксановой матрицы, который определяет доступность каталитического центра.
3. Использование МОС с функциональными группами в органических заместителях у атома кремния и метода деструктивного сульфидирования (расщепление связей Si-O-М с образованием сульфидов металлов) - перспективный подход к созданию нового типа полимерных композиционных материалов, обладающих специфическими электрическими (оптическими) свойствами.
4. Введение металлоорганосилоксанов (МОС) и получение нанокомпозитов в полимерных матрицах на их основе - перспективное направление в области отечественных конкурентоспособных разработок по созданию оптически прозрачных диэлектрических наноматериалов для электронной техники.
СПИСОК ЛИТЕРАТУРЫ
1. М.М.Левицкий, Б.Г.Завин, А.Н.Биляченко. Химия металлоорганосилоксанов. Современные тенденции развития и новые концепции. // Успехи химии. – 76 (9). – 2007.
2. Тарханова И.Г., Левицкий М.М., Ланин С.Н., Кузнецов Б.В., Смирнов В.В. //Тезисы доклада. XII Симпозиум «Современная химическая физика», Туапсе, 18-29 сент., 2000, с. 125.
3. Тарханова И.Г., Левицкий М.М., Судьина А.Е., Петров А.Р. //Тезисы доклада. XII Симпозиум «Современная химическая физика», Туапсе, 18-29 сент., 2000, с.225.
4. А.Н.Биляченко, Б.Г.Завин, М.М.Левицкий. Особенности синтеза и строения полиметилорганосилоксанов с объемными органическими группами у атома кремния. //Материалы тезисов докладов III Всероссийской Каргинской конференции "Полимеры-2004".-М.: МГУ, 2004 - Т.1.- с. 40
5. Shchgolikhina O.I., Pozdnyakova Y.A., Molodtsova Y.A., Korkin S.D., Bukalov S.S., Leites L.A., Lyssenko K.A., Peregudov A.S., Auner N., Katsoulis D.E. //Inorganic Chemistry, 2002, v.41, P. 6892-6904.
6. Аликовский А.В., Данько Е.Т., Золотарь Г.Я. Изв. ВУЗов. Химия и хим. технология, 2001, т.44, вып.1, с. 66-69.
7. Автореферат диссертации на соискание уч. степени кандидата хим. наук Данько Е.Т., Владивосток, 2001.
8. Палютин Ф.М., Лебедев Е.П. и др. Герметики на основе жидких силоксановых каучуков. //Журнал "Клеи.Герметики.Технологии".- № 4.- 2004. – с. 4-8.
9. Шапкин Н.П., Капустина А.А., Кучма А.С., Талашкевич Е.А. Изв. ВУЗов, Химия и хим. технология, 2001, т.44, вып.1, с. 115-118.
10. Щеголихина О.И., Позднякова Ю.А., Коркин С.Д., Букалов С.С, Лейтес Л.А., Лысенко К.А., Перегудов А.С. 4-й Международный симпозиум по химии и применению фосфор-, сера- и кремнийорганических соединений «Петербургские встречи», Санкт-Петербург, Россия, 2002, с. 91.
11. А.Н. Биляченко, А.А. Корлюков, М.М. Левицкий, М.Ю. Антипин, Б.Г.
Завин. Известия Академии наук, Сер. хим., 2007, №3, с. 52.
12. А.Н. Биляченко, А.А. Корлюков, М.М. Левицкий, Б.Г. Завин, М.Ю.
Антипин, О.А. Филиппов, В.И. Цупрева. Известия Академии наук, Сер. хим.,
2008, №10, с. 2162.
13. А.Н. Биляченко, Н.В. Сергиенко, А.А. Корлюков, М.Ю. Антипин, Б.Г. Завин, М.М. Левицкий. Известия Академии наук, Сер. хим., 2006, №5, с. 909.
14. А.А. Жданов, Н.В. Сергиенко, Е.С. Транкина. Рос. хим. ж. (Ж. Рос. об-ва им. Д.И. Менделеева), 2001, XIV, №4, с. 44.
15. M.D. Skowronska-Ptasinka, M.L.W. Vorstenbosch, R.A. Van Santen, H.C.L. Abbenhuis. Angew. Chem. Int. Ed., 2002, V. 41, №4, P. 637.
16. Т.М.Чигорина, Е.А.Чигорина, Арутюнянц А.А., Бестаев М.В. Металлоорганические функциональные материалы, на основе силоксановых блок-сополимеров. // Журнал «Клеи. Герметики. Технологии». – № 4. – 2010. – С. 15- 18
17. T.M.Chigorina, E.A.Chigorina, and V.T.Abaev. Organomettallic fuctional materials based on siloxane block copolymers. // Polymer Sciece, Series D. - 2010. - Vol. 3. - № 4. - pp. 228-230.
18. Хелевина О.Г., Малясова А.С., Ишуткина М.В. Структурирование олигоалюмо-силоксанов. // ЖПХ. - Т. 86. - № 2. - С. 155. - 2013
0 комментариев