ЗМІСТ
ЗМІСТ. 1
РЕФЕРАТ. 4
ВСТУП.. 5
РОЗДІЛ 1 ХАРАКТЕРИСТИКА ЦІЛЬОВОГО ПРОДУКТУ.. 8
РОЗДІЛ 2 ХАРАКТЕРИСТИКА БІОЛОГІЧНОГО АГЕНТА.. 10
2.1 Обгрунтування вибору біологічного агента. 10
2.2 Обгрунтування вибору складу поживного середовища. 14
2.3 Обрахунок складу поживного середовища. 17
2.4 Характеристика біологічного агента. 19
РОЗДІЛ 3 ТЕХНІКО-ЕКОНОМІЧНЕ ОБГРУНТУВАННЯ.. 22
3.1 Короткий огляд технологій виробництва декстрану. 22
3.2 Розрахунок потужності виробництва декстрану. 24
3.3 Розрахунок кількості стадій підготовки посівного матеріалу. 27
РОЗДІЛ 4 БІОСИНТЕЗ ЦІЛЬОВОГО ПРОДУКТУ.. 28
4.1 Шляхи катаболізму сахарози у L. mesenteroides PCSIR-4. 28
4.2 Біотрансформація декстрану у L. mesenteroides PCSIR-4
з сахарози. 31
РОЗДІЛ 5 ОБГРУНТУВАННЯ ВИБОРУ ТЕХНОЛОГІЧНОЇ СХЕМИ.. 32
5.1 Обгрунтування доферментаційних процесів та виробничого біосинтезу 32
5.1.1 Обгрунтування необхідності підготовки персоналу. 32
5.1.2 Обгрунтування необхідності підготовки чистих
приміщень. 33
5.1.3 Обгрунтування необхідності підготовки вентиляційного повітря 35
5.1.4 Обгрунтування необхідності підготовки
ферментаційного обладнання. 35
5.1.5 Обгрунтування способу культивування
і типу ферментера. 37
5.1.6 Обгрунтування вибору стадії підготовки повітря. 39
5.1.7 Вибір мийних та дезінфікуючих засобів. 40
5.1.7.1 Дезінфікуючі засоби для обробки рук персоналу. 41
5.1.7.2 Дезінфікуючі засоби для обробки поверхонь
обладнання. 42
5.1.7.3 Дезінфікуючі засоби для обробки поверхонь
приміщень. 44
5.2 Особливості підготовки та стерилізації поживного середовища. 46
5.3 Обгрунтування стадій виділення та очищення цільового
продукту. 47
5.3.1 Обгрунтування необхідності попередньої обробки
культуральної рідини. 48
5.3.2 Обгрунтування вибору способу відділення біомаси
та відповідного обладнання. 49
5.3.3 Обгрунтування стадій осадження та розділення
на фракції декстрану. 51
5.3.3.1 Обгрунтування вибору стадії деструкції 52
5.3.3.2 Обгрунтування стадії розділення декстрану на фракції 54
РОЗДІЛ 6 МАТЕРІАЛЬНИЙ БАЛАНС ТА ПРОДУКТОВИЙ
РОЗРАХУНОК.. 56
6.1 Матеріальний баланс на одну ферментацію (партію) 57
6.2 Продуктовий розрахунок. 60
РОЗДІЛ 7 СПЕЦИФІКАЦІЯ ОБЛАДНАННЯ.. 70
РОЗДІЛ 8 ОПИС ТЕХНОЛОГІЧНОЇ СХЕМИ.. 73
РОЗДІЛ 9 КОНТРОЛЬ ВИРОБНИЦТВА.. 95
9.1 Карта постадійного контролю............................................................ 95
9.2 Мікробіологічний контроль. 102
9.3 Показники росту та синтезу цільового продукту. 103
9.3.1 Конценртація біомаси. 103
9.3.2 Концентрація цільового продукту. 103
9.3.3 Концентрація джерела вуглецю і азоту. 105
РОЗДІЛ 10 ОХОРОНА ПРАЦІ 108
ВСТУП.. 108
10.1 Законодавство України, що забезпечує охорону праці 109
10.2 Фінансування заходів з охорони праці 110
10. 3 Аналіз шкідливих та небезпечних виробничих факторів. 111
10.3.1 Повітря робочої зони. 111
10.3.2 Шум та вібрації 112
10.3.3 Електробезпека. 113
10.3.4 Освітлення. 114
10.3.5 Пожежна безпека. 114
10. 4 Пропозиції на покращення умов праці 115
ВИКОРИСТАНА ЛІТЕРАТУРА.. 117
РЕФЕРАТ
Дипломний проект присвячений вивченню біосинтезу полісахариду декстрану бактеріями Leuconostoc mesenteroides PCSIR-4, який у порівнянні зі штамом Leuconostoc mesenteroides 05-19S є набагато продуктивніший і синтезує 90,4 г/л декстрану.
В роботі наведено технологічну та апаратурну схеми виробництва полісахариду декстрану, які включають стадії допоміжних робіт : підготовку приміщень, персоналу, дезінфікуючих розчинів, обладнання, вентиляційного та аераційного повітря, підготовку соляної кислоти та лугу (гідрооксид натрію), підготовку піногасника (гланапон), а також стадії приготування та стерилізації поживного середовища (5 стадій), підготовка посівного матеріалу та виробниче культивування бактерій-продуцентів Leuconostoc mesenteroides PCSIR-4.
Також наведено технологічний процес виділення та очищення продутку, який складається з таких стадій: розбавлення культуральної рідини водою (задля зменшення в’язкості), центрифугування (для осадження бактеріальних клітин), осадження полісахариду етиловим спиртом, розчинення декстрану водою, кислотний гідроліз (для розділення на фракції), нейтралізація соляної кислоти та ультрафільтрація розчину для отримання низькомолекулярної фракції (40000-70000 кДа).
На основі вивчення статистичних даних захворюваності в Україні, було розраховано річну потужність виробництва кровозамінника Реополіглюкіна, а саме: культуральної рідини – 1658 м3/рік та готового продукту – 125 тон/рік.
Дипломний проект викладений на 119 сторінках друкованого тексту, в тому числі 26 таблиць, 11 рисунків, 2 схеми формату А1.
Ключові слова: Leuconostoc mesenteroides PCSIR-4, декстран, кровозамінник, поживне середовище, біосинтез.
ВСТУП
Фармацевтична галузь відіграє важливу роль в економіці України, оскільки є важливим сегментом національного ринку, багато в чому визначає національну і оборонну безпеку країни, відрізняється великою наукоємною і розвиненою кооперацією. Українська фармацевтична промисловість виробляє близько 1400 із 3000 препаратів, що продаються в Україні. Фармацевтичні компанії України виробляють лікарські засоби майже в усіх формах (твердих, рідких, порошкоподібних тощо). Основними групами є серцево-судинні препарати, анальгетики, вітаміни, засоби для лікування респіраторної та ендокринної систем, шлунково-кишкового тракту і антибіотики [14].
В даний час полісахариди мікроорганізмів досить широко використовуються в практиці. Вони знаходять застосування в різних сферах людської діяльності: у медицині, фармацевтичній, харчовій, хімічній та текстильній промисловості. Можливість і перспективність використання полісахаридів в медицині значною мірою визначається їх біологічною активністю [14, 18].
Широке застосування мікробних полісахаридів у фармацевтичній, парфумерній, харчовій та інших галузях промисловості визначається їх властивостями: в’язкістю, реологічними характеристиками, здатністю до набухання, взаємодією з певними структурами.
В харчовій промисловості полісахариди використовують в якості гелеутворювачів, згущувачів, стабілізаторів водно-жирових емульсій.
У фармацевтичній промисловості вони використовуються в якості основи для виготовлення лікарських форм: як пом’якшувачі, емульгатори і стабілізатори суспензій, як склеюючі агенти і розпушувачі в мазях, пігулках, таблетках.
Вони забезпечують тривалу стійкість лікарських пр. епаратів, стабілізують і пролонгують їхню дію [25, 31].
Декстран являє собою бактеріальний полісахарид, який є комерційно доступним, і його використовують в якості лікарських засобів, особливо в якості розширювача обсягу плазми крові. Декстран знайшов промислового застосування в харчовій, фармацевтичній та хімічній промисловості як ад’ювант, емульгатор, носій і стабілізатор. У харчовій промисловості декстран в даний час використовується як загусник для варення і морозива. Він запобігає кристалізації цукру, покращує утримання вологи і підтримує аромат, і зовнішній вигляд різних продовольчих товарів [27].
Актуальність теми: В наш час кровозамінники використовують частіше, ніж донорську кров. Загроза зараження людей збудниками СНІДу, сифілісу, гепатитів і інших інфекцій, які передаються при переливанні цільної крові, посттрансфузійні ускладнення потребують максимального зниження кількості гемотрансфузій. Крім того, економічне застосування кровозамінних та плазмозамінних препаратів вигідніше, ніж застосування крові та її елементів. Також навіть сумісна кров все одно викликає «стрес» імунної системи реципієнта. Приблизно одне із ста переливань супроводжується ознобом, лихоманкою і сипом. На кожні 6000 переливань еритроцитної маси виникає одна гемолітична реакція, яка може призвести до внутрішньосудинного згортання крові, до ниркової недостатності і навіть смерть [7].
Використання декстрану дасть змогу отримувати кровозамінники, які мають ряд очевидних переваг перед донорською кров’ю:
1. Штучна кров явно нічим не заражена;
2. Не потребує доборі по антигенним групам;
3. Менш вразлива щодо умов зберігання;
4. І що особливо важливо, процес створення таких препаратів будь — якої миті можна збільшити.
В Україні на сьогодні не існує біотехнологічних підприємств, що виготовляють субстанцію декстрану [7].
Новизна проекту: В представленому проекті, як продуцент використовується новий штам бактерій-продуцентів декстрану Leuconostoc mesenteroides PCSIR-4. Даний штам здатен синтезувати до 90,4 г/л декстрану, що у 5 разів вище ніж синтезує його прототип, штам Leuconostoc mesenteroides 05-19S, що використовується у існуючих технологіях виробництва. При вирощуванні Leuconostoc mesenteroides PCSIR-4 тривалість культивування складає 18 годин, натомість для Leuconostoc mesenteroides 05-19S тривалість процесу – 48 годин, що є суттєвою перевагою обраного продуцента [1, 20].
РОЗДІЛ 1
ХАРАКТЕРИСТИКА ЦІЛЬОВОГО ПРОДУКТУ
Кінцевим продуктом біосинтезу бактерій Leuconostoc mesenteroidesє полісахарид декстран (молекулярна маса 35000–45000 кДа) – основа для виробництва кровозамінників, а саме Реополіглюкіну.
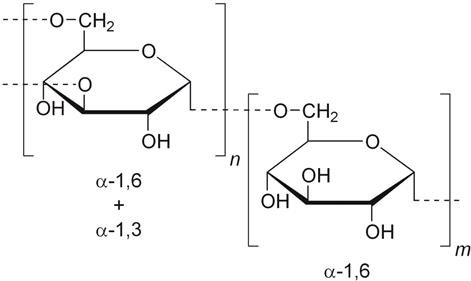
Рис. 1.1 Повторювана одиниця полісахариду декстрану
Декстран (С6Н10О5)n – це високомолекулярний полімер з довгим розгалуженим ланцюгом, який складається з глюкози, з’єднаної головним чином α – 1,6 глікозидними і в меншій мірі β – 1,4 і α – 1,3 глікозидними зв’язками. Молекулярна маса декстрану від 20000 до 200000. Кільцева структура піранозної ланки містить п’ять атомів вуглецю і один атом кисню. Декстрани розрізняються за своєю молекулярною масою, просторовим розташуванням , типом і ступенем розгалуження, довжиною ланцюжків [32].
Класифікація декстранів:
Клас 1: декстрани, що містять α ( 1 → 6 ) зв’язки, модифікований невеликими бічними ланцюгами гілок D- глюкози з α ( 1 → 2 ) , α ( 1 → 3 ) і α ( 1 → 4 ) зв’язками.
Клас 2: декстрани, що містять магістральну структуру та зв’язки α ( 1 → 3 ) і α ( 1 → 6 ) [32].
Фізико – хімічні властивості очищеного декстрану
Його властивості залежать від штаму-продуценту, з якого він синтезується і від методу виробництва. Він являє собою аморфний світло-жовтий або білий порошок, який у воді утворює колоїдний розчин . Декстран має високу розчинність у воді і його розчини поводяться як ньютонівські рідини. В’язкість розчину залежить від концентрації, температури і молекулярної маси декстрану, що мають характерний розподіл [32].
Розчинність декстрану
Фракції декстрану добре розчиняються у воді і електролітах. Значення рН не робить істотного впливу на розчинність. Декстран також розчинний у деяких інших розчинниках, зокрема, сульфід метил, формамід, етиленгліколь, гліцерин. Фракції декстрану нерозчинні у одноатомних спиртах, наприклад, метанолу, етанолу та ізопропанолу, а також більшості кетонах, таких як ацетон і 2-пропанон [32].
Декстран — вуглевод, який містить розгалужені ланцюги залишків глюкози, які являються продуктами життєдіяльності бактерій та грибів. Завдяки відносно великій молекулярній масі, декстран повільно проникає через судинні стінки і при введенні в кров’яне русло, довго в ньому циркулює.
На основі декстрану було виготовлено препарати гемодинамічної дії з функцією нормалізації кислотно-лужного та електролітного балансу, який являє собою водний розчин декстрану з ММ 40000 кДа і містить додаткові компоненти: калій хлорид, кальцій хлорид, натрій хлорид. Є декілька видів препарату на основі декстрану: поліглюкін, поліглюсоль, поліоксидин, рондеферин, реоглюман та реополіглюкін [32].
РОЗДІЛ 2
ХАРАКТЕРИСТИКА БІОЛОГІЧНОГО АГЕНТА
2.1 Обгрунтування вибору біологічного агента
Продуцентом декстрану є бактерії виду Leuconostoc mesenteroides. На даний час відомо декілька штамів даного виду бактерій: L. mesenteroides NRRL B512 (F), L. mesenteroides 05–19S, L. mesenteroides NRRL B512 (f), L. mesenteroides PCSIR-4, L. mesenteroides PCSIR-9,L. mesenteroides CMG713. Представлені штами бактерій синтезують декстран на поживному середовищі з сахарозою, концентрація якої в кожному випадку різна. Відповідно вихід продукту коливається в різних межах. Це є однією з головних відмінностей між мікроорганізмами. Також умови культивування мікроорганізмів різні, вони представлені в табл. 2.1 [1, 20, 26, 28, 29].
Таблиця 2.1 Порівняння штамів-продуцентів декстрану
| № | Продуцент | Поживне середовище (г/л) | Вихід продукту (г/л) | Час культивування (год) | Вихід декстрану від заданого субстрату, % |
| 1 | L. mesenteroides NRRL B512(f) | Сахароза–20; Дріжджовий екстракт–20; K2HPO4–8 | 10 [9] | 17 | 50 |
| 2 | L. mesenteroides 05–19S | Сахароза — 50; дріжджовий екстракт — 0,001 дм3; MgSO4 × 7H2O — 0,10; КCl — 0,10; CaCl2 — 0,02; KH3PO4 –1; FeSO4 — 0,01; NH4Cl — 0,50; Na2HPO4 — 2,50; сіль Мора — 0,01; фолієва кислота — 0,05; сухий ферментативний пептон – 0,20; вода | 17 [1] | 48 | 34 |
| 3 | L. mesenteroides NRRL B512 (F) | Сахароза–100; дріжджовий екстракт–20,0; NaCl–0,01; MgSO4×7H2O–0,01; FeSO4×7H2O–0,01; CaCl2–0,05. | 40,8 [10] | 18 | 41 |
Продовження табл. 2.1
| 4 | L. mesenteroides PCSIR-4 | Сахароза–300; дріжджовий екстракт–5,0; пептон–5,0; К2НРО4–15; NaCl–0,01; MgSO4×7H2O–0,01; MnCl2×H2O–0,01; CaCl2–0,05. | 90,4 [10] | 18 | 30 |
| 5 | L. mesenteroides PCSIR-9 | Сахароза–100; дріжджовий екстракт–5,0; пептон–5,0; К2НРО4–5,0. | 37,9 [10] | 18 | 38 |
| 6 | L. mesenteroides CMG713 | 1) Сахароза–50, триптон–10; дріжджовий екстракт–1,0; К2НРО4–2,5; 2) Сахароза–150; пептон бактеріальний–5; дріжджовий екстракт–5; К2НРО4–15; МnCl2×H2O–0,01; NaCl–0,01; CaCl2–0,05. | 1) 12,40 [11] 2) 15,72 [11] | 1) 24 2) 24 | 1) 25 2) 10 |
З табл. 2.1 видно, що найбільшу кількість декстрану синтезує штам L. mesenteroides PCSIR-4. При внесенні в середовище 300 г/л сахарози синтезується 90,4 г/л полісахариду за 18 годин. Порівняно з іншими штамами, даний представник синтезує найбільшу кількість продукту за відносно невеликий проміжок часу (18 год) [28].
Розрахуємо вихід декстрану від заданого субстрату (сахароза) для кожного штаму–продуценту.
Загальна формула для розрахунку:
Y = ![]() , де
, де
Nn – вихід продукту біосинтезу,
Сс – концентрація заданого субстрату.
L. mesenteroides NRRL B512(f):
Y = ![]() ,
,
L. mesenteroides 05–19S:
Y = ![]() ,
,
L. mesenteroides NRRL B512 (F):
Y = ![]() ,
,
L. mesenteroides PCSIR-4:
Y = ![]() ,
,
L. mesenteroides PCSIR-9:
Y = ![]() ,
,
L. mesenteroides CMG713:
Y1 = ![]() ,
,
Y2 = ![]() .
.
У інших штамів вихід продукту набагато менший, але кількість внесеного субстрату більша. Це економічно невигідно, адже завдання біотехнолога полягає у тому, щоб якнайменше затратити кошт на компоненти поживного середовища для вирощування мікроорганізмів, але при цьому отримати максимальну кількість продукту біосинтезу. Також у бактерій L. mesenteroides PCSIR-4 час культивування найменший, порівняно з іншими. Це є важливим показником, адже чим менше затрачено часу, тим швидше і більше ми отримаємо насинтезованого продукту [1, 20, 26, 28, 30].
Отже, в даному проекті, як продуцент буде використаний штам бактерій L. mesenteroides PCSIR-4 зважаючи на високі показники синтезу декстрану, виходу цільового продукту від заданого субстрату та малу тривалість процесу культивування бактерій.
2.2 Обгрунтування вибору складу поживного середовища
Поживне середовище для культивування мікроорганізмів повинно містити всі елементи, з яких складається клітина, причому в доступній для засвоєння організмом формі. Такими основними компонентами поживного середовища повинні бути: джерело вуглецю та енергії, джерела мінеральних сполук (азот, фосфор, сірка, калій, магній, кальцій, залізо та мікроелементи), а також (у разі потреби) і фактори росту [12].
Тільки невелика кількість елементів періодичної системи потрібна мікроорганізмам у відносно високих концетраціях (³ 10-4 М). ). Це десять головних біологічних елементів: вуглець, кисень, водень, азот, сірка, фосфор, калій, магній, кальцій та залізо. Крім десяти головних біоелементів, мікроорганізмам необхідні мінорні біоелементи, джерелом яких, як правило, є водопровідна вода [12].
Поживні середовища, на яких вирощують мікроорганізми, мають відповідати таким мінімальним вимогам: у них мають бути присутні всі елементи, з яких будується клітина, причому в такій формі, в якій мікроорганізми здатні їх засвоювати [12].
До складу бактеріальної клітини входять такі елементи, % до маси сухої речовини: вуглець — 50; кисень — 20; азот — 10; водень — 8; фосфор — 3; сірка, калій, натрій — 1; кальцій, магній, хлор — 0,5; залізо — 0,2; решта елементів — близько 0,3 [12].
У природі більшість біологічних елементів міститься у вигляді солей, мікроорганізми поглинають їх у вигляді катіонів та аніонів. Велика різноманітність сполук, які використовуються мікроорганізмами, спостерігається тільки щодо сірки, азоту, кисню, водню, вуглецю [12].
Так сірка, як правило, споживається у вигляді сульфатів, відновлюється до сульфіду і потім використовується в біосинтетичних процесах.
Азот необхідний у великих кількостях, оскільки в клітині його міститься близько 10%. У природі азот зустрічається у вигляді аміаку, нітрату, нітриту, азотовмісних органічних сполук та молекулярного азоту. Кращим джерелом азоту для мікроорганізмів є аміак, який може використовуватися практично всіма мікроорганізмами. Нітрат спочатку відновлюється до аміаку і тільки після цього використовується в біосинтетичних процесах [12].
Вуглець, водень і кисень можуть споживатися у формі органічних та неорганічних сполук. Метаболізм цих сполук має велике значення не тільки тому, що ці елементи є важливими компонентами клітини, а й тому, що ці сполуки є субстратами для одержання мікроорганізмами енергії [12].
Для продуцента полісахариду декстрану штаму L. mesenteroides PCSIR-4 наведено декілька складів поживних середовищ (табл. 2.2).
Таблиця 2.2 Приклади поживних середовищ [28]
| Компоненти ПС | Кількість компонентів ПС (г/л) | |||
| № 1 | № 2 | № 3 | № 4 | |
| Сахароза | 100.00 | 300.00 | 100.00 | 100.00 |
| Дріжджовий екстракт | 5.00 | 5.00 | 5.00 | 20.00 |
| Пептон | 5.00 | 5.00 | 5.00 | – |
| K2HPO4 | 5.00 | 15.00 | – | – |
| NaCl | – | 0.01 | – | 0.01 |
| MgSO4×7H2O | – | 0.01 | – | 0.01 |
| MnCl2×H2O | – | 0.01 | – | – |
| FeSO4×7H2O | – | – | – | 0.01 |
| CaCl2 | – | 0.05 | – | 0.05 |
З наведених вище поживних середовищ було обрано поживне середовище № 2. Воно містить усі необхідні елементи, що входять до складу клітин і дає змогу накопичувати максимальну кількість декстрану (див. табл. 2.2) [28].
Сахароза є джерелом вуглецю;
Пептон – азоту;
K2HPO4 – джерело фосфору та кальцію;
NaCl – джерело натрію та хлору;
MgSO4×7H2O – джерело магнію, водню та сірки;
MnCl2×H2O – джерело марганцю та хлору;
FeSO4×7H2O – джерело заліза та сірки;
CaCl2 – джерело кальцію та хору.
Таблиця 2.3Порівняння в’язкості продукту та його виходу[28]
| № ПС | L. mesenteroides PCSIR-4 | |
| Кількість декстрану, (г/л) | В’язкість, (сСт) | |
| 1 | 36,80 | 23,15 |
| 2 | 90,40 | 20,64 |
| 3 | 34,00 | 18,72 |
| 4 | 39,60 | 25,08 |
На поживному середовищі № 2 синтезується найбільша кількість декстрану. Максимальна його кількість накопичується після 18 годин культивування, далі кількість продукту поступово зменшується, а в’язкість збільшується, що свідчить про високу молекулярну масу речовини. В’язкість декстрану, який утворюється на обраному нами ПС є оптимальною для того, щоб його можна було виділити та очистити. При подальшому збільшенні тривалості культивування спостерігається суттєве підвищення в’язкості декстрану до 25-27 сСт, що суттєво ускладнить процеси виділення та очищення продукту [28].
Таблиця 2.4 Порівняльна залежність виходу декстрану від кількості субстрату [28]
| Кількість сахарози г/л | Кількість декстрану г/л | Вихід декстрану від субстрату, % |
| 50 | 17,90 | 35 |
| 100 | 47,80 | 48 |
| 200 | 70,01 | 35 |
| 300 | 90,04 | 30 |
| 400 | 80,09 | 20 |
| 500 | 53,20 | 10 |
Кількість сахарози у базовому поживному середовищі складає 300 г/л, оскільки розрахунки економічного коефіцієнта показали, що саме при такій кількості вуглецевого субстрату можна отримати найбільший вихід продукту біосинтезу, а саме 30%. При збільшенні кількості сахарози у поживному середовищі, вихід декстрану від заданого субстрату зменшується (див. табл. 2.4), тому дана операція стає економічно неефективною [28].
Отже, з усього вище сказаного можна зробити висновок, що оптимальна концентрація сахарози складає 300 г/л, в результаті отримуємо найбільший вихід декстрану (90,40 г/л або 30 %). Оптимальна тривалість культивування складає 18 годин. При подальшому збільшенні часу унеможливлюються операції виділення та очищення декстрану за рахунок підвищеної в’язкості речовини [28].
2.3 Обрахунок складу поживного середовища
Скласти базове поживне середовище для вирощування штаму L. mesenteroides PCSIR-4 – продуцента декстрану, якщо за 18 годин культивування концентрація декстрану в культуральній рідині становить 90,4 г/л, а концентрація біомаси 9 г/л [28].
Розрахунок вмісту в середовищі джерела вуглецевого живлення
Потреби для синтезу біомаси. Припустимо, що у біомасі міститься 50 % вуглецю. Таким чином, у 9 г біомаси вміст вуглецю становить 4,5 г. Розрахуємо кількість сахарози, необхідної для одержання 9 г/л біомаси. Молекулярна маса сахарози становить 270. Отже, у 270 г сахарози міститься 72 г вуглецю, тоді 4,5 г вуглецю буде міститися в:
С (С6Н22О11) = ![]() = 16,87 г
= 16,87 г
Враховуючи 40% втрат субстрату на «холосте окиснення» для одержання 9 г/л біомаси, необхідно внести:
С (С6Н22О11) = (16,87 * 0,4) + 16,87 = 23,62 г/л
Розрахунок вмісту в середовищі джерела азотного живлення
Потреби для синтезу біомаси. Припустимо, що в біомасі міститься 10 % азоту. Таким чином, у 9 г біомаси вміст азоту становить 0,9г. Пептон є джерелом органічного азоту, який засвоюється продуцентом декстрану. Концентрація доступного для бактерій органічного азоту (за елементом N) у пептоні становить 14 % [10]. Отже,
100 г пептону – 14 г N
Xn – 0,9 г N,
X = ![]() г пептону
г пептону
Розрахунок вмісту фосфору у середовищі
У біомасі міститься близько 3% фосфору (за елементом Р). Отже, для синтезу 9 г/л біомаси вміст фосфору у середовищі повинен становити (9 * 0,03 = 0,27 г/л). Розрахуємо кількість K2HPO4 , необхідного для одержання 9 г/л біомаси. Молекулярна маса K2HPO4 становить 174. Отже, у 174 г K2HPO4 міститься 31 г фосфору, тоді 0,27 г фосфору буде міститися у:
С (Р) = ![]() солі.
солі.
Для одержання 9 г/л біомаси вміст K2HPO4 у середовищі повинен становити 1,5 г солі [10].
Отже, компоненти поживного середовища:
Сахароза – 23,62 г/л
Пептон – 6,4 г/л
K2HPO4 – 1,5 г/л
2.4 Характеристика біологічного агента
Бактерії L. mesenteroides відносяться до групи грампозитивних коків. До цієї групи відносять істотно відрізняючі роди, які зібрані в одну групу на основі двох загальних ознак — сферична форма клітин і позитивна реакція по фарбуванню за Грамом. Ці бактерії не утворюють ендоспор. У більшості організмів цієї групи клітини сферичні і лише злегка овальні і майже завжди чітко грампозитивні. Рухливість нетипова. Роди розподіляються на підгрупи аеробних, факультативно анаеробних та строго анаеробних мікроорганізмів [12].
Рис. 2.1 Бактерії виду L. mesenteroides під електронним мікроскопом
Морфолого — культуральні ознаки
Дрібні коки, розташовані як поодинці і попарно (25%), так і у вигляді ланцюжків (75%) витягнутої форми довжиною 0,5 – 0,7 × 0,7 – 1,2 мкм. Іноді спостерігаються довгі ланцюжки із коротких паличок з заокругленими кінцями. Не утворюють спори та нерухливі. Ростуть досить повільно, утворюючи дрібні, іноді слизисті колонії на середовищах з сахарозою. При візуальному вивченні колоній, які виросли на поживному середовищі в термостаті при температурі 24°С і при використанні бінокулярної лупи при звичайному освітленні можна побачити колонії в S-формі не більше 2 мм в діаметрі, матові, зернисті, з рівними краями. Декстран візуально не визначається. При вивченні колоній в косопроходячому штучному освітленні (кут нахилу світлового променя 45°) з використанням бінокулярної лупи можна побачити, що колонії володіють оранжево-зеленим і голубим світінням [8, 12].
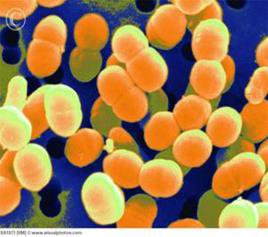
Рис. 2.2 L. mesenteroidesпід електронним мікроскопом: голубе світіння (зліва) та оранжево-зелене (справа)
Фізіолого — біохімічні ознаки біологічного агента
Факультативні анаероби, оптимальна концентрація розчиненого в середовищі кисню дорівнює 5% від повного насичення. За типом живлення — хемоорганотрофи з облігатною потребою в зброджувальнму вуглеводі, які потребують багатих поживних середовищ. Асимілюють амонійний азот. Штам не потребує вітамінів. Оптимальна температура росту штаму 24-250С і при рН середовища — від 6,2 до 7,2. Оптимум 7,0. Присутність каталази, цитохромів і тейхоєвих кислот у складі клітинної стінки — варіабельні ознаки. Бактерії даного роду є гетероферментативними, оскільки у процесі зброджування глюкози утворюється не тільки молочна кислота, а й етанол, оцтова кислота, СО2 [12, 28].
При культивуванні штаму на середовищах з глюкозою, декстран не утворюється. Синтез декстрану відбувається при вирощуванні продуцента на середовищах з сахарозою, при цьому відбувається виділення ферменту декстрансахарози, який каталізує відщеплення від сахарози молекул глюкози і наступний синтез декстрану з 1,6-глюкозидними зв’язками по одноланцюговому механізму без утворення проміжних з’єднань [28].
На сьогодні маємо такий таксономічний статус L. mesenteroides згідно з IX виданням Керівництва Бергі з систематики бактерій(фенотипова класифікація):
Царство – Procaryotae
Відділ – Firmicutes
Клас – Firmibacteria
Родина – Lactobacillaceae
Рід – Leuconostoc
Вид – Leuconostoc mesenteroides
Згідно з філогенетичною класифікацією Бергі даний вид бактерій відноситься до 17 групи, грампозитивні коки, яка в свою чергу поділяється на три підгрупи: 1) аеробні коки, 2) факультативні анаеробні або мікроаерофільні коки, 3) строго анаеробні коки. Мікроорганізми Leuconostoc mesenteroides відносяться до факультативних анаеробів [12].
Особливості метаболізму L. mesenteroides
Бактерії даного роду є гетероферментативними, оскільки у процесі зброджування глюкози утворюється не тільки молочна кислота, а й етанол, оцтова кислота, СО2. Зброджувальні вуглеводи в основному моно- і дисахариди. Дані бактерії здатні тільки до бродіння, вони не містять гемопротеїнів (цитохромів і каталази), аргінін не гідролізують, індол не утворюють, негемолітичні, нітрат не відновлюють. Ще однією особливістю цих бактерій є потреба в ростових факторах (фолієва кислота). Для даних бактерій є характерним гетероферментативне молочнокисле бродіння. Уних відсутні такі ферменти гліколізу, як альдолаза та триозофосфатізомераза. Початкове розщеплення глюкози у них відбувається лише за пентозофосфатним шляхом. Далі проходить процес гетероферментативного бродіння [12, 13].
РОЗДІЛ 3
ТЕХНІКО-ЕКОНОМІЧНЕ ОБГРУНТУВАННЯ
Декстран — вуглевод, який містить розгалужені ланцюги залишків глюкози, які являються продуктами життєдіяльності бактерій та грибів. Його використовують в якості лікарських засобів, особливо в якості розширювача обсягу плазми крові. Декстран знайшов промислового застосування в харчовій, фармацевтичній та хімічній промисловості як ад’ювант, емульгатор, носій і стабілізатор. У харчовій промисловості декстран в даний час використовується як загусник для варення і морозива. Він запобігає кристалізації цукру, покращує утримання вологи і підтримує аромат, і зовнішній вигляд різних продовольчих товарів [28].
3.1 Короткий огляд технологій виробництва декстрану
Першими технологіями отримання декстрану для медицини був кислотний гідроліз. В результаті утворювались багаточисленні біологічно активні побічні продукти, що не задовольняли вимогам безпеки медичних препаратів. Сучасні технології (біотехнологічні) отримання декстранів із середньою молекулярною масою 35 та 60 кДа в більшій мірі дозволені для використання в медичних цілях. За допомогою різних методів очистки, можна отримати чистий продукт, без будь-яких домішок [8].
Розглянемо більш детально виробничий процес отримання декстрану з використанням бактерій в якості продуцента основного продукту. В основу його виробництва закладений принцип розділення на функціональні блоки.
Розділяють етапи, які відповідають за синтез продукту (передферментаційний та ферментаційний) і його очистку [8].
Процес виробництва декстрану починається з приготування компонентів поживного середовища для вирощування батерій-продуцетів, які потім переносять у змішувач. Отримане поживне середовище передають на стерилізацію та охолодження.
Культивування продуцентів (Leuconostoc mesenteroides PCSIR-4) здійснюють до утворення полісахариду необхідної в’язкості (18 год) [8, 28].
Крім етапів синтезу продукту і їх очистки, технологія виробництва декстрану містить етап фракціонування.
Фракціонування декстранів на виробництві проводять з використанням спиртів, в основному метилового, як найбільш доступного.
На наступній стадії культуральну рідину пропускають через осаджувач для відокремлення декстрану від бактерій [8].
Далі відбувається процес фільтрації, що дозволяє відокремити біологічний матеріал. Наступна стадія – це розділення декстрану на окремі фракції з заданими характеристиками та очищення субстанції на іонообмінній колонці, після чого розчин піддають фінальній ультратонкій фільтрації і стабілізації (див. рис. 1) [8].
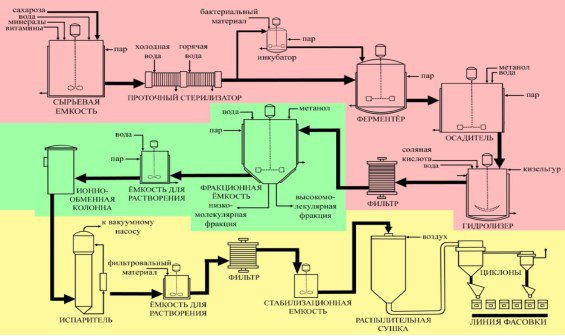
Рис. 3.1 Схема виробничої лінії отримання декстрану
Декстран являється лікарською речовиною у складі кровозамінників, які найбільш часто використовуються в стаціонарних умовах. Вони входять в схеми лікування захворювань різного ступеня тяжкості і в рецептурі клінік хірургічного і терапевтичного профілю, і складають близько 70 % [6, 12, 14].
На сьогоднішній день в Україні зареєстровано 122 торгові назви препаратів в формі перфузійних розчинів. Більше половини асортименту (52,46 %) складає продукція вітчизняних підприємств фармацевтичної промисловості [6, 12, 14].
За класифікацією АТС Реополіглюкін відноситься до групи кровозамінників та білкових фракцій плазми крові (В05АА). В даній групі нараховано 29 торгових назв препаратів.
Реополіглюкін можна віднести до життєво необхідних препаратів, адже цей кровозамінник використовується при таких захворюваннях як: тромбоз, ендартериїт, хвороба Рейно, тромбофлебіт, профілактика та лікування травматичного, операційного, опікового та токсичного шоків, під час судинних та пластичних операціях та операціях на серці. Якщо вчасно не застосувати розчин кровозамінника, половина хворих закінчують своє життя летально [7, 18].
3.2 Розрахунок потужності виробництва декстрану
Станом на 1 червня 2014 року населення України складає майже 43 млн. людей.
Таблиця 3.1 Статистика захворюваності в Україні[1, 3, 5, 15, 18]
| Назва захворювання | Коротка характеристика | Статистичні дані, % | Перерахунок на кількість населення, чол. | Дозування, мл (г) |
| Тромбоз | Процес зажиттєвого утворення згустків крові — тромбів — у кровоносних судинах або в порожнинах серця людини | 3 | 1 290 000 | 400 мл (40 г декстрану) |
| Ендартериїт | Системна хвороба артерій | 8 | 3 440 000 | 400 мл (40 г декстрану) |
Продовження табл. 3.1
| Хвороба Рейно | Розлад, що викликає сильне звуження кровоносних судин шкірних покривів, яке відбувається у людини як наслідок сильного стресу або дії холоду. | 4 | 1 720 000 | 400 мл (40 г декстрану) |
| Тромбофлебіт | Запалення стінки вени із закупоркою вени згустком крові (тромбом). | 16 | 6 880 000 | 400 мл (40 г декстрану) |
| Травматични й операційний, опіковий, токсичний шок | – | 3 | 1 290 000 | 600 мл (60 г декстрану) |
| Судинні та пластичні операції | – | – | 12 000 | 1000 мл (90 г декстрану) |
| Операції на серці | – | – | 17 000 | 1000 мл (90 г декстрану) |
Загальна кількість українців, які потребують лікування розчинами кровозамінників складає 14 649 000 людей (34 %). Реополіглюкін займає приблизно 10 % усіх кровозамінників на ринку України. Тому кількість населення, яка потребує саме Реополіглюкін така:
14 649 000 × 0,1 = 1 464 900 чол.
В Україні зареєстровано 4 підприємства, які виготовляють даний лікарський засіб: «Новофарм – Біосинтез», «Юрія – Фарм», ООО «Ніко», «Фармація» [6].
Представлені вище підприємства не мають власного виробництва субстанції (декстран) для виготовлення Реополіглюкіну, вони купують її за кордоном, а саме в Словаччині та Данії [14].
Тому ми пропонуємо розпочати його повне виробництво, починаючи із біосинтезу декстрану і до готового препарату в аптеках.
Проектом передбачено забезпечення субстанцією і препаратом 50% фармацевтичного ринку України та аналогічну кількість в країни близького зарубіжжя.
Продуцентом декстрану є штам бактерій Leuconostoc mesenteroides PCSIR-4, продуктивність яких складає 90,4 г/л, а час культивування – 18 годин [28].
Порахуємо необхідну кількість декстрану на рік:
1л – 90,4 г
1 382 900 л – х г
х = 125 000 (кг)
Загальна кількість культуральної рідини:
125 000 кг × 1 л / 90,4 г/л = 1382 м3/рік.
Врахуємо 20% втрат:
1382 м3 × 120% / 100% = 1658 м3/рік.
Припустимо, що час підготовки процесу стерилізації складає 8 годин, тоді загальний цикл ферментації цикл буде складати:
8 + 18 = 26 годин.
Нехай кількість робочих днів (з урахуванням простою) складає 336 днів (8064 годин). Враховуючи кількість часу на один цикл, порахуємо кількість циклів в рік:
7920 / 26 = 310 циклів.
Кількість культуральної рідини за один цикл складатиме:
1658 м3 / 310 = 6,373 м3
Отже, враховуючи вище викладені розрахунки, річна потужність підприємства буде сягати 1658 м3 культуральної рідини. Кількість робочих днів – 336. За цей час буде відбуватися 310 ферментацій у ферментері об’ємом 10 м3 з коефіцієнтом заповнення 0,7.
3.3 Розрахунок кількості стадій підготовки посівного матеріалу
Перед тим як засіяти поживне середовище мікроорганізмами його попередньо потрібно приготувати та простерилізувати. Це є важливий та відповідальний процес, оскільки від цього залежить якість посівного матеріалу та відповідно кількість продукту біосинтезу.
Компоненти поживного середовища (г/л) [10]:
Сахароза – 300
Дріжджовий екстракт – 5
Пептон – 5
K2HPO4 – 15
NaCl – 0,01
MgSO4×7H2O – 0,01
MnCl2×H2O – 0,01
CaCl2 – 0,05
Отже, при об’ємі ферментера 10 м3, об’єм середовища складатиме (10 * 0,6) 6 м3, оскільки коефіцієнт заповнення (К) дорівнює 0,6 від об’єму ферментера. Оскільки кількість посівного матеріалу складає 10%, то об’єм інокуляту складає (6 * 0,1) 0,6 м3. Враховуючи усі представлені дані ми матимемо 5 стадій підготовки посівного матеріалу:
I стадія – Vінок = 0,6 дм3,
II стадія – Vінок 1 = 6 дм3,
III стадія – Vінок 2 = 60 дм3,
IV стадія – Vінок 3 = 600 дм3,
V стадія – Vінок 4 = 6000 дм3
РОЗДІЛ 4
БІОСИНТЕЗ ЦІЛЬОВОГО ПРОДУКТУ
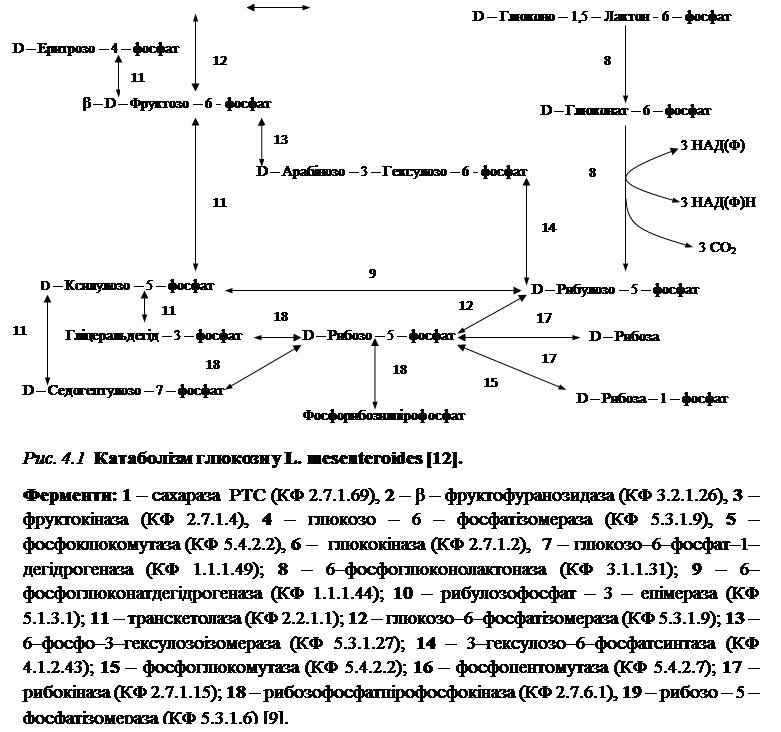
4.1 Шляхи катаболізму сахарози у L. mesenteroides PCSIR-4
Джерелом вуглецю та енергії (ростовим субстратом) у поживному середовищі (див. п. 1) для біосинтезу декстрану є сахароза [12, 28].
За Kyoto Encyclopedia of Genes and Genomes сахароза розщеплюється наступним шляхом:
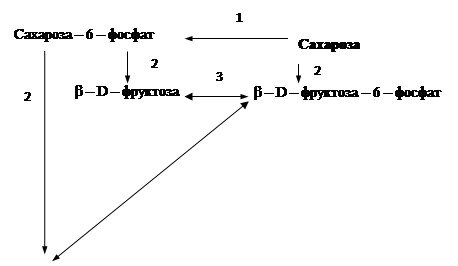
1. З сахарози утворюється сахароза-6-фосфат (фермент сахараза РТС (КФ 2.7.1.69)) [21].
2. Наступним є перетворення сахароза – 6 – фосфат на β – D – фруктозу (фермент – β-фруктофуранозидаза (КФ 3.2.1.26)). В свою чергу β-D-фруктоза розщеплюється за допомогою фруктокінази (КФ 2.7.1.4) до β- D- фруктози- 6- фосфат та α- D- глюкозо- 6- фосфат , яка в свою чергу перетворюється на α- D- Глюкозо-1-фосфат (ферменти 5 – глюкозо-6-фосфатізомераза (КФ 5.3.1.9), 6 – фосфоклюкомутаза (КФ 5.4.2.2)) [21].
Згідно Kyoto Encyclopedia of Genes and Genomes катаболізм сахарози представлений на прикладі штаму L. mesenteroides. Оскільки у біосинтезі бактерій L. mesenteroides не виявлено ключового ферменту гліколізу, то розщеплення глюкози у них відбувається за пентозофосфатним циклом. Також бактерії L. mesenteroides до гетероферментативних молочнокислих бактерій, у яких розщеплення субстрату відбувається лише за пентозофосфатним циклом [21].
У пентозофосфатному циклі α-D-глюкозо-1-фосфат перетворюється на D-глюконо-1,5-лактон-6-фосфат (фермент глюкозо-6-фосфатдегідрогеназа (КФ 1.1.1.49)). Далі D-глюконо-1,5-лактон-6-фосфат під дією ферменту 6-фосфоглюконолактоназа (КФ 3.1.1.31) перетворюється на D-глюконат-6-фосфат, який окиснюється до D-рибулозо-5-фосфат (фермент 6-фосфоглюконатдегідрогеназа (КФ 1.1.1.44)). В свою чергу D-рибулозо-5-фосфат окиснюється до D-рибозо-5-фосфат. На даному етапі схема розгалужується. За допомогою ферментів фосфоглюкомутази (КФ 5.4.2.2); фосфопентомутази (КФ 5.4.2.7); рибокінази (КФ 2.7.1.15) D-рибозо-5-фосфат може перетворитися на D-рибозу, D-рибозу-1-фосфат, а за участю ферменту рибозофосфатпірофосфокінази (КФ 2.7.6.1) на фосфорибозилпірофосфат [12, 27].
D-рибулозо-5-фосфат під дією ферменту рибулозофосфат-3-епімерази (КФ 5.1.3.1) перетворюється на D-ксилулозо-5-фосфат, останній продукт реакції каталізується транскетолазою і розщеплюється з утворенням гліцеральдегідфосфату та D-седогептулозо-7-фосфат. На даному етапі закінчуються окиснювальні процеси пентозофосфатного циклу [12, 27].
Наступні реакції є реакціями перетворення пентозофосфатів на гексозофосфати, та навпаки. D- ксилулозо-5-фосфат перетворюється на β-D-фруктозо-6-фосфат з якої утворюється α-D-глюкозо-6-фосфат (фермент глюкозо-6-фосфатізомераза (КФ 5.3.1.9)) і цикл замикається [12, 27].
Схема катаболізму сахарози за пентозофосфатним циклом представлена на рис. 4.1.
|
|
|
 | |||
 | |||
![]()
|
|
4.2 Біотрансформація декстрану у L. mesenteroides PCSIR-4 з сахарози
Декстран належить до групи гомополісахаридів, що складається з мономерів глюкози, пов’язаних в основному (95 %) α – 1-6 зв’язками, рідше α – 1-2 та α – 1-3 зв’язками. Він являє собою полімер D-глюкози з високою молекулярною масою [26].
|
|
|
|
 | |||||||||||||
 | |||||||||||||
РОЗДІЛ 5
ОБГРУНТУВАННЯ ВИБОРУ ТЕХНОЛОГІЧНОЇ СХЕМИ
5.1 Обгрунтування доферментаційних процесів та виробничого біосинтезу
5.1.1 Обгрунтування необхідності підготовки персоналу
Організація та функціонування фармацевтичної галузі головним чином залежить від кваліфікованого персоналу. Для того, щоб підприємство виготовляло якісні лікарські засоби, кожен працівник повинен мати спеціальну, вищу освіту та достатній кваліфікаційний рівень. На підприємстві повинна бути достатня кількість персоналу і кожен з них повинен виконувати свої певні обов’язки [9].
Роботодавець повинен забезпечити персоналу навчання відповідно на місці роботи. Воно включає в себе вивчення головних правил та принципів «Належної Виробничої Практики» (GMP), а також навчання для досягнення певного кваліфікаційного рівня. Особливу увагу приділяють робітникам, які працюють в чистих приміщеннях, адже в таких зонах виготовляються стерильні лікарські засоби [9].
Персонал, який працює з сильнодіючими, токсичними, інфікуючими, сенсибілізуючими речовинами, а також мікроорганізмами, повинен проходити додаткове, спеціальне навчання. Перевірку кваліфікаційного рівня персонал проходить один раз на рік.
Велика увага приділяється здоров’ю та гігієні персоналу. Кожен працівник повинен бути ознайомлений з методиками, що стосуються здоров’ю та дотримання гігієнічних правил і безпосередньо дотримуватися їх. Головним правилом є медичне обстеження перед прийомом на роботу та один раз на рік в подальшому [9].
Слід постійно звертати увагу на санітарний стан персоналу, адже люди – це головне джерело забруднення лікарських засобів мікрочасточками та мікроорганізмами. Найбільша їх кількість виділяється з волосся, шкіри та верхніх дихальних шляхів. Тому кожен робітник повинен бути проінформований про правила безпеки та поведінки на підприємстві.
Повинні бути сформовані відповідні методики за якими персонал миється та переодягається. Кожна особа, яка входить і виробничі зони, повинна носити захисний одяг, що відповідає виконуваним нею операціям.
Слід уникати прямого контакту між руками оператора і продукцією, для забезпечення повної стерильності [9].
Необхідно, щоб одяг і його якість відповідали процесу і класу робочої зони, для уникнення контамінації. Робочий одяг за правилами GMP необхідно змінювати один раз на день, а маску раз на дві години.
|
|
|
![]()
![]()
![]() Прання
Прання
5.1.2 Обгрунтування необхідності підготовки чистих приміщень
Полісахарид декстран є діючою речовиною кровозамінника Реополіглюкіна. Враховуючи те, що в даному курсовому проекті розглядаються доферментаційні та ферментаційні процеси, то ці операції будуть проходити у класифікованих приміщеннях [20].
Середовище приміщення повинно представляти мінімальний ризик у плані контамінації вихідної сировини, матеріалів. Приміщення повинні бути спроектовані і оснащені таким чином, щоб забезпечувати максимальний захист від контамінації. Їхнє об’ємно-планувальне рішення і розташування устаткування повинні відповідати вимогам державних будівельних норм (ДБН) і інших законодавчих актів України. Приміщення повинні бути розташовані таким чином, щоб виробництво протікало логічно у відповідності з порядком технологічних операцій [9].
Внутрішні фізичні фактори (температура, вологість тощо) повинні бути відповідними і не впливати негативно на проведення усіх стадій ферментації та на сам персонал.
Внутрішні поверхні (стіни, підлога, стеля) повинні бути гладенькі, без щілин і тріщин на стиках, а супряження стін між собою і стін з стелею повинно мати закруглення радіусом 300мм. Стіни «чистих» приміщень покривають пластмасами або емалями. Легко та ефективно очищатися, дезінфікуватися. З них не повинні виділятися часточки. Стеля має бути герметизована задля запобігання виділяння часточок. На підлозі має бути простелений лінолеум або наливна композитна підлога [9].
Також необхідно застосовувати правила безпечного ведення процесу по культивуванню продуцента:
1. Для попередження витоку культуральної рідини, у разі розгерметизації ферментера, підлога повинна бути нижчою на 10 см, ніж оточуючого середовища.
2. Всі стоки, промивні води з ферментерів повинні поступати у окрему ємність та проходити етап знезараження.
3. Викиди технологічного повітря з ферментера повинні проходити очищення на стерилізаційних фільтрах з діаметром пор менше 0,3 мкм (наприклад, фільтри фірми Pall).
4. Всі вузли подачі середовища у ферментер, вентилі, комунікації повинні знаходитися під паровим захистом, що попередить витік продуцента назовні ферментера та надходження контамінуючої мікрофлори у ферментер.
Після завершення робіт приміщення слід обробити дезінфікуючими засобами і УФ-випромінюванням.
Дотримання цих заходів дозволяє виготовляти якісні та безпечні лікарські засоби.
5.1.3 Обгрунтування необхідності підготовки вентиляційного повітря
Лікарські засоби виготовляються у чистих, класифікованих приміщеннях. Для забезпечення повної стерильності чистих зон, за правилами GMP, необхідна підготовка вентиляційного повітря, що забезпечить якість та безпеку готової продукції.
Для очистки повітря, що подається у класифіковані приміщення використовують методи фільтрування.
Система для очистки вентиляційного повітря є ступінчастою і має три ступені очистки:
1. Стадія грубого очищення – після забору, повітря потрапляє на фільтр грубої очистки. В якості фільтра грубої очистки використовують механічні фільтри. У таких фільтрах застосовують металізовані сітки у вигляді гофрованих листів. Ступінь його очищення складає 80%;
2. Кондиціонування повітря – даний процес проходить у теплообміннику, де відбувається стабілізація усіх термодинамічних показників;
3. Стадія тонкого очищення – на даній стадії повітря очищається на фільтрах із багатошарового мікроволокна. В якості матеріалу будемо використовувати скловолокно.
4. НЕРА фільтр (Н12) – фільтр надтонкого очищення повітря. Даний фільтр має ряд переваг: велика пилоємність, високоякісне очищення повітря, висока продуктивність, використання пожежобезпечного матеріалу (скловолокно). Ефективність такого фільтра складає 99,995% за розмірами частинок від 0,3 мкм [9].
5.1.4 Обгрунтування необхідності підготовки ферментаційного обладнання
Обладнання – це одне із основних частин фармацевтичного підприємства, яке може нести небезпеку забруднення сировини, адже з ним безпосередньо контактують усі компоненти поживного середовища та кінцевий продукт. Тому задля уникнення ризику контамінації та механічного забруднення сировини необхідно застосовувати методи очищення. Також для забезпечення повної стерильності та безпечності, обладнання повинно відповідати наступним вимогам:
· Експлуатуватися відповідно до свого призначення;
· Легко і ретельно очищатися;
· Розміщатися таким чином, щоб не допускатися ризику контамінації;
· Матеріал, з якого виготовлене обладнання не повинно будь-яким чином контактувати з продуктами.
|
![]()
![]() Миття та ополіскування
Миття та ополіскування
|
Ми пропонуємо використовувати такий спосіб миття обладнання, як СІР-модулі.
СІР-модулі — принцип дії цих систем полягає у тому, що мийні розчини під великим тиском подають на спеціальні розбризкувальні головки, що є нерухомими або обертаються. Завдяки високому напору мікроструменів відбувається ретельне очищення ферментаційного обладнання. Після очищення на головки подають водопровідну воду для ополіскування. Використання СІР-модулів дає змогу швидко очищувати біореактори й економити мийні засоби та воду для ополіскування [14].

Рис. 5.1 СІР-станція
Стерилізацію обладнання будемо проводити за допомогою подачі гострої пари в середину обладнання і дезінфекції труб та ємностей. Даний вид стерилізації забезпечує 100 % стерильності.
5.1.5 Обгрунтування способу культивування і типу ферментера
Вибір способу проведення біосинтезу відіграє важливу роль в процесі росту мікроорганізмів. Наявні різні способи культивування: глибинне, поверхневе, періодичне, безперервне [12, 13].
До промислових способів культивування мікроорганізмів належать періодичне, безперервне культивування та культивування іммобілізованих клітин.
Глибинне культивування мікроорганізмів має ряд очевидних переваг перед поверхневим, оскільки дозволяє значно скоротити виробничі площі, виключити важку непродуктивну ручну працю, покращити гігієну праці, спрощує механізацію та автоматизацію виробництва, робить можливим перехід на безперервний спосіб культивування. При глибинному способі культивування раціональніше використовуються поживні речовини середовищ, що дають можливість значно скоротити відходи виробництва у вигляді нерозчинних осадів твердого поживного середовища, отримувати препарати з меншим вмістом домішок і більшою питомою активністю. Глибинне культивування проводять у вертикальних герметичних ємностях різного розміру, що називаються ферментаторами [12, 13].
Отже, культивування L. mesenteroides PCSIR-4 проводимо глибинним, періодичним методом. Тому, що цей мікрорганізм росте на рідкому поживному середовищі, потребує постійної аерації, частого технологічного контролю, також за глибинного методу культивування економляться виробничі площі [28].
Для періодичного культивування L. mesenteroides найефективнішим являється ферментер з механічним перемішуванням барботажного типу в асептичному виконанні.
Адже основною перевагою механічного перемішування є можливість досягти інтенсифікації масообмінних процесів. Це дасть змогу забезпечити рівномірний розподіл мікроорганізмів та компонентів поживного середовища в об’ємі апарату, ефективно постачати клітини повітрям, що подається в апарат через барботер [13].
Для перемішування обираємо турбінну мішалку, оскільки турбінні мішалки забезпечують інтенсивне перемішування у всьому об’ємі апарата. Потужність, що споживається турбінними мішалками, які працюють в апаратах з відбивними перегородками, при турбулентному режимі перемішування практично не залежить від в'язкості середовища. Тому мішалки цього типу можуть застосовуватися для сумішей, в'язкість яких під час перемішування змінюється. Також в середині ферментера має бути встановлена труба з нержавіючої сталі для подачі в неї гострої пари, для стерилізації поживного середовища [13].
Проведення культивування L. mesenteroides передбачає забезпечення інтенсивного перемішування та аерації середовища. Застосування відкритої турбінної мішалки розташованої над барботером забезпечує високий рівень диспергування повітря, сприяє збільшенню поверхні контакту фаз та коефіцієнту масопередачі. Запропонований апарат має високі масообмінні характеристики по кисню, в ньому легко можна варіювати режими перемішування та масообміну.
5.1.6 Обгрунтування вибору стадії підготовки повітря
Повітря являється постачальником мікрофлори та часточок, тому перед процесом аерації (при культивуванні мікрооргазмів-продуцентів) повітря повинно пройти очистку за допомогою фільтрів від різного виду забруднень. Адже навіть незначний вміст посторонньої мікрофлори в повітрі може призвести до інфікування поживного середовища і різкого зменшення виходу продукту [9].
Підготовка технологічного повітря є трьохступенева:
1. Очищення повітря на фільтрах грубої очистки – для попередньої очистки повітря від грубого пилу використовують чарункові фільтри, заповнені різним фільтруючим матеріалом: рулонні з ультратонким скловолокном, панельні регенеруємі, рулонні з пінополіуретаном та ін. Найбільш ефективні є безмасляні фільтри із кераміки, скла, пластмаси. Такі фільтри мають контролюєму структуру, вони хімічно інертні, легко очищаються, володіють високою міцністю, дешеві та прості при виготовленні і обслуговуванні. Тому для грубої очистки повітря будемо використовувати фільтр з керамічним пористим фільтруючим блоком. Ефективність такого фільтра складає 90% за частинками розміром 50 – 100 мкм [4].
2. Очищення повітря в головному фільтрі – для глибинної очистки повітря широко використовують глибинні фільтри, які представляють собою металеву ємність, забезпечену сорочкою, з перфорованими решітками в середині. Між решітками встановлюється волокнистий фільтруючий матеріал (зокрема базальтове волокно, скловолокно). В якості волокнистого матеріалу пропонуємо використання базальтового волокна висотою шару 6 см. Ефективність очистки повітря на таких фільтрах є високою, тривалість використання фільтруючого матеріалу не менше 1 року без необхідності заміни. Ефективність складає 96 % за частинками 1 – 50 мкм [4].
3. Очищення повітря в індивідуальному фільтрі – необхідна ступінь біологічної очистки повітря може бути досягнута при використанні в якості фільтруючого матеріалу пористих фторопластових пластин, дисків або втулок товщиною 4 мм, отриманих із порошку методом спікання. В якості індивідуального фільтру будемо використовувати фторопластові фільтри, ефективність яких складає 99,999% за частинками 0,5 – 1 мкм.
5.1.7 Вибір мийних та дезінфікуючих засобів
Санітарна підготовка виробництва є одним з головних заходів боротьби з мікробною контамінацією та забезпечення асептичних умов на підприємстві.
Приміщення слід прибирати та дезінфікувати відповідно до докладних письмових методик. Миючі і дезінфікуючі засоби необхідно контролювати щодо мікробіологічної чистоти [9].
При проведенні дезінфекції об’єкта (поверхні приміщення, технологічне обладнання, комунікації, прибиральний інвентар тощо) найчастіше використовують хімічні, рідше фізичні й механічні засоби. Сучасні вимоги до дезінфекційних речовин включають:
· широкий спектр антимікробної дії;
· бактерицидний ефект;
· добру розчинність у воді;
· відсутність пошкоджуючої дії на оброблювані об'єкти;
· низьку токсичність і алергенність.
При виборі дезінфікуючого засобу необхідно враховувати не тільки його бактерицидні властивості і спектр дії, але і можливу токсичність для людини. Тривале використання будь-якого дезінфікуючого засобу приводить до утворення стійких штамів. Тому дезінфікуючий засіб повинен змінюватися через кожні 14 днів [9].
5.1.7.1 Дезінфікуючі засоби для обробки рук персоналу
Антисептичні засоби повинні забезпечувати знищення патогенних та сапрофітних мікроорганізмів на шкірі рук персоналу. Для використання персоналом було обрано засіб для дезінфекції рук – «Стерилліум». Адже з усіх представлених на ринку дезінфікуючих засобів, лише цей має дію проти широкого спектру мікроорганізмів [46].
Таблиця 5.1 Характеристика дезінфікуючого засобу
| Назва засобу | Склад | Призначення | Фізико-хімічні властивості | Вплив на організм | Ціна грн./л (кг) |
| «Стерилліум» | 2-пропанолу, | гігієнічна та хірургічна антисептична обробка шкіри рук | прозорий розчин блакитного кольору із запахом спирту, густина — приблизно 0,85 г/см3, в’язкість — біля 3мПа·с, рН — нейтральне | належить до 3 класу помірно небезпечних речовин | 154 |
«Стерилліум» — спиртовий антисептик для рук (засіб застосовується для гігієнічної дезінфекції (деконтамінації) шкіри рук медичного персоналу, персоналу аптек та підприємств фармацевтичної, мікробіологічної, парфюмерно-косметичної, харчопереробної промисловості, готелів, перукарень, косметологічних клінік та салонів [46].
Властивості розчину:
ü Бактерицидні (включаючи збудників туберкульозу),
ü Віруліцидні (включаючи збудників гепатитів, ВІЛ, кишкових вірусних інфекцій),
ü Фунгіцидні (включаючи збудників кандидозів та дерматомікозів, плісняві гриби).
ü Засіб не пошкоджує об’єкти, що виготовлені із металів, скла, гуми, полімерних матеріалів, дерева, кахлю, порцеляни, фаянсу.
ü Не фіксує білкові забруднення на поверхні виробів медичного призначення, добре змочує поверхні.
ü Швидко висихає, при цьому не залишає нальоту [46].
5.1.7.2 Дезінфікуючі засоби для обробки поверхонь обладнання
«Дезосепт» — комбінований препарат для дезінфекції різних видів технологічного обладнання [48].
Таблиця 5.2 Характеристика дезінфікуючого засобу
| Назва засобу | Склад | Призначення | Фізико-хімічні властивості | Вплив на організм | Ціна грн./л (кг) |
| «Дезосепт» | надоцтова кислота 15–20%, пероксид водню 15–25%, оцтова кислота 15– 25%. | дезінфекція технологічного обладнання | випускається у формі водного розчину | належить до 3 класу помірно небезпечних речовин | 33 |
Суттєві переваги препарату:
- широкий спектр антимікробної дії: препарат має високу бактерицидну, туберкулоцидну, віруліцидну, спороцидну та фунгіцидну дію;
- сильна біоцидна та спороцидна дія завдяки високій окислюючій здатності надоцтової кислоти;
- відсутність ефекту призвичаєння мікроорганізмів до препарату;
- швидкість і надійність мікробіологічної дії внаслідок специфічної високої швидкості дифузії надоцтової кислоти через кліткову мембрану;
- препарат не викликає осадження білків;
- препарат добре розчиняється у воді, розчини препарату не піняться;
- широкий температурний інтервал застосування, в тому числі при низьких температурах;
- низькі концентрації робочого розчину препарату та низькі температури застосування;
- препарат на поверхні обладнання розкладається на нешкідливі продукти;
- залишки препарату легко та швидко змиваються водою;
- продукти розкладу надоцтової кислоти — оцтова кислота, вода, кисень – не токсичні та не шкідливі і не забруднюють навколишнього середовища [48].
«Полідез» – високоефективний дезінфікуючий засіб для дезінфекції різних типів технологічного обладнання, інвентарю, тари [49].
Таблиця 5.3 Характеристика розчину «Полідез»
| Назва засобу | Склад | Призначення | Фізико-хімічні властивості | Вплив на організм | Ціна грн./л (кг) |
| «Полідез» | полігексаметиленгуанідин гідрохлорид, алкілдиметилбензиламоній гідрохлорид, коректор рН, барвник, ароматизатор | дезінфекція технологічного обладнання | випускається у формі водного розчину | відповідає 4 класу малонебезпечних речовин | 120 |
Переваги препарату:
· Препарат не токсичний;
· Має широкий спектр дії і високу біологічну активність;
· Надає надійну дію при наявності білка, сироватки, крові;
· Активність препарату мало змінюється під впливом різних умов зовнішнього середовища;
· Не має запаху;
· Не леткий (дозволяє проводить дезінфекцію в присутності людей, а обслуговуючому персоналу при роботі з робочими розчинами не застосовувати традиційних засобів індивідуального захисту очей та слизових оболонок);
· Не агресивний до всіх матеріалів (не знебарвлює тканини, не викликає корозію, не ушкоджує полімерні, латексні й інші матеріали);
· Добре розчинний у воді;
· Не володіє алергенними, шкірно-дратівливими і шкірно-резорбтивними властивостями;
· Не має побічних ефектів.
· Висока бактерицидна активність [49];
5.1.7.3 Дезінфікуючі засоби для обробки поверхонь приміщень
«Хлорантоін» — хлорактивний, багатокомпонентний, поліфункціональний дезінфекційний засіб з мийним ефектом [47].
Таблиця 5.4 Характеристика дезінфікуючого засобу
| Назва засобу | Склад | Призначення | Фізико-хімічні властивості | Вплив на організм | Ціна грн./л (кг) |
| «Хлорантоін» | Дихлорантин, диметилгідантоїн , натрій триполіфосфат, аніонні поверхнево-активні речовини ; натрій бензоат; наповнювач | для профілактики на підприємствах фармацевтичної, мікробіологічної, парфюмерно-косметичної, харчової промисловості | Сипкий порошок світлих тонів з помірним запахом хлору | належить до помірно небезпечних речовин | 150 |
Переваги розчину:
Ø Широкий спектр антимікробної дії;
Ø мають високу бактерицидну, віруліцидну, спороцидну та фунгіцидну дію;
Ø відсутність ефекту призвичаєння мікроорганізмів до препарату;
Ø швидкість і надійність мікробіологічної дії;
Ø добре розчинні у воді;
Ø не піняться;
Ø широкий температурний інтервал;
Ø залишки препаратів легко та швидко змиваються водою;
Ø не токсичні та не шкідливі;
Ø не забруднюють навколишнє середовище [47].
«Неохлор» — це концентрований хлорактивний засіб, багатокомпонентний препарат, для дезінфекції та санітарної обробки, що містить також миючий засіб, ароматизатор, інгібітор корозії і стабілізатор вмісту активного хлору [45].
Активно діюча речовина — гіпохлорит натрію (початкова концентрація активного хлору 7–9%) [45].
Таблиця 5.5 Характеристика препарату «Неохлор»
| Назва засобу | Склад | Призначення | Фізико-хімічні властивості | Вплив на організм | Ціна грн./л (кг) |
| «Неохлор» | гіпохлорит натрію, миючі, антикорозійні, стабілізуючі і ароматизуючі добавки. | для знезараження поверхонь приміщень | випускається у вигляді рідкого концентрату жовтуватого кольору з характерним запахом хлору і ароматизатора. | належить до речовин ІІІ класу небезпеки (помірно небезпечні речовини) | 29 |
Основні переваги препарату:
• поєднання дезінфікуючої, миючої і дезодоруючої дії;
• відсутність необхідності в застосуванні активаторів;
• пожежо-вибухобезпечність препарату і робочих розчинів;
• знижена, порівняно із звичайними хлорактивними препаратами, корозійна дія;
• просте і швидке приготування робочих розчинів шляхом розведення концентрату питною водою;
• економічність, зумовлена порівняно невисокою ціною, низькими концентраціями і питомою витратою робочих розчинів;
• загальнодоступність засобів контролю вмісту активно діючої речовини в концентраті, робочих розчинах і на оброблених поверхнях;
• універсальність в застосуванні [45].
Представлені розчини відповідають усім вимогам до дезінфікуючих засобів. Найголовніше те, що вони не шкодять здоров’ю людини та відносно дешеві і зручні у використанні. Не потребують додаткових зусиль у приготуванні та використанні.
5.2 Особливості підготовки та стерилізації поживного середовища
Після того як ми визначили кількість стадій підготовки посівного матеріалу, нам потрібно визначити скільки композицій (розчинів) ми матимемо для стерилізації. Даний процес потрібен тому, що в поживному середовищі знаходяться речовини, параметри стерилізації яких відрізняються (температура, тиск та час стерилізації) [13].
Сахароза при високій температурі може карамелізуватися, оскільки це є термолабільний компонент. Тому сахарозу, дріжджовий екстракт та пептон стерилізуємо разом при температурі 1120С протягом 30 хвилин.
Фосфорні та основні солі стерилізуємо окремо для запобігання випадання осаду. Параметри стерилізації такі: Т = 1310С протягом 40 хвилин [13].
Таблиця. 3.1 Кількість композицій та умови їх стерилізації
| Компоненти | Композиції | Умови стерилізації |
| Сахароза | А | Т = 1120С, τ = 30 хв. |
| дріжджовий екстракт | ||
| пептон | ||
| K2HPO4 | Б | Т = 1310С, τ = 40 хв. |
| NaCl | В | Т = 1310С, τ = 40 хв. |
| MgSO4×7H2O | ||
| MnCl2×H2O | ||
| CaCl2 |
Отже, виходячи з табл. 3.1, ми матимемо три композиції для стерилізації, які відповідно мають різні умови стерилізації.
Приготування і стерилізація розчину сахарози для дробного внесення в поживнесередовище
В процесі біосинтезу сахарозу вносимо дробно – 300 г/л починаючи з 10-ї години культивування. Постійно підтримували концентрацію сахарози у культуральній рідині 9 г/л.
На початку процесу біосинтезу в поживне середовище ми внесли 40 г/л сахарози. Залишилось – 260 г/л. Отже, 260 : 40 = 7 разів ще потрібно внести сахарозу. Так, як тривалість процесу біосинтезу декстрану бактеріями L. mesenteroides PCSIR-4 18 годин: (18 – 10) : 7 = 1 година, тобто через кожну годину потрібно вносити 40 г/л сахарози в поживне середовище.
5.3 Обгрунтування стадій виділення та очищення цільового продукту
Після закінчення процесу культивування (18 год) та накопичення цільового продукту для можливості використання декстрану у фармацевтичній галузі, а саме в якості замінника плазми крові, необхідно провести такі технологічні процеси, як виділення та очищення ЕПС. Даний полісахарид являється позаклітинним продуктом бактерій штаму Leuconostoc mesenteroides PCSIR-4, тому немає необхідності проводити дезінтеграцію клітин.
Проаналізувавши особливості технологічного процесу, ми матимемо такі стадії:
1. Розбавлення водою культуральної рідини;
2. Центрифугування;
3. Осадження;
4. Фільтрування;
5. Розбавлення водою;
6. Деструкція ЕПС;
7. Нейтралізація кислоти;
8. Ультрафільтрація розчину (до 10 000 кДа);
Обгрунтування вибору всіх технологічних процесів наведено нижче по тексту [20, 22-27, 31, 33, 34].
5.3.1 Обгрунтування необхідності попередньої обробки культуральної рідини
Культуральна рідина, що містить у своєму складі декстран представляє собою високов’язку рідину, на що впливають умови культивування бактерій.
Таблиця 5.5 Залежність в’язкості продукту від часу та його виходу
| L. mesenteroides PCSIR-4 | ||
| Час культивування | Кількість декстрану, (г/л) | В’язкість, (сСт) |
| 8 | 36,80 | 23,15 |
| 18 | 90,40 | 20,64 |
| 20 | 34,00 | 18,72 |
| 25 | 39,60 | 25,08 |
Максимальна кількість полісахариду накопичується після 18 годин культивування, далі кількість продукту поступово зменшується, а в’язкість збільшується, що свідчить про високу молекулярну масу речовини. В’язкість декстрану, який утворюється за 18 годин є оптимальною для того, щоб його можна було виділити та очистити. При подальшому збільшенні тривалості культивування спостерігається суттєве підвищення в’язкості декстрану до 25-27 сСт, що суттєво ускладнить процеси його подальшого оброблення. Також за цей час накопичується найбільша кількість продукту [28].
Виходячи з цього, необхідно розбавляти культуральну рідину водою, задля зменшення її в’язкості та полегшення подальшого процесу виділення ЕПС.
5.3.2 Обгрунтування вибору способу відділення біомаси та відповідного обладнання
Першою стадією у процесі виділення декстрану є процес відділення біомаси (L. mesenteroides PCSIR-4) від культуральної рідини та отримання супернатанту, що містить готовий продукт ЕПС.
В літературних даних представлено декілька способів отримання супернатанту: фільтрування, сепарування, центрифугування. Але за представленими недоліками ми не можемо використовувати деякі способи відділення бактеріальних клітин [25-27, 31].
Отже, ми маємо такі недоліки в процесах фільтрування та сепарування:
1. Культуральна рідина є достатньо в’язкою, навіть після розбавлення водою, що ускладнює процес фільтрування.
2. Процес фільтрування не забезпечить повне очищення культуральної рідини від бактеріальної мікрофлори.
3. Фільтрування є громіздкий процес за рахунок додаткових процесів оброблення культуральної рідини.
4. Виробництво декстрану є багатотоннажне, тому процес фільтрування займе велику кількість часу. За допомогою центрифугування ми скоротимо цей час.
5. Процес фільтрування є економічно затратний процес за рахунок можливості забивання фільтрів.
6. Сепарування використовується для дріжджових клітин.
Отже, найдоцільнішим способом відділення клітин продуценту та мікрочасточок у технологічному процесі виробництва декстрану буде процес центрифугування.
Центрифугування - спосіб розділення рідких неоднорідних систем під дією відцентрових сил, яке здійснюється в машинах-центрифугах [31].
Виходячи з конструктивних ознак, центрифуги розрізняють головним чином за розташуванням і способом закріплення валу. За цією ознакою центрифуги ділять на: вертикальні, горизонтальні і похилі. Існує три види вертикальних центрифуг: стоячі (з підпертим валом), підвішені на колонках і висячі (з верхнім підвісом головного валу). Горизонтальні центрифуги з ножовим зніманням осаду працюють періодичним способом, але оскільки в них можлива повна автоматизація всіх операцій, вони називаються автоматичними центрифугами.
За технологічним призначенням центрифуги розділяються на три типи: 1) освітлюючі – для очищення рідин від твердих домішок, 2) розділяючі – для розділення суспензій і емульсій, 3) концентруючі – для згущування суспензій шляхом відділення частини рідкої фази.
В даному технологічному процесі доцільним буде використання горизонтальної, автоматичної центрифуги.
Горизонтальна автоматична центрифуга (рис. 1.1) має дірчастий барабан 1, розташований між підшипниками горизонтального валу 3. Суспензія подається по трубі 3, введення і припинення подачі суспензії проводяться за допомогою клапана 4, роботою якого управляє гідравлічний (масляний) циліндр 5. Такий же циліндр приводить в дію ніж 6 для зняття осаду, масло поступає під поршень циліндра (під час підйому ножа) або зверху поршня (під час опускання ножа).
Головними перевагами такої центрифуги є: скорочення часу та повна автоматизація процесу.
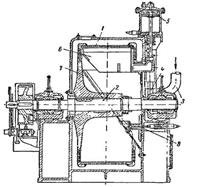
Рис. 5.1 Горизонтальна, автоматична центрифуга
5.3.3 Обгрунтування стадій осадження та розділення на фракції декстрану
Наступною стадією отримання ЕПС є стадія осадження декстрану. Даний процес можна здійснити за допомогою трьох осадників: метиловий та етиловий спирт, поліетиленгліколь. Вибір осадника залежить від того, де буде використовуватися продукт та як впливатиме осадник на декстран після осадження . В нашому випадку декстран використовується у якості замінника плазми крові, тому він повинен бути у першу чергу не токсичний [8, 20, 28, 29].
Якщо в якості осадника використовувати поліетиленгліколь, то в подальшому ми матимемо проблеми з очищенням фракцій ЕПС. Це збільшить час технологічного процесу та кількість коштів виділену підприємством на отримання даного продукту [22].
Метиловий спирт також негативно впливає на якість полісахариду, оскільки є надто токсичним, що унеможливлює використання декстрану в якості замінника плазми крові. Для того, щоб декстран був придатний до використання після осадження метиловим спиртом, необхідно проводити додаткові процеси його очищення [8].
Тому, найдоцільнішим буде використання етилового спирту. Хоч він є дорожчим, ніж метиловий спирт, але фінансові вклади в цьому випадку будуть нижчими, ніж під час додаткових процесів очистки ЕПС. Також він є менш токсичний і тому найкраще підходить для виробництва замінника крові [23, 24, 28].
Використання нативного декстрану без попередньої деструкції в фармакологічних препаратах, зокрема в плазмозамінниках крові, не представляється можливим.
Виходячи з цього є необхідним розділення декстрану на фракції, що включає два етапи:
1. Деструкція полісахариду;
2. Ультрафільтрація.
5.3.3.1 Обгрунтування вибору стадії деструкції
На виробництві плазмозамінників крові використовують низькомолекулярний декстран з молекулярною масою 30000-70000 кДа. Для цього нативний декстран піддають якого-небудь виду деструкції.
Відомі такі способи деструкції ЕПС:
· Кислотний гідроліз;
· Лужний гідроліз з -опроміненням;
· Обробка електронами високих енергій;
· Термічна обробка.
Низькомолекулярний декстран, використовуваний на виробництві плазмозамінників крові, повинен відповідати ряду вимог:
· Молекулярна маса 30 000-70 000 кДа;
· Вузький молекулярно-масовий розподіл (ММР), щоб виключити вміст небажаних низькомолекулярних і високомолекулярних фракцій;
· Характеристична в’язкість водного розчину не повинна перевищувати значення 0,28-0,30.
Одним з технічних рішень є спосіб отримання низькомолекулярного декстрану шляхом опромінення сухого нативного декстрану електронами високих енергій. За вказаним способом розчин нативного декстрану попередньо висушують, а потім порошок в присутності лугу опромінюють електронами високих енергій [34].
Але в даному способі є ряд недоліків:
1. Відсутність повної гомогенності декстрану і лугу призводить до нерівномірності процесу деструкції, а це призводить до того, що кінцевий продукт (низькомолекулярний декстрин) має дуже широкий молекулярно-масовий розподіл;
2. Полідисперсність перевищує 10.
3. Внаслідок цього опромінений прискореними електронами декстран піддають спиртовому фракціонуванню. При цьому втрачається близько 30-40% декстрану, тобто вихід продукту, придатного для отримання плазмозамінника крові становить 60-70%.
4. Відсутні відомості про модифікацію низкомолекулярного декстрану.
5. Продукту, одержуваному за цим способом, притаманна інтенсивне жовто-коричневе забарвлення, яке знижують шляхом додаткової обробки розчину низкомолекулярного декстрану на сорбентах при нагріванні.
6. За вказаним способом для отримання низкомолекулярного декстрану з молекулярною масою 50000 кДа використовують дозу опромінення 800 кГр [34].
Ще одним способом розділення декстрану на фракції є лужний гідроліз з подальшим -опроміненням [34].
Але недоліки цього методу не дають можливості його використання у даному технологічному процесі.
Недоліки методу:
1. Нерівномірність процесу деструкції;
2. Низькомолекулярний декстран має дуже широкий молекулярно-масовий розподіл;
3. Полідисперсність перевищує 10;
4. При цьому втрачається 30-40 % продукту;
5. Відсутні відомості про модифікацію низькомолекулярного декстрану;
6. Продукт набуває інтенсивного жовто-коричневого забарвлення, яке знижують за допомогою додаткових процесів очищення [34].
Найоптимальнішим рішенням буде використання соляної кислоти у якості деструктора (кислотний гідроліз). Метод кислотного гідролізу має переваги над тими, які описані вище:
ü Декстран має необхідний молекулярно-масовий розподіл;
ü Полідисперсність складає 2,3, що є необхідною нормою;
ü Втрати продукту складають менше 30 %;
Після деструкції ЕПС соляною кислотою, необхідно провести процес нейтралізації кислоти за допомогою гідрооксиду натрію задля отримання нейтрального значення рН (6,0-6,5) [33].
5.3.3.2 Обгрунтування стадії розділення декстрану на фракції
Після отримання розчину з фракціями декстрану різної молекулярної маси, необхідно провести процес їх розділення. В літературних даних представлені такі методи розділення декстрану на фракції: ультрафільтрація, використання активованого вугілля або катіонообмінних та аніонообмінних смол, застосування колонки Сефадекс С-15 [33].
Відомий спосіб очищення клінічних фракцій декстрану, заснований на застосуванні активованого вугілля, має ряд недоліків, що унеможливлює його використання у даному технологічному процесі.
Недоліки методу:
· Неможливість повністю очистити клінічні фракції від органічних домішок, що є причиною реактогенності кровозамінників;
· Втрати цільового продукту через незворотну сорбцію декстранів на вугіллі;
· Існує проблема освітлення сірих плівок;
· Випадання пластівчастого осаду в процесі зберігання препаратів за наявності мікрочастинок вугілля в готових лікарських формах;
· Процес багатостадійний та вимагає складного апаратурного оформлення [33].
Отримання низькомолекулярної фракції декстрану за допомогою колонки Сефадекс С-15 є економічно невигідним зважаючи на високу вартість. Дану установку можливо використовувати лише в лабораторних умовах [33].
Інші різновиди колонок, в тому числі і колонки з катіонообмінними та аніонообмінними смолами також можуть бути використані лише в лабораторних умовах.
Виходячи з цього, можна зробити висновок, що в технологічному процесі виробництва декстрану доцільним буде використання методу ультрафільтрації.
Ультрафільтрація - продавлювання рідини через напівпроникну мембрану — проникну для малих молекул і іонів, але непроникну для макромолекул і колоїдних часток. Промислове застосування технології ультрафільтрації - фракціонування макромолекул: великі молекули затримуються мембраною, в той час як невеликі молекули разом з молекулами розчинника вільно проходять через мембрану. Для підбору ультрафільтраційних мембран, виробники використовують концепцію молекулярної маси "відсікання" [51].
Перевагами даного методу є:
· Можливість проведення багатотоннажного процесу;
· Повна очистка і фракціонування готового продукту;
· Мінімальні фінансові затрати;
· Нескладне технологічне обладнання;
· Мінімальні затрати часу.
Для отримання низькомолекулярної фракції декстрану (40000-70000 кДа) будемо використовувати ультрафільтраційну установку «Амикон» DM 5 (США). Мембрани вироблені з поліелектролітного комплексу, робочий тиск 0,38 МПа [51].

Рис. 5.2 Ультрафільтраційна установка «Амикон» DM5 (США)
![]() РОЗДІЛ 6
РОЗДІЛ 6
МАТЕРІАЛЬНИЙ БАЛАНС ТА ПРОДУКТОВИЙ РОЗРАХУНОК
Згідно з техніко-економічним обґрунтуванням і розрахунком потужності виробництва (див. розділ 3) кількість культуральної рідини, яку необхідно отримати за один цикл становить 6373 л. Реальний об’єм культуральної рідини буде вищим із врахуванням втрат на всіх етапах її одержання. А саме:
· отримання посівного матеріалу в інокуляторі–2%,
· отримання посівного матеріалу в посівному апараті 1–2%,
· отримання посівного матеріалу в великому посівному апараті — 3%,
· отримання посівного матеріалу у ферментері — 3%.
6.1 Матеріальний баланс на одну ферментацію (партію)
| № з/п | Використано | Отримано | ||||||||
| Назва сировини і напівпродукту | Кількість, кг/дм3 | Назва кінцевого продукту, відходів та втрат | Кількість, кг/дм3 | |||||||
| 1 | 2 | 3 | 4 | 5 | ||||||
| 1. | Приготування поживного середовища для інокулятора | |||||||||
| 1.2 | Сахароза | 1,89 | Поживне середовище (нестерильне) | 5,67 | ||||||
| 1.3 | Дріжджовий екстракт | 0,032 | ||||||||
| 1.4 | Пептон | 0,032 | ||||||||
| 1.5 | K2HPO4 | 0,095 | ||||||||
| 1.6 | NaCL | 0,00006 | ||||||||
| 1.7 | MgSO4×7H2O | 0,00006 | ||||||||
| 1.8 | MnCl2× H2O | 0,00006 | ||||||||
| 1.9 | CaCl2 | 0,00032 | ||||||||
| 1.10 | Вода | 3,62 | ||||||||
| 1.11 | Всього | 5,67 | Всього | 5,67 | ||||||
| 2 | Стерилізація поживного середовища в бутлях в автоклаві | |||||||||
| 2.1 | Нестерильне поживне середовище | 5,67 | ПС стерилізоване в апараті | 6,3 | ||||||
| 2.2 | (Конденсат – 10% води) | 0,63 | ||||||||
| 2.3 | Всього | 6,3 | Всього | 6,3 | ||||||
| 3 | Отримання посівного матеріалу в інокуляторі | |||||||||
| 3.1 | ПС стерилізоване в апараті | 6,3 | Посівний матеріал | 6,9 | ||||||
| 3.2 | Посівний матеріал з колб | 0,7 | ||||||||
| 3.3 | Втрати (частка) | 0,02 | Втрати (кількість) | 0,1 | ||||||
| 3.4 | Всього | 7 | Всього | 7 | ||||||
| 4 | Приготування поживного середовища для посівного апарату 1 | |||||||||
| 4.1 | Сахароза | 18,6 | Поживне середовище (нестерильне) | 55,8 | ||||||
| 4.2 | Дріжджовий екстракт | 0,31 | ||||||||
| 4.3 | Пептон | 0,31 | ||||||||
| 4.4 | K2HPO4 | 0,93 | ||||||||
| 4.5 | NaCL | 0,00062 | ||||||||
| 4.6 | MgSO4×7H2O | 0,00062 | ||||||||
| 4.7 | MnCl2× H2O | 0,00062 | ||||||||
| 4.8 | CaCl2 | 0,0031 | ||||||||
| 4.9 | Вода | 35,645 | ||||||||
| 4.10 | Всього | 55,8 | Всього | 55,8 | ||||||
| 5 | Стерилізація поживного середовища в посівному апараті 1 | |||||||||
| 5.1 | Нестерильне поживне середовище | 55,8 | ПС стерилізоване в апараті | 62 | ||||||
| 5.2 | (Конденсат – 10% води) | 6,2 | ||||||||
| 5.3 | Всього | 62 | Всього | 62 | ||||||
| 6 | Отримання посівного матеріалу в посівному апараті 1 | |||||||||
| 6.1 | ПС стерилізоване в апараті | 62 | Посівний матеріал | 67,7 | ||||||
| 6.2 | Посівний матеріал малого посівного апарату 1 | 6,9 | ||||||||
| 6.3 | Втрати (частка) | 0,02 | Втрати (кількість) | 1,3 | ||||||
| 6.4 | Всього | 69 | Всього | 69 | ||||||
| 7 | Приготування поживного середовища для посівного апарата 2 | |||||||||
| 7.1 | Сахароза | 182,7 | Поживне середовище (нестерильне) | 548 | ||||||
| 7.2 | Дріжджовий екстракт | 3,045 | ||||||||
| 7.3 | Пептон | 3,045 | ||||||||
| 7.4 | K2HPO4 | 9,135 | ||||||||
| 7.5 | NaCL | 0,0061 | ||||||||
| 7.6 | MgSO4×7H2O | 0,0061 | ||||||||
| 7.7 | MnCl2× H2O | 0,0061 | ||||||||
| 7.8 | CaCl2 | 0,03 | ||||||||
| 7.9 | Вода | 350,03 | ||||||||
| 7.10 | Всього | 548 | Всього | 548 | ||||||
| 8 | Стерилізація поживного середовища в посівному апараті 2 | |||||||||
| 8.1 | Нестерильне поживне середовище | 548 | ПС стерилізоване в апараті | 609 | ||||||
| 8.2 | (Конденсат – 10% води) | 60,9 | ||||||||
| 8.3 | Всього | 609 | Всього | 609 | ||||||
| 9 | Отримання посівного матеріалу в посівному апараті 2 | |||||||||
| 9.1 | ПС стерилізоване в апараті | 609 | Посівний матеріал | 657 | ||||||
| 9.2 | Посівний матеріал з малого посівного апарату 2 | 67,7 | ||||||||
| 9.3 | Втрати (частка) | 0,03 | Втрати (кількість) | 20 | ||||||
| 9.4 | Всього | 677 | Всього | 677 | ||||||
| 10 | Приготування поживного середовища для ферментера | |||||||||
| 10.1 | Сахароза | 1773,9 | Поживне середовище (нестерильне) | 5321,7 | ||||||
| 10.2 | Дріжджовий екстракт | 29,565 | ||||||||
| 10.3 | Пептон | 29,565 | ||||||||
| 10.4 | K2HPO4 | 88,695 | ||||||||
| 10.5 | NaCL | 0,059 | ||||||||
| 10.6 | MgSO4×7H2O | 0,059 | ||||||||
| 10.7 | MnCl2× H2O | 0,059 | ||||||||
| 10.8 | CaCl2 | 0,296 | ||||||||
| 10.9 | Вода | 3399,5 | ||||||||
| 10.10 | Всього | 5321,7 | Всього | 5321,7 | ||||||
| 11 | Стерилізація поживного середовища в УБС | |||||||||
| 11.1 | Нестерильне поживне середовище | 5321,7 | ПС стерилізоване в апараті | 5913 | ||||||
| 11.2 | (Конденсат – 10% води) | 591,3 | ||||||||
| 11.3 | Всього | 5913 | Всього | 5913 | ||||||
| 12 | Виробничий біосинтез | |||||||||
| 12.1 | Стерильне поживне середовище | 5913 | Культуральна рідина на центрифугування | 6373 | ||||||
| 12.2 | Посівний матеріал з посівного апарату | 657 | ||||||||
| 12.3 | Втрати (частка) | 0,03 | Втрати (кількість) | 197 | ||||||
| 12.4 | Всього | 6570 | Всього | 6570 | ||||||
| 13. | Центрифугування культуральнї рідини | |||||||||
| 13.1. | Культуральна рідини на центрифгуування, л | 6373 | Об'єм отриманого фільтрату | 5426,84 | ||||||
| 13.2. | Об'єм вологого осаду | 308,86 | ||||||||
| 13.3. | Втрати (частка) | 0,1 | Втрати (кількість) | 637,3 | ||||||
| Всього | 6373 | Всього | 6373 | |||||||
| 14. | Концентрування розчину полісахариду ультрафільтацією | |||||||||
| 14.1. | Фільтрат зі стадії центрифугування | 5426,84 | Концентрат, л | 1269,62 | ||||||
| 14.2. | Пермеат, л | 3885,88 | ||||||||
| 14.3. | Втрати (частка) | 0,1 | Втрати (кількість) | 271,34 | ||||||
| Всього | 5426,84 | Всього | 5426,84 | |||||||
| 6.2 Продуктовий розрахунок | |||||||
| Вихідні дані для розрахунку: | |||||||
| Культура біологічного агенту – Leuconostoc mesenteroides PCSIR-4 | |||||||
| Річна потужність підприємства, кг/рік; | Gнт = | 82583 | |||||
| Кількість робочих днів у рік | Tрд = | 336 | |||||
| Час виробничого циклу, год | Tц = | 26 | |||||
| Концентрація біомаси в культуральній рідині, г/л | Хкр = | 9 | |||||
| Концентрація полісахарида в культуральній рідині, г/л | Ркр = | 90.4 | |||||
| Вміст абсолютно сухих речовин в готовому продукті, частка (0,90...0,92) | СРгп = | 0,9 | |||||
| Коефіцієнт запасу (втрати культуральної рідини або посівного матеріалу від нестерильних операцій), 1,1; | K1 = | 1,1 | |||||
| Коефіціент заповнення ферментера, частка: | Kз = | 0,6 | |||||
| Коефіціент заповнення посівного апарата, частка | Kпа = | 0,6 | |||||
| Коефіціент заповнення інокулятора, частка | Kін = | 0,6 | |||||
| Коефіціент заповнення колб, частка | Kкол = | 0,2 | |||||
| Сумарні втрати активності пза цикл переробки культуральної рідини (сума всіх втрат по стадіям виділення готового продукту), частка | Eцп = | 0,41 | |||||
| Концентрація посівного матеріалу для виробничих ферментерів, частка (0,05-0,1) | Хвф = | 0,1 | |||||
| Концентрація посівного матеріалу для посівних апаратів, частка (0,02-0,1) | Хпа = | 0,1 | |||||
| Концентрація посівного матеріалу для інокуляторів, частка (0,02-0,1) | Хін = | 0,1 | |||||
| Концентрація посівного матеріалу для качалочних колб, частка (0,02-0,1) | Хкол=0.05 | 0,1 | |||||
| Втрати культуральної рідини при біосинтезі, частка (0,1- 0,2) | Еф = | 0,1 | |||||
| Втрати посівного матеріал при його культивуванні в посівних апаратах, частка (0,1- 0,2) | Епа = | 0,05 | |||||
| Втрати посівного матеріал при його культивуванні в інокуляторах, частка (0,1- 0,2) | Еін = | 0,05 | |||||
| Втрати посівного матеріал при його культивуванні в колбах, частка (0,01- 0,02) | Екол = | 0,01 | |||||
| CP1-6 частка абсолютно сухої речовини в компоненті | |||||||
| Склад поживного середовища для виробничого біосинтеза, г/л | |||||||
| Сахароза (0.9) | C1 = | 300,00 | |||||
| Дріжджовий екстракт (0.9) | C2 = | 5,00 | |||||
| Пептон (0.95) | C3 = | 5,00 | |||||
| K2HPO4 (СР2=0,98) | C4 = | 15,00 | |||||
| NaCl (СР6=0,95) MgSO4×7H2O(СР6=0,95) MnCl2× H2O (СР7=0,96) | C5 = C6 = C7= | 0,01 0,01 0,01 | |||||
| CaCl2(СР6=0,95) | C8= | 0,05 | |||||
| Разом: | CΣ = | 325,08 | |||||
| 1.Розрахунок кількості партій продукту (виробничих циклів) | |||||||
| 1.1. Кількість полісахариду на добу, кг /добу | |||||||
| Gнтд = Gнт/Трд | Gнтд = | 245,78 | |||||
| 1.2. Кількість продукту на добу у урахуванням втрат за виробничий цикл (Есв), кг | |||||||
| Gпд = Gнтд/(1-Ецп) | Gпд = | 409,64 | |||||
| 1.3. Кількість продукту за цикл кг/цикл | |||||||
| Gцк = Gпд*Тцф/24 | Gцк = | 443,77 | |||||
| 1.6. Кількість ферментацій (циклів) на рік | |||||||
| Nцк = Gнт/Gцк | Nцк = | 72,96 | |||||
| Приймаємо цілочисельне значення кількості циклів | Nцк= | 186 | |||||
| 1.4.Об'єм КР, що зливається за одну ферментацію (цикл), м3 | |||||||
| Vкр = К1*Gцк /(СРст*Ркр) | Vкр = | 6,00 | |||||
| 1.8. Реальний вихід полісахарида у кг з 1 м3 культуральної рідини | |||||||
| qнат. = Gцк/Vкр | qнат = | 73,96 | |||||
| 2.1. Розрахунок об'ємів поживного середовища та посівного матеріалу виробничих ферментерів | |||||||
| 2.2.1. Об'єм готового поживного середовища та посівного матеріалу у виробничих ферментерах з врахуванням втрат при біосинтезі (Еф), л | |||||||
| Vф = Vкр/(1-Еф) | Vф = | 6666,6 | |||||
| 2.2.2. Витрати посівного матеріалу на засів виробничих ферментерів (Хвф), л | |||||||
| Vпмф = Vф · Хвф | Vпмф = | 666,6 | |||||
| 2.2.3. Об'єм готового поживного середовища для виробничих ферментерів, л | |||||||
| Vпсф = Vф - Vпмф | Vпсф= | 6000 | |||||
| 2.2. Розрахунок складу поживного середовища виробничих ферментерів | |||||||
| 2.2.1. У відповідності з прийнятим складом поживного середовища його витрати на Vф (л) культуральної рідини складають, кг: | Gсрпс= | 361,22 | |||||
| 2.3.1. Розбавлення виробничого поживного середовища конденсатом пари при його стерилізаціїї в УБС, л, Ккон = 0,2 | |||||||
| Vфк = Vпсф 9 Ккон | Vфк = | 1200,0 | |||||
| 2.3.2. Витрати води на приготування виробничого поживного середовища,з врахуванням конденсату пари при стерилізаціїї в УБС, л | |||||||
| Vвф = Vпсф - Gф - Vфк | Vвф = | 4400,9 | |||||
| 3.1. Розрахунок об'ємів поживного середовища та посівного матеріалу | |||||||
| 3.1.1.Об'єм готового поживного середовища та посівного матеріалу з врахуванням втрат при культивування в посівних апаратах (Епа), л | |||||||
| Vпа =Vпмф/(1-Епа) | Vпа = | 740,66 | |||||
| 3.1.2. Витрати посівного матеріалу на засів посівних апаратів (Хпа), л | |||||||
| Vпмп = Vпа*Xпа | Vпмп = | 74,06 | |||||
| 3.1.3. Об'єм готового поживного середовища для посівних апаратів, л | |||||||
| Vпсп = Vпа - Vпмп | Vпсп = | 666,6 | |||||
| 3.2. Розрахунок складу поживного середовища посівних апаратів | |||||||
| 3.2.1. У відповідності з прийнятим складом поживного середовища його витрати на Vпсп (л) культуральної рідини складають, г: | |||||||
| Gпа =Vпсп9 CΣ , в тому числі: | Gпа = | 42006,67 | |||||
| Сахароза (0.9) | C1 = | 37895,04 | |||||
| Дріжджовий екстракт (0.9) | C2 = | 189,5 | |||||
| Пептон (0.95) | C3 = | 126,316 | |||||
| K2HPO4 (СР2=0,98) | C4 = | 189,47 | |||||
| NaCl (СР6=0,95) MgSO4×7H2O(СР6=0,95) MnCl2× H2O (СР7=0,96) | C5 = C6 = C7= | 126,316 315,79 6,32 | |||||
| CaCl2(СР6=0,95) | C8 = | 3157,92 | |||||
| Разом: | CΣ = | 42006,67 | |||||
| Вміст абсолютно сухих речовин в поживному середовищі посівного апарата, кг | |||||||
| Gсpпа = (G1*СР1+G2*СР2 + G3*СР3+ G4*СР4+ G5*СР5 + G6*СР6+ G7*СР7 + G8*СР8)/1000 | Gсpпа = | 38,02 | |||||
| 3.3.1. Розбавлення поживного середовища конденсатом пари при його стерилізаціїї в посівному апараті (Ккон = 15%) , л | |||||||
| Vпак = Vпсп 9 Ккон | Vпак = | 94,73 | |||||
| 3.3.2. Витрати води на приготування поживного середовища у посівних апаратах з врахуванням конденсату пари при стерилізаціїї, л | |||||||
| Vвпа = Vпсп - (Gпа /1000) - Vпак | Vвпа = | 494,85 | |||||
| 4.1. Розрахунок об'ємів поживного середовища та посівного матеріалу для інокулятора | |||||||
| 4.1.1. Об'єм готового поживного середовища та посівного матеріалу з врахуванням втрат при культивуванні в інокуляторі (Еін), л | |||||||
| Vін = Vпмп/(1-Еін) | Vін = | 73,87 | |||||
| 4.1.2. Витрати посівного матеріалу на засів інокулятора (Хін), л | |||||||
| Vінм = Vін·Xін | Vінм = | 7,387 | |||||
| 4.1.3. Об'єм готового поживного середовища для інокуляторів, л | |||||||
| Vпсін = Vін - Vінм | Vпсі = | 66,483 | |||||
| 4.2. Розрахунок складу поживного середовища інокулятора | |||||||
| 4.2.1. У відповідності з прийнятим складом поживного середовища його витрати на Vпсін (л) культуральної рідини складають, г: | |||||||
| Gін =Vпсін 9 CΣ , в тому числі: | Gін = | 4421,7 | |||||
| Меляса | C1 = | 3988,98 | |||||
| K2HPO4 (СР2=0,98) | C2 = | 19,9 | |||||
| CaHPO4 (СР3=0,95) | C3 = | 13,3 | |||||
| MgSO4(СР4=0,95) | C4 = | 19,9 | |||||
| K2SO4 (СР5=0,96) NaCl (СР6=0,95) FeCl3 (СР7=0,96) | C5 = C6 = C7= | 13,3 33,24 0,66 | |||||
| CaCO3 (СР6=0,95) | C6 = | 332,415 | |||||
| Разом: | |||||||
| Загальна витрата компонентів поживного середовища, г | GΣ= | 4421,7 | |||||
| 4.3. Розрахунок кількості води для приготування поживного середовища інокуляторів | |||||||
| 4.4.1. Розбавлення поживного середовища конденсатом пари при його стерилізаціїї в інокуляторі (Ккон = 15%) , л | |||||||
| Vінк = Vпсін9Ккон | Vінк = | 9,97 | |||||
| 4.4.2. Витрати води на приготування поживного середовища в інокуляторах з врахуванням конденсату пари при стерилізаціїї, л | |||||||
| Vвін = Vпсін - (Gін/1000) - Vінк | Vвін = | 52,1 | |||||
| 5.1. Розрахунок об'ємів поживного середовища та посівного матеріалу для колб | |||||||
| 5.1.1. Об'єм готового поживного середовища та посівного матеріалу з врахуванням втрат при культивуванні в колбах, л | |||||||
| Vкол = Vінм/(1-Eкол) | Vкол = | 7,46 | |||||
| 5.1.2. Витрати посівного матеріалу на засів качалочних колб, л | |||||||
| Vколм = Vкол · Xкол | Vколм= | 0,746 | |||||
| 5.1.3. Об'єм готового поживного середовища для колб, л | |||||||
| Vпск = Vкол - Vколм | Vпск = | 6,714 | |||||
| 5.2. Розрахунок складу поживного середовища качалочних колб | |||||||
| 5.2.1. У відповідності з прийнятим складом поживного середовища його витрати на Vкол (л) культуральної рідини складають, г: | |||||||
| Gкол =Vпск9 CΣ , в тому числі: | Gкол = | 446,55 | |||||
| Меляса | C1 = | 402,84 | |||||
| K2HPO4 (СР2=0,98) | C2 = | 2,01 | |||||
| CaHPO4 (СР3=0,95) | C3 = | 1,34 | |||||
| MgSO4(СР4=0,95) | C4 = | 2,01 | |||||
| K2SO4 (СР5=0,96) NaCl (СР6=0,95) FeCl3 (СР7=0,96) | C5 = C6 = C7= | 1,34 3,36 0,07 | |||||
| CaCO3 (СР6=0,95) | C6 = | 33,57 | |||||
| Загальна витрата компонентів поживного середовища, г | GΣ | 446,54 | |||||
| 5.3. Розрахунок кількості води для приготування поживного середовища качалочних колб, л | |||||||
| Vвк = Vпск - (GΣ /1000) | Vвк = | 6,27 | |||||
| 6. Кількість абсолютно сухих речовин в ферментері Gсрф до біосинтеза, кг | |||||||
| Gcpф = Gаспс + Gаспа | Gсрф= | 399,24 | |||||
| 7. Втрати абсолютно сухих речовин при біосинтезі Gвт (краплевинос), кг | |||||||
| Gвт=Gсрф · Еф | Gвт= | 39,924 | |||||
| 9. Витрати сухих речовин на на енергію біосинтезу (СРбс = 10…15%), кг | СРбс= | 0,13 | |||||
| Gбc = Gсрф · СРбс | Gбс = | 51,9 | |||||
| 10. Кількість абсолютно сухих речовин в культуральній рідині, що пішли на подальшу переробку, кг | |||||||
| Gсркр =Gсрф - (Gвт+Gбс) | Gсркр= | 307,416 | |||||
| Стадія ТП. Виділення, очищення та отримання готової продукціі | |||||||
| 11. Центрифугування культуральної рідини | |||||||
| 11.1. Об'єм суспензії, що йде на подальшу переробку складає, м3 | |||||||
| Vcус = Vкр | Vcус= | 5,99 | |||||
| 11.2. Відсоток асолютно сухої біомаси в суспензії складає, мас.% | |||||||
| CРасб=Xкр/10 | CРасб = | 0,58 | |||||
| 11.3. Вміст води в клітинах біомаси складає Wкл= 65-85 %, | Wкл= | 75,0 | |||||
| тоді відсоток вологої біомаси в суспензії буде, мас.% | |||||||
| СРвб =СРасб/(1-Wкл) | СРвб= | 2,32 | |||||
| 11.4. При густині осаду ρос = 1010…1100 кг/м3 маса | ρос= | 1 050,0 | |||||
| абсолютно сухого осаду в Vсус складає, кг | |||||||
| Gос = Vсус · Gбм · ρос | Gос = | 145,9 | |||||
| при вологості осаду Woc (частка), його маса в суспензії складе, кг | Woc = | 0,55 | |||||
| Gосв = Gос /(1- Woc) | Gосв = | 324,3 | |||||
| 11.5. Об'єм волого осаду в суспензії становить, л | |||||||
| Vосв = Gосв · 1000/ρос | Vосв = | 308,86 | |||||
| 11.6. Об'єм отриманого фільтрату з урахуванням втрат при фільтраціії, л | Ефт = | 0,1 | |||||
| Vфгм=(Vсус -Vосв) · (1-Ефт) | Vфгм= | 5113 | |||||
| 11.5. Маса абсолютно сухих речовин у фільтраті становить, кг | |||||||
| Gфт = (Gсркр - Gос) | Gфт = | 161,5 | |||||
| 11.6. Вміст сухих речовин у фільтраті становить, мас.% | |||||||
| СРф=Gфт · 100/Vфгм | СРф= | 3,16 | |||||
| 12. Концентрування розчину полісахарида методом ультрафільтрації | |||||||
| 12.1. Об'єм концентрата полісахарида при ступені концентрування Суф, л , та при втратах на концентруванні Еуф (5-8 %) становить | |||||||
| Eуф= | 0,05 | ||||||
| Vуф = Vфгм · (1-Еуф)/Суф | Vуф = | 971,47 | |||||
| 12.2. Маса абсолютно сухих речовин після концентрування з врахуванням втрат, кг | |||||||
| Gуф= Gфт · (1-Eуф) | Gуф= | 153,4 | |||||
| 12.3. Вміст сухих речовин в концентраті становить, мас.% | |||||||
| СРуф=Gуф · 100/Vуф | СРуф= | 15,79 | |||||
| 12.4. Вміст абсолютно сухого полісахарида в концентраті СРкон становить, частка, | СРкон= | 0,63 | |||||
| 12.5. Маса абсолютно сухого полісахарида в концентраті складає, кг | |||||||
| Gанб = Gуф*СРкон | Gанб = | 96,64 | |||||
| 12.6. Маса баластних речовин в пермеаті | |||||||
| Gбр = Gуф-Gанб | Gбр= | 56,758 | |||||
| 13. Сушіння концентрату | |||||||
| 13.1. Масса концентрату, що йде на сушіння, при його густині ρуф = 1050 ...1100 кг/м3, кг | Еуп= | Еуп= | |||||
| Gуф =Vуф · 1000/ ρуф | Gуф= | 925,2 | |||||
| 13.2. Кількість висушеного препарату з врахуванням втрат (10%) сухої речовини з повітрям, що виходить з сушарки, при стандартній вологості препарату Wгп = 1-СРгп =1-0,9 = 0,1 | Есш= | 0,05 | |||||
| Gcш = Gанб · (1-Есш)/СРгп | Gcш = | 102 | |||||
| 13.3. Об'єм води, що підлягає видаленню, л | |||||||
| Wсш = Gуф*(1- Есш) - Gcш | Wсш = | 776,9 | |||||
| 14. Стадія ПМВ. Пакування, маркування, відвантаження | |||||||
| 14.1. Препарат розфасовують в полієтиленові пакети по 10 кг, а потім у картонні туби. Втрати при фасуванні складають Еуп=0,5… 1%. Кількість упаковано препарату, кг | Еуп= | 0,01 | |||||
| Gуп = Gcш*(1-Еуп) | Gуп= | 100,98 | |||||
| або кількість пакетів Nпк =Gуп/10 | Nпк = | 10,098 | |||||
| 14.2. Механічні втрати, кг | |||||||
| Gвтм = Gcш - Gуп | Gвтм= | 1,02 |
![]() РОЗДІЛ 7
РОЗДІЛ 7
СПЕЦИФІКАЦІЯ ОБЛАДНАННЯ
Специфікація обладнання, яке представлене на апаратурній схемі (додаток 2) наведене у табл. 7.1.
Таблиця 7.1 Відомість специфікації обладнання
| Позначення обладнання | Назва | Кількість | Коротка характеристика |
| МП-1 | Пральна машина | 1 | Пральна машина для одягу з автоматичним керуванням. |
| СШ-2 | Сушильна шафа | 1 | Сушильна шафа для одягу з автоматичним керуванням. |
| ГФ-3 | Машина для пакування одягу в пакети | 1 | Машина з автоматичним керуванням. |
| З-4 З-5 З-6 З-7 З-8 | Збірник для приготування дезінфекційних розчинів | 8 | Металева ємність для приготування дезінфекційних розчинів місткістю 200 л, оснащена перемішуючим пристроєм з нижнім спуском. |
| ПЗ-9 ПЗ-17 | Повітрозабірник | 2 | Обладнаний металевою сіткою для видалення механічних забруднень. |
| Ф-10 | Фільтр грубої очистки повітря | 1 | Механічний фільтр з металізованою сіткою у вигляді гофрованих листів. Е = 80 %. |
| В-11 | Вентилятор | 1 | Пристрій для подачі повітря на теплообмінник. |
| Т-12 Т-20 | Теплообмінник –охолоджувач | 2 | Теплообмінник для переохолодження повітря до температури 25–40ºС. |
| Т-13 Т-22 | Теплообмінник-нагрівач | 2 | Теплообмінник для нагріву повітря. |
| Ф-14 | Фільтр тонкої очистки повітря | 1 | Фільтр із багатошарового мікроволокна. В якості матеріалу використовується скловолокно. |
| Н-16 | Насос | 1 | Насос перистальтичний для подачі повітря. |
| Н-42 Н-44 Н-46 Н-49 Н-53 | Насос | 5 | Насос вихровий, призначений для подачі поживного середовища в нагрівач (Н-44) та в ферментер (Н-42). |
| Ф-15 | Фільтр надтонкої очистки повітря | 1 | НЕРА-фільтр (Н 12) ефективність якого складає 99,995% за розмірами частинок від 0,3 мкм. |
Продовження табл. 7.1
| Ф-18 | Фільтр грубої очистки аераційного повітря | 1 | Фільтр з керамічним пористим фільтруючим блоком. Ефективність такого фільтра складає 90% за частинками розміром 50–100 мкм. |
| К-19 | Компресор | 1 | Апарат для стиснення повітря |
| Р-21 | Ресивер | 1 | Вертикальний металевий апарат циліндричної форми з сферичним дном та кришкою |
| Ф-23 | Фільтр головний | 1 | Металева ємність, забезпечена сорочкою, з перфорованими решітками в середині. Між решітками встановлюється волокнистий фільтруючий матеріал базальтове волокно висотою шару 6 см. Ефективність очистки повітря складає 96 % за частинками 1 – 50 мкм. |
| Ф-24 | Фільтр індивідуальний | 1 | фторопластовий фільтр, ефективність якого складає 99,999% за частинками 0,5 – 1 мкм. |
| М-27 М-28 М-29 М-31 М-32 М-33 М-50 | Мірник | 7 | Металева ємність оснащена сорочкою та перемішуючим пристроєм, об’ємом 200 л. |
| М-51 | Мірник | 1 | Металева ємність з перемішуючим пристроєм. |
| З-25 З-26 | Збірник | 2 | Металева ємність для приготування поживного середовища, місткістю 20 л, оснащена паровою сорочкою та перемішуючим пристроєм з нижнім спуском. |
| З-30 | Збірник | 1 | Металева ємність для приготування поживного середовища, місткістю 50 л, оснащена паровою сорочкою та перемішуючим пристроєм з нижнім спуском. |
| Р-34 | Посівний апарат | 1 | Посівний апарат об’ємом 10 л для вирощування посівного матеріалу, оснащений сорочкою, перемішуючим пристроєм та барботером. |
| Р-35 | Посівний апарат | 1 | Посівний апарат об’ємом 100 л для вирощування посівного матеріалу, оснащений сорочкою, перемішуючим пристроєм та барботером. |
| Р-36 | Ферментер | 1 | Ферментер об’ємом 1000 л для вирощування посівного матеріалу, оснащений сорочкою, перемішуючим пристроєм та барботером. |
| З-37 | Збірник | 1 | Металева ємність для приготування поживного середовища, місткістю 500 л, оснащена перемішуючим пристроєм з нижнім спуском. |
| К-38 | Колонка | 1 | Колонка для нагрівання поживного середовища. |
Продовження табл. 7.1
| Т-39 | Теплообмінник–витримувач | 1 | Витримувач поживного середовища при температурі 140° С протягом 2 хв. |
| З-40 | Збірник | 1 | Металева ємність для приготування сахарози, оснащена паровою сорочкою та перемішуючим пристроєм з нижнім спуском |
| Т-41 | Теплообмінник-рекуператор | 1 | Теплообмінник пластинчатий для охолодження стерильного поживного середовища. |
| Р-43 | Реактор | 1 | Ферментер об’ємом 10000 л для вирощування посівного матеріалу, оснащений сорочкою, перемішуючим пристроєм та барботером. |
| Р-45 Р-48 Р-52 Р-55 | Реактор | 4 | Металева ємність для процесів очищення полісахариду декстрану. |
| Ц-47 | Центрифуга | 1 | Горизонтальна автоматична центрифуга має дірчастий барабан , розташований між підшипниками горизонтального валу. Суспензія подається по трубі, введення і припинення подачі суспензії проводяться за допомогою клапана, роботою якого управляє гідравлічний (масляний) циліндр. Такий же циліндр приводить в дію ніж для зняття осаду, масло поступає під поршень циліндра (під час підйому ножа) або зверху поршня (під час опускання ножа). Кількість обертів становить 10 000 об/хв. |
| УФ-54 | Ультрафільтраційна установка | 1 | Установка фірми «Амикон» (США). Мембрани вироблені з поліелектролітного комплексу, робочий тиск 0,38 МПа. |
![]() РОЗДІЛ 8
РОЗДІЛ 8
ОПИС ТЕХНОЛОГІЧНОЇ СХЕМИ
ДР 1. Санітарна підготовка виробництва
ДР 1.1 Санітарна підготовка персоналу
ДР 1.1.1 Перевірка знань персоналу
Навчання персоналу включає в себе підготовку персоналу у відповідності з діючими на підприємстві технологічними інструкціями та стандартними робочими процедурами (СРП). Особливу увагу приділяють навчанню персоналу, який працює в чистих зонах. Навчання персоналу включає вивчення основних вимог "Належної виробничої практики GMP" та вимог, які стосуються гігієни.
Персонал, що працює з токсичними і летучими речовинами, небезпечними для здоров'я, повинен проходити додаткову підготовку по спеціальній програмі.
Не рідше 1 разу на рік персонал повинен проходити перепідготовку знань.
ДР 1.1.2 Санітарно – гігієнічна підготовка персоналу
Кожне фармацевтичне підприємство повинно мати спеціально виділене приміщення (гардеробна) для переодягання персоналу. В даному приміщенні кожен робітник повинен знімати верхній одяг (пальто, куртки, головні убори, вуличне взуття тощо) та надягати перехідний (халат, косинку або шапочку з бавовняних тканин). В усіх приміщення підприємства забороняється носити верхній, вуличний одяг.
Одяг, який використовують на підприємстві повинен відповідати вимогам GMP. Персонал, що входить у виробниче приміщення, повинний бути одягнений у спеціальний одяг. Технологічний одяг персоналу повинен відповідати класу чистоти тієї зони, у якій він працює. Основне призначення одягу — максимально захищати продукт виробництва від часток, що виділяє людина.
Форма одягу для приміщень класу чистоти D має бути наступна: комбінезон або куртка і брюки або халат; шапочка або косинка, що покриває волосся та бахіли, що одягаються зверху на взуття.
Найбільша кількість мікроорганізмів виділяється з верхніх дихальних шляхів, волосся і шкірних покривів. Тому до персоналу виробничих приміщень пред’являються наступні вимоги:
- мити голову необхідно 1–2 рази на тиждень;
- рекомендується носити коротку стрижку;
- забороняється носити бороду;
- перед роботою 2 рази на тиждень варто робити гігієнічний манікюр;
- забороняється використання косметики під час роботи, покривати волосся і нігті лаком;
- забороняється носити ювелірні вироби;
- забороняється вносити у виробничі приміщення особисті речі (документи, гроші, ключі, гребінці, носові хустки й ін.), а також зберігати їжу, приймати їжу, палити.
При надходженні на роботу персонал повинний пройти медичне обстеження.
Весь персонал, зайнятий безпосередньо на виробництві, повинний проходити регулярні медичні огляди, а персонал, що здійснює візуальний контроль ін'єкційних препаратів, повинний проходити регулярні огляди лікарями-окулістами.
Тимчасово до роботи не допускаються хворі інфекційними захворюваннями і співробітники, що мають ушкодження шкіри різного ступеня.
Одягнувшись, персонал направляється в умивальну. Для миття рук варто використовувати рідке або туалетне мило. При необхідності руки ретельно вимивають теплою водою з милом протягом 1–2 хвилин за допомогою стерильної щітки. Після миття, руки необхідно витерти насухо рушником із безворсової тканини або висушити за допомогою повітряної сушарки.
Під час роботи через кожні 2 години варто проводити дезобробку рук.
ДР 1.2 Підготовка одягу для персоналу
Перед тим, як персонал переодягнеться у спеціальний одяг його необхідно підготувати відповідно до вимог GMP.
ДР 1.2.1 Прання одягу
Прання одягу здійснюють у спеціальній машині-автомат (МП-1), яка виконує такі операції: прання та ополіскування, віджим. Прання відбувається за допомогою миючого засобу «ЛОТОС». Прасування одягу відбувається протягом 45 хв при температурі миючого засобу 60°С.
ДР 1.2.2 Сушіння одягу
Сушіння одягу проводять за допомогою гарячого стерильного повітря у сушильній шафі (СШ-2) при температурі 80–90°С протягом 45 хвилин.
ДР 1.2.3 Упаковка одягу
Кожний комплект технологічного спецодягу може бути використаний тільки протягом однієї зміни. Потім він передається на обробку.
ДР 1.2.4 Зберігання одягу
Технологічний спецодяг перед відправленням у прання повинен зберігатися в контейнерах або боксах, що закриваються кришками (ГФ-3).
ДР 1.3 Підготовка дезінфікуючих розчинів
ДР 1.3.1 Підготовка дезінфікуючих розчинів для персоналу
ДР 1.3.1.1 Приготуання розчину «Стерилліум»
Робочий розчин «Стерилліум» доставляється на підприємство у готовому вигляді в коніcтрах об’ємом 5 л. Розчин «Стерилліум» розливають в ємкості об’ємом 1л.
ДР 1.3.1.2 Зберігання розчину
Термін зберігання 48 годин.
ДР 1.3.2 Підготовка дезінфікуючих розчинів для обладнання
ДР 1.3.2.1 Приготування розчину «Дезосепт»
Розчин «Дезосепт» доставляється на підприємство в коніcтрах об’ємом 22 кг [48].
Для приготування дезінфікуючих робочих розчинів використовують концентрат "Дезосепт". Готують робочі розчини у відповідній ємності-збірнику (З-5) шляхом розчинення необхідної кількості концентрату, відібраного за допомогою дозатора або ручного насоса, в питній воді за ГОСТ 2874-82 згідно табл. 3.1 та табл. 3.2 [48].
Таблиця 8.1 Приготування робочих розчинів засобу "Дезосепт"
| Концентрація робочих розчинів,% | Кількість на 10 л розчину | |
| Препарату, г | Води, г | |
| 0,05 | 5 | 9995,0 |
| 0,07 | 7 | 9993,5 |
| 0,1 | 10 | 9990,0 |
| 0,15 | 15 | 9985,0 |
Таблиця 8.2 Режими дезінфекції розчинами засобу "Дезосепт "
| Температура, °С | Час експозиції, хв. | Концентрація за препаратом, % |
| Нижче 8 | 15 | 0,1–0,15 |
| 8–22 | 5–10 | 0,1–0,15 |
| 8–22 | 15 | 0,07–0,1 |
| 22–40 | 5–10 | 0,05–0,1 |
| 70–90 | 5 | 0,05 |
ДР 1.3.2.2 Зберігання розчину
Термін зберігання 48 годин.
ДР 1.3.2.3 Приготування розчину «Полідез»
Розчин готують у спеціальній ємності (З-6) шляхом змішування (2–3 хв) концентрату препарату з водою (див. табл. 3.2). Для приготування розчину використовують воду питну [49].
Таблиця 8.3Приготування робочих розчинів «Полідез»
| Концентрація робочого розчину, % | Кількість засобу і води, мл | |||
| 1 л | 10 л | |||
| Засіб | Вода | Засіб | Вода | |
| 0,1 0,2 0,3 0,4 0,5 | 1 2 3 4 5 | 999,0 998,0 997,0 996,0 995,0 | 10 20 30 40 50 | 9,990 9,980 9,970 9,960 9,950 |
ДР 1.3.2.4 Зберігання розчину
Готовий розчин зберігають при кімнатній температурі не більше 48 годин
ДР 1.3.3 Приготування дезінфікуючих розчинів для приміщень
ДР 1.3.3.1 Приготування розчину «Хлорантоін»
Робочі розчини "Хлорантоіну" готують у окремому збірнику (З-7) з будь-яких матеріалів, за винятком оцинкованого заліза. Препарат вносять у збірник додають воду та розчиняють при перемішуванні протягом 1–2 хв [47].
Для приготування робочих розчинів засобу використовують воду питну згідно ГОСТ 2874-82. При виготовленні робочих розчинів 0,5–2,5 % концентрації доцільно спочатку приготувати суспензію засобу у невеликій кількості води, а потім розвести її водою до розрахованого об'єму. Допускається використовувати гарячу воду за температури (60±5) °С для приготування 0,5–2,5 % розчинів засобу з метою прискорення його розчинення у воді [47].
Для приготування робочих розчинів "Хлорантоіну" відповідної концентрації виходять із наступних розрахунків, наведених у табл. 3.3 [47].
Таблиця 8.4 Розрахунки для робочих розчинів
| Концентрація, % | 1 л розчину | |
| Кількість «Хлорантоіну», г | Кількість води, мл | |
| 0,1 | 1,0 | 999,0 |
| 0,2 | 2,0 | 998,0 |
| 0,3 | 3,0 | 997,0 |
| 0,5 | 5,0 | 995,0 |
| 1,0 | 10 | 990,0 |
| 2,5 | 25 | 975,0 |
ДР 1.3.3.2 Зберігання розчину
"Хлорантоін" зберігають у пакуванні виробника в критих неопалюваних складських приміщеннях, які захищені від вологи та прямого сонячного проміння. Препарат зберігають осторонь від джерел відкритого вогню та тепла не більше, ніж у 3 яруси. Термін зберігання — 48 годин з дати виробництва [47].
ДР 1.3.3.3 Приготування розчину « Неохлор»
Робочі розчини засобу "Неохлор" готують у спеціально виділеному збірнику (З-8) шляхом розведення засобу водою (див. табл. 3.4) [45].
Таблиця 8.5 Приготування робочих розчинів «Неохлор»
| Вміст активного хлору, % | Концентрація робочого розчину | Кількість засобу для приготування, мл | |
| 1 л | 10 л | ||
| 5,5 | 0,015 0,02 0,03 0,05 0,1 | 2,7 3,6 5,4 9,0 18 | 27 36 54 90 180 |
| 6,5 | 0,015 0,02 0,03 0,05 0,1 | 2, 3 3,1 4,6 7,5 15 | 23 31 46 75 150 |
| 7,5 | 0,015 0,02 0,03 0,05 0,1 | 2,0 2,6 4,0 6,5 13 | 20 26 40 65 130 |
Вода додається до засобу у кількості, яка необхідна для отримання потрібної кількості робочого розчину (відповідно до 1 л або до 10 л).
ДР 1.3.3.4 Зберігання розчину
Допускається зберігання приготовлених робочих розчинів у темному прохолодному місті у закритій тарі протягом 3 діб [45].
ДР 1.4 Підготовка приміщень
ДР 1.4.1 Щодення прибирання приміщень
Прибирання проводять у гумовому взутті, гумових рукавичках і фартуху. Інструмент, призначений для миття (відра, губки, швабри) маркують і знезаражують на протязі 2–3 годин у 3% розчині перекису водню.
Стіни, двері і інші поверхні протирають поролоновою губкою, яка змочена дезінфікуючим розчином (3% перекис водню, хлорантіон) з розрахунку 100–150 мл/м поверхні, потім цим же розчином миють підлогу.
ДР 1.4.2 Генеральне прибирання приміщень
Генеральне прибирання приміщень проводять 1 раз в 5–6 днів.
У виробничих приміщеннях підлогу миють 0,1% розчином миючого засобу із розрахунку 100 мл/м2 поверхні підлоги.
ДР 1.5 Підготовка технологічного обладнання
ДР 1.5.1 Миття та ополіскування ферментаційного обладнання
Спочатку проводять миття обладнання за допомогою розчину «Каустичної соди» для видалення наявних білково-жирових відкладень та забруднень неорганічного походження. Миття обладнання здійснюють за допомогою СІР-модулів.
Після цього проводять дезінфекцію обладнання циркуляційним методом через миючий пристрій, нанесенням дезінфектанту на поверхню обладнання або його заповненням.
Розбірне обладнання, з’ємні частини обладнання, дрібний інвентар, посуд дезінфікують методом занурення в пересувні або стаціонарні 2-х та 3-х секційні мийні ванни з робочим розчином дезінфектанту, столи для запчастин, стелажі для просушування деталей,інвентарю.
Санітарну обробку препаратом "Дезосепт" проводять вручну, за допомогою щіток або ганчірок методом протирання. Методом розбризкування за допомогою гідропульта. Обробку проводять при кімнатній температурі або з підігрівом. В даному випадку розчин не споліскується водою.
Для дезінфекції обладнання і комунікацій використовують робочий розчин "Дезосепт" з концентрацією 0,05–0,15% і експозицією 5–20 хв. у відповідності з режимами викладеними у табл. 3.1 та 3.2.
Безпосередньо після обробки обладнання розчином "Дезосепт" та при умові повного опорожнення обладнання та трубопроводів від дезінфекційного засобу, витримці та просушуванні можна і не змивати їх водою, так як препарат розкладається на сліди оцтової кислоти, воду і кисень.
ДР 1.5.2 Перевірка на герметичність
Ємкісне обладнання на герметичність перевіряють при повітряному тиску 0,5 − 0,6 МПа. Якщо упродовж 30 хв тиск (за манометром) не знижується, обладнання вважають герметичним. Фланцеві з’єднання та зварні шви перевіряють на герметичність за допомогою мильної води при повітряному тиску від 0,5 до 0,6 МПа.
ДР 1.5.3 Стерилізація обладнання
Після перевірки обладнання на герметичність, подають гостру пару t = 125 − 130 ºС протягом 45 хв.
По закінченні стерилізації зупиняють подачу гострої пари, ставлять всі вузли під паровий захист та знижують тиск. При зниженні тиску проводять охолодження до температури 90 ºС.
ДР 2 Підготовка вентиляційного повітря
ДР 2.1 Забір атмосферного повітря
Забір атмосферного повітря здійснюється через шахту (ПЗ-9), яка розташована на висоті 10 м.
ДР 2.2 Очищення повітря на фільтрах грубої очистки
Попередню очистку повітря здійснюють у чарунковому фільтрі (Ф-10). При проходженні повітря через фільтр грубого очищення , пил та механічні частки з повітря осідають, а очищене повітря надходить у компресор. Ступінь очищення становить Е = 80 %.
ДР 2.3 Кондиціонування повітря
Комфортна температура в чистих приміщеннях підтримується за рахунок кондиціонування повітря на рівні від 19 до 23 С зимою та від 21 до 25 С літом, відносна вологість повітря – від 30% до 60%. Щоб забезпечити випадання вологи в краплевловлювачі, повітря «переохолоджують» до температури 25–40ºС в теплообмінному апараті (Т-12), яке подається туди за допомогою вентилятора(В-11) . Надалі, для забезпечення надійної роботи подальших фільтрів, повітря нагрівають до температури 70–90ºС. При таких температурах не відбувається конденсація пари води на волокнах фільтрів. Транспортування повітря відбувається по трубопроводах під тиском.
ДР 2.4 Стадія тонкого очищення
Тонку очистку повітря здійснюють у фільтрах з багатошарового мікроволокна (скловолокно). Ступінь очищення в яких складає 80 %.
ДР 2.5 Фільтрація повітря для D класу чистоти
Повітря для D класу чистоти пропускають крізь фільтри Н-12 (Ф-14), ступінь його очищення становить 95%
ДР 3 Підготовка стерильного технологічного повітря
ДР 3.1. Забір атмосферного повітря
Атмосферне повітря забирають через шахту, що розташована на висоті 10 м (ПЗ-17) .
ДР 3.2. Грубе очищення повітря
Попередню очистку повітря здійснюють у чарунковому фільтрі (Ф-18). При проходженні повітря через фільтр грубого очищення, пил та механічні частки з повітря осідають, а очищене повітря надходить у компресор. Ступінь очищення становить Е = 80 % .
ДР 3.3 Стиснення повітря
Після грубої фільтрації повітря потрапляє в компресор (К-19), там воно стискається до 0,35–0,5 МПа. Стиснення повітря в компресорі приводить до підвищення його температури до 80–100° С і збільшення вмісту вологи на одиницю об’єму.
ДР 3.4 Охолодження повітря
Процес охолодження повітря відбувається в теплообмінному апараті (Т-20) (кожухотрубчастий теплообмінник) до температури 30–35° С. Охолодження здійснюють шляхом подачі у між трубний простір теплообмінника води захолодженої. В теплообміннику повітря охолоджують до температури культивування 26°С.
ДР 3.5 Видалення вологи
Після теплообмінника повітря потрапляє в ресивер (Р-21), де відбувається стабілізація вологи. Вологість повітря становить 40%.
ДР 3.6 Нагрів повітря
З ресивера повітря надходить до теплообмінника (Т-22), де воно нагрівається до температури вище на 1–2°С, ніж температура культивування.
ДР 3.7. Очищення повітря в головному фільтрі
Попереднє очищення повітря від пилу та мікроорганізмів здійснюється в головному фільтрі (Ф-23). Головний фільтр представляє собою циліндричну ємність з сферичним дном та кришкою. В середині фільтру знаходяться дві решітки, між якими розміщують фільтруючий матеріал. Заміну фільтрувального матеріалу проводять 2 рази на рік. У разі забруднення, зволоження, інфікування фільтруючого матеріалу проводять позачергову його заміну.
Охолоджене повітря, проходячи крізь шар базальтового волокна, очищається від пилу та мікроорганізмів. Ступінь очищення становить Е = 98%.
ДР 3.8. Очищенняповітря в індивідуальному фільтрі
Заключна стадія очищення повітря від контамінантів здійснюється в індивідуальних фільтрах (Ф-24).
Як фільтруючий матеріал використовують фторопластові втулки, товщиною 4 мм. Фільтр являє собою металевий циліндр з кришкою та конічним дном. Ступінь очищення становить Е = 99,99%, КУО ‹ 1.
ДР 4. Підготовка розчину соляної кислоти та лугу
ДР 4.1. Приготування розчину соляної кислоти
Розчин соляної кислоти використовують для запобігання випадання фосфорних солей в осад, при їх сумісній стерилізації із солями Ca2+ i Mg2+, процес здійснюють при рН 2,0, для чого використовується 10 % розчин HCl. Приготування розчину здійснюють у окремому мірнику (М-28) об’ємом 200 л приєднаному до ферментера за допомогою з’єднувальних трубок.
ДР 4.2. Приготування та стерилізація розчину гідрооксиду натрію
10 % розчин NaOH готується для подальшої стабілізації рН середовища. Приготування здійснюють у окремому мірнику (М-29) об’ємом 200 л приєднаному до ферментера за допомогою з’єднувальних трубок.
Стерилізацію проводять в мірнику (М-29) при температурі 131 ºС протягом 30 хвилин.
ДР 5. Підготовка і стерилізація піногасника
ДР 5.1. Приготування піногасника
В якості піногасника використовується гланапон, який є повністю готовий до стерилізації. Піногасник подають в мірник (М-27) об’ємом 200 л, звідки гланапон дозовано потрапляє у ферментер після сигналу датчика піни.
ДР 5.2. Стерилізація піногасника
Стерилізацію піногасника проводять безпосередньо в мірнику (М-27) при температурі 131 °С протягом 40 хв подачею гострої пари в сорочку мірника.
ДР 6 Підготовка соляної кислоти та гідрооксиду натрію
ДР 6.1 Підготовка соляної кислоти
10 % розчин соляної кислоти готується розведенням з більш концентрованого 35 % розчину до встановлення необхідної концентрації за формулою:
![]()
де V1 – об’єм концентрованої соляної кислоти V2 – об’єм соляної кислоти необхідної концентрації, л; С1 та С2 – відповідно концентрації концентрованої (35%) і необхідна концентрація кислоти, %.
![]()
Тому для приготування 10 % соляної кислоти необхідно наповнити мірник (М-50) ємкістю 10000 л 5715 літрів води, долити 2285 л 35 % соляної кислоти.
ДР 6.2 Підготовка гідрооксиду натрію
Щоб приготувати 10 % розчин гідрооксиду натрію необхідно помістити у мірник (М-51) ємкістю 2000 л 100 кг сухого порошку NaOH та додати до нього 1000 л води, ретельно перемішати та простерилізувати. Маємо 1000 л 10 % розчину гідрооксиду натрію.
ДР.7 Приготування компонентів поживного середовища
Всі окремі складові частини середовища перед приготуванням стерилізуються. В залежності від природи речовин обирають відповідні режими стерилізації.
ДР 7.1. Приготування компонентів поживного середовища для культивування в колбах на качалках.
Оскільки деякі речовини неможна стерилізувати разом, то на першому етапі розподіляємо їх на групи:
Таблиця 8.6 Розрахунок кількості компонентів та води
| Назва компонентів | Кількість компонентів у 1 літрі ПС, (г/л) | Кількість компонентів для 0,596 л ПС, кг/дм3 | Композиції | Кількість води для розчинення, (л) |
| Сахароза | 300 | 0,179 | А | 0,202 |
| Дріжджовий екстракт | 5 | 0,003 | ||
| Пептон | 5 | 0,003 | ||
| K2HPO4 | 15 | 0,0089 | Б | 0,100 |
| NaCl | 0,01 | 0,000006 | В | 0,100 |
| MgSO4×7H2O | 0,01 | 0,000006 | ||
| MnCl2×H2O | 0,01 | 0,000006 | ||
| CaCl2 | 0,05 | 0,00003 |
ДР 7.1.1 Приготування і стерилізація композиції А
0,176 кг сахарози та дріжджового екстракту (0,003 кг) з 0,003 кг пептону зважуємо на папері, на технічних вагах. Далі наважку переносимо у колбу ємкістю 3 л, до наважок додаємо 0,202 мл води, перемішуємо до розчинення. Маємо 0,202 мл розчину сахарози та дріжджового екстракту з пептоном. Стерилізацію проводимо в автоклаві при температурі 112° С протягом 30 хвилин.
ДР 7.1.2 Приготування і стерилізація композиції Б
Готуємо розчин солі K2HPO4, а саме зважуємо 0,0089 г солі на папері на технічних вагах і переносимо у колбу місткістю 200 мл. До солі мірним циліндром доливаємо 200 мл води і перемішуємо до повного розчиненння. Стерилізуємо в автоклаві при температурі 131°С протягом 40 хвилин. Фосфорні солі ми повинні стерилізувати окремо від основних для того, щоб не утворився осад.
ДР 7.1.3 Приготування і стерилізація композиції В
Четвертий розчин солей робимо так само як і третій. Тобто зважуємо кожну сіль окремо на папері на технічних вагах, переносимо їх у колбу місткістю 250 мл. До солей мірним циліндром додаємо 100 мл води та розчиняємо їх. Маємо 100 мл сольового розчину, який стерилізуємо в автоклаві при температурі 131° С протягом 40 хвилин.
Після автоклавування та охолодження в стерильних умовах, в колбу з стерильною композицією А по черзі зливаємо усі раніше приготовлені та простерилізовані розчини солей. Маємо готове поживне середовище об’ємом 0,6 л.
ДР 7.2 Приготування компонентів поживного середовища для культивування в посівному апараті 1
Таблиця 8.7 Розрахунок кількості компонентів та води
| Назва компонентів | Кількість компонентів у 1 літрі ПС, г/л | Кількість компонентів для 5,67 ПС, кг/дм3 | Композиції | Кількість води для розчинення, (л) |
| Сахароза | 300 | 1,89 | А | 2 |
| Дріжджовий екстракт | 5 | 0,032 | Б | 0,5 |
| Пептон | 5 | 0,032 | ||
| K2HPO4 | 15 | 0,095 | В | 1,120 |
| NaCl | 0,01 | 0,00006 | ||
| MgSO4×7H2O | 0,01 | 0,00006 | ||
| MnCl2×H2O | 0,01 | 0,00006 | ||
| CaCl2 | 0,05 | 0,00032 |
ДР 7.2.1. Приготування і стерилізація композиції А
Таким чином 1,89 кг сахарози зважуємо на товарних вагах та переносимо у бутель ємкістю 10 л доливаємо 2 л води і стерилізуємо в автоклаві при температурі 112°С протягом 30 хвилин. Маємо розчин об’ємом 2 л.
ДР 7.2.2 Приготування і стерилізація композиції Б
Наважку дріжджового екстракту та пептону завантажують у колбу ємкістю 3 л і заливаються 0,5 л водопровідної води, стерилізацію проводять в автоклаві . Параметри стерилізації такі: Т = 112 °С, t = 40 хв .
ДР 7.2.3 Приготування і стерилізація композиції В
Зважуємо кожну сіль окремо на папері на технічних вагах, переносимо їх у колбу місткістю 3 л. До солей додаємо 1,120 л води та розчиняємо їх при перемішуванні. Маємо 1,120 л сольового розчину, який стерилізуємо при температурі 131°С протягом 40 хвилин.
Після автоклавування та охолодження розчини А, Б та В переносимо в посівний апарат об’ємом 10 л. Маємо готове поживне середовище об’ємом 5,67 л.
ДР 7.3 Приготування компонентів поживного середовища для культивування у малому посівному апараті 2
Таблиця 8.8 Розрахунок кількості компонентів та води
| Назва компонентів | Кількість компонентів у 1 літрі ПС, (г/л) | Кількість компонентів для 55,8 л ПС, кг/дм3 | Композиції | Кількість води для розчинення, (л) | |
| Сахароза | 300 | 18,6 | А | 20 | |
| Дріжджовий екстракт | 5 | 0,31 | Б | 5, 645 | |
| Пептон | 5 | 0,31 | |||
| K2HPO4 | 15 | 0,93 | В | 10 | |
| NaCl | 0,01 | 0,00062 | |||
| MgSO4×7H2O | 0,01 | 0,00062 | |||
| MnCl2×H2O | 0,01 | 0,00062 | |||
| CaCl2 | 0,05 | 0,0031 | |||
ДР 7.3.1. Приготування і стерилізація композиції А
Таким чином, 18,6 кг сахарози зважуємо на товарних вагах та переносимо в збірник (З-25) місткістю 50 л. Додаємо 20 л води та перемішуємо до розчинення. Стерилізуємо за допомогою подачі гострої пари в сорочку апарату, за таких параметрів: Т = 112 °С, t = 30 хв. Маємо розчин об’ємом 15 л.
ДР 7.3.2. Приготування і стерилізація композиції Б
Зважуємо дріжджовий екстракт та пептон на технічних вагах, далі наважки переносимо у збірник (З-26) місткістю 20 л. Доливаємо 5,645 л водопровідної води та проводимо процес стерилізації за таких параметрів: Т = 112 °С, t = 40 хв .
ДР 7.3.3. Приготування і стерилізація композиції В
Зважуємо кожну сіль на технічних вагах та переносимо у посівний апарат об’ємом 100 л. Подаємо воду (10 л) та перемішуємо до розчинення. Проводимо процес стерилізації при температурі 131° С протягом 40 хвилин.
Для запобігання випадання фосфорних солей в осад, рН середовища доводиться до значення 4,0 за допомогою 10 % соляної кислоти. Після стерилізації розчин охолоджується подачею холодної води в трубу апарата і його рН доводиться до значення 5,5 – 5,6 за допомогою стерильного 10 % розчину гідроксиду натрію.
До простерилізованої композиції В за допомогою з’єднувальних трубок додаємо готовий, простерилізований розчин А та Б із збірників. Маємо 55,8 л готового поживного середовища.
ДР 7.4. Приготування та стерилізація поживного середовища для культивування у посівному апараті 2
Таблиця 8.9 Розрахунок кількості компонентів та води
| Назва компонентів | Кількість компонентів у 1 літрі ПС, (г/л) | Кількість компонентів для 548 л ПС, кг/дм3 | Композиції | Кількість води для розчинення, (л) |
| Сахароза | 300 | 182,7 | А | 200 |
| Дріжджовий екстракт | 5 | 3,045 | Б | 10,03 |
| Пептон | 5 | 3,045 | ||
| K2HPO4 | 15 | 9,135 | В | 140 |
| NaCl | 0,01 | 0,0061 | ||
| MgSO4×7H2O | 0,01 | 0,0061 | ||
| MnCl2×H2O | 0,01 | 0,0061 | ||
| CaCl2 | 0,05 | 0,03 |
ДР 7.4.1. Приготування і стерилізація композиції А
Отже, зважуємо сахарозу на товарних вагах у необхідних кількостях (див. табл. 3.8) завантажуємо її у збірник (З-25) об’ємом 500 л. Додаємо воду та перемішуємо за допомогою механічної мішалки до розчинення. Далі проводимо процес стерилізації, за допомогою подачі гострої пари в сорочку апарата, за таких параметрів: Т = 112 °С, t = 30 хв.
ДР 7.4.2. Приготування і стерилізація композиції Б
Наважки дріжджового екстракту та пептону переносимо у збірник (З-30) ємкістю 50 л та додаємо воду (10,03 л). Стерилізуємо за допомогою подачі гострої пари в сорочку апарата при таких параметрах: Т = 112 °С, t = 40 хв .
ДР 7.4.3. Приготування і стерилізація композиції В
Зважуємо кожну сіль на технічних вагах та переносимо у посівний апарат об’ємом 1000 л. Подаємо воду (140, 89 л) та перемішуємо до розчинення. Проводимо процес стерилізації при температурі 131° С протягом 40 хвилин.
Для запобігання випадання фосфорних солей в осад, рН середовища доводиться до значення 4,0 за допомогою 10 % соляної кислоти. Після стерилізації розчин охолоджується подачею холодної води в трубу апарата і його рН доводиться до значення 5,5 – 5,6 за допомогою стерильного 10 % розчину гідроксиду натрію.
До простерилізованої композиції В за допомогою з’єднувальних трубок додаємо готовий, простерилізований розчин А та Б із збірників. Маємо 515,6 л готового поживного середовища.
ДР 7.5. Приготування та стерилізація поживного середовища для культивування у ферментері
Таблиця 8.10 Розрахунок кількості компонентів та води
| Назва компонентів | Кількість компонентів у 1 літрі ПС, (г/л) | Кількість компонентів для 5321,7 л ПС, (кг) | Композиції | Кількість води для розчинення, (л) |
| Сахароза | 300 | 1773,9 | А | 3000 |
| Дріжджовий екстракт | 5 | 29,565 | Б | 400 |
| Пептон | 5 | 29,565 | ||
| K2HPO4 | 15 | 88,695 | ||
| NaCl | 0,01 | 0,059 | ||
| MgSO4×7H2O | 0,01 | 0,059 | ||
| MnCl2×H2O | 0,01 | 0,059 | ||
| CaCl2 | 0,05 | 0,296 |
ДР 7.5.1. Приготування і стерилізація композиції А
Стерилізацію сахарози проводимо окремо від інших компонентів в збірнику (З-40) об’ємом 10 м3 л. Зважуємо сахарозу на товарних вагах, переносимо до збірника та стерилізуємо за допомогою подачі гострої пари в сорочку апарата за таких параметрів: Т = 112 °С, t = 30 хв.
ДР 7.5.2. Приготування і стерилізація композиції Б
Для стерилізації компонентів поживного середовища (крім сахарози) будемо використовувати Установку безперервної стерилізації (УБС) об’ємом 5 м3. За допомогою даної установки, ми завантажуємо усі компоненти (попередньо зважені у необхідних кількостях) почергово, що заощадить нам час підготовки поживного середовища. Компоненти завантажуються починаючи з тих, які мають найменшу температуру стерилізації (дріжджовий екстракт, пептон). Після цього завантажують фосфорні та основні солі почергово, задля запобігання випадання осаду.
Спочатку компоненти зважують на товарних вагах, а потім переносять у збірник (З-37). Далі за допомогою насоса (Н-44) воно потрапляє у колонку нагріву (К-38) і після цього у теплообмінник-витримувач (Т-39). Наступною стадією є попередній підігрів поживного середовища у теплообміннику рекуператорі (Т-41). І тільки після цього стерильне поживне середовище за допомогою насоса (Н-42) потрапляє у реактор (Р-43).
ТП 8. Підготовка посівного матеріалу
Для засівання готують посівний матеріал глибинним способом.
ТП 8.1. Вирощування посівного матеріалу для засіву колб
Культуру L. mesenteroides PCSIR-4 засівають на скошене агаризоване середовище (ГКА) та вирощують протягом 18 годин при температурі 26°С та рН 5,5.
ТП 8.2. Підготовка поживного середовища та вирощування інокуляту в колбах на качалках
В колбу місткістю 3 л зливаємо стерильні розчини А, Б, В від ДР 7.1.4. Розливаємо дане поживне середовище (при палаючих пальниках) по 200 мл в качалочні колби місткістю 750 мл. Будемо мати 3 колби. В стерильних умовах в кожну качалочну колбу вносимо посівну культуру L. mesenteroides вирощену на скошеному агаризованому середовищі (ГКА) в пробірках (13 пробірок з культурою). Колби ставимо на качалки з частотою обертання 250 об/хв.
ТП 8.3. Вирощування посівного матеріалу в інокуляторі
об’ємом 10 л.
Стерильні розчини А, Б, В від ДР 7.2.1., ДР 7.2.2., ДР 7.2.3 зливаємо у посівний апарат (Р-34), де міститься стерильний, охолоджений розчин солей, місткістю 10 л. Потім вносимо 0,6 л посівного матеріалу, приготовленого на попередньому етапі ТП 8.2. Культивування проводиться протягом 18 годин при Т = 26 ± 1 °С при постійному перемішуванні (частота обертання 250 об/хв) і подачі очищеного повітря від ДР 3.8., рН = 5,5 – 5,6 на сталому рівні.
Піногасник вносимо тільки за необхідності, спостерігаючи за протіканням технологічного процесу. Піногасник (ДР 5.2) вноситься в розрахунку 0,01 піногасника від загального об’єму поживного середовища.
ТП 8.4. Вирощування посівного матеріалу в посівному апараті об’ємом 100 л.
Даний етап проводять у посівному апараті (Р-35) об’ємом 100 л. Після змішування всіх компонентів середовища від ДР 7.3.1., ДР 7.3.2., додається посівний матеріал зі стадії ТП 8.3. по посівній лінії, що знаходиться під паровим захистом. Культивування проводиться протягом 18 годин при Т = 26 ± 1 °С, рН = 5,5 ± 0,1 при постійному перемішуванні (частота обертання 250 об/хв) і подачі очищеного повітря від ДР 3.8.
Піногасник вносимо тільки за необхідності, спостерігаючи за протіканням технологічного процесу. Піногасник (ДР 5.2) вноситься в розрахунку 0,01 піногасника від загального об’єму поживного середовища.
ТП 8.5. Вирощування посівного матеріалу в посівному апараті об’ємом 1000 л.
Для приготування даної кількості посівного матеріалу, у ферментер (Р-36)об’ємом 1000 л до простерилізованого розчину солей, подаємо (через з’єднувальні трубки) сахарозу та дріжджовий екстракт з пептоном від ДР 7.4.1., 7.4.2. Далі додаємо інокулят у кількості з попередньої стадії ТП 8.4. Культивування проводиться протягом 18 годин при Т = 26 ± 1 °С, рН = 5,5 ± 0,1 при постійному перемішуванні (частота обертання 250 об/хв) і подачі очищеного повітря від ДР 3.8.
Піногасник вносимо тільки за необхідності, спостерігаючи за протіканням технологічного процесу. Піногасник (ДР 5.2) вноситься в розрахунку 0,01 піногасника від загального об’єму поживного середовища.
ТП 9. Виробниче культивування
ТП 9.1. Виробниче культивування
Для приготування даної кількості посівного матеріалу, у ферментер (Р-43) об’ємом 10 000 л подаємо простерилізовані компоненти з УБС та сахарозу (вносимо дробно), яка стерилізувалася в окремому збірнику. Через засівну лінію вносимо посівний матеріал з попередньої стадії ТП 8.4. Інокулят вноситься у кількості 10 % від робочого об’єму ферментера.
Культивування проводиться протягом 18 годин при Т = 26 ± 1 °С, рН = 5,5 ± 0,1 при постійному перемішуванні (частота обертання 250 об/хв) і подачі очищеного повітря від ДР 3.8.
Піногасник вносимо тільки за необхідності, спостерігаючи за протіканням технологічного процесу. Піногасник (ДР 5.2) вноситься в розрахунку 0,01 піногасника від загального об’єму поживного середовища.
ТП 10 Виділення та очищення полісахариду декстрану.
ТП 10.1 Оброблення культуральної рідини.
ТП 10.1.1 Розбавлення водою.
У реактор (Р-45) ємкістю 30 000 літрів, оснащений мішалкою, перекачують культуральну рідину, отриману в процесі біосинтезу. До культуральної рідини додають 3 об’єми дистильованої води, тобто 18000 літрів, ретельно перемішують. Кількість обертів мішалки становить 180 об./хв..
ТП 10.2 Відділення бактеріальних клітин.
ТП 10.2.1 Центрифугування.
Після зменшення в’язкості, культуральна рідина за допомогою насосу (Н-46) надходить до центрифуги, де відбувається процес осадження клітин-продуцента. Центрифугування (Ц-47) відбувається за таких параметрів: частота обертання (n) 10 000 об/хв., протягом 15 хвилин. Отриманий супернатант переходить на наступну технологічну стадію. Осад знешкоджують.
ТП 10.3 Виділення декстрану.
ТП 10.3.1 Осадження полісахариду.
Отриманий супернатант на попередній стадії, поміщають у три реактори (Р-48) ємкістю 20 000 літрів кожний, оснащених мішалкою. До супернатанту, через передавальні лінії, додають охолоджений спирт 96 % у кількості 3 об’єми на 1 об’єм розчину. Тобто, ми повинні внести 50000 літрів спирту для осадження ЕПС.
ТП 10.3.2 Розбавлення водою (розчинення ЕПС).
До осаду, що утворився додають ін’єкційну воду для розчинення полісахариду. рН суспензії, що утворилася буде близькою до 6,0. Воду додають у кількості 1:1 (1 об’єм води та 1 об’єм суспензії).
ТП 10.4 Фракціонування декстрану.
ТП 10.4.1 Деструкція полісахариду.
Після отримання водного розчину декстрану, необхідно провести його деструкцію. Від реакторів (Р-48) за допомогою насоса (Н-59) перекачуть суспензію до трьох реакторів (Р-52), об’ємом 20000 л кожний, проводять процес кислотного гідролізу за допомогою соляної кислоти. Процес проходить таким чином: за допомогою насосу подають 10 % розчин соляної кислоти (нагріту до температури 85-870 С) у реактор із водним розчином декстрану до отримання рН 1,0-1,5. Ретельно перемішують протягом декількох хвилин.
ТП 10.4.2 Нейтралізація кислоти.
Процес проводять у тих же реакторах (Р-52), де проводився процес деструкції. До отриманого розчину (соляна кислота та декстран) додають 10 % розчин NaOH для нейтралізації соляної кислоти до рН 6,0-6,5. Маємо готовий розчин декстрану з фракціями різної молекулярної маси.
ТП 10.4.3 Ультрафільтрація розчину.
Розділення декстрану на фракції буде здійснюватися на ультрафільтраційній установці «Амикон» (США) (УФ-54). З реакторів (Р-52) уже готові фракції декстрану різної молекулярної маси перекачують насосом (Н-53) до ултрафільтраційної установки. Мембрани виготовлені з поліелектролітного комплексу, робочий тиск 0,38 МПа. Процес проходить таким чином, що на мембрані затримується високомолекулярна фракція, а низькомолекулярна (10000 кДа) проходить через мембрану і надходить у реактор (Р-55).
![]() РОЗДІЛ 9
РОЗДІЛ 9
КОНТРОЛЬ ВИРОБНИЦТВА
9.1 Карта постадійного контролю
Для забезпечення відповідності готової продукції вимогам згідно науково-технічної документації на підприємстві здійснюється контроль процесу виробництва та контроль готової продукції.
У процесі виробництва контролюють відповідність сировини, допоміжних матеріалів та напівпродуктів вимогам нормативно-технічної документації, контролюють санітарний стан цехів та робочих місць, виконання регламентованих технологічних операцій і виконання технологічних режимів роботи.
Таблиця 9.1 Карта постадійного контролю
| Номер контрольної точки та назва стадії | Об’єкт контролю і показник, що визначається | Методи контролю | Періодичність перевірки та порядок відбору проб | Нормативна характеристика показника, що визначається |
| К 1.2.1 Технологічний контроль процесу прання одягу | Температура, час | Термометр, годинник | Під час кожного прання | Т = 60 °С, t = |
| К 1.2.2 Технологічний контроль процесу сушіння одягу | Температура, час | Термометр, годинник | При подачі повітря | Т = 80–90 °С, t = |
| К 1.2.3 Технологічний контроль процесу упаковки одягу | Якість упаковки | Візуально | Під час упаковки | Якість |
| К 1.2.4 Мікробіологічний контроль процесу зберігання одягу | Наявність мікроорганізмів та часток | Лічильник часточок | Під час зберігання | КУО5 |
| К 1.3.1.2 Технологічний контроль зберігання розчину «Стерилліум» | Час | За журналом контролю | Під час зберігання | t = 48 год. |
| К 1.3.2.1 Технологічний контроль приготування розчину «Дезосепт» | Концентрація робочого розчину | Хімічний | Під час кожного приготування | С=0,05–0,15% |
| К 1.3.2.2 Технологічний контроль зберігання розчину «Дезосепт» | Час | За добовим годинником | Під час зберігання | t = 48 год. |
| К 1.3.2.3 Технологічний контроль процесу приготування розчину «Полідез» | Концентрація робочого розчину | Хімічний | Під час кожного приготування | С=0,1–0,5% |
| К 1.3.2.4 Технологічний контроль процесу зберігання розчину «Полідез» | Час | За годинником | Під час зберігання | t = 48 год. |
Продовження табл. 9.1
| К 1.3.3.1 Технологічний контроль приготування розчину «Хлорантоін» | Концентрація робочого розчину, температура | Хімічний | Під час приготування | С=0,5=2,5%, Т = 60°С | ||
| К 1.3.3.2 Технологічний контроль зберігання розчину «Хлорантоін» | Час | За годинником | Під час зберігання | t = 48 год. | ||
| К 1.3.3.3 Технологічний контроль приготування розчину «Неохлор» | Концентрація робочого розчину | хімічний | Під час приготування | С=0,015–0,5% | ||
| К 1.3.3.4 Технологічний контроль зберігання розчину «Неохлор» | Час | За годинником | Під час зберігання | t = 48 год. | ||
| К 1.4.1 Мікробіологічний контроль щоденного прибирання приміщень | Наявність мікроорганізмів | Висів на щільні середовища | Після прибирання | КУО 100 | ||
| К 1.4.2 Мікробіологічний контроль генерального прибирання приміщень | Наявність мікроорганізмів | Висів на щільні середовища | Після прибирання | КУО 100 | ||
| К 1.5.1 Технологічний контроль миття та ополіскування обладнання | Час, температура | За допомогою годинника та термометра | Під час процесу | t = 45–60 год, Т=100°С | ||
| К 1.5.2 Технологічний контроль перевірки на герметичність обладнання | Тиск | За манометром | Під час процесу | Р = 0,5–0,6 МПа | ||
| К 1.5.3 Технологічний контроль стерилізації обладнання | Час, температура | За допомогою годинника, термометра | Під час процесу стерилізації | Т=130 ± 1°С, t = 45хв. | ||
Продовження табл. 9.1
| К2.3 Технологічний контроль кондиціонування повітря | Температура | Датчик температури, датчик вологості | Під час процесу | Т=19–23°С, W=60% |
| К 2.5 Технологічний та мікробіологічний контроль очищення повітря для D класу чистоти | Ефективність фільтрації | За допомогою лічильника часток | Після фільтрації | Е=99,95%, концентрація часток |
| К 3.2 Технологічний контроль очищення повітря на фільтрах грубої очистки | Ефективність фільтрації | За допомогою лічильника часток | Після фільтрації | Е=80%, концентрація часток |
| К 3.3 Технологічний контроль стиснення повітря | Тиск | манометр | Під час процесу | Р=0,35–0,5 МПА |
| К 3.4 Технологічний контроль охолодження повітря | Температура | Датчик температури | Під час процесу | Т=26°С |
| К3.5 Технологічний контроль процесу видалення вологи | Вологість | Під час процесу | W = 40% | |
| К 3.6 Технологічний контроль нагріву повітря | Температура | Датчик температури | Під час процесу | Т=26° + 1–2°С |
| К 3.7 Технологічний контроль очищення повітря на головному фільтрі | Ефективність фільтрації | За допомогою лічильника часток | Під час кожної зміни | Е=98%, концентрація часток |
| К 3.8 Технологічний контроль очищення повітря на індивідуальному фільтрі | Ефективність фільтрації | За допомогою лічильника часток | Під час кожної зміни | Е=99,995%, концентрація часток |
Продовження табл. 9.1
| К 4.1 Хімічний контроль приготування розчину соляної кислоти | Концентрація соляної кислоти, об’єм кислоти, об’єм води. | Титриметричний, хімічний, за датчиком рівня. | Після приготування розчину | С = 10 %, Vкислоти=28,75 л (35 %) Скислоти=10 % Vводи=71,25 |
| К 4.2, К 6.1 Хімічний, технологічний, мікробіологічний контроль приготування та стерилізації розчину гідроксиду натрію | Концентрація гідроксиду натрію, температура та час стерилізації, наявність мікроорганізмів, об’єм лугу, об’єм води. | Титриметричний, датчик температури, годинник, розведення та висів на МПА та ГКА, хімічний, за датчиком рівня. | Після приготування емульсії | С = 10 %, Т=131° С, t= 30 хв, присутність мікроорганізмів не допускається Vлугу = 10 кг, С лугу = 10 % Vводи = 100 л |
| К 5.2, К 6.2 Технологічний та мікробіологічний контроль стерилізації піногасника | Режим стерилізації розчину, температура, час, мікробна контамінація | Мікробіологічний метод, розведення та висів на МПА та ГКА | Температура визначається під час стерилізації. | t = 30 хв, Т= 120 °С, присутність мікроорганізмів не допускається. |
| К 7.1.1., К 7.2.1., Мікробіологічний, технологічний контроль приготування та стерилізації розчину А | Режим стерилізації розчину сахарози; температура; час; мікробна контамінація; | Технічний термометр, годинник, мікробіологічний метод, розведення та висів на МПА та ГКА. | Температура визначається безперервно під час стерилізації; наявність контамінантів після проведення стерилізації | T= 112 °С, t = 30 хв; присутність мікроорганізмів не допускається. |
| К 7.1.2., К 7.2.2., К 7.3.2., К 7.4.2. Мікробіологічний та технологічний контроль приготування та стерилізації розчину Б | Режим стерилізації розчину дріжджового екстракту та пептону, температура; час; мікробна контамінація | Технічний термометр, годинник, мікробіологічний метод, розведення та висів на МПА та ГКА. | Наявність контамінантів після проведення стерилізації, тиск під час стерилізації. | Т=112°С, Р = 0,15 МПа,
|
Продовження табл. 9.1
| К 7.1.2, К 7.1.3., К 7.1.4., К 7.2.3., К 7.3.3., К 7.4.3, К 7.5.2 Мікробіологічний та технологічний контроль приготування та стерилізації розчину В | Режим стерилізації фосфорних та основних солей, температура, час, мікробна контамінація | Технічний термометр, годинник, Автоматичний регулятор температури. Мікробіологічний метод, розведення та висів на МПА та ГКА. | Наявність контамінантів після проведення стерилізації, тиск під час стерилізації | Р = Т=131°С, 0,15 МПа,
|
| К 8.1., К 8.2. Технологічний та мікробіологічний контроль процесу вирощування інокуляту в колбах на качалках | Температура, час, кількість обертів мішалки, мікробна контамінація | Термометр технічний, годинник, ФЕК. мікроскопіювання, розведення та висів на МПА та ГКА. | Під час вирощування посівного матеріалу в колбах, наявність контамінантів після процесу ферментації. | T = 26 °С, t = 18 год, n = 250 об/хв, , відсутність сторонньої мікрофлори |
| К 8.3. Технологічний та мікробіологічний контроль процесу вирощування посівного матеріалу в посівному апараті 1 | Температура, час, кількість обертів мішалки, мікробна контамінація | Термометр, годинник, ФЕК, мікроскопіювання, розведення та висів на МПА та ГКА. | Під час вирощування посівного матеріалу в інокуляторі, наявність контамінантів після процесу ферментації. | T = 26 °С, t = 18 год, n = 250 об/хв; відсутність сторонньої мікрофлори |
| К 8.4. Технологічний та мікробіологічний контроль процесу вирощування інокуляту в посівному апараті 2 | Температура, час, кількість обертів мішалки, мікробна контамінація, концентрація розчиненого кисню в ПС від повного насичення. | Термометр, годинник, ФЕК, рН-метр, мікроскопіювання, розведення та висів на МПА та ГКА. | Під час вирощування посівного матеріалу в ферментері, наявність контамінантів кожні 4–6 годин.. | T = 26 °С, pH = 5,5, t = 18 год, n = 250 об/хв., N = 1 об/об/хв., відсутність сторонньої мікрофлори |
Продовження табл. 9.1
| К 8.5. Технологічний та мікробіологічний контроль процесу вирощування інокуляту в ферментері 1 | Температура, час, кількість обертів мішалки, мікробна контамінація, концентрація розчиненого кисню в ПС від повного насичення. | Термометр, годинник, ФЕК, рН-метр, мікроскопіювання, розведення та висів на МПА та ГКА. | Під час вирощування посівного матеріалу в ферментері, наявність контамінантів кожні 4–6 годин. | T = 26 °С, pH = 5,5, t = 18 год, n = 250 об/хв., N = 1 об/об/хв., відсутність сторонньої мікрофлори | |||
| К 9.1 Технологічний, хімічний та мікробіологічний контроль при виробничому культивуванні | Температура, час, рН, кількість обертів мішалки, мікробна контамінація, концентрація розчиненого кисню в ПС від повного насичення. | Термометр, годинник, рН-метр, оксиметр, ФЕК, мікроскопіювання, розведення та висів на МПА та ГКА. | Під час вирощування посівного матеріалу у ферментері, наявність контамінантів кожні 4–6 годин. | T = 26 °С, pH = 5,5, t = 18 год, n = 250 об/хв., N = 1 об/об/хв., Сдекстрану = 90,4 г/л, Сдекстрансахарази = 108.26 ДСУ/мл, Скисню = 5%, відсутність сторонньої мікрофлори | |||
| К 10.1.1 Технологічний контроль розбавлення культуральної рідини | Об’єм | За датчиком рівня | Під час процесу | 1 Vк.р. = 3 Vводи | |||
| К 10.2.1 Технологічний контроль процесу центрифугування | Кількість обертів, час | Годинник | Під час процесу | п= 10 000 об/хв., t = 15 хв. | |||
| К 10.3.1 Хімічний, технологічний контроль осадження ЕПС | Концентрація спирту, об’єм | За датчиком рівня | Під час процесу | 1 Vк.р. = 3 Vспирту, Сспирту = 96% | |||
| К 10.3.2 Технологічний контроль розчинення ЕПС | Об’єм | За датчиком рівня | Під час процесу | 1 Vк.р. = 3 Vводи | |||
| К 10.4.1 Технологічний контроль деструкції ЕПС | Об’єм, концентрація кислоти, рН | За датчиком рівня, за датчиком рН. | Під час процесу | С кислоти = 10 %, рН=1,0-1,5 | |||
Продовження табл. 9.1
| К 10.4.2 Технологічний контроль нейтралізації кислоти | Об’єм та концентрація гідрооксиду натрію, рН | За датчиком рівня, датчиком рН. | Під час процесу | Слугу = 10 %, рН=6,0-6,5 |
| К 10.4.3 Технологічний контроль ультрафільтрації | тиск. | манометр | Під час процесу | Р=0,38 МПа |
9.2 Мікробіологічний контроль
Першим етапом мікробіологічного контролю є перевірка культуральної рідини на чистоту за допомогою прямого мікроскопіювання (у пробах повинні бути тільки колонії біологічного агента – Leuconostoc mesenteroides PCSIR-4).
Морфолого-культуральні ознаки бактерій
Дрібні коки, розташовані як поодинці і попарно (25%), так і у вигляді ланцюжків (75%) витягнутої форми довжиною 0,5 – 0,7 × 0,7 – 1,2 мкм. Іноді спостерігаються довгі ланцюжки із коротких паличок з заокругленими кінцями. Не утворюють спори та нерухливі. Ростуть досить повільно, утворюючи дрібні, іноді слизисті колонії на середовищах з сахарозою [12].
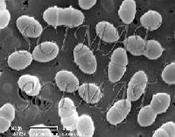
Рис. 9.1 Бактерії виду L. mesenteroides під електронним мікроскопом
При візуальному вивченні колоній, які виросли на поживному середовищі в термостаті при температурі 24°С і при використанні бінокулярної лупи при звичайному освітленні можна побачити колонії в S-формі не більше 2 мм в діаметрі, матові, зернисті, з рівними краями.
Але деякі мікроорганізми мають надзвичайно малі розміри, їх буде не видно у мікроскопі, тому необхідно зробити висів до ізольованих колоній на м'ясо-пептонний агар (МПА) (для бактерій) та глюкозо-картопляний агар (ГКА) (для грибів і дріжджів). Посіви на ГКА інкубують при 30 °С, результати посівів рахувати через 2 – 4 діб інкубування [12].
Після інкубації посівів на середовищах МПА не повинно бути виявлено ріст сторонньої мікрофлори, на середовищі ГКА – грибів і дріжджів. Мікробіологічний контроль здійснюють кожні 4 години [12].
9.3 Показники росту та синтезу цільового продукту
9.3.1 Конценртація біомаси
9.3.2 Концентрація цільового продукту
Визначення в’язкості — в культуральній рідині накопичується декстран і його концентрація визначається за ступенем в’язкості. Зміну в’язкості визначали в присутності 0,1 М KCl при рН 4–4,5 (за умови переведення ЕПС в Н+ — форму), в системі Cu2+ — гліцин.
Для вивчення поведінки розчинів декстрану в системі Cu2+ – гліцин до розчину ЕПС додавали 0,003 М CuSO4 × 5H2O та 0,015 М гліцину, розчин нагрівали до 80°С і витримували при цій температурі 5 хв, після чого охолоджували. В’язкість розчинів декстрану вимірювали на скляному капілярному віскозиметрі Оствальда при 20°С [28].
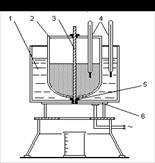
Рис. 9.2 Віскозиметр Енглера
ОПИС ДОСЛІДНОЇ УСТАНОВКИ
Віскозиметр Енглера (рис. 5.2) складається з металевої судини 2, поміщеної в водяну ванну 1.Посудина 2 має сферичне дно з припаяної до нього латунної циліндричної трубки
В отвір латунної циліндричної трубки вставляється платиновий насадок 5 діаметром 2,8 мм, службовець для випуску досліджуваної рідини з посудини 2. Отвір насадка 5 закривається спеціальним стержнем 3.Віскозиметр Енглера укомплектований спеціальним триніжком, на якому змонтований електронагрівач 6 для підігріву води та досліджуваної рідини.У посудину 2 наливають випробувану рідина, підігрівають її до заданої температури, а потім випускають через насадок. Ставлення часу закінчення t 200 см3 випробуваної рідини до часу закінчення t в 200 см3 дистильованої води при температурі 20°С називається градусом Енглера (0E).
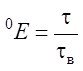 , (1)
, (1)
Для переходу від умовної в’язкості, вираженої в градусах Енглера, до кінематичного коефіцієнту в’язкості n (см2 / с) можна користуватися емпіричною формулою:
 , (2)
, (2)
ПОРЯДОК ВИКОНАННЯ РОБОТИ
1. Закрити отвір платинового насадка 5 стержнем 3 і налити в посудину 2 досліджувану рідину в кількості 200 см3.
2. За допомогою електронагрівача 6 і водяної ванни 1 підтримувати в посудині 2 необхідну температуру, контрольовану термометрами 4.
3. При досягненні заданої температури відкрити отвір насадка і визначити час t витікання 200 см3 досліджуваної рідини.
4. Досліди провести при наступних п’яти значеннях температури: кімнатної; 30°С;40°С; 50°С; і 60°С.
5. Після проведення останнього досліду рідину злити у відповідну посудину і протерти насухо віскозиметр. Час t в витікання 200 см3 дистильованої води при температурі 20°С прийняти рівним 54 с.
ОБРОБКА ДОСЛІДНИХ ДАНИХ
1. Обрахувати градус Енглера (0Е) i (i = 1, 2, 3, 4, 5) для кожного зробленого досліду за формулою (1).
2. Визначити кінематичний коефіцієнт в’язкості n i (i = 1, 2, 3, 4, 5) за емпіричною формулою Убеллоде (2).
3. Визначити динамічний коефіцієнт в’язкості m i (i = 1, 2, 3, 4, 5) за формулою (3).
 , (3)
, (3)
4. Побудувати графік залежності n від t і порівняти отримані числові значення n з відомими [28] .
9.3.3 Концентрація джерела вуглецю і азоту
Визначення концентрації джерела вуглецю
КОНДУКТОМЕТРИЧНИЙ БІОСЕНСОР НА ОСНОВІ ТРИФЕРМЕНТНОЇ СИСТЕМИ ДЛЯ ВИЗНАЧЕННЯ САХАРОЗИ
Підготовка проби
По закінченню ферментації відбирають пробу, далі розчин відфільтровують, для відділення біомаси. Отриманий фільтрат (супернатант) використовують у дослідженні [15].
Матеріали і методи
У дослідженнях використовували препарати ліофілізованих ферментів: ГОД із Penicillium vitale (ЕС 1.1.3.4.) з активністю 130 U/мг фірми «Діагностикум»; інвертазу (β фруктофуранозидазу, ЕС 3.2.1.26) із пекарських дріжджів з активністю 355 U/мг фірми Sigma Aldrich Chеmie (Німеччина); мутаротазу (ЕС 5.1.3.3.) з активністю 100 U/мг фірми Biozyme Laborаtories Ltd (Великобританія). Бичачий сироватковий альбумін (БСА, фракція V) та 50%_й водний розчин глутарового альдегіду (ГА) було отримано від фірми Sigma Aldrich Chеmie (Німеччина). Як субстрат і речовину для аналізів використовували цукрозу. Робочим буфером був калій фосфатний розчин (КН2Р04_NаОН), рН 7,2, фірми Меrck (Німеччина). Інші неорганічні сполуки, що їх застосовували в роботі, були вітчизняного виробництва зі ступенем чистоти «х.ч.» та «ч.д.а.». Використовували також вимірювальну установку та перетворювачі [17].
Виготовлення біоселективних мембран.
Для виготовлення робочої мембрани готували розчин зі вмістом ферментів: інвертаза —4%, мутаротаза — 3%, глюкозооксидаза — 3% (триферментний розчин) у 20 мМ фосфатному буфері, рН 7,2, з 10%_м гліцерол. Суміш для приготування референтної мембрани готували так само, але замість ферментів брали тільки БСА. Перед нанесенням на поверхню перетворювача розчини для референтної і робочої мембран змішували з 2%_м водним розчином глутарового альдегіду у співвідношенні 1:1 і наносили суміші на робочі поверхні гребінчастих електродів. Обидві мембрани мали однаковий вміст білка. Потім сенсори висушували протягом 20 хв на повітрі при кімнатній температурі. Перед початком роботи для вимивання надлишку ГА сенсор занурювали у буферний розчин, в якому і проводили подальші досліди [17].
Методика вимірювання.
Вимірювання проводили у 5мМ фосфатному буфері та універсальному буфері з різним рН при кімнатній температурі у відкритій комірці за інтенсивного перемішування. Концентрацію субстратів у комірці задавали, додаючи до робочого буфера порціями стандартні концентровані вихідні розчини субстрату. Дослідження здійснювали щонайменше у трьох серіях. Неспецифічні зміни вихідного сигналу, пов’язані з коливанням температури, рН середовища, електричними наводками, пригнічували, застосовуючи диференційний режим вимірювань [17].
Визначення концентрації джерела азоту
Метод К’єльдаля
Суть методу: суть методу заключається в розкладанні азотовмісної речовини і перетворення азоту в аміак, який потім кількісно визначають титруванням соляною кислотою [35].
Масову долю основної речовини визначають за формулою:
Х2 = ![]() , де
, де
V – об’єм розчину соляної кислоти концентрацією 0,1 моль/дм3, використану на титрування аналізуємої речовини;
V1 – об’єм розчину соляної кислоти, використаної на титрування в контрольному досліді;
m1 – маса аналізує мого реактиву;
m – маса наважки речовини.
Проведення обробки: оцтову кислоту обробляють на протязі однієї години розчином аніліну в оцтовій кислоті з масовою часткою 0,5 %.
Об’єм розчину аніліну необхідний для обробки 100 см3 оцтової кислоти (V) розраховують за формулою:
V = ![]() , де
, де
93,13 – молекулярна маса аніліну;
102,09 – молекулярна маса оцтового ангідриду;
Х – масова частка оцтового ангідриду в оцтовій кислоті.
До розрахованого об’єму додають надлишок розчину аніліну [35].
![]() РОЗДІЛ 10
РОЗДІЛ 10
ОХОРОНА ПРАЦІ
ВСТУП
Тема дипломного проекту «Виготовлення кровозамінника декстрану» (розробка проекту виготовлення кровозамінника декстрану). Суб’єктом охорони праці обрано мікробіолога. Робочим місцем даного суб’єкта є частина загального приміщення, що розташовується окремо. Розробка заходів з охорони праці необхідна для того, щоб забезпечити санітарно-гігієнічні, лікувально-профілактичні, правові та соціально-економічні заходів та засоби, спрямовані на збереження життя, здоров’я та працездатності людини в процесі трудової діяльності.
Сучасний стан охорони праці в Україні можна охарактеризувати як такий, що викликає серйозне занепокоєння. Створення безпечних умов праці – це невід'ємна частина соціально-економічного розвитку держави, складова державної політики, одна з найважливіших функцій органів виконавчої влади, місцевих державних адміністрацій, підприємств. Впродовж останніх 10 років в Україні намітилася позитивна тенденція до зниження рівня виробничого травматизму. Загальний травматизм зменшився в 4 рази, смертельний − в 2 рази.
На кожному підприємстві, в кожній установі, організації наявні установлені правила охорони праці, яких повинен дотримуватися кожен працівник. На робочому місці працівника повинні бути наявні оптимальні умови праці, дотримання яких створювало б усі передумови для найвищої працездатності людини. Саме для опису та повноти проведення заходів щодо надання оптимальних умов праці на робочому місці необхідно розробити розділ "Охорона праці".
10.1 Законодавство України, що забезпечує охорону праці
Основним законодавчим документом в галузi охорони працi є Закон Украни «Про охорону працi». Закон України «Про охорону праці» — це самостійна гілка в законодавстві України про працю. Закон визначає основні положення конституційного права громадян на охорону життя і здоров'я у процесі трудової діяльності, регулює відносини між роботодавцем і працівником з питань безпеки, гігієни праці, а також встановлює єдиний порядок організації охорони праці в Україні [44].
Даний закон був укладений 14 жовтня 1992 року та має велике соціально-економічне значення, оскільки стосується життєвих інтересів майже 30 мільйонів громадян України [44].
Дія закону поширюється на всі підприємства, установи і організації незалежно від форми власності та видів діяльності, фізичних осіб, які, відповідно до законодавства, використовують найману працю, та на всіх громадян, які працюють за наймом [44].
Система управління охороною праці (СУОП) є складовою частиною загальної системи керування підприємством або установою. При автоматизованих системах управління охороною праці є її складовою частиною, або підсистемою. Управління охороною праці передбачає участь у цьому процесі майже всіх служб та підрозділів підприємства, установи, організації, діяльність яких визначається Положенням про службу охорони праці. Об'єктом управління є діяльність структурних підрозділів, яка спрямована на створення безпечних і здорових умов праці. Управління охороною праці підприємства або установи у цілому здійснює роботодавець, а в підрозділах (цехах, відділах, службах) керівники або головні фахівці. Координує всю цю діяльність служба охорони праці. Завдання служби охорони праці та її функції викладені в Типовому положенні про службу охорони праці.
Взагалі охорону праці розглядають як елемент трудових правовідносин. Працівники мають право на безпечні та нешкідливі умови праці та охорону здоров'я в процесі професійної діяльності. Роботодавець зобов'язаний створити у кожному структурному підрозділі і на кожному робочому місці умови праці, що відповідають вимогам нормативних актів, а також забезпечити додержання прав працівників, гарантованих законодавством про охорону праці. Цей обов'язок роботодавця є комплексом зобов'язань, встановлених чинним законодавством, колективними та трудовими договорами і угодами [44].
Законодавством на працівника також покладаються зобов'язання з охорони праці. Він зобов'язаний знати і виконувати нормативно-правові акти з охорони праці, дотримуватись зобов'язань щодо охорони праці, передбачених колективним та трудовим договорами, проходити обов'язкові медичні огляди і співпрацювати з роботодавцем в організації безпечних і нешкідливих умов праці. Порушення працівниками зазначених обов'язків вважається дисциплінарним проступком, відповідно роботодавець має право застосувати до працівника заходи дисциплінарної відповідальності [44].
Особливістю законодавства України про охорону праці є те, що значна частина питань з охорони праці регулюється нормативними актами, прийнятими на конкретному підприємстві, в установі, організації. Порядок їх прийняття встановлюється централізованим законодавством [44].
10.2 Фінансування заходів з охорони праці
Відповідно до ст. 19 Закону України "Про охорону праці" фінансування заходів з охорони праці на підприємстві здійснюється роботодавцем.
Для підприємств, незалежно від форм власності, або фізичних осіб, які використовують найману працю, витрати на охорону праці становлять не менше 0,5 % від суми реалізованої продукції, а для підприємств, що утримуються за рахунок бюджету, такі витрати передбачаються в Державному або місцевих бюджетах і становлять не менше 0,2 % від фонду оплати праці [44].
Суми витрат з охорони праці, що належать до валових витрат юридичної чи фізичної особи, яка відповідно до законодавства використовує найману працю, визначаються згідно з переліком заходів та засобів з охорони праці, що затверджується Кабінетом Міністрів України [44].
Фінансування профілактичних заходів з охорони праці, виконання загальнодержавної, галузевих та регіональних програм поліпшення стану безпеки, гігієни праці та виробничого середовища, інших державних програм, спрямованих на запобігання нещасним випадкам та професійним захворюванням, передбачається, поряд з іншими джерелами фінансування, визначеними законодавством, у Державному і місцевих бюджетах, що виділяються окремим рядком [36].
10. 3 Аналіз шкідливих та небезпечних виробничих факторів
Аналіз шкідливих та небезпечних виробничих факторів проводять згідно з ГОСТ 12.1.003-74. Небезпечними та шкідливими називають фактори, що призводять до раптового погіршення здоров’я людини, або навіть смерті, під час її трудової діяльності [37].
10.3.1 Повітря робочої зони
Стан повітря у приміщенні називають мікрокліматом. Мікроклімат повинен відповідати ДСН 3.3.6.042-99 "Стан повітря робочої зони" [37].
Людина внаслідок своєї життєдіяльності виділяє тепло у навколишнє середовище. Інтенсивність витрат енергії залежить від характеру та інтенсивності праці, а також від параметрів оточуючого середовища і, у першу чергу, від стану повітря в приміщенні. Стан повітря у виробничому приміщенні називають мікрокліматом виробничого приміщення, або метеорологічними умовами [37].
Для забезпечення безпечних умов праці людини повітря у виробничому приміщенні повинно відповідати санітарно-гігієнічним нормативам.
![]() Мікроклімат виробничих приміщень визначається такими параметрами: температурою повітря в приміщенні, °С; відносною вологістю повітря, % і швидкістю руху повітря, м/с. Значення цих параметрів, які забезпечують найкраще самопочуття і найвищу працездатність людини, вважають оптимальними нормами мікроклімату. Відхилення зазначених параметрів повітряного середовища від оптимальних норм створює несприятливі метеорологічні умови, що призводять до погіршення самопочуття, передчасної втоми людини і зниження її працездатності.
Мікроклімат виробничих приміщень визначається такими параметрами: температурою повітря в приміщенні, °С; відносною вологістю повітря, % і швидкістю руху повітря, м/с. Значення цих параметрів, які забезпечують найкраще самопочуття і найвищу працездатність людини, вважають оптимальними нормами мікроклімату. Відхилення зазначених параметрів повітряного середовища від оптимальних норм створює несприятливі метеорологічні умови, що призводять до погіршення самопочуття, передчасної втоми людини і зниження її працездатності.
Мікроклімат виробничих приміщень нормується у залежності від теплових характеристик виробничого приміщення, категорії робіт по важкості і періоду року [37].
Для цеху приготування готового стерильного препарату існують наступні норми мікроклімату в залежності від періоду року:
Таблиця 10.1 Норми мікроклімату
| Виробничі приміщення | Категорія робіт | Період року | Температура, °С | Вологість, % | Фактичні значення | Швидкість руху повітря, м/с | Фактичні значення | |
| оптимальні значення | Дійсні Значення | |||||||
| Відділення ферментації | 2-а | Теплий | 21-23 | 20-22 | 40-60 | 45 | 0,1-0,2 | 0,1 |
| холодний | 18-20 | 16-21 | 40-60 | 50 | 0,1-0,2 | 0,1 | ||
| Відділення очищення продукту | 1-б | Теплий | 22-24 | 27-29 | 40-60 | 45 | 0,1-0,2 | 0,1 |
| холодний | 21-23 | 23-25 | 40-60 | 50 | 0,1-0,2 | 0,1 | ||
| Відділення пакування готової продукції | 1а | Теплий | 23-25 | 23-25 | 50 | 46 | 0,2 | 0,1 |
| холодний | 22-24 | 22-24 | 50 | 47 | 0,2 | 0,1 | ||
Оптимальними умовами праці є підтримання таких процесів, як вентиляція та кондиціювання виробничих приміщень. Контроль проводиться 1 раз на 2 місяці.
10.3.2 Шум та вібрації
Допустимі рівні шуму на робочих місцях регламентуються ДСН 3.3.6.037-99 «Санітарні норми виробничого шуму, ультразвуку та інфразвуку» [38].
Одним із найбільш розповсюджених негативних факторів, які впливають на людину в процесі виробництва є шум. Він завдає великої шкоди здоров’ю та виробничій діяльності людини. В результаті втоми, яка виникає під дією шуму, збільшується кількість помилок при роботі, підвищується загроза виникнення травм, знижується продуктивність праці. Для успішної боротьби з шумом необхідно знати його фізичну природу, основні закономірності його виникнення і поширення [38].
Шум – це механічні звукові коливання в пружних середовищах (повітря). Основним джерелом виробничого шуму на даних стадіях є обертаючі частини обладнання (мішалки в збірнику, мішалки в реакторі).
![]() З метою попередження високого рівня шуму проектують обладнання з малими габаритами деталей, що обертаються, і електроприводами малої потужності (до 5.0 кВт), які виробляють шум невисокого рівня, а саме 40 дБ, що знаходиться в межах допустимого рівня (не вище 80 дБ).
З метою попередження високого рівня шуму проектують обладнання з малими габаритами деталей, що обертаються, і електроприводами малої потужності (до 5.0 кВт), які виробляють шум невисокого рівня, а саме 40 дБ, що знаходиться в межах допустимого рівня (не вище 80 дБ).
Контроль проводиться 1 раз на рік [38].
10.3.3 Електробезпека
Виконання, розміщення, вибір, спосіб установки і клас ізоляції застосовуваних машин, апаратів та іншого електроустаткування проводять відповідно до вимог державних стандартів і правил експлуатації електроустановок відповідно до НПАОП 40.1-1.21-98 "Правила безпечної експлуатації електроустановок споживачів" [41].
Електричне обладнання становить велику потенційну небезпеку для людини. До небезпечних і шкідливих виробничих факторів відносять підвищене значення напруги в електричному полі, замкнення якого може відбутися через тіло людини, підвищений рівень статичної електрики, електромагнітних випромінювань, підвищену напруженість електричного та магнітного полів [41].
Електробезпека забезпечується відповідною конструкцією електроустановок, застосуванням технічних способів та засобів захисту, організаційними та технічними заходами.
Конструкція електроустановок в цеху виготовлення декстрану відповідає умовам експлуатації, забезпечує захист персоналу від дотику із струмоведучими і рухомими частинами та від попадання всередину обладнання сторонніх предметів і води.
10.3.4 Освітлення
Освітлення виробничих приміщень та допоміжних проектується з дотриманням ДБН В.2.5-28-2006 «Природне і штучне освітлення» [42].
Правильно виконане раціональне освітлення виробничих приміщень має важливе значення для виконання всіх видів робіт. Світло є важливим стимулятором не тільки зорового аналізатора, але й організму в цілому.
Раціональне освітлення є важливим фактором загальної культури виробництва. Воно забезпечує зоровий та психологічний комфорт працюючого, виключає професійні захворювання, сприяє збільшенню продуктивності праці, знижує небезпеку травматизму.
В денні робочі години – освітлення забезпечується природнім одностороннім бічним світлом, якого достатньо для 4 розряду зорових робіт середньої точності [42].
В вечірні та нічні години працівники використовують штучне освітлення, яке забезпечується за рахунок встановлених люмінесцентних ламп білого світла (ЛБ-80). Вони найбільш економні та дають світло теплих тонів. Лампи ЛТБ використовуються в примішеннях для відпочинку. Там, де необхідно проводити ретельний контроль якості продукції, належить застосовувати лампи ЛДЦ [42].
10.3.5 Пожежна безпека
Всі приміщення підприємства повинні відповідати вимогам пожежної безпеки і BBмати засоби пожежогасіння згідно з НАПБ А.01.001-2004 Правила пожежної безпеки в Україні [43].
Так як і на будь-якому біотехнологічному підприємстві, в даному приміщенні передбачається наявність трубопроводів з газом, наявність якого може стати причиною пожежі.
У цеху є в наявності вогнегасники: 1) вуглекислотний (ВВ – 2 шт.), 2) порошковий (ВП – 3 шт.) і ящики з піском, тканина для гасіння легкої пожежі. Для виявлення пожеж у цеху використовують тепловий оповіщувач ДСП-038, що реагуює на підвищення температури навколишнього середовища [43].
Евакуаційні шляхи забезпечують безпечну евакуацію всіх людей, що знаходяться в цеху, через евакуаційні виходи. Ширина шляхів евакуації в світлі повинна бути не менше 1 м, дверей - не менше 0,8 м. Висота проходу на шляхах евакуації повинна бути не менше 2 м [43].
10. 4 Пропозиції на покращення умов праці
Повітря робочої зони:
· теплоізоляція нагрітого обладнання;
· полегшення тепловіддачі від тіла людини в оточуюче середовище;
· індивідуальний захист від теплового впливу, а саме, використання сучасних матеріалів для пошиття захисного одягу;
· встановлення парового та теплового відведення.
2. Шум та вібрація:
· використання віброгасящих пристроїв та спеціального покриття;
· використання основ та фундаментів для віброактивного обладнання, які відповідають їх динамічним навантаженням;
· переведення енергії механічного коливання і інші види енергії.
3. Освітлення:
· встановлення достатньої кількості світильників та ламп;
· очищення та миття віконного скла світильників та ламп;
· встановлення сучасних газорозрядних ламп.
4. Електронебезпека:
· створення на підприємстві захисного заземлення;
· захисне відімкнення;
· ізоляція провідників із струмом;
· створення огороджувальних пристроїв;
· автоматизація попереджувальної сигналізації; наклеювання на обладнання різноманітних знаків безпеки;
· використання засобів захисту та запобіжних пристроїв;
· встановлення сучасних розпізнавальних знаків.
5. Пожежна безпека:
· використання пожежних оповіщувачів та автоматичних пожежних сигналізаторів;
· наявність у цеху сучасних вогнегасників типу ВП-4 (3) для уникнення небезпеки.
ВИКОРИСТАНА ЛІТЕРАТУРА
1. А.с. 2147316 , С12N1/20, A61K39/00, C12N1/20, C12R1:01. Штам бактерій Leuconostoc mesenteroides–продуцент антигенного комплекса содержащего белок / Суханов Ю.С., Баснакьян И.А., Алексахина Н.Н., Артемьева Т.А. – Опубл. 10.04.2002.
2. Василюк С. М., Клим’юк В. М. Комплексне лікування хворих на індукований тромбоз глибоких вен нижніх кінцівок // Харківська хірургічно школа. – 2010. – Т.44. - № 6. – С. 60-62.
3. Васильєва Тетяна хвороба артерій – облітеруючий ендартериїт // Медичні статті. – 2013. - №3. – С. 1-2.
4. Калунянц К. А., Голгер Л. И. Оборудование микробиологических производств. – М.: Агропромиздат, 1987. – 398 с. Кіндзерський Ю.В. Потенціал національної промисловості: цілі та механізми ефективного розвитку. – К.: НАН України; Ін-т екон. та прогноз., 2009. – 928 с.
5. Колесников А. М., Серединская А. И. Проблемы оказания неотложной помощи пациентам с травматическим шоком и основные направления организации интенсивной терапии // Травма. – 2011. – Т.12. № 1. – С. 1-7.
6. Коловоротски C. B. Инфузионные растворы: положение дел на фармацевтическом рынке Украины // Аптека. – 2002. – Т. 256. - № 35. – С. 1-5
7. Милешко М.И. Кровозаменители: Учебно-методическое пособие – Г.: ГрГМУ, 2012. – 108с.
8. Медведев В. С. Разработка технологии получения полиальдегиддекстранов окислением декстранов перманганатом калия: Дис. канд-та техн. наук, доцент. – Бийск, 2014. – 129 с.
9. Нормативне забезпечення: Метод. вказівки для студ. напряму 6.051401 «Біотехнологія» ден. форм. навч. / Уклад: С.В. Ігнатенко - К.: НУХТ, 2008. – С 55.
10. Основи наукових досліджень: Метод. вказівки до викон. курс. роботи для студ. напряму 6.051401 «Біотехнологія» ден. форм. навч. / Уклад: Т.П.Пирог, В.О. Красінько, Ігнатенко С. В. - К.: НУХТ, 2010. – С 55.
11. Панфилова Л. А. Кровезаменители и перфузионные растворы заводского изготовления. Обзор рынка, предложения, фармакоэкономическая оценка, динамика оптовых цен // Провизор. – 2000. - № 18. – С. 1-9.
12. Пирог Т.П. Загальна мікробіологія: Підручник –2-е вид., доп і перероб. – К.: НУХТ, 2010. – 632с.
13. Пирог Т.П.,Ігнатова О.А. Загальна біотехнологія: Підручник –К.: НУХТ, 2009. – 336с.
14. Поспелов К. Г. Сравнительный анализ рынков инфузионных растворов России, Беларуси, Украины и Казахстана // Ремедиум. – 2088. - № 11. – С. 1-3. Поспелов К. Г. Сравнительный анализ рынков инфузионных растворов России, Беларуси, Украины и Казахстана // Ремедиум. – 2088. - № 11. – С. 1-3.
15. Савенкова М. С. Синдром Рейно // Аптека. – 2013. - № 1. – С. 1-3.
16. Сидоров Ю. И. Промислові ферментери // Львівська політехніка. – 2011. - № 1. – С. 33-39.
17. Солдакін О.О., Пєшкова В.М.Кондуктометричний біосенсор на основі триферментної системи для визначення сахарози // Ін-т мол. біології і генетики НАН України. – 2008. – Том 1. – №1. – 116-122 с.
18. Фролова Г. І.,Фролова В. Ю. Конкурентоспроможність підприємств фармацевтичної галузі України // Вісник Бердянського університету менеджменту і бізнесу. – 2012. - № 1. – С. 146-152.
19. Чибисова Марина Госпитальный рынок Украины // Провизор. – 2007. - № 23. – С. 1-3.
20. GhosalT., ThaslimJ. Production and Cross Linking Studies of Dextran from Leuconostoc mesenteroides MTCC10508 for Biopolymer Preparation // J. Pharm. And Tech. – 2014. – Vol. 7. – № 1. – Р. 8-11.
21. KEGG: Kyoto Encyclopedia of Genes and Genomes. Pathway Database. [Електронний ресурс] // Режим доступу: http://www.genome.jp/kegg/.
22. Mary Helen P. B., Kate C. B. Dextran: effect process parameters on production, purification and molecular weight application // Dialogos & Ciencta. – 2012. – Vol. – 10. - № 7. – Р. 171-186.
23. Hamdy M. K.,Gardner E. Factors affecting production and clarification of dextran // Ohio Journal of Science. – 2001. – V.54. - № 5. – Р. 316-328.
24. Hamed A.,Mohsen G. Fermentativ production of dextran using Food industry wastes // Int. Sch. and Sci.. – 2010. – Vol.4. - № 1. – Р. 1015-1017.
25. Javad B., Zohreh S. Optimization of production by Leuconostoc mesenteroides NRRL B-512 using cheap and local sources of carbohydrate and nitrogen // Biotech. And Applied Bioch. – 2003. – Vol.38. - № 5. – Р. 267-269.
26. Moosavi-Nasab M., Alahdad Z., Nazemi S. Characterization of the Dextran Produced by Leuconostoc mesenteroides from Date Fruit Extract // Iran Agricultural Research. – 2009–2008. – Vol. 27–28. –№ 1-2.
27. Naussens .M, Cerdobble A. Leuconostoc dextransucrose and dextran: production, properties and application // Journal of Chemical Technology and Biotechnology. – 2005. – Vol.4. - № 6. – Р. 845-860.
28. QaderSAU, AmanA. Production of Dextran by Newly Isolated Strains of Leuconostoc mesenteroides PCSIR-4 and PCSIR-9 // Turk.J.Biochem. – 2006. – Vol. 31. – № 1. – P. 21-26.
29. Qader SAU, Aman A. Production & Characterization of a Unigua Dextran from an Indigenous Leuconostoc mesenteroides CMG713 // Int. J. Biol. Sci. – 2008. – Vol 4. – № 6. – Р. 379-386.
30. Santos M., Teixeira J. Production of dextransucrose, dextran and fructose from sucrose using Leuconostoc mesenteroides NRRL B512 (f) // Bio. Engin. Journal. – 2000. – Vol 4. – Р. 177-188.
31. Sivakumar B., Aswathi R., Sreejith R. Bacterial exopolysaccharide based magnetic nanoparticles: a versatile nanotool for cancer cell imaging, targeted drug delivery and synergistic effect of drug and hyperthermia mediated cancer therapy // J. Biomed. Nanotechnol. – 2014. – Vol 10, № 6. – Р. 99–121.
32. Caligur V. Dextran and Related Polysaccharides // BioFiles. – 2008. – № 17. – P. 1-4.
33. Пат. 2021284 РФ, С08В37/02, А61К31/715, Способ очистки клинических фракцій декстрана / Донецкий И. А., Персанова Л. В. – Опубл. 15.10.2000.
34. Пат. 2039754, С08В37/02, Способ получения низкомолекулярного декстрана / Петров П. Т., Гапанович В. Н. – Опубл. 20.07.2000.
35. ГОСТ 17444-76Реактивы. Методы определения основного вещества азотсодержащих органических соединений и солей органических кислот. – Введ. 01.07.1977.
36. ГОСТ 12.1.003-74. Опасные и вредные производственные факторы. Классификация.
37. ДСН 3.3.6.042-99. Санітарні норми мікроклімату виробничих приміщень.
38. ДСН 3.3.6.037-99. Санітарні норми виробничого шуму, ультразвуку та інфразвуку.
39. ДСН 3.3.6.039-99. Санітарні норми виробничої загальної та локальної вібрації.
40. НПАОП 0.01.1.01-95. Правила пожежної безпеки України.
41. НПАОП 40.1-1.21-98. Правила безпечної експлуатації електроустановок споживачів.
42. ДБН В.2.5-28-2006. Природне та штучне освітлення.
43. НАПБ А.01.001-2004. Правила пожежної безпеки в Україні.
44. Закон України «Про охорону праці». – 21.11.2002 р.
45. «Неохлор» лучшее средство дезинфекции, методические указания [Електронний ресурс] // Режим доступу: http://soda.kiev.ua/a110676-neohlor-luchshee-sredstvo.html.
46. Антисептик для рук Стериллиум [ Електронний ресурс] // Режим доступу: http://antiseptika.prom.ua/p1177565-antiseptik-dlya-ruk.html.
47. Засіб дезінфекції Хлорантоін [ Електронний ресурс] // Режим доступу: http://antiseptika. http://www.sfera.com.ua/dezinfekcija/khlorantoin.
48. Дезосепт форте [Електронний ресурс] // Режим доступу: http://www.datonal.org/?m0prm=3&m1prm=4&showItem=27.
49. Полідез [Електронний ресурс] // Режим доступу: http://datonal.org/?m0prm=3&m1prm=4&showItem=24.
50. http://www.genome.jp/kegg/ KEGG: Kyoto Encyclopedia of Genes and Genomes. Pathway Database.
51. Ультрафільтрація [Електронний ресурс] // Режим доступу: http://www.hydropark.ru/equipment/ultrafiltration.htm.
0 комментариев