Синаптофизин-1 это высоко консервативный, многочисленный, широко распространенный мембранный белок синаптических везикул, составляющий от 7 до 10% массы всех везикулярных белков. Синаптофизин это гексамерный белок, состоящий из мономеров массой 38 kDa, и основной интегральный белок везикул с нейротрансмиттером, он входит в группу MARVEL (MAL and Related proteins for VEsicle trafficking and membrane Link). Он формирует тяжелый высокомолекулярный комплекс в везикулярной мембране с низкомолекулярным белком, идентифицируемым как синаптобревин/VAMP. Каждая синаптическая везикула содержит около 32 копий синаптофизина, с которыми связана каждая вторая молекула синаптобревина (70 копий на везикулу, 8% по массе). С помощью ультраструктурной иммуноцитохимии СФ выявлен во всех малых (не содержащих пептиды) синаптических пузырьках в нервной системе, независимо от того, какой нейромедиатор они содержат, но не был обнаружен в мембранах крупных гранулярных пептидсодержащих везикул. Поскольку синаптофизин эксклюзивно представлен в синаптической везикуле, он широко используется как маркер пре-синаптической терминали.
Синаптофизин-1 содержит короткий амино-N-конец, 4 трансмембранных домена, две внутривезикулярных петли с дисульфидными мостиками и длинный карбоксильный С-конец, содержащий уникальный Са-связывающий повтор. Есть свидетельства, показывающие, что синаптофизин, особенно его 4ре трансмембранных домена, могут участвовать в формировании высокоизогнутой мембраны мелких пузырьков. Оба конца (N-амино и C-карбоксильный) вынесены на цитоплазматическую поверхность везикулы. Синаптофизин N-гликозилирован на первой внутримембранной петле и фосфорилирован по цитоплазматическому С-концу как серин-треониновой, так и тирозин-киназой. В зрелых терминалях это основной белок, несущий фосфотирозин. Основываясь на структуре, возможно, что синаптофизин формирует канал в везикулярной мембране и модулируется входом кальция.
В дополнение к синаптофизину-1 везикулы содержат высокогомологичный мембранный белок, названный синаптопорин или синаптофизин-2. Синаптофизин-1 и синаптофизин-2 показывают различное распределение по мозгу. Синаптофизин-1 повсеместно экспрессируется и присутствует во всех синапсах, тогда как синаптофизин-2 экспрессируется на высоких уровнях только в избранных нейронах, вероятно неся более специализированную функцию. В гиппокампе высокие уровни синаптофизина-2 детектируются в терминалях моховидных волокон. Хотя синаптофизин-2 представляет гетеромультимерную субъединичную структуру, наподобие синаптофизину-1, два синаптофизина существуют в различных комплексах и не формируют гетеромультимеры между собой. Множественная однотипная синаптическая экспрессия и субъединичная структура синаптофизина-1 наводила на мысль, что он может играть важную роль с экзоцитозе синаптических везикул. Эта гипотеза поддерживалась следующими исследованиями:
1) Было показано, что при воссоздании в плоском липидном бислое очищенный синаптофизин ассоциируется в мультимеры, которые формируют каналы в липидной мембране, и показывает потенциал-чувствительную канальную активность. В несимметричной концентрации KCl синаптофизин формировал быстро изменяющийся канал. Проницаемость для калия оказалась выше, чем для хлора в 8 раз. Каналы высокоселективны к калию, менее проницаемы для Na, Li, Cs, непроницаемы к кальцию, который не изменил его активность. Вероятность открытия каналов уменьшалась при деполяризации. Уменьшение вероятности открытия при высоких потенциалах происходит из-за уменьшения времени открытого состояния. При отрицательном потенциале канал полностью закрыт. Этот канал отличается от известных каналов не только специфической локализацией и структурой, но и биофизическими свойствами. Однако неясно, отражают ли эти каналы физиологически активное состояние синаптофизина-1, так как дисульфидные мостики и субъединичная структура очищенного синаптофизина-1 отличается от нативной.
2) Взаимодействие пузырька с плазматической мембраной происходит через формирование пор слияния. В этом процессе синаптофизин также принимает непосредственное участие. Известны два механизма слияния пузырьков: полное и переходное (также известное как kiss-and-run). Ряд работ доказывает, что взаимодействие синаптофизина с синаптобревином может регулировать выбор между kiss-and-run и полным слиянием. Когда синаптический пузырек закреплен на мембране, олигомеры синаптофизина могут быть встроены в мембрану в месте слияния в комплексе с еще неизвестными компонентами плазматической мембраны, что вызывает формирование каналов для быстрого освобождения нейромедиаторов во время kiss-and-run или полного слияния.
3) В блоттинговых экспериментах синаптофизин-1 показывал Ca-связывающую активность.
4) Инъекция тотальной мРНК из мозжечка крыс в ооциты Xenopus привело к кальций-зависимому высвобождению глутамата, который ингибировался ко-инъекцией антисмысловой РНК к синаптофизину. Однако предыдущие исследования с инъекциями мРНК в ооциты показали, что Са-зависимый выброс нейротрансмиттера выглядит как не везикулярный.
5) Инъекция антител к синаптофизину-1 в бластомеры Xenopus ингибировала секрецию трансмиттера в нейромышечном синапсе.
6) Трансфекция синаптофизина-1 в не нейрональные клетки приводила к его встраиванию в рецептор-опосредованный путь эндоцитоза и даже к созданию нового типа везикул.
7) Оверэкспрессия в ооцитах Xenopus приводила к усиленной нейротрансмиттерной секреции из получавшихся нейромышечных синапсов
8) Установлено, что СФ появляется в аксональных конусах роста до формирования синапсов. В ходе изучения процесса образования межклеточных контактов в культуре нервной ткани гиппокампа, содержащей клетки, лишенные синаптофизина, было выявлено значительное снижение плотности синапсов у этих клеток, по сравнению с синаптофизин-содержащими клетками.
Вместе эти результаты поддерживают мнение, что синаптофизин играет важную роль в нервной терминали. Однако функции, предполагаемые в этих различных экспериментах слишком разнообразны. В попытке выделить существенную функцию были изучены мыши, нокаутные по гену синаптофизина-1.
Мутантные мыши были жизнеспособны и фертильны. Кроме уменьшения синаптобревина/VAMPII не было обнаружено существенных изменений в структуре и белковом составе мозгов мутантов, макроскопически и микроскопически мозг был нормален, изменений в распределении антител к синаптофизину-2 и другим белкам не было. Синаптическая передача была нормальной без детектируемых изменений в синаптической пластичности или вероятности освобождения медиатора. Только синаптобревин показал статистически значимое снижение экспрессии. Вместе эти данные показывают, что отсутствие синаптофизина не вызывает структурных перестроек мозга, и не меняет его белковый состав.
Для анализа возможных эффектов на трансмиссию записывался суммарный возбуждающий постсинаптический ток в ответ на стимуляцию шафферовых волокон. Различий в вызванных ответах с группой контроля не было, формы пластичности не были изменены.
Эти результаты показывают, что делеция по синаптофизин1 не оказывает основного эффекта на Ca-зависимое высвобождение медиатора. Спонтанные события высвобождения, которые, как минимум, частично кальций-независимые тоже не изменялись.
Эти данные показывают, что синаптофизин, основной мембранный белок синаптических везикул, не существенен для синаптической функции. Единственные наблюдаемые изменения состояли из небольшого снижения синаптобревина-2 (<20%) и небольшого увеличения амплитуды квантов (<10%).
С точки зрения этих данных широкое представительство синаптофизина удивительно и расходится с данными о существенной роли, полученными непрямыми методами. Возможные объяснения:
1) Синаптофизин-1 функционально излишний. Возможно, синаптофизин-2 способен его замещать, однако синаптофизин1 и синаптофизин2 имеют различные паттерны распределения. Таким образом, если отсутствие фенотипа в нокаутных мышах происходит вследствие компенсации функций за счет синаптофизина-2, то низкие уровни синаптофизина 2 должны были бы полностью нсти эту функцию
2) Делеция синаптофизин1 может быть компенсирована изменением других белков, однако существенного изменения других белков, кроме синаптобревина, тоже не было обнаружено.
3) Синаптофизин1 несет не столь очевидную функцию.
4) синаптофизин-1 представляет собой эволюционный пережиток без функции, однако его многочисленность, эволюционная консервативность и белок-белковые взаимодействия ставят это под сомнение
Как тогда предыдущие результаты могут быть интерпретированы с позиций этих данных? Поскольку синаптофизин1 – многочисленный протеин, инъекция антител могла препятствовать экзоцитозу, поскольку АТ могли загородить везикулы от плазмалеммы. Возможно, что адаптивные изменения могут случаться в нокаутах, но не в системе ооцита. Выброс трансмиттера в ооците может не отражать функции везикул.
Поскольку синаптофизин и синаптобревин формируют комплексы в нейрональных терминалях, их взаимодействие может играть роль в функциях пресинапса, а синаптофизин выступает в роли внутреннего регулятора формирования комплекса. Для того чтобы понять, как синаптофизин контролирует траффик синаптобревина в нейроне использовалась комбинации имиджинговых техник на культуре, полученной от нокаутных мышей.
Локализованный возврат и рециркуляция везикул после экзоцитоза существенны для осуществления нейротранмиссии. Ключевое событие в этом процессе – эффективная кластеризация и возврат белков везикулы из плазматической мембраны, что обеспечивает корректность молекулярного состава везикулы для ее участия в следующем цикле нейротрансмиссии. Сортировка везикулярных белков осуществляется клатриновыми адаптерными белками, распознающими специфический эндоцитозный мотив груза. Однако не все белки везикулы имеют такой мотив, предполагая, что другие молекулы могут участвовать в их возврате.
Цитозольный конец syb2 содержит неканонический мотив распознавания грузов, предполагая, что он потенциально может быть распознан классическими или альтернативными адаптерными белками. Синаптофизин может быть шапероном для syb2, контролируя как его включение в везикулу, так и в SNARE комплекс. Поскольку синаптофизин вовлечен как в эндоцитоз везикул, так и в таргетинг syb2 к везикуле, он может быть потенциальным адаптерным протеином.
Для изучения этого наблюдали за переносом флюоресцентной метки, прикрепленной к syb2. Её динамика присутствия на поверхности отмечалась как увеличением (экзоцитоз), так и снижением (эндоцитоз). Syb2 с меткой в диких мышах показывал точечное распределение, а в нокаутных диффузное, свидетельствуя об ошибочной локализации в плазматической мембране.
Однако увеличение метки в плазматической мембране может быть, как из-за дефективного таргетинга к везикуле, так и из-за увеличенной доставки в мембрану, или из-за неэффективного возврата из плазматической мембраны. Дополнительные эксперименты со стимуляцией культур пачками потенциалов показали, что именно неэффективный возврат из мембраны – причина такого поведения меток: во время стимуляции метка эффективно включалась в мембрану клетки, однако после прекращения стимуляции нокаутные клетки не могли восстановить уровень метки к базовой линии. Экспрессия экзогенного синаптофизина привела к полному восстановлению кинетики возврата пузырьков.
Показано, что синаптофизин специфически требуется для возврата PH чувствительного флюоресцентно-меченого syb2-флюорина из плазматической мембраны при эндоцитозе. Возвращение других белковых грузов везикулы всё-таки происходило, хотя и с пониженной скоростью. Вклад этого замедления в общий эндоцитоз крайне мал, приводя к уменьшению эндоцитозной емкости лишь на 10% для определенных периодов. Эти результаты идентифицировали специфическую селективную вовлеченность синаптофизина в возврат синаптобревина при эндоцитозе везикул и наводят на мысль, что их взаимодействие может регулировать эффективность возвратного эндоцитоза пузырьков.
Дальнейшие исследования показывают, что кальциевый вход – ключевое событие в разобщении комплекса синаптофизин-синаптобревин, показывая, что манипулирование внутриклеточными уровнями свободного кальция может также влиять на возврат синаптобревина.
Также звестно, что мембрана синаптических пузырьков обогащена холестерином в сравнении с другими мембранами нейронов. Было показано, что одним из основных холестерин-связывающих белков везикул является синаптофизин. На этом факте основывается мнение о том, что СФ является одним из ключевых белков, необходимых для биогенеза синаптических пузырьков. Известно, что синаптобревин2 взаимодействует с синаптофизином через его трансмембранный регион, показывая, что локальное липидное микроокружение может быть критично в определении силы такого взаимодействия. Обеднение или расширение холистерольного состава мембраны приводит к сниженному или увеличенному формированию комплексов соответственно.
Некоторые факторы, однако не влияют на стабильность комплекса. Например, антагонисты протеин-киназ или фосфатаз не влияют на комплексы in vivo. Также присутствие цитозольного С-конца не требуется для связи с syb2. Цитозольный C-конец синаптофизина представляет собой классический сайт взаимодействия с адаптерным протеином AP2 плазматической мембраны. Таким образом, синаптофизин может действовать как молекулярный мост между классическими адаптерными протеинами и syb2.
Таким образом, синаптофизин хотя и не требуется для эндоцитоза как такового, он требуется для кинетически эффективного эндоцитоза синаптических везикул в культуре нейронов. Последние исследования показывают, что эндоцитоз, происходящий в течение постоянной стимуляции, протекает через молекулярные механизмы, которые отличаются от эндоцитоза после стимуляции. C-конец синаптофизина избирательно требуется для эндоцитоза в течение стимуляции, но не после остановки активности, отсутствие С-конца ведет к неэффективному эндоцитозу и приводит к синаптической депрессии при продолжительной активности. Таким образом, синаптофизин регулирует как минимум две фазы эндоцитоза, а дефекты эндоцитоза обостряют синаптическую депрессию и задержку пополнения пула медиаторов.
Приведенные данные указывают на роль синаптофизина в облегчении быстрого и эффективного эндоцитоза. Дефективные по синаптофизину нейроны показывают сниженный эндоцитоз, тогда как экзоцитоз и размер пула рециклинга не изменен. Обрезание С-конца приводит к замедлению эндоцитоза в течение нейрональной активности, но не влияет на эндоцитоз после неё.
Быстрая депрессия в синаптофизин-нокаутных нейронах напоминает нам о необходимости проверить возможность что быстрый возврат, или «кисс анд ран» эндоцитоз страдает в отсутствие синаптофизина. Соотношение эффектов «кисс ан ран» и быстрого возврата (в теч 1сек) в гиппокампальных синапсах обсуждается. В контроле только около 1.3% общего пула рециркуляции возвращается обычным эндоцитозом за 1 сек, след-но кисс и ран доминирует.
Альтернативное объяснение депрессии на нокаутах может быть в том, что синаптофизин может регулировать другой шаг – такой как очистка везикулярных сайтов высвобождения. Взаимодействия между SNARE белками на везикулярной и целевой мембранах должны быть разобщены после экзоцитоза, позволяя везикулам рециркулировать. Синаптофизин может ускорять этот процесс, связываясь с синаптобревином-2 и очищая его из активных зон. Недостаток синаптофизина может вызвать пробку везикулярных компонентов в сайтах высвобождения и приводить к депрессии. Однако неизвестно, является ли очистка сайтов высвобождения лимитирующей.
Есть два мнения относительно того, как везикулярный эндоцитоз может быть поврежден в отсутствие синаптофизина: 1) единичные события эндоцитоза становятся медленнее или 2) количество везикул, которые могут быть возвращены за одно время (синаптическая емкость) уменьшается, в то время как индивидуальные события остаются не затронутыми.
Похожие работы
... и радиоиммунологических методов позволила в 70 – 80‑е годы выявить в разных отделах нервной системы позвоночных и безпозвоночных множество пептидов, участвующих в синаптической передаче. Нейропептиды составляют четвертую, самую многочисленную группу медиаторов и, кроме того, выступают как модуляторы действия других медиаторов. 3.1. Принцип Дейла В 30‑е годы Г. Дейл пришел к ...
... нейротрофической и нейропротективной активности. Поэтому для лучшего понимания молекулярно-биохимических основ терапевтического действия препарата, необходимо ознакомиться с важнейшей группой нейропептидов - нейротрофическими ростовыми факторами (НРФ). Начиная с 70-х годов ХХ столетия, открытие и продолжающиеся интенсивные исследования нейротрофических ростовых факторов побудили к развитию новой ...
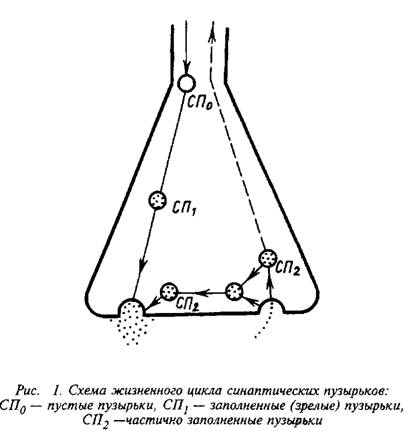
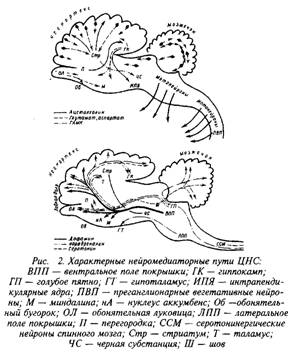

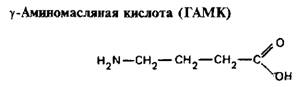
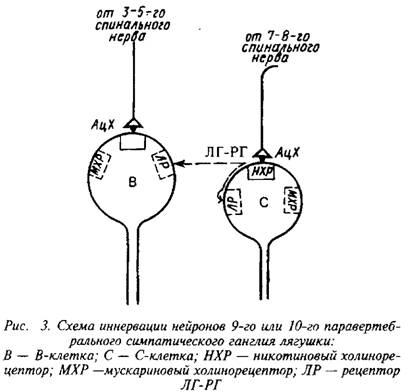
0 комментариев