Молекулярная электроника определяется как кодирование (запись), обработка и распознавание (считывание) информации на молекулярном и макромолекулярном уровне. Основное преимущество молекулярного приближения заключается в возможности молекулярного дизайна и производства приборов "снизу вверх", т.е. атом за атомом или фрагмент за фрагментом, - параметры приборов определяются органическим синтезом и методами генной инженерии. Двумя общепризнанными достоинствами молекулярной электроники являются значительное уменьшение размеров устройств и времени срабатывания (gate propagation delays) логических элементов.
В принципе, темпы развития компьютерных технологий таковы, что размеры полупроводниковых чипов согласно закону Мура приблизятся к молекулярным аналогам около 2030 года, что, однако, потребует значительных финансовых затрат. Выходом из положения может стать гибридная молекулярная и полупроводниковая технология, первым коммерческим успехом которой стали жидкокристаллические дисплеи (LCD).
Биоэлектроника, являющая разделом молекулярной электроники, исследует возможность применения биополимеров в качестве управляемых светом или электрическими импульсами модулей компьютерных и оптических систем (Birge R.R., 1999). Основное требование к вероятным кандидатам среди большого семейства биополимеров состоит в том, что они должны обратимо изменять свою структуру в ответ на некое физическое воздействие и генерировать, по крайней мере, два дискретных состояния, отличающихся легко измеряемыми физическими характеристиками (например, спектральными параметрами).
Значительный интерес в связи с этим представляют белки, основная функция которых связана с трансформацией энергии света в химическую в различных фотосинтетических системах. Наиболее вероятным кандидатом среди них является светозависимый протонный насос - бактериородопсин (БР) из галофильного микроорганизма Halobacterium salinarum (ранее Halobacterium halobium), открытый в 1971 году (Oesterhelt D., Stoeckenius W., 1971).
Бактериородопсин - ретиналь-содержащий генератор протонного транспорта представляет собой трансмембранный белок в 248 аминокислот с молекулярным весом 26 кДа, пронизывающий мембрану в виде семи a-спиралей; N- и C-концы полипептидной цепи находятся по разные стороны цитоплазматической мембраны: N-конец обращен наружу, а C-конец - внутрь клетки (рис.1, 2).
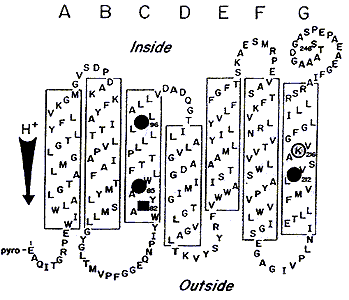
Рис.1. Модель БР в элементах вторичной структуры. Выделены аминокислоты,
участвующие в протонном транспорте: кружками остатки аспарагиновой кислоты,
квадратом остаток аргинина. С Lys-216 (К-216) образуется основание Шиффа (SB).
Стрелкой показано направление протонного транспорта.
Хромофор БР - протонированный альдимин ретиналя с e - аминогруппой остатка Lys-216 размещен в гидрофобной части молекулы. После поглощения кванта света в ходе фотоцикла происходит изомеризация ретиналя из all-E в 13Z-форму. Белковое микроокружение хромофора может рассматриваться как рецептор с субстратной специфичностью для all-E /13Z-ретиналя, который катализирует эту изомеризацию при комнатной температуре. Кроме того, часть аминокислот ответственна за подавление изомеризаций, отличных от all-E /13Z, например от all-E- к 7Z-, 9Z-, 11Z-ретиналю. Остальная часть полипептидной цепи обеспечивает канал протонного транспорта или экранирует фотохромную внутреннюю группу от влияний внешней среды.
Взаимная топография образованных полипептидной цепью БР элементов вторичной структуры после поглощения молекулой хромофора кванта света изменяется, в результате чего формируется канал трансмембранного переноса протонов из цитоплазмы во внешнюю среду. Однако молекулярный механизм светозависимого транспорта до сих пор неизвестен.
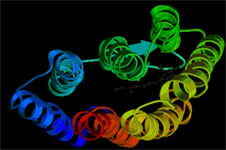
Рис.2. Схематическая модель трехмерной (пространственной) структуры БР (PDB Index 1FBB).
Семь a-спиралей формируют хромофорную полость и трансмембранный канал переноса протона.
БР содержится в клеточной мембране H. salinarum - галофильной архебактерии, которая живет и размножается в соленых болотах и озерах, где концентрация NaCl может превышать 4 М, что в 6 раз выше, чем в морской воде (~ 0,6 М). Этот уникальный белок во многом подобен зрительному белку родопсину, хотя их физиологические функции различны. В то время как зрительный родопсин действует как первичный фоторецептор, который обеспечивает темновое зрение большинства позвоночных животных, физиологическая роль БР заключается в том, чтобы давать возможность галобактериям действовать как факультативным анаэробам в случае, когда парциальное давление кислорода в окружающей среде мало. Белок функционирует как светозависимый протонный насос, который обеспечивает образование электрохимического градиента протонов на поверхности мембраны клетки, который, в свою очередь, служит для аккумулирования энергии. Первичная работа, производимая градиентом, заключается в синтезе АТФ через анаэробное (фотосинтетическое) фосфорилирование и, в этом случае, представляет собой классический пример хемиосмотической гипотезы Митчелла об окислительном фосфорилировании. Когда освещение отсутствует, а парциальное давление кислорода высоко, бактерии возвращаются к аэробному окислительному фосфорилированию (Lanyi J.K., 1978).
Клетки H. salinarum содержат также два так называемых сенсорных родопсина (СР I и СР II), которые обеспечивают положительный и отрицательный фототаксис. Различные длины волн считываются СР I и СР II как детекторными молекулами, что вызывает каскад сигналов, управляющих жгутиковым двигателем бактерии. При помощи такого элементарного процесса светового восприятия микроорганизмы самостоятельно перемещаются в свет подходящего спектрального состава. Кроме того, в клетках имеется галородопсин (ГР), представляющий собой светозависимый насос ионов Cl–. Его основная функция - транспорт в клетку ионов хлора, которые постоянно теряются бактерией, перемещаясь в направлении изнутри —> наружу под действием электрического поля, создаваемого БР. Механизм действия ГР неясен. Предполагается, что Cl– связывается с положительно заряженным четвертичным азотом протонированного Шиффова основания, а изомеризация ретиналя из all-E в 13Z-форму вызывает перемещение этого азота с прикрепленным к нему ионом Cl– от входного к выходному Cl– – проводящему пути.

Рис.3. Участок пурпурной мембраны (вид сверху).
БР локализован в участках клеточных мембран H. salinarum в виде пурпурных мембран (ПМ), образующих двумерные кристаллы с гексагональной решеткой. Эти участки содержат сам белок, некоторые липиды, каротиноиды и воду (рис.3). Обычно они имеют овальную или круглую форму со средним диаметром около 0,5 мкм и содержат около 25 % липидов и 75 % белка (Oesterhelt D., Stoeckenius W., 1974). ПМ устойчивы к солнечному свету, воздействию кислорода, температуре более чем 80ºC (в воде) и до 140ºC (сухие), рН от 0 до 12, высокой ионной силе (3 М NaCl), действию большинства протеаз, чувствительны к смесям полярных органических растворителей с водой, но устойчивы к неполярным растворителям типа гексана. Большое практическое значение имеет существующая возможность встраивания ПМ в полимерные матрицы без потери фотохимических свойств.
Индуцированный светом протонный транспорт сопровождается рядом циклических спектральных изменений БР, совокупность которых называется фотоциклом (рис.4). Тридцать лет исследований привели к довольно детальному пониманию фотоцикла, однако подробности протонного транспорта все еще изучаются.
Фотохимический цикл БР состоит из отдельных интермедиатов, которые могут быть идентифицированы как максимумами поглощения, так и кинетикой образования и распада. На рис.4 показана упрощенная модель фотоцикла БР (Hampp N., 2000).
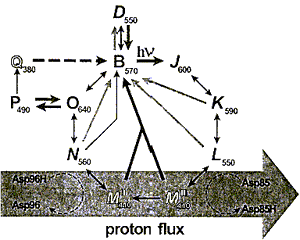
Рис.4. Фотоцикл БР.
Фотохимические и тепловые стадии показаны как толстые и тонкие стрелки соответственно. Вертикальные символы указывают на all-E-конформацию ретиналя (интермедиаты B и О), наклонные символы - на 13Z-конформацию. В темноте БР превращается в 1:1 смесь D и B, эта смесь называется темноадаптированным БР. При освещении БР происходит световая адаптация, т.е. переход в основное состояние B. Оттуда начинается фотоцикл, который приводит к транспорту протона через мембрану. В течение перехода L —> М, длящегося примерно 40 мксек, Шиффово основание депротонируется и Asp85 становится протонированным. Оттуда протон идет к внешней стороне внеклеточной части протонного канала. В течение перехода М —> N альдимин репротонируется. В качестве донора протонов выступает остаток Asp96. Asp96 репротонируется через цитоплазматический протонный полуканал. В то время как все преобразования между интермедиатами обратимы, переход от MI к MII, как полагают, является основным необратимым шагом в фотоцикле. В течение этого перехода азот Шиффова основания становится недоступным для внеклеточной части протонного канала, а только для цитоплазматического полуканала (Brown L.S. et al, 1998), что связано с конформационными изменениями белковой молекулы.
Физико-химические свойства интермедиатов характеризуются длиной волны их максимумов поглощения и величиной специфического молярного коэффициента экстинкции. Протонирование SB и конфигурация ретинилиденового остатка воздействует на величины максимумов поглощения. В течение фотоцикла БР происходит несколько зависящих от температуры конформационных изменений в белке, таким образом, формирование большинства интермедиатов может быть подавлено охлаждением.
Кроме основного фотоцикла имеется два состояния, которые могут быть вызваны искусственно. В интермедиатах P и Q конформация ретиналя 9Z. Это достигается после фотохимического возбуждения all-E-ретиналя, когда в то же самое время Asp85 протонирован. Это может быть достигнуто в диком типе БР при низком значении pH или деионизацией (формирование так называемых голубых мембран), однако такие препараты нестабильны. Альтернативным подходом является замена Asp85 аминокислотой, имеющей другое значение pKa, которая остается незаряженной при интересующих значениях pH или полное удаление карбоксильной группы методами сайт-направленного мутагенеза. Стабильность таких мутантных голубых мембран выше.
Уникальные свойства бактериородопсина обеспечивают широкий диапазон технических приложений, в которых он может использоваться, однако коммерчески осуществимы на сегодняшний день только оптические, поскольку их интеграция в современные технические системы наиболее проста.
Оптические приложения основаны на применении пленок БР - полимерных матриц различного состава с включенными в них молекулами белка. Впервые в мире такие пленки на основе дикого типа БР были получены и исследованы в нашей стране в рамках проекта "Родопсин"; в 80-х годах была продемонстрирована эффективность и перспективность применения таких материалов, названных "Биохром", в качестве фотохромных материалов и среды для голографической записи.
Весьма интересной является возможность варьирования фотохимических свойств пленок БР:
а) заменой природного хромофора на модифицированный;
б) химическими (физико-химическими) воздействиями;
в) точечными заменами определенных аминокислотных остатков методами генетической инженерии.
Такие модифицированные материалы могут обладать ценными специфическими свойствами, что предопределит их использование как элементной базы биокомпьютера.
Авторы статьи: Студентка 5-го курса МАТХТ им. М.В. Ломоносова, бакалавр технологии и биотехнологии Гончарова Елена. Главный научный сотрудник ФГУП "ГосНИИгенетика", д.б.н. Складнев Д.А
Похожие работы
... или вращении, а также комбинации всех этих способов. Рис. 6. Сравнение оптических и голографических методов записи Рисунок 7. Принцип голографической записи Рисунок 8. Схема записи/чтения данных методом голографии Достоинства голографической памяти: высокая плотность записи и большая скорость чтения; параллельная запись информации (не по одному биту, а целыми страницами, рис. ...
... масштаба с учетом признания важной роли нанотехнологий на самом высоком государственном уровне. Широкомасштабное и скоординированное развертывание на базе существующего задела работ в области нанотехнологий позволит России восстановить и поддерживать паритет с ведущими государствами в науке и технике, ресурсо- и энергосбережении, в создании экологически адаптированных производств, в ...
... воды определялся в лаборатории завода им. Кирова. Эти данные говорят о очень высоком содержании хлоридов и о высокой минерализации воды Мраморного озера. Глава 2. Объекты и методы исследования. С целью выделения и изучения галофильных микроорганизмов были отобраны пробы воды из антропогенного водоема гипсового карьера оз. Мраморное (народное название). Исследовались пробы воды из оз. ...
... качестве генераторов электрической энергии. Проведенные опыты — первый этап в создании новых видов фотоэлектрических и топливных элементов, способных трансформировать световую энергию с большой эффективностью. 7. Фотосинтез и урожай Жизнь современного человека немыслима без выращивания различных культурных растений. Органические вещества, образуемые ими в ходе фотосинтеза, служат основой ...
0 комментариев