Тианептин (коаксил) – новый антидепрессант с трициклической структурой. Одним из основных нейрохимических эффектов препарата является усиление обратного захвата серотонина. Антидепрессивный эффект тианептина подтвержден результатами ряда плацебо-контролируемых исследований при терапии пациентов психиатрического стационара в сравнении с эталонными антидепрессантами. Для оценки клинической переносимости и безопасности тианептина по результатам повседневной оценки было выполнено открытое мультицентровое исследование с большой выборкой амбулаторных пациентов, получавших терапию в течение трех месяцев в условиях общетерапевтической практики. В настоящем реферате изложены окончательные данные по всей изученной выборке: 1927 амбулаторных больных депрессией без признаков меланхолии и психотической симптоматики при участии 392 врачей общетерапевтической практики из разных клинических центров Франции. 1458 пациентов полностью завершили трехмесячный курс терапии.
МетодыХарактеристика пациентов
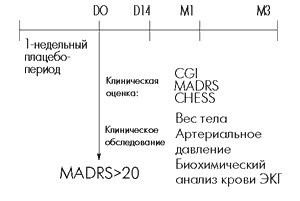
В выборку исследования включались амбулаторные больные, достигшие 18-летнего возраста. Основанием для включения служило соответствие критериям DSM-III для одной из следующих диагностических категорий: большой депрессивный эпизод (без признаков меланхолии и психотической симптоматики), первый (296.22) или повторный (296.32); дистимическое расстройство (300.40). Распределение пациентов с разными диагнозами депрессивных расстройств было рандомизированным. Другой критерий включения – суммарный балл шкалы оценки депрессии Монтогомери-Асберг (MADRS) > 20. Для включения в исследование требовалось письменное информированное согласие пациента на участие.
Схема терапии
В течение первых 7 дней исследования все пациенты получали плацебо. По завершении плацебо-периода назначался тианептин (таблетки по 12.5 мг) курсом на 3 месяца в суточной дозе 37.5 мг (1 таблетка 3 раза в сутки); пациенты старше 70 лет, а также больные с почечной недостаточностью получали 2 таблетки в сутки.
Отмена тианептина планировалась в зависимости от состояния пациента: предусматривалось быстрое снижение суточной дозы в течение 1 недели после завершения трехмесячного курса терапии с последующей полной отменой препарата.
Клиническая оценка
Оценка состояния пациентов проводилась исходно (Д0), через 14 дней (Д14), один (М1) и 3 (М3) месяца терапии, а также через 14 дней после постепенного снижения дозы и полной отмены терапии (М3 + 14 дней).
Для оценки использовались следующие шкалы: шкала общего клинического впечатления (GGI), MADRS и анкета для оценки соматических симптомов (CHESS).
Также проводилось тщательное клиническое обследование больных с регистрацией показателей массы тела и артериального давления в положении стоя и лежа в указанные выше дни.
Обострение симптоматики, признаки синдрома отмены и лекарственной зависимости регистрировались на М3+14 дней, через 1 неделю после полной отмены тианептина. Оценка параклинических показателей безопасности препарата предусматривала биохимические анализы крови и электрокардиографию (ЭКГ), которые выполнялись на Д0, М1 и М3. При анализе результатов терапии использовались различные показатели, которые обрабатывались с помощью вариационного анализа (субъект х время) с последующим расчетом по методу Newman-Keuls.
РезультатыПациенты и рейтинг участия врачей-терапевтов в отборе больных для исследования.
Всего в исследование было включено 1927 пациентов, отбор которых осуществлялся 392 врачами-терапевтами (ВТ). Для обеспечения гомогенности выборки каждому врачу, участвовавшему в исследовании, предлагалось отобрать от 5 до 10 больных. 100 ВТ (27%) полностью соблюдали это условие протокола, доля их пациентов составила 35% от всей выборки. 44 ВТ (11%) отобрали больше 10 пациентов каждый, а оставшиеся 248 ВТ (63:) – от 1 до 4 пациентов.
Тяжесть депрессии (MADRS) и частота большого депрессивного эпизода были выше среди пациентов, включенных врачами, наиболее активными в отборе больных. Поскольку эти показатели не являются клинически важными, терапевтическая эффективность тианептина оценивалась по данным всех больных, включенных в исследование.
Преждевременная отмена терапии потребовалась 303 (16.3%) пациентам по следующим причинам: 1) отсутствие эффекта или ухудшение состояния – 112 (6%) наблюдений, из них в 69 случаях это была единственная причина прекращения лечения в рамках исследования; обострение депрессивной симптоматики в течение 3 месяцев терапии – 19 (1%) наблюдений, из них в 32 случаях ремиссия была единственной причиной отмены терапии; 3) побочные эффекты – 90 (4.8%) наблюдений, из них в 51 случае побочные эффекты были единственной причиной отмены лечения.
Эффективность
У 79% пациентов на момент включения в исследование отмечалась “крайне тяжелая, тяжелая или умеренно тяжелая” депрессия. Общее улучшение состояния оценивалось с помощью шкалы GGI: “очень выраженное или выраженное” улучшение отмечалось на Д14 у 45% пациентов, на М1 – у 63%, на М3 – 66.5%.
За период исследования выявлены следующие изменения средних баллов MADRS:
– У пациентов, полностью завершивших курс терапии (n=1.449), снижение балла MADRS между Д0 (30.5±7.6) и М3 (10.4±7.6) составило 66%. Редукция исходного балла MADRS была статистически достоверной уже на Д14, а также между каждыми двумя последующими визитами.
– Окончательный анализ данных всех пациентов с минимум двумя показателями MADRS (n=1.837) подтверждает достоверное снижение среднего балла MADRS между Д0 (30.5±4.3) и М3 (12.7±8.6).
– При использовании в качестве критерия эффективности снижения исходного балла MADRS на > 50%, число респондеров составило 836 пациентов на М1 и 1100 – на М3. С учетом 40 случаев преждевременной отмены терапии из-за ремиссии процент реcпондентов на М3 составил 61.4%.
– Выявлены достоверные различия в редукции баллов MADRS между двумя диагностическими подгруппами: большой депрессивный эпизод (296.х2) и дистимическое расстройство (300.40). У пациентов, завершивших трехмесячный курс терапии, снижение исходного балла MADRS к М3 равнялось 68% в подгруппе 296.х2 (n=1.060; Д0: 31.2±6.5) и 60 в подгруппе 300.40 (n-389; Д0: 28,5±5.9, р<0,001). В каждой из двух диагностических групп снижение исходного балла MADRS было достоверным уже к Д14.
Клинические показатели безопасности и переносимости
Жалобы пациентов на ухудшение соматического состояния, которые ВТ расценивали как “вероятно” или “очевидно” связанные с приемом тианептина, регистрировались с помощью шкалы CHESS у всех больных изученной выборки (1837 пациентов обследовались исходно и не менее 1 раза во время лечения). К наиболее частым жалобам на ухудшение соматического состояния относились сухость во рту (12.2%), запоры (4.2%), ощущение горечи во рту (4.1%), сновидения неприятного содержания (3.6%), сонливость (3.6%), жалобы на увеличение веса тела (3.3%), ажитация/напряжение (2.7%), тошнота (2.6%).
Преждевременная отмена терапии из-за побочных эффектов потребовалась 90 пациентам (4.8% от всех включенных в исследование); для 51 из них побочные эффекты были единственной причиной прекращения лечения. Клинически тяжелых побочных эффектов ни у одного из больных, участвовавших в исследовании, не отмечалось. Наиболее часто преждевременная отмена терапии была связана с жалобами на тошноту (0.9%), нарушение сна (0.9%), тревогу/раздражительность (0.8%), головокружение (0.8%), слабость/ощущение дурноты (0.6%), головные боли (0.6%), нарушения со стороны желудка (0.6%), сухость во рту (0.5%), зуд/кожная аллергия (0.5%)), сердцебиение (0,4%), запоры (0.3%).
В целом представленные в жалобах пациентов изменения соматического состояния, связанные с приемом тианептина, характеризовались умеренной тяжестью; медикаментозная коррекция побочных эффектов потребовалась только в 4% случаев.
Индекс эффективности (шкала CGI, пункт 3), объединяющий эффективность и переносимость тианептина, оценивался во время каждого из указанных выше дней обследований. У пациентов, полностью завершивших исследование, среднее значение индекса эффективности составило 2.25 на М1 и 2.92 и на М3. У 986 (53%) больных отмечался выраженный или умеренный терапевтический эффект при полном отсутствии побочных эффектов в течение последнего месяца терапии.
Биологические показатели безопасности
Результаты анализов крови 1050 пациентов на М3 сравнивались с исходными показателями. Через 3 месяца терапии не было обнаружено достоверных изменений по таким показателям, как гемоглобин, гематокрит, количество эритроцитов, лейкоцитов, тромбоцитов и ретикулоцитов, мочевина, общий белок, аспартатаминотрансфераза, аланинаминотрансфераза, щелочная фосфотаза, гамма-глютамилтранспептидаза, мочевая кислота, натрий, хлор, холестерин и триглицериды.
Все отклонения в биохимических показателях имевшие место во время исследования, тщательно регистрировались и не были связаны с приемом тианептина. Наиболее частыми изменениями были снижение гемоглобина, нейтропения и повышение уровня триглицеридов – соответственно 1.0%, 0.9% и 1.4% пациентов с нормальными исходными показателями и минимум одним повторным биохимическим анализом во время лечения. Указанные изменения были умеренными и единичными, в некоторых случаях кратковременными даже при продолжении терапии тианептином и не сопровождались, по мнению ВТ, клиническими проявлениями.
Параметры ЭКГ
Проводилось сравнение параметров ЭКГ на момент начала и окончания (М3 или преждевременная отмена терапии) лечения, зарегистрированных у 1991 пациента. Изменения параметров ЭКГ отмечались у 1444 больных, 55 из которых обнаруживали отклонения ЭКГ еще до начала терапии. Наиболее частые изменения включали умеренную синусовую тахикардию (29 пациентов), неполную блокаду ножек Гиса (26 пациентов), умеренную синусовую брадикардию (18 пациентов). За исключением одного случая инфаркта миокарда, который не требовал отмены тианептина, все обнаруженные изменения параметров ЭКГ были слабо выраженными, не имели клинического значения и не требовали терапевтического вмешательства.
Оценка периода отмены тианептина
Отмена терапии тианептином предусматривала постепенное снижение дозы в течение 1 недели по истечении трехмесячного курса лечения. Из 1458 пациентов, полностью завершивших трехмесячный курс, 30 отмена тианептина проводилась одномоментно, 12 продолжали лечение другим антидепрессантом, 334 продолжали прием тианептина, 1082 проводилась постепенная отмена препарата по запланированной схеме. За период с М3 по М3+14 у 988 пациентов наиболее часто отмечались следующие симптомы: затрудненное засыпание (12%), чувство общей слабости (11.4%), нервозность (10.8%), ночные пробуждения (10.1%), головные боли (9.8%), ажитация/напряжение (9.6%), раздражительность (9.1%), ранние утренние пробуждения (8.4%), дисфония (7.7%).
Назначение анксиолитических препаратов требовалось в единичных случаях в связи с обострениями тревоги и нарушений сна. 61 пациенту на М3+14 (через 1 неделю после отмены тианептина) потребовалось возобновление приема антидепрессантов (тианептина в 27 случаях).
В целом, из 927 больных, полностью завершивших трехмесячный курс терапии тианептином (общая выборка исследования), 385 продолжили лечение тианептином, 64 – другим антидепрессантом. Специфических признаков синдрома отмены тианептина и явлений лекарственной зависимости не обнаружено.
Дизайн исследования и критерии включения пациентов в исследование
| ПАЦИЕНТЫ | n | % |
| Женщины | 1 388 | 74,7 |
| Мужчины | 470 | 25,3 |
| Всего | 1 858 | |
| Возраст | 74,7±17,2 | |
| ДИАГНОЗ | n | % |
| Большой депрессивный эпизод: | ||
| Единичный | 678 | 36,5 |
| Повторный | 679 | 36,5 |
| Дистимическое расстройство | 501 | 27 |
Целью исследования была оценка клинических показателей эффективности и безопасности тианептина при терапии большого количества амбулаторных больных депрессией в течение трех месяцев в условиях общетерапевтической практики. Для обеспечения однородности данных каждому врачу, участвовавшему в исследовании, передавалась видеокассета с разъяснениями условий протокола и правил заполнения рейтинговых шкал; проводились регулярные региональные информационные семинары и проверки историй болезни на предмет выявления нарушений протокола и неточностей в регистрации данных (в случае обнаружения последних врачу отправлялось письменное сообщение с дополнительной информацией). Одним из результатов такого тщательного контроля было крайне малое число пациентов, данные которых были неполными – 29 случаев. Исходно планировалось, что каждый врач отберет для исследования 5 – 10 больных. Однако, возможно вследствие недостатков предварительного обучения, только 26% ВТ полностью соблюдали это условие: доля отобранных ими пациентов составила 35%. Тем не менее состояние всех пациентов, включенных в исследование, полностью соответствовало принятым критериям включения, поэтому окончательный анализ результатов проводился с учетом всех больных, участвовавших в исследовании.
Цель исследования объясняет не очень жесткие ограничения в отношении сопутствующей медикаментозной терапии, в первую очередь – производных бензодиазепина, которые, как известно, широко применяются в медицинской практике. Схема открытого исследования не предусматривала контроля над клиническим действием других лекарственных средств. Поэтому влияние производных бензодиазепина на терапевтический эффект тианептина не поддавалось анализу.
Ограничения и методологические недостатки таких иследований также хорошо известны: отсутствие контроля над эффектом сопутствующей медикаментозной терапией, недостаточная однородность выборки. Однако участие в наблюдении за больными врачей общетерапевтической практики и большое число пациентов позволяют получить достоверные данные по безопасности применения тианептина в повседневной медицинской практике, свидетельствующие о хорошей переносимости препарата в условиях амбулаторной терапии.
| Результаты |
0 комментариев