ВВЕДЕНИЕ
Аллергическими заболеваниями страдает около 10—15% населения земного шара. В структуре аллергических заболеваний видное место занимают аллергические поражения респираторного тракта, из которых наиболее тяжелым является бронхиальная астма (БА). В последние десятилетия во всех экономически развитых странах отмечается значительный рост частоты и тяжести течения БА, характерен более ранний дебют заболевания. Частота БА составляет в структуре детской заболеваемости по России от 0.2—0.5% до 8% (в США 6—8%).
В связи с бурным развитием в последние годы клинико-иммунологических, лабораторных и инструментальных методов исследования, появилось много сведений характеризующих с новых позиций этиологические и патогенетические варианты развития БА.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
В этиологии бронхиальной астмы различают две группы факторов: антигенные и неантигенные. К антигенным относится широкий круг экзогенных аллергенов, среди которых у детей ведущую роль играют неинфекционные:
— «бытовые» аллергены (пылевые, эпидермальные, частицы тел насекомых — сухой корм аквариумных рыбок, некоторые вещества бытовой химии и др.),
— пыльцевые аллергены,
— пищевые,
— лекарственные, включая гамма-глобулин и другие белковые препараты.
В формировании неинфекционной сенсибилизации у детей прослеживаются определенные закономерности. В раннем возрасте наиболее значимой является пищевая сенсибилизация, реализующаяся чаще всего в виде аллергодерматоза. У некоторых больных при ранней пищевой сенсибилизации органами-мишенями являются пищеварительный тракт и дыхательная система. Присоединение эпидермальной сенсибилизации (шерсть животных, перо подушек и др.) закономерно совпадает с возникновением респираторного аллергоза, который на этом этапе чаще проявляется в виде ринофарингита, ларинготрахеита и других «малых» форм респираторной аллергии. Респираторные аллергические заболевания нередко ошибочно трактуются как инфекционные, что ведет к массивной медикаментозной терапии, а это приводит к формированию медикаментозной аллергии. Развертывание типичной клиники бронхиальной астмы у большинства детей происходит на фоне присоединения сенсибилизации к домашней пыли. Формирование БА, как правило, происходит на втором-пятом годах жизни. Сенсибилизация к пыльце растений у детей, проживающих в умеренном климатическом поясе, обычно формируется в старшем возрасте, однако наслоение ее на предшествующую сенсибилизацию к аллергенам эпидермиса и домашней пыли может произойти и в возрасте 2—5 лет. Сенсибилизирующая роль бактерий, вирусов в этиологии астмы многими исследователями оспаривается, однако нельзя исключить возможность наслоения инфекционной сенсибилизации на поливалентную неинфекционную в пубертатном возрасте и у взрослых. При отсутствии своевременной этиологической диагностики и терапии сенсибилизация при аллергозах у детей развивается по типу цепной реакции с расширением круга непереносимых аллергенов, усугублением клинических проявлений заболевания, вовлечением в патологический процесс новых органов-мишеней.
Неантигенные факторы. Провоцировать приступ БА могут многие физические факторы (охлаждение, перегревание, инсоляция и др.), метеорологические условия (ветер, перепады атмосферного давления и температуры), психогенные факторы (волнение, испуг, возбуждение), физическая нагрузка.
По патогенезу бронхиальная астма может быть разделена на два варианта: иммунопатологический и неиммунный. Среди иммунопатологических форм у детей основную роль играет атопическая БА, реализующаяся по I типу классификации Gell и Coombs. Причиной этого варианта чаще всего являются неинфекционные аллергены. Значительно реже встречается иммунокомплексный вариант заболевания (III тип по Gell и Coombs), в этиологии которого наряду с неинфекционными аллергенами, могут играть роль и инфекционные. В индивидуальном патогенезе указанные иммунопатологические формы БА могут сочетаться.
В основе неиммунологических механизмов БА лежит неспецифическая гиперреактивность бронхов, которая может быть генетически детерминированной или приобретенной на фоне течения иммунопатологических форм БА. Одним из существенных факторов, повышающих реактивность бронхов, является острая и хроническая бронхолегочная инфекция. Механизмы, лежащие в основе провоцирующего эффекта инфекции, многогранны, но в конечном итоге они сводятся к повышению проницаемости эпителиальных барьеров органов-мишеней, снижению их резистентности к патологическому действию специфических аллергенов, непосредственному возбуждению инфекционным агентом рецепторов клеточных мембран органов-мишеней. Велика провоцирующая роль инфекции у детей первых лет жизни в связи с наличием у них повышенной проницаемости эпителиальных мембран, недостаточностью секреторных иммуноглобулинов, сниженной способностью к фагоцитозу. Сопряженность обострения аллергоза с интеркуррентными инфекциями нередко является основанием для ошибочной констатации инфекционно-аллергической природы заболевания.
Одним из современных направлений исследований неиммунологических механизмов явилось изучение рецепторных и метаболических особенностей больных бронхиальной астмой. Показано, что одной из характерных черт болезни является преобладание холинергической системы регуляции над адренергической. Этот дисбаланс определяется на разных уровнях: на уровне рецепторов клеточных мембран, соотношения внутриклеточных посредников — циклических нуклеотидов (адренергическая система — циклический аденозинмонофосфат, ЦАМФ; холинергическая система — циклический гуанозинмонофосфат, ЦГМФ) и метаболических систем, активируемых ЦАМФ- и ЦГМФ-зависимыми механизмами.
Именно эти механизмы обусловливают легкость возникновения бронхоспастических реакций у больных астмой при действии различных экзо- и эндогенных факторов. В связи с этим, одной из распространенных концепций этиопатогенеза бронхиальной астмы является так называемая «теория бета-адренергической блокады». Следует считать, однако, что в большинстве случаев обнаруживаемые изменения в соотношении компонентов системы циклических нуклеотидов являются вторичными по отношению к иммунологическим и лишь потенцируют проявление патохимической и патофизиологической фаз иммунологических реакций. Однако, в ряде случаев они являются ведущим звеном патогенеза, что позволяет выделять неиммунную БА («паторецепторную», с «первично-измененной реактивностью бронхов»). Особым вариантом неиммунных механизмов является патогенез так называемой «аспириновой бронхиальной астмы». Аспирин и близкие ему вещества, ингибируя циклооксигеназный путь метаболизма арахидоновой кислоты (синтез простагландинов), активируют тем самым второй путь ее метаболизма — липооксигеназный (синтез лейкотриенов, медленно реагирующей субстанции анафилаксии — МРСА). МРСА, обладающая мощным и длительным бронхоконстрикторным действием, является тем основным эндогенным фактором, который обусловливает обострение астмы.
БРОНХИАЛЬНАЯ АСТМА И АСТМАТИЧЕСКИЙ БРОХИТ У ДЕТЕЙ РАННЕГО ВОЗРАСТА
Своеобразие клинической картины бронхиальной астмы у детей раннего возраста обусловлено анатомо-физиологическими возрастными особенностями бронхо-легочного аппарата. Как известно, у детей раннего возраста бронхи имеют узкий просвет, их мышечный аппарат развит недостаточно, слизистая оболочка дыхательных путей богато васкуляризирована, избыточно развиты лимфатическая и кровеносная системы интерстициальной ткани. Перечисленные особенности являются причиной ведущей роли отека слизистой бронхов и относительно менее выраженных проявлений бронхоспазма при приступе бронхиальной астмы у детей до 3 лет. Поскольку классическим симптомом бронхиальной астмы является удушье, обусловленное в первую очередь бронхоспазмом, варианты заболевания, при которых отек слизистой бронхиального дерева превалирует над бронхоспазмом, представляют определенные диагностические трудности. Ранние проявления заболевания ошибочно диагностируются как различные варианты острых респираторных инфекций. Указанные особенности в клинических вариантах проявления заболевания при единой этиопатогенетической сущности поражения, общих лечебных и диагностических подходах, прогнозе, и т.д., позволяют рассматривать астматический бронхит как типичный вариант течения БА у детей первых лет жизни.
Обычно обострению бронхиальной астмы у детей раннего возраста предшествует период предвестников (такой предприступный период может наблюдаться в любом возрасте), имеющий специфическую у каждого больного клиническую картину. Предприступный период может проявляться изменением поведения, нарушением сна, аппетита, появлением зудящих сыпей, катаральным синдромом: насморком с приступами чихания, приступообразным кашлем, зудом слизистой носа и конъюнктив, иногда — подъемом температуры до субфебрильных цифр. Длительность предприступного периода может колебаться от нескольких часов до нескольких дней. Знание индивидуальной клинической характеристики периода предвестников в ряде случаев позволяет с помощью своевременной терапии купировать обострение аллергического бронхита до появления развернутой клинической картины заболевания. Приступ БА у ребенка раннего возраста характеризуется появлением одышки смешанного типа с удлиненным выдохом, обилием жужжащих сухих и разнокалиберных влажных хрипов на фоне эмфиземы. При одновременном аллергическом поражении верхних дыхательных путей обострение сопровождается спазматическим кашлем, насморком. В отличие от приступа бронхиальной астмы у детей старшего возраста и у взрослых признаки удушья, обусловленные бронхоспазмом, как правило, отсутствуют или минимально выражены.
При рентгенологическом обследовании больных часто обнаруживается клинико-рентгенологический диссонанс: при богатой аускультативной картине рентгенологические изменения оказываются минимальными, затрагивают преимущественно интерстициальную ткань. Иногда может выявляться и очаговая инфильтрация, которая, в отличие от таковой при микробно-вирусной пневмонии, имеет очень быструю обратную динамику в течение 3—5 дней.
Аускультативная симптоматика при инфекционном процессе отличается большей стабильностью, в то время как при аллергическом бронхите может наблюдаться динамика аускультативных изменений в течение нескольких часов,— исчезновение хрипов, изменение их локализации, чередование преобладания сухих и влажных хрипов.
В гемограмме у детей с аллергическим процессом с большим постоянством определяются эозинофилия, лимфоцитоз, при нормальных значениях СОЭ, в то время как для инфекционного бронхита, пневмонии характерны воспалительные изменения со стороны периферической крови.
Перечисленные дифференциально-диагностические критерии оказываются менее эффективными при проведении дифференциального диагноза в поздние сроки от начала обострения астматического бронхита, т. к. при отсутствии своевременной диагностики и терапии на аллергическое воспаление может наслаиваться инфекция.
Ошибочная диагностика инфекционного поражения у больного с аллергическим бронхитом нередко приводит к тому, что в течение нескольких лет болезни у ребенка диагностируется 6—8 и более таких пневмоний. Результатом такой диагностической ошибки является нерациональное массивное применение антибиотиков, злоупотребление физиотерапевтическими процедурами, в то время как для больного необходимо сочетание неспецифической десенсибилизирующей терапии с поисками и возможной элиминацией причинно-значимых аллергенов. При отсутствии своевременной диагностики БА у детей раннего возраста правильный диагноз ставится со значительным запозданием, в период типичных приступов экспираторного удушья, появляющихся в более старшем возрасте. Ошибочно установленные ранее пневмонии дают основание в таком случае трактовать бронхиальную астму как инфекционно-аллергическую. Таким образом, поздняя диагностика астматического бронхита ведет к гипердиагностике микробно-вирусных пневмоний, что и свою очередь является причиной гипердиагностики инфекционно-аллергической бронхиальной астмы в детском возрасте. Ошибочная трактовка формы бронхиальной астмы, в свою очередь, препятствует своевременному проведению комплекса профилактических и лечебных мероприятий.
ЛЕЧЕНИЕ И ПРОФИЛАКТИКА
Терапевтические методы, используемые в лечении бронхиальной астмы, существенно отличаются в зависимости от фазы болезни. В остром периоде проводится синдромная терапия. В периоде ремиссии используются тренирующие этиотропные методы, основанные на имитации патогенной реакции на низком уровне интенсивности и, соответственно, стимуляции различных эндогенных механизмов защиты организма больного от этих повреждающих факторов (аллергены, факторы неантигенной природы).
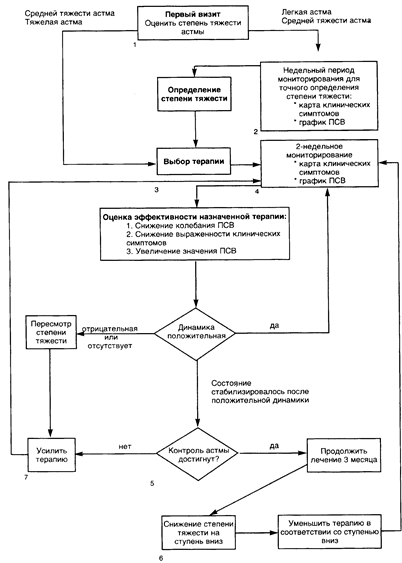
Целью лечения должно быть предоставление детям возможности вести нормальный образ жизни, включая занятия спортом и физические нагрузки. Необходимо достичь отсутствия существенных пропусков занятий в школе. Симптомы астмы должны отсутствовать как днем, так и ночью. Должна быть нормализована функция легких и достигнуто отсутствие значительных суточных колебаний показаний пикфлоуметрии. Потребность в приеме бета-агонистов должна быть снижена до незначительной, желательно менее одного раза в два-три дня, без возникновения обострении болезни. Необходимо избегать побочных эффектов терапии, особенно в отношении роста и развития. Невозможность достижения этих целей свидетельствует о необходимости смены терапии.
Лечение астмы — не просто назначение ряда медикаментов, это целая стратегия. Это не только ситуации, когда обращение за помощью происходит по инициативе больного в период приступа, это регулярные консультации, инициированные врачом. Мы не должны предлагать пациентам заботиться о себе самостоятельно, а организовывать лечение в тесном взаимодействии с медицинскими работниками. Следует признать, что ежедневное лечение осуществляется пациентом и членами его семьи, а не врачом. Задачей врача является подготовка индивидуальных программ обучения и согласованного лечения для больного ребенка. Особенно важно в этом случае привлечение хорошо подготовленных медсестер и персонала отделений реабилитации. Нужно насколько возможно помочь детям и их родителям понять сущность заболевания, принципы его лечения и то, как реагировать на любые изменения в клиническом состоянии.
Программа начинается сразу после постановки диагноза, основой ее является партнерство. Пациенты должны научиться пользоваться ингаляционными препаратами и пикфлоуметрами, понять различие между медикаментами для снятия симптомов и профилактическими средствами, знать признаки ухудшения состояния и какие изменения в лечении должны последовать при появлении этих признаков. Таким образом, стратегия совместного лечения состоит из четырех элементов:
1) понимание заболевания;
2) мониторирование симптомов, результатов пикфлоуметрии и принимаемых препаратов;
3) заранее разработанный план действий;
4) письменные инструкции.
В зарубежных странах (США, Англия и др.) признаны удобными дневники пациента, адаптированные для детского возраста. И все же, самое главное взаимодействие между пациентом, его семьей и медицинскими работниками, особенно если речь идет о психологических факторах, которые могут помешать эффективному контролю течения заболевания.
ПРИНЦИПЫ АЛЛЕРГЕННОГО ЩАЖЕНИЯ
Независимо от периода заболевания необходимым является соблюдение принципа аллергенного щажения. т.е. выполнение комплекса мероприятий, уменьшающих (исключающих) контакт ребенка с причинно-значимыми аллергенами и с веществами, потенциально обладающими высокой аллергизирующей способностью. Игнорирование этого принципа ухудшает прогноз заболевания и снижает эффективность любых лечебных мероприятий.
Из предыдущих разделов видно, что наиболее частыми формами бронхиальной астмы и респираторных аллергозов в целом, являются формы с ведущим иммунопатологическим компонентом, т.е. зависимые от разрешающего действия антигена. Наибольшее значение для детей с БА имеют аллергены неинфекционной природы, из которых ведущую роль играют «бытовые» аллергены.
Элиминационные мероприятия по группе бытовых аллергенов:
— произвести максимальную разгрузку комнаты (квартиры) от лишних вещей (ковры, лишняя мебель, шкуры животных и т.д.),
— проводить влажную уборку пола и других гладких поверхностей ежедневно,
— тщательно проветривать квартиру, в том числе следить за свежестью воздуха в ночное время,
— не держать животных,
— перьевую подушку заменить на ватную (желательно, чтобы матрац и одеяло также были ватными),
— хранить книги только в застекленных шкафах,
— не держать декоративные комнатные цветы (в цветочных горшках создаются условия для размножения плесеней — грибковые аллергены),
— если есть аквариум, то пользоваться только живым кормом,
— ребенок не должен участвовать в уборке квартиры пылесосом и контактировать с веществами бытовой химии (аллергенное и ирритантное действие).
Все перечисленные элиминационные мероприятия должны быть проведены врачом общего профиля всем детям с установленным нозологическим диагнозом респираторной аллергии еще на доспециализированном этапе диагностики и лечения. Данные специального аллергообследования могут лишь дополнить указанный перечень рядом уточнений. Например, при положительном результате кожной пробы с аллергеном шерсти овцы, аллергологом будет дана рекомендация по сведению до минимума шерстяных вещей ребенка, замена их на синтетические и т.д.
Использование гипоаллергенной диеты обязательно у всех детей с респираторной аллергией. Неспецифическая (неиндивидуализированная) гипоаллергенная диета предусматривает исключение группы облигатных пищевых аллергенов, таких как: рыба, икра, крабы, креветки, крепкие мясные бульоны, яйца, мед, орехи, кофе, какао, шоколад, цитрусовые, гранат, ананас, дыня, земляника, клубника, малина, черная смородина, копчености, консервированные продукты, пряности.
В случае если бронхиальная астма сочетается с пищевой аллергией, должна соблюдаться индивидуальная гипоаллергенная диета, которая сводится к исключению индивидуально непереносимых продуктов на фоне неспецифической гипоаллергенной диеты.
Режим антигенного щажения детей с аллергическими заболеваниями предусматривает медицинский отвод их от вакцинаций. Для детей с бронхиальной астмой вакцинация должна проводиться индивидуально. Не подлежат вакцинации дети, получающие специфическую гипосенсибилизацию. В дальнейшем вакцинация проводится по щадящим схемам.
Провоцирующими факторами нередко являются вещества неантигенной природы и острые респираторные инфекции. Последнее позволяет рекомендовать Ограничение контактов ребенка, формирующего респираторный аллергоз (т.е. особенно в периоде раннего детства), с детскими коллективами, где высока вероятность повторных заражений острыми респираторными инфекциями.
ПЕРВАЯ ДОВРАЧЕБНАЯ ПОМОЩЬ.Для оказания эффективной помощи врач должен на основании клинико-анамнестических данных составить представление об этиологии заболевания и данного приступа. Эта информация необходима для обеспечения мер по ограничению контакта больного ребенка с «виновными» аллергенами. При бытовой этиологии приступа проветривается помещение, из постели больного удаляются перовые и пуховые принадлежности. Если приступ является следствием пыльцевой аллергии, целесообразно закрыть окна, ограничив таким образом, поступление пыльцевых аллергенов извне, увлажнить воздух помещения, в котором находится больной, способствуя этим осаждению пыльцевых зерен. Если приступ спровоцирован приемом непереносимого пищевого продукта, для уменьшения всасывания его из кишечника ставится очистительная клизма, внутрь даются обволакивающие и адсорбирующие средства (альмагель, холестирамин). Тактика медикаментозной терапии приступа определяется его патогенетической характеристикой.
При приступе, протекающем с преобладанием вазосекреторных нарушений, в связи с минимальной выраженностью бронхоспастического компонента использование бета-адреномиметиков нецелесообразно. Препаратом выбора при оказании первой помощи является — эуфиллин (теофиллин), который, не уступая бета-адреномиметикам по противоаллергической активности, имеет перед ними в данной ситуации ряд преимуществ. Он снижает давление в малом круге кровообращения, вызывает умеренный противоотечный эффект. 2,4% раствор эуфиллина разводится в 20—100 мл 5% глюкозы или физиологического раствора и вводится медленно струйно или капельно внутривенно. Разовая доза для детей до 4 лет — 6 мг/кг массы (0,25 мл 2,4% раствора), после 4 лет — 4—5 мг/кг массы (0,16—0,2 мл 2,4% раствора). Учитывая значительную вариабельность степени чувствительности к эуфиллину, приведенные дозы являются ориентировочными, на их основе под контролем лечебного и нежелательных эффектов подбирается индивидуальная доза препарата. Наиболее ранние из нежелательных эффектов эуфиллина — тахикардия и рвота. Если в течение 4 часов до обращения к врачу ребенок получал эуфиллин внутрь, доза вводимого внутривенно препарата уменьшается на 20%. В случае возобновления приступа менее, чем через 4 часа после введения внутривенно терапевтической дозы эуфиллина, препарат повторно не вводится. Детям раннего
возраста, у которых вазосекреторный вариант приступа протекает с выраженной дыхательной недостаточностью и, нередко, с тяжелым общим состоянием, показано введение преднизолона в дозе 2—3 мг/кг массы (1/2 дозы внутривенно струйно, 1/2 — внутримышечно), после чего ребенок госпитализируется.
При выраженном отечном синдроме, проявляющемся обилием мелких влажных хрипов, можно сочетать эуфиллинотерапию с однократным внутримышечным введением лазикса в дозе 2 мг/кг массы. Применение антигистаминов и препаратов кальция как средств неотложной помощи хотя и традиционно, но мало оправдано с позиций патогенеза приступа бронхиальной астмы и обычно малоэффективно. Антигистаминные препараты эффективны у больных с высокой чувствительностью HI-рецепторов. После ликвидации приступа показана бронхосанационная терапия (мокроторазжижающие препараты, теплые аэрозоли с солесодовым раствором, кашлевая гимнастика). Для профилактики рецидива удушья эуфиллин в виде порошков или микстуры назначается внутрь на несколько суток постприступного периода в дозе 12—15 мг/ кг массы, разделенной на 4 приема в сутки. Отмена препарата проводится постепенно, путем уменьшения количества приемов. Такая лечебная тактика правомочна как для амбулаторного, так и стационарного ведения больного.
ФАРМАКОТЕРАПИЯ БРОНХИАЛЬНОЙ АСТМЫ
Фармакотерапия бронхиальной астмы подробно обсуждается в современной медицинской литературе.
Исходя из концепции современного лечения БА предлагается алгоритм ступенчатой терапии. Поэтому мы ограничиваем круг задач данного учебного пособия до разбора нескольких наиболее принципиальных в терапии вариантов, делая акценты на тактике догоспитального этапа врачебной помощи. Тем не менее, считаем необходимым напомнить некоторые исходные положения по использовании группы бронхоспазмолитических препаратов, как наиболее представительной и принципиальной.
Центральной особенностью бронхоспазма является преобладание холинергических влияний над адренергическими. В клинической фармакологии существует три принципиальных пути восстановления соотношения адренергической системы ЦАМФ и холинергической — ЦГМФ. Использование М-холинолитиков у детей, больных бронхиальной астмой, лимитировано их неблагоприятным действием на экзокринные железы бронхиального дерева (сгущение секрета, подсушивание слизистой и пр.). Конкретные варианты сочетаний адреномиметиков и ингибиторов ФДЭ (эуфиллина) приводится ниже.
Учитывая широкий набор адреномиметиков, используемых в клинической практике, приводим их основные характеристики.
ПЕРВАЯ ВРАЧЕБНАЯ ПОМОЩЬ
Для оказания эффективной помощи врач должен на основании клинико-анамнестических данных составить представление об этиологии заболевания и данного приступа. Эта информация необходима для обеспечения мер по ограничению контакта больного ребенка с «виновными» аллергенами. При бытовой этиологии приступа проветривается помещение, из постели больного удаляются перовые и пуховые принадлежности. Если приступ является следствием пыльцевой аллергии, целесообразно закрыть окна, ограничив таким образом поступление пыльцевых аллергенов извне, увлажнить воздух помещения, в котором находится больной, способствуя этим осаждению пыльцевых зерен. Если приступ спровоцирован приемом непереносимого пищевого продукта, для уменьшения всасывания его из кишечника ставится очистительная клизма, внутрь даются обволакивающие и адсорбирующие средства (альмагель, холестирамин). Тактика медикаментозной терапии приступа определяется его патогенетической характеристикой.
При приступе, протекающем с преобладанием вазосекреторных нарушений, в связи с минимальной выраженностью бронхоспастического компонента использование β-адреномиметиков нецелесообразно. Препаратом выбора при оказании первой помощи является — эуфиллин (теофиллин), который, не уступая β-адреномиметикам по противоаллергической активности, имеет перед ними в данной ситуации ряд преимуществ. Он снижает давление в малом круге кровообращения, вызывает умеренный противоотечный эффект. 2,4% раствор эуфиллина разводится в 20—100 мл 5% глюкозы или физиологического раствора и вводится медленно струйно или капельно внутривенно. Разовая доза для детей до 4 лет — 6 мг/кг массы (0,25 мл 2,4% раствора), после 4 лет — 4—5 мг/кг массы (0,16—0,2 мл 2,4% раствора). Учитывая значительную вариабельность степени чувствительности к эуфиллину, приведенные дозы являются ориентировочными, на их основе под контролем лечебного и нежелательных эффектов подбирается индивидуальная доза препарата. Наиболее ранние из нежелательных эффектов эуфиллина — тахикардия и рвота. Если в течение 4 часов до обращения к врачу ребенок получал эуфиллин внутрь, доза вводимого внутривенно препарата уменьшается на 20%. В случае возобновления приступа менее, чем через 4 часа после введения внутривенно терапевтической дозы эуфиллина, препарат повторно не вводится. Детям раннего возраста, у которых вазосекреторный вариант приступа протекает с выраженной дыхательной недостаточностью и, нередко, с тяжелым общим состоянием, показано введение преднизолона в дозе 2—3 мг/кг массы (1/2 дозы внутривенно струйно, 1/2 — внутримышечно), после чего ребенок госпитализируется.
При выраженном отечном синдроме, проявляющемся обилием мелких влажных хрипов, можно сочетать эуфиллинотерапию с однократным внутримышечным введением лазикса в дозе 2 мг/кг массы. Применение антигистаминов и препаратов кальция как средств неотложной помощи хотя и традиционно, но мало оправдано с позиций патогенеза приступа бронхиальной астмы и обычно малоэффективно. Антигистаминные препараты эффективны у больных с высокой чувствительностью H1-рецепторов. После ликвидации приступа показана бронхосанационная терапия (мокроторазжижающие препараты, теплые аэрозоли с солесодовым раствором, каш левая гимнастика). Для профилактики рецидива удушья эуфиллин в виде порошков или микстуры назначается внутрь на несколько суток постприступного периода в дозе 12—15 мг/ юг массы, разделенной на 4 приема в сутки. Отмена препарата проводится постепенно, путем уменьшения количества приемов. Такая лечебная тактика правомочна как для амбулаторного, так и стационарного ведения больного.
Недостаточная эффективность эуфиллинотерапии на догоспитальном этапе обычно связана с наличием сопутствующего приступу острого вирусного или вирусно-бактериального бронхита. В этом случае ребенок госпитализируется в боксовое инфекционное отделение.
ОСТРЫЙ ТИПИЧНЫЙ ПРИСТУП
Поскольку ведущим в его патогенезе является бронхоспастический компонент, наиболее эффективны в этом случае β-адреномиметики. Нетяжелые приступы нередко удается купировать у старших детей введением 2 ингаляционных доз патентованных селективных β-адреномиметиков (алупент, астмопент, сальбутамол и др.), а у детей раннего возраста — принудительной ингаляцией тех же препаратов через маску с помощью аэрозольного ингалятора АИ-1 или ПАИ-1. При отсутствии эффекта вводится 0,1% раствор адреналина в дозе, не превышающей 0,05 мл на год жизни. Использование малых доз адреналина обосновано избирательной чувствительностью к нему β-2-адренорецеп-торов бронхов и позволяет рассчитывать на лечебный эффект с минимальным риском осложнений со стороны β сердечно-сосудистой системы (α- и β-эффекты). Если после введения адреналина приступ купировался, для получения пролонгированного эффекта внутримышечно вводится 5% раствор эфедрина в дозе 0,05—0,1 мл на год жизни или проводится ингалирование селективного β-адреномиметика. Помимо адреналина для купирования острого приступа бронхиальной астмы может применяться 0,05% раствор алупента (β-2-адреномиметик), вводимый внутримышечно в дозе 0,1 мл на год жизни. Бронхоспазмолитическая активность у него несколько слабее, чем у адреналина, но он имеет и ряд преимуществ, в частности: меньшую выраженность нежелательных реакций со стороны сердца, отсутствие сосудистых побочных эффектов, существенно более стойкий, чем у адреналина эффект (4—6 час). При введении алупента или других селективных β-2-адреномиметиков в течение минимум 4 часов нет необходимости в использовании каких-либо бронхоспазмолитических средств, пролонгирующих полученный лечебный эффект.
Описанная тактика купирования острого приступа адреномиметиками не может использоваться у детей со сниженной чувствительностью β-адренорецепторов бронхов. В такой ситуации даже ингаляционное введение препаратов этой группы, не говоря уже о внутримышечном, может усугубить рефрактерность β-адренорецепторов и привести к формированию астматического статуса. Кроме того, при частичной блокаде этих рецепторов существенно возрастает вероятность нежелательных эффектов адреномиметиков, опосредованных их α- и β-адренергической активностью (повышение артериального давления, тахикардия, сердечная аритмия и др.). Клинико-анамнестические критерии несостоятельности β-адренорецепторов бронхиального дерева:
· сведения о неэффективности адреналина или о побочных реакциях на него в недавнем прошлом;
· сведения о бесконтрольном ингалировании селективных адреномиметиков непосредственно во время данного обострения или в недавнем прошлом;
· наличие кортикостероидной зависимости, длительное применение кортикостероидов в виде ингаляций или внутрь.
Косвенным, но существенным признаком рефрактерности β-адренорецепторов является ведущая роль неантигенных раздражителей и вирусно-бактериальной инфекции как в структуре факторов, провоцирующих обострения заболевания в прошлом, так и в развитии данного приступа.
Наличие перечисленных признаков дисфункции адренергического звена («адренергического дисбаланса») служит основанием для использования в качестве препарата первого ряда эуфиллина, который вводится внутривенно капельно или медленно струйно в дозах и режимах, указанных выше. При отсутствии эффекта возможна попытка внутримышечного введения терапевтических доз адреналина или алупента в период максимальной концентрации эуфиллина в крови, т. е. через 30 — 60 мин после окончания инфузии. Обосновывают правомерность такого варианта тактики сведения о синергичном действии адреномиметиков и метилксантинов на тонус бронхиальных мышц и о способности последних восстанавливать чувствительность β-адренорецепторов. Такое взаимоотношение препаратов объясняется высокой активностью фермента фосфодиэстеразы, обнаруживаемой у большинства больных в остром приступе бронхиальной астмы. Инактивируя внутриклеточный посредник адренергической стимуляции — циклический АМФ, ФДЭ делает неэффективными любые активирующие влияния, идущие через рецептор. Ингибирование ФДЭ приводит к восстановлению функционирования β-адренергической системы в целом. От потенцирования эффекта эуфиллина адреномиметиками следует воздержаться при наличии их непереносимости в прошлом и в том случае, когда они уже вводились до начала эуфиллинотерапии и время их действия еще не истекло.
Если приступ удается купировать в домашних условиях, больному на 1—2 суток назначается ингаляционная или энтеральная бронхорасширяющая терапия: эуфиллин в суточной дозе 12—15 мг/кг массы, комбинированные бронхорасширяющие средства — солутан, антастман, теофедрин, дозированные ингаляции селективных адреномиметиков. Одновременно проводится активная бронхосанационная терапия.
ЗАТЯЖНОЙ ПРИСТУП
Особенности тактики купирования определяются, с одной стороны, наличием предшествующей доврачебной терапии (ингаляции адреномиметиков, энтеральные формы эуфиллина, комбинированные бронхоспазмолитические средства), с другой — усугублением рефрактерности β-адренорецепторов по мере удлинения приступа. С учетом сказанного нецелесообразно и опасно начинать лечение с введения адреномиметиков. Препаратом выбора в этой ситуации остается эуфиллин, вводимый в описанных дозах и режимах. С осторожностью, под постоянным контролем состояния и самочувствия следует использовать эуфиллин у больных, которые непосредственно до обращения к врачу получали препарат внутрь. В этом случае допустимо только капельное внутривенное введение, а доза препарата уменьшается на 20% по сравнению со среднетерапевтической. Продолжительность инфузии составляет 30 мин. При отсутствии нежелательных эффектов к концу введения можно в случае необходимости, дополнительно медленно струйно ввести 1—2 мг эуфиллина на 1 кг массы. Больным, в анамнезе которых нет сведений о побочных реакциях на адреномиметики, для усиления эффекта эуфиллина допустимо введение алупента, но не ранее, чем через 30 мин после окончания инфузии. После купирования приступа Бронхоспазмолитическая и мокроторазжижающая терапия продолжается минимум в течение 3 дней. Если затяжной приступ удушья возник на фоне упорно рецидивирующего течения бронхиальной астмы, в постприступном периоде возобновляется противорецидивная терапия, назначенная аллергологом или пульмонологом (ингалирование интала, бекотида, эуфиллинотерапия и т. д.).
Показания к назначению кортикостероидной терапии на догоспитальном этапе при приступе бронхиальной астмы:
· неэффективность проведенной в полном объеме бронхоспазмолитической терапии,
· анамнестические сведения о неоднократном применении кортикостероидных препаратов в приступном периоде заболевания и в качестве противорецидивного средства.
При наличии показаний оптимальным кортикостероидом является преднизолон, который вводится в дозе 2—3 мг на 1 кг массы. Для получения быстрого и продолжительного эффекта половина дозы вводится внутривенно струйно, половина — внутримышечно. Все больные, которым на догоспитальном этапе пришлось использовать кортикостероидную терапию, подлежат обязательной госпитализации, даже в том случае, когда приступ удалось частично или полностью купировать.
Показания к госпитализации в остром периоде:
· затяжной приступ бронхиальной астмы, не копирующийся адреномиметическими веществами, астматический статус (соматический, реанимационный стационары);
· приступ БА, развившийся на фоне острой или хронической передозировки ингаляционных адреномиметических средств (соматический стационар);
· аллергический бронхит у детей до 3 лет, не поддающийся лечению в домашних условиях (соматический стационар);
· острый аллергический ларингит со стенозом гортани (бокс инфекционного стационара).
На стационарном этапе выбор основных направлений в лечении в зависимости от клинико-патофизиологических особенностей приступа, а также комбинации основных препаратов, принципиально не отличаются от разобранных выше. В стационаре появляются лишь некоторые технические возможности по способу введения препарата, длительности курсов, большему арсеналу вспомогательных средств, их комбинаций и т.д. Следует подчеркнуть, что нередко даже в неаллергологических отделениях проявляет себя отчетливый эффект разобщения больного с его причинно-значимыми аллергенами (как правило, «бытовой» группы) — эффект элиминации. На этом фоне становится эффективным даже минимальный лечебный комплекс, который в домашней обстановке не оказывал своего действия.
Одной из принципиальных возможностей, появляющейся у врача стационара, является возможность индивидуального подбора и дозирования бронхоспазмолитических препаратов. Для этого проводятся фармакологические пробы с бронхоспазмолитиками под контролем показателей спирографии или пневмотахометрии (ПТМ). Метод пневмотахометрии — определение объемной скорости вдоха и выдоха (л/сек), является общедоступным в любом соматическом стационаре для детей в возрасте старше 6 лет (возраст ограничен тем, что в процедуре необходимо активное участие ребенка).
Для изучения эффекта бронхоспазмолитического препарата наиболее демонстративным является увеличение (восстановление) изначально сниженного показателя ПТМ-выдоха. Методику проведения пробы приводим на примере пробы с ингаляционным селективным β2-адреномиметиком: после определения исходного показателя ПТМ-выдоха и аускультации легких ребенка, производится 1-2 ингаляции (вдоха) препарата и контролируется изменение показателя ПТМ и Аускультативная картина в сроки начала действия препарата (5—10 мин), сохранения его максимального действия (1—3 часа), снижения действия (4—6 час). Таким же образом может контролироваться индивидуальная эффективность любого препарата с учетом его фармакокинетических характеристик. В случае рефрактерности β-адренорецепторов повышение показателя ПТМ-выдоха будет минимальным или может полностью отсутствовать; низкая чувствительность может проявиться в быстром истощении эффекта (возврат показателя на исходно низкие величины в сроки 1—3 часа после ингаляции). У больного с выраженным проявлением адренергического дисбаланса возможен парадоксальный ответ: усиление бронхоспазма после ингаляции β-адреномиметика за счет активации α-адренорецепторов. Состояние рефрактерности, тем более в варианте извращенной реакции на β-адреномиметик, является патогенетической сущностью астматического статуса.
В случаях затяжного течения синдрома бронхиальной обструкции в стационаре появляется возможность в плановом использовании внутривенного капельного пути введения эуфиллина. Обычно препарат один-два раза в сутки вводится внутривенно, а в остальное время — внутрь. Кратность назначений, с учетом скорости его выведения и метаболизма — каждые 4—6 часов.
В условиях стационара возможно также курсовое применение различных инструментальных методов лечения (ФТЛ, ингаляционное введение муколитических препаратов и др.), специальных методов (ЛФК, иглорефлексотерапия, точечный массаж и др.), проведение которых требует участия соответствующих специалистов.
АСТМАТИЧЕСКИЙ СТАТУСУчитывая ключевое звено патогенеза астматического статуса — блокаду β-адренорецепторов, основой бронхоспазмолитической терапии служит эуфиллин. Категорически противопоказано использование адреномиметиков, антигистаминов, препаратов, угнетающих дыхательный центр, мочегонных. Помимо эуфиллина для восстановления бронхиальной проходимости на догоспитальном этапе по показаниям используются кортикостероиды, реанимационные пособия. Объем помощи определяется стадией астматического состояния и ответом больного на проведенную терапию. Существенную специфику имеет тактика эуфиллинотерапии. Для получения клинического эффекта при астматическом статусе необходимо создание и поддержание в крови больного стабильной, значительно более высокой, чем при приступе бронхиальной астмы концентрации препарата. Это требование достигается проведением быстрой эуфиллинизации с переходом на поддерживающую инфузию, темп которой соответствует скорости выведения эуфиллина. Если перед началом эуфиллинизации эуфиллин применялся внутрь, стартовая доза уменьшается на 20%, и с учетом реакции ребенка на ее введение модифицируется темп поддерживающей инфузии. При астматическом статусе I стадии улучшение или восстановление бронхиальной проходимости в большинстве случаев достигается на фоне введения эуфиллина. Больным, находящимся во II стадии, одновременно с началом эуфиллинизации внутривенно вводятся кортикостероиды (2—3 мг на 1 кг массы по преднизолону). В III стадии астматического статуса эуфиллинотерапия и введение кортикостероидов (более 4—5 мг на 1 кг массы по преднизолону) сочетается с реанимационными мероприятиями.
Во второй-третьей стадиях возможно присоединение сердечной недостаточности. В этом случае перед началом эуфиллинизации медленно внутривенно вводится возрастная доза 0,05% раствора строфантина в 20 мл физиологического раствора или 5% глюкозы.
Все больные с астматическим статусом независимо от результатов лечения на догоспитальном этапе подлежат госпитализации. При астматическом статусе III стадии весь рекомендованный комплекс лечебных мероприятий осуществляется одновременно, сначала в домашних условиях, а затем — в процессе транспортировки больного в стационар. Первая врачебная помощь при астматическом статусе оказывается только «Скорой помощью», желательно — специализированными аллергопульмонологическими бригадами.
КОРТИКОСТЕРОИДНАЯ ТЕРАПИЯШирокий круг осложнений КС-терапии, возможность формирования гормонозависимости, существенно ухудшающей прогноз заболевания, являются основанием для ограничения показаний к использованию пероральных КС в лечении у детей. В то же время разработан целый ряд ингаляционных препаратов КС, что позволяет широко использовать их в лечении БА.
Опыт работы ведущих аллергоцентров свидетельствует о возможности минимального использования пероральных и инъекционных КС в терапии при бронхиальной астме в условиях адекватной этиологической диагностики, проведения комплекса этиотропной терапии и специализированного диспансерного наблюдения. Единственным абсолютным показанием для использования КС является астматический статус.
Относительным показанием для назначения КС-терапии является непрерывно-рецидивирующее течение тяжелой бронхиальной астмы при неэффективности остальных методов лечения и невозможности получения элиминационного эффекта в условиях специализированного отделения.
Уменьшение дозы и отмена КС больному БА возможны только при соблюдении режима аллергенного щажения. У многих больных при отмене КС используется этап перехода с парентерального (при астматическом статусе) и энтерального способа введения на ингаляционный. Снижение дозы проводится на фоне мероприятий, стимулирующих функцию коры надпочечников. С этой целью используются курсы лечения глицирамом, этимизолом, большими дозами витаминов С, В5 и В6 и индуктотермия поясничной области. По мере восстановления чувствительности к бронхоспазмолитикам, определяемой с помощью фармакологических проб, переходят к плановому назначению эуфиллина в сочетании с ингаляционными адреномиметическими препаратами. У части больных удается полностью отказаться от КС-терапии на фоне ее замены профилактическими ингаляциями интала. Такая тактика позволяет практически полностью избежать формирования стойкой гормонозависимости у большинства больных.
Ингаляционные КС — в настоящее время наиболее эффективные противовоспалительные препараты для лечения БА. Исследования показали их эффективность, которая проявлялась в улучшении функции внешнего дыхания, снижении гиперчувствительности бронхов, уменьшении симптомов болезни, уменьшении частоты и тяжести обострении и улучшении качества жизни больных.
Основным правилом КС-терапии является применение препарата в минимальной эффективной дозе в течение возможно короткого периода времени, необходимого для достижения максимального симптоматического эффекта. Для лечения БА тяжелого течения необходимо назначение высоких доз ингаляционных КС на длительный период времени, что снизит потребность больных в таблетированных КС. Такая терапия оказывает значительно меньшее системное побочное действие. Дозу препаратов следует подбирать индивидуально, так как оптимальная доза варьирует у отдельных больных и может изменяться с течением времени у одного и того же больного. Для выбора оптимальной дозировки и режима приема ингаляционных КС следует использовать показатели функции внешнего дыхания, ежедневный мониторинг пикфлоуметрии. Дозу КС всегда следует снижать постепенно.
Лечение ингаляционными КС следует начинать с максимальной дозы, которая в зависимости от возраста составляет 6—8 дозированных ингаляций бекотида или бекломета в сутки. Темп снижения числа ингаляций и длительность определяются индивидуально врачом-аллергологом, пульмонологом. В группе больных, получающих ингаляционную КС-терапию. даже при длительном ее использовании (до полугода), осложнений (признаки гиперкортицизма, грибковые поражения полости рта), как правило, не отмечается.
ГЕМОСОРБЦИЯ И ПЛАЗМОФЕРЕЗВ последние годы у больных с тяжелым течением бронхиальной астмы стала использоваться гемосорбция и плазмоферез. Клинико-экспериментальные исследования не дают четких представлений о механизмах лечебного действия этих методов при бронхиальной астме. Однако они свидетельствуют о вегетотропной направленности терапии, проявляющейся в повышении чувствительности рецепторов бронхов к симпатомиметикам, в уменьшении потребности в глюкокортикоидах — средствах, наиболее активно корригирующих дисфункцию вегетативных рецепторов бронхиального дерева. Применение гемосорбции при коллагеновых заболеваниях продемонстрировало возможность сорбции циркулирующих иммунных комплексов.
Исходя из этих представлений о механизмах действия плаз-мофореза и гемосорбции показанием к применению считается:
· тяжелая бронхиальная астма, с паторецепторным механизмом патогенеза, проявляющаяся в виде астматического статуса или непрерывно-рецидивирующих приступов затрудненного дыхания и удушья;
· бронхиальная астма с доказанным иммунокомлексным патогенезом, которая всегда также имеет тяжелое течение.
Проведение этого метода лечения допустимо только в условиях специализированного центра при строгом отборе показаний квалифицированным аллергологом и врачом отделения гемосорбции.
Первый сеанс рекомендуется всегда проводить в приступном периоде БА: в астматическом статусе или у больных с непрерывно-рецидивирующим течением БА при низкой эффективности плановой бронхоспазмолитической терапии и формировании рефрактерности β-адренорецепторов. При эффективности этого метода части больным рекомендовано получение лечения гемосорбциями в плановом порядке в межприступном периоде. Неэффективность первых двух сеансов является основанием для отказа от повторных сеансов.
Терапевтические методы, используемые в периоде ремиссии респираторных аллергозов с учетом их этиопатогенетических вариантов
СПЕЦИФИЧЕСКАЯ ГИПОСЕНСИБИЛИЗАЦИЯ
Метод специфической гипосенсибилизации или специфической иммунотерапии был предложен Noon в 1911 году для лечения больных поллинозами. Обоснованием явилось предположение о выработке у больных при введении малых доз аллергена (расценивавшегося автором как токсин) — антитоксической защиты. С тех пор этот метод широко используется во всем мире для лечения атопических форм респираторной аллергии.
Методика СГ состоит в дробном парентеральном введении больному причинно-значимого аллергена, выявленного в процессе аллергологического обследования, с постепенным наращиванием его дозы. Одним из наиболее распространенных объяснений механизма действия СГ является описание иммунологического феномена: нарастание «блокирующих» антител (класса IgG) в процессе курса лечения, конкурирующих со специфическими реагиновыми антителами за аллерген. Стимулируется также комплекс неиммунных механизмов защиты от действия аллергена, проявляющих себя на уровне патохимической и патофизиологической фаз аллергической реакции. Тренируются такие саногенные механизмы, как ускорение инактивации освобождающихся биологически активных веществ, восстановление адренергического дисбаланса и др. Общепринятым является проведение СГ аллергенами домашней пыли и пыльцы растений, поскольку эти аллергены не могут быть полностью элиминированы. В лечебную смесь может входить несколько серий аллергенов домашней пыли или несколько родственных пыльцевых аллергенов. При использовании водно-солевых экстрактов аллерген вводится ежедневно один раз в день, при ускоренных схемах — 2—3 раза в день.
Ускорение темпа лечения может быть достигнуто введением 2—3 инъекций аллергена в день с интервалом между ними в 2 часа (до разведения аллергена 1:100).
Пороговая доза определяется появлением местных и общих гиперергических реакций: инфильтрата, ринита, бронхоспазма, эозинофилии более 20%. При отсутствии местных, органных и гематологических проявлений гиперергии постепенное наращивание дозы аллергена продолжается до 0,5— 0,8 мл разведения 1:10.
При любых вариантах схем СГ может проводиться длительная поддерживающая терапия с введением аллергенов один раз в 7—30 дней (доза вводимого аллергена в 10 раз меньше пороговой).
Оценка эффективности лечения у больных бронхиальной астмой проводится по предложенной А. Д. Адо и Н. В. Адриановой схеме, модифицированной с учетом особенностей детского возраста: отсутствие приступов БА и их эквивалентов (другие проявления респираторной аллергии) в течение последнего года — 4 балла (отличный эффект), отсутствие приступов, но сохранение их эквивалентов — 3 балла (хороший), сохранение приступов, но их урежение и облегчение — 2 балла (удовлетворительный), отсутствие динамики — 1 балл.
Положительный эффект СГ-терапии у больных с атопической формой бронхиальной астмы отмечается в 90—95% случаев, причем, хороший и отличный результаты наблюдаются у 70—75% детей. Эффективность лечения повышается по мере увеличения общего числа курсов, проводимых не реже одного раза в год. Следует подчеркнуть, что дети второй группы также находились под наблюдением аллерголога, получали общие рекомендации по проведению элиминационных мероприятий, проходили курсы неспецифической десенсибилизирующей терапии, получали санаторное лечение, курортотерапию, часть детей проходили курсы иглорефлексотерапии и баротерапии.
У больных с сочетанием атопической и паторецепторной форм бронхиальной астмы специфическая гипосенсибилизация мало влияет на проявления неспецифической гиперреактивности бронхов, хотя у некоторых больных в процессе СГ она снижается.
ГИСТАМИНОТЕРАПИЯ
Этот метод лечения аллергических заболеваний был введен в 20-е годы; применительно к больным бронхиальной астмы, Дтельность ингаляции — 3 мин. Ежедневно концентрация ингалируемого гистамина увеличивается в 10 раз. Контроль за возможным появлением бронхообструкции проводится аус-культативно (появление сухих свистящих хрипов) и по данным пневмотахометрии (падение показателя объемной скорости выдоха).
При использовании такой схемы всем больным через 6—8 дней от начала лечения удается проингалировать гистамин в пороговой диагностической концентрации, а у части больных удается сформировать устойчивость и к максимальной диагностической концентрации гистамина (0,01%).
Получаемый феномен снижения чувствительности H1-рецепторов бронхиального дерева является функциональным, поскольку повторные ИПП с гистамином, проводимые через 1—3 месяца после окончания аэрозольной терапии, всегда оказываются положительными, причем степень чувствительности соответствует исходной. В связи с этим необходимо повторять ингаляции пороговых концентраций гистамина один раз в две недели. Эта поддерживающая терапия проводится в аллергологических кабинетах.
Непосредственный положительный клинический результат ингаляционной гистаминотерапии достигается у большинства больных. Основным недостатком этого метода является необходимость для сохранения эффекта проведения длительной поддерживающей терапии.
Методами вегетотропной терапии, эффективными у больных с паторецепторными механизмами бронхиальной астмы, являются также метод иглорефлексотерапии и точечный массаж. Эти методы в различных схемах могут использоваться как в остром периоде для купирования бронхоспазма, так и в качестве противорецидивной терапии. К сожалению все названные вегетотропные методы не обеспечивают длительного клиникофизиологического эффекта после прекращения курса лечения.
ИСПОЛЬЗОВАНИЕ ПРЕПАРАТА ИНТАЛГруппы фармакопрепаратов и их конкретные представители, используемые в лечении аллергических заболеваний, являются средствами, тем или иным путем подавляющими проявления развернутых патохимической и патофизиологической фаз аллергической реакции. Поэтому использование их в периоде клинико-лабораторной ремиссии аллергических заболеваний неоправдано.
Интал, не влияя на патофизиологическую фазу, предупреждает развитие аллергической реакции на уровне ее патохимической фазы в том случае, если его воздействие на клетку произошло до ее контакта с аллергеном. Это свойство интала позволяет называть его препаратом профилактическим и использовать в ремиссии заболевания для предупреждения развития обострении. Молекулярный механизм действия остается неразрешенным, наиболее общее объяснение механизма — «стабилизация клеточной мембраны тучной клетки».
Особенности фармакокинетики препарата (прежде всего отсутствие резорбтивного эффекта) требует его прямого контакта со слизистой дыхательных путей в тех концентрациях, которые могут быть достигнуты лишь при ингаляционном пути введения.
Наиболее эффективен интал при атопической форме БА. При паторецепторной форме заболевания также может быть получен отчетливый клинический эффект в том случае, если ведущим провоцирующим фактором является физическая нагрузка («астма напряжения»). Поскольку эти формы БА являются превалирующими в детском возрасте, в случаях неидентифицированной БА (отсутствие аллергослужбы, невозможность обследования больного по другим причинам), может быть рекомендовано назначение интала всем детям с установленным нозологическим диагнозом БА и АБ. Вопрос об его эффективности и, следовательно, о показании к использованию в дальнейшем у данного больного решается в течение первого курса (обычно в сроки около месяца). Единственным ограничением является возраст ребенка, т. к. ингаляции требуют его активного участия. Обычно удается научить ингалировать препарат детей в возрасте 4—6 лет.
Нетоксичность и отсутствие привыкания к препарату позволяют использовать его длительно. Начальная доза — 4—6 капсул в сутки (в ингаляциях) с последующим постепенным снижением дозы (по 1 капсуле в 3—4 недели). Эта схема может быть в значительной степени индивидуализирована. Например, больному атопической формой БА с бытовой сенсибилизацией целесообразно назначать интал в поддерживающей дозе (1—3 капсулы в сутки) в течение всего учебного года (сентябрь—май), т.е. в период, когда наиболее постоянен контакт с бытовыми аллергенами.
Похожие работы
... отделения мокроты или в сложных в диагностическом плане случаях исследуют промывные воды из трахеобронхиального дерева, а так же проводят морфологическое исследование биоптатов слизистой, поскольку при бронхиальной астме происходит инфильтрация подслизистого слоя тучными клетками и эозинофиллами. - собрать аллергологический анамнез с целью выяснения причин заболевания. - установить наличие ...
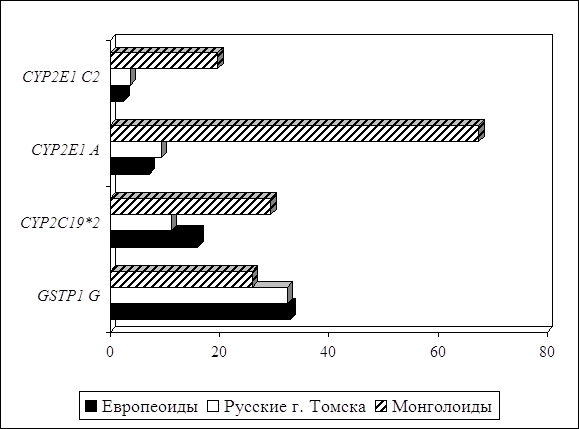
... препаратов. Установлена связь полиморфизма 313A>G гена GSTP1 с изменчивостью уровня аланинаминотрансферазы (р=0,021). 7. Выявлены различия в структуре генетической подверженности к бронхиальной астме и туберкулезу по генам ферментативной системы метаболизма ксенобиотиков: гены GSTM1, CYP2E1 и CYP2C19 связаны с бронхиальной астмой и значимыми для заболевания качественными и ...
... оценке ряда методов терапии, в частности, специфической гипосенсибилизации бактериальными аллергенами. Таким образом, все теоретические и практические попытки выработать определённые рекомендации для профилактики и лечения бронхиальной астмы привели прежде всего к выводу о полиморфизме проявлений этого заболевания. Отсюда ряд зарубежных учёных оценили астму как синдромное понятие. В соответствии ...
... и опасения и обсудить их, так как многие пациенты не могут следовать советам врача до тех пор, пока все их вопросы не будут разрешены. Целью обучения является создание плана длительного лечения бронхиальной астмы, включая план самоведения, приемлемого как для медицинских работников, так и для больного. Система зон в лечении бронхиальной астмы эффективна для самоведения и должна быть включена в ...

0 комментариев