АСТАТ (лат. Astatium), астатин, Аt - радиоактивный химический элемент VII группы периодической системы Менделеева, атомный номер 85. Стабильных изотопов у астата нет; известно не менее 20 радиоактивных изотопов астата, из которых наиболее долгоживущий 210At имеет период полураспада T1/2 8,3 ч. Многократные попытки ученых разных стран открыть элемент № 85 всевозможными химическими и физическими способами в природных объектах были неудачны. В 1940 Э. Сегре, Т. Корсон и У. Мак-Кензи получили на циклотроне в Беркли (США) первый изотоп 211At, бомбардируя висмут a-частицами. Название "астат" дано от греческого astatos - неустойчивый. Лишь после этого искусственного получения астата было показано, что 4 его изотопа (215At, 216At, 218At и 219At) образуются в очень маловероятных (5*10-5 - 0,02%) ответвлениях трех природных рядов радиоактивного распада урана и тория. Астат хорошо адсорбируется на металлах (Ag, Au, Pt), легко испаряется в обычных условиях и в вакууме. Благодаря этому удается выделить астат (до 85%) из продуктов облучения висмута путем их вакуумной дистилляции с поглощением астата серебром или платиной. Химические свойства астата очень интересны и своеобразны; он близок как к иоду, так и к полонию, т. е. проявляет свойства и неметалла (галогена) и металла. Такое сочетание свойств обусловлено положением астата в периодической системе: он является наиболее тяжелым (и следовательно, наиболее "металлическим") элементом группы галогенов. Подобно галогенам астат дает нерастворимую соль AgAt; подобно иоду окисляется до 5-валентного состояния (соль AgAtO3 аналогична AgJO3). Однако, как и типичные металлы, астат осаждается сероводородом даже из сильно кислых растворов, вытесняется цинком из сернокислых растворов, а при электролизе осаждается на катоде. Присутствие астата определяют по характерному a-излуч
Похожие работы
... хлор вытесняет из солей бром, йод: 2KBr + Cl2 = 2KCl + Br2 бром вытесняет из солей йод: 2KI + Br2 = 2KBr + I2↓. II. Взаимодействие органическими веществами (галогенирование - присоединение галогена). Галогены взаимодействуют со всеми классами органических соединений. Рассмотрим некоторые реакции: 1. С алканами: CH3–CH3 + Cl2 → CH2Cl–CH3 + HCl хлорэтан 2. С алкенами: CH2=CH2 ...
... реакции на альдегидную группу – окисляется оксидом серебра (1), присоединяет синильную кислоту (4): Химические свойства: 1. 2. 3. 4. 5. 6. 7. 8. Спиртовое брожение. Эта реакция характерна для гексоз. Она осуществляется с помощью биологических катализаторов – ферментов. При сбраживании гексозы превращаются в этиловый спирт. Для пентоз брожение ...
... осаду РbCl2 при дії на розчини солей свинцю (ІІ) соляною кислотою або розчинними хлоридами; г) утворення жовтого осаду РbCl2 при введенні йодид-іонів в розчини солей свинцю (ІІ). 6. Основні закони хімії та їх наслідки 1. Закон збереження маси речовини: маса речовин, які вступили в реакцію, дорівнює масі речовин, отриманих внаслідок реакції. 2. Закон сталості складу: кожна чиста речовина ...
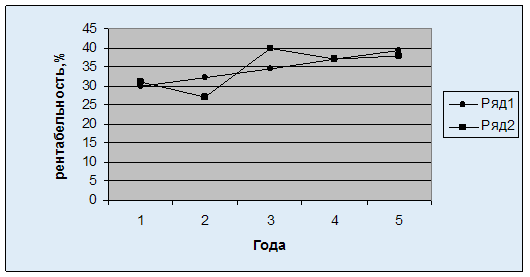
... к среднегодовой стоимости основных и нормируемых оборотных фондов. Различают два вида рентабельности: рассчитанную на основе балансовой (общей) прибыли и на основе чистой прибыли. 2. Организационно-экономическая характеристика КСП имени Дзержинского Новоайдарского района Луганской области Результаты работы сельскохозяйственных предприятий существенно зависят от условий производства. Поэтому ...
0 комментариев