При гетерогенном катализе катализатор и реагирующие вещества находятся в разных фазах, чаще всего катализатором является твёрдое тело, а реагирующие вещества находятся в жидком или газообразном состоянии и реакция протекает на поверхности раздела двух фаз, то есть на поверхности катализатора. Поэтому гетерогенные каталитические процессы часто называют контактными, а твёрдые катализаторы – контактными веществами.
Опыт показывает, что при гетерогенном катализе большое значение имеют структура, химический состав и величина поверхности катализатора. Так, гладкая платиновая пластинка, опущенная в раствор пероксида водорода, практически не вызывают разложения последнего. Если же поверхность этой пластинки шероховатая, разложение пероксида водорода протекает заметно. Ещё больше увеличивается скорость разложения, если в качестве катализатора использовать платину в виде порошка. И, наконец, если к раствору пероксида водорода прибавить еще более раздробленную платину в виде её коллоидного раствора, то разложение Н2О2 произойдёт практически мгновенно - в виде взрыва.
Как правило все гетерогенные каталитические реакции (даже относительно простые из них) протекают в несколько стадий: 1) сближение молекул реагирующих веществ, 2) ориентация молекул на активных центрах катализатора, 3) адсорбция молекул реагирующих веществ, сопровождающаяся деформацией связей в молекулах, 4) химическое превращение адсорбированных (и активированных) молекул, 5) десорбция продуктов реакции, 6) удаление этих продуктов с поверхности катализатора.
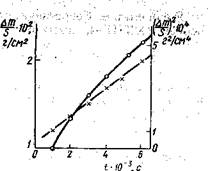
Скорость химической реакции определяют как уменьшение количества реагирующего вещества или увеличение количества за единицу времени, например за секунду. Для реакций протекающих при постоянном объёме, как например в закрытом сосуде или в растворе, скорость выражают через уменьшение концентрации реагирующего вещества или увеличение концентрации продукта, отнесённых к единице времени. Так скорость образования иодоводорода из Н2 и I2 , протекающего при ~ 4000C в газовой фазе
Н2+I2![]() 2Hi,
2Hi,
можно выразить тремя способами:
![]()
знак минус ставят, когда скорость выражается через убыль концентрации исходного вещества, чтобы скорость была положительной величиной. Скорость выражается через прирост концентрации иода водорода, разделана на стехиометрический коэффициент 2, чтобы все три выражения были численно одинаковы.
В общем случае для реакции
Скорость можно выразить любым из следующих способов:
Скорость представляет, таким образом, первую производную от концентрации по времени. Графически скорость изображается величиной тангенса угла наклона касательной, проведённой к прямой, показывающую зависимость концентрации по времени. Графически скорость изображается величиной тангенса угла наклона касательной, проведённой к кривой, показывающей зависимость концентрации прореагировавшего или образовавшегося вещества от времени.
Из вышеприведённых формул следует, что размерность скорости химической реакции равна: химическая масса * объём –1 * время –1. В системе СИ размерность скорости равна – моль * м –3 * сек –1. Однако в литературе до сих пор принято выражать скорость реакций в моль * дм –3 * сек –1.
На практике при измерении скоростей реакции вместо секунды за единицу времени часто берут минуту или час.
В гетерогенных системах реакционным пространством является поверхность раздела между фазами. Введя понятие поверхностной концентрации Cs, измеряемой числом молей реагирующего вещества (n), приходящихся на единицу реакционного пространства S, имеем
Тогда среднюю скорость гетерогенной реакции можно измерять изменением поверхностной концентрации одного из реагентов (исходного вещества или продукта реакции) за единицу времени, выражая её в моль/м с или моль/см с):
Истинную (мгновенную) скорость гетерогенной реакции определяем, переходя в (1.7) к пределу Т-О:
Скорость гетерогенных взаимодействий зависит не только от самого химического взаимодействия, но и от стадии переноса вещества, каковым являются подвод молекул газообразного или растворённого реагента из объёма V к реакционной поверхности S и интенсивность отвода от поверхности продуктов реакции. Скорость протекания всего гетерогенного взаимодействия определяет та из трёх стадий скорость, которой минимальна. Её называют имитирующей стадией.
В 1865 году профессор Н.Н. Бекетов высказал гипотезу о взаимосвязи между массами реагентов и временем течения реакции: «... притяжение пропорционально произведению действующих масс», которая в 1867 году была подтверждена норвежским химиком К.М. Гульдбергом и П. Вааге в законе действия масс. Современная формулировка этого закона: «при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции».
Для реакции aA + bB – mM + nN
Математическое выражение закона действия масс имеет вид:
![]()
Где V – скорость реакции; k – константа скорости реакции (при [А] = [В] = 1 моль / п k = v – численно), [А] и С [В] и С – разные формы обозначения концентрации, a и в – стехиометрические коэффициенты реагентов А и В в уравнении реакции.
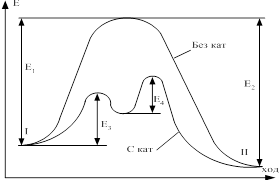
Константа скорости k определяется природой реагирующих веществ, зависит от температуры и присутствия катализатора, но не зависит от концентрации реагентов участвующих в реакции.
Закон действия масс справедлив только для наиболее простых по своему механизму взаимодействий, протекающих в газах или в разбавленных растворах. Если сложная реакция является совокупностью нескольких процессов, осуществляемых параллельно или последовательно, то этот закон справедлив для каждой отдельной стадии реакции, но не всего взаимодействия в целом. Математическое выражения закона действия масс для самой медленной (лимитирующей) стадии процесса определяет скорость всей реакции.
В случае гетерогенной реакции, например, горения углерода:
С + О2 = СО2
Математическое выражение закона действия масс имеет вид:
V = k[c] [02]
Но концентрация твёрдой фазы (углерода) в ходе реакции не меняется. Поэтому её обычно включают в константу скорости (k):
V = k const [02] = k[02],
То есть скорость гетерогенной реакции зависит только от концентрации веществ находящихся в газовой или жидкой фазах.
Опыт №1:
Наблюдение зависимости скорости гетерогенной реакции от площади поверхности соприкосновения реагирующих веществ.
Применяемые приборы и реактивы.
1.1. Равные навески карбоната кальция Са СО3 в виде порошка и в виде кусочков.
1.2. 15% раствор соляной кислоты HCL.
1.3. Пипетки, стаканчики, секундомер.
Выполнение опыта.
Налейте в два стаканчика по 15 или 15% соляной кислоты. В первый стаканчик положите навеску измельченного мела Са СО3, а во второй такой же по весу кусочек мела. Запишите время, потребовавшееся на растворение мела в том и другом стаканчике. Объясните результаты опыта, запишите уравнения реакций и выражения для скорости реакции в зависимости от соприкосновения твёрдой и жидкой фазы.
Опыт №2.
Разложение пероксида водорода.
Цель: проследить каталитическое действие разных катализаторов на реакцию разложения пероксида водорода по скорости обесцвечивания индигокармина за счет окисления красителя выделяющимся кислородом 2H2O2 – 2H2O + O2
Реактивы: 1) раствор индигокармина
2) 0,5г. оксида марганца (IУ)
3) 0,5г. оксида свинца (IУ)
4) 30% – ный. раствор пероксида водорода
Оборудование: 1) шесть пробирок
2) секундомер
Ход работы: налить в три пробирки по десять капель раствора индигокармина. В первую пробирку добавить щепотку оксида марганца (IУ) MnO2, во вторую – столько же оксида свинца (IУ) PbO2. Третью пробирку оставить в качестве эталона.
В трёх других пробирках приготовить по 3 мл 30% – ного раствор пероксида водорода, и быстро перелить их в каждую из пробирок с красителем. Встряхнуть все три пробирки. Записать, через какой промежуток времени обесцветится краситель в каждой из трёх пробирок, и сделать вывод о сравнительном каталитическом действии взятых катализаторов.
Похожие работы
... для следующего механизма реакции НX + hv→Н· + X Н· + НХ→Н2 + Х Х + Х→Х2. Ответ: А.0,45·10-7 Эйнштейн·с-1 . Б. γ=1,95. В. γ = 2 Глава 3. Кинетика гетерогенных реакций 3.1 Примеры 3.1.1. Образец сплава металла А и В длиной 0,5 см и образец металла В длиной 0,5 см спаяны друг с другом. Определите время, за которое в результате диффузии А ...
... , т. е. к увеличению скорости реакции. Количественно зависимость между скоростью реакции и молярными концентрациями реагирующих веществ описывается основным законом химической кинетики — законом действующих масс. Скорость химической реакции при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ. Для мономолекулярной реакции скорость реакции ...
... , с другой. Реакции, протекающие с выделением энергии, называют экзотермическими, а реакции, при которых энергия поглощается, — эндотермическими. Термохимия Энергетические изменения, сопровождающие протекание химических реакций, имеют большое практическое значение. Иногда они даже важнее, чем происходящее при данной реакции образование новых веществ. В качестве примера достаточно вспомнить ...
... по известным константам скорости при двух температурах, либо для вычисления константы скорости реакции при неизменной температуре, если известна энергия активации. Для большинства хим. реакций энергия активации определяется в пределах . Физический смысл энергии активации раскрывается в теории химической кинетики, её можно определить как некоторый избыток энергии по сравнению со средним значением ...
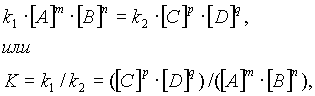
0 комментариев