Мембранное равновесие, связанное с различием концентрации солей внутри и вне клеток, известно давно. В 1911 г. Ф. Доннан объяснил это явление, впоследствии названное его именем.
Мембранное равновесие Доннана связано с переносом некоторого количества вещества низкомолекулярного электролита внутрь пространства, содержащего полимер, и, вследствие этого, неравномерного распределения концентраций этого электролита по обе стороны полупроницаемой мембраны.
Пусть в некоторый начальный момент времени концентрации ионов низкомолекулярного и высокомолекулярного соединений по обе стороны мембраны распределяются следующим образом:
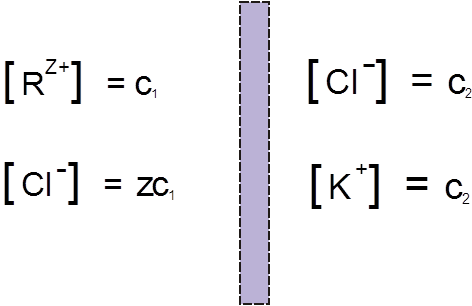
Рис 1.
В левой части сосуда, разделенного полупроницаемой мембраной, находится раствор полимера, который в результате диссоциации представлен поликатионом R(Z+) и противоионом Cl–, концентрации которых равны соответственно C1 и ZC1. В левой части – раствор низкомолекулярного электролита, например KCl, с концентрацией С2, диссоциирующий на К+ и Cl–. При установлении равновесия вследствие диффузии в такой системе малые ионы K+ перемещаются преимущественно из правой части сосуда в левую. Макрокатионы R(Z+) не могут проникать через мембрану, поэтому для сохранения электронейтральности вместе с катионами K+ справа налево происходит перемещение избыточного числа анионов Cl–. В результате этих процессов концентрация низкомолекулярного электролита в растворе ВМС повышается:
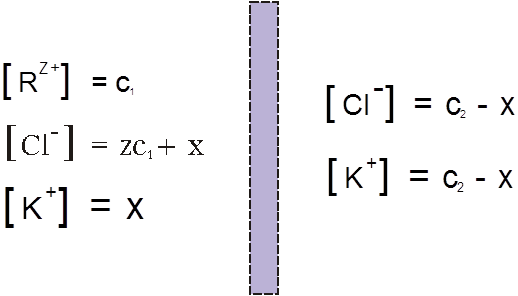
Рис 2.
Условием равновесия является равенство произведений концентраций электролитов в левой и правой части сосуда, разделенного полупроницаемой мембраной:
[K+]внутр.[Cl–]внутр. = [K+]внеш.[Cl–]внеш.
Подставляя обозначения из рис.2, имеем уравнение:
X (ZC1 + X) = (C2 – X)2
Решая это уравнение относительно X, получаем:
C22
![]() X = .
X = .
ZC1 + 2C2
Это и есть уравнение Доннана, которое показывает количество низкомолекулярного вещества, переносимого в фазу ВМС через полупроницаемую мембрану. Из него следует вывод, что низкомолекулярный электролит распределяется неравномерно по обе стороны мембраны. Перенос вещества всегда существует из внешнего раствора во внутренний, в результате чего во внутреннем растворе наблюдается более высокая концентрация переносимых электролитов по сравнению с внешним раствором. Этим же объясняется некоторый избыток осмотического давления в растворах, содержащих ВМС и электролиты.
Если концентрация низкомолекулярного электролита намного больше концентрации полимера (С2 >> C1), то X = C2/2, т.е. при малых концентрациях макроионов и больших концентрациях малых ионов наблюдается равномерное распределение малых ионов по обе стороны мембраны.
При обратном соотношении концентраций (C2 << C1), XZC1 = C22, откуда следует, что перенос X очень мал и обратно пропорционален величине ZC1.
Осмотическое давление раствора в левом отсеке складывается из осмотического давления, обусловленного присутствием ВМС и низкомолекулярного соединения:
p1 = p1(ВМС) + p1(НМС) – p2(НМС).
Та часть осмотического давления крови, которая создается растворенными в ней белками, называется онкотическим давлением. Хотя по абсолютной величине оно, как правило, незначительно (например, для плазмы крови на долю осмотического давления, создаваемого растворами белков приходится всего лишь 0,5 – 1 %), эта составляющая имеет большое физиологическое значение.
Все биологические мембраны полупроницаемы: в нормальных условиях проницаемы для неорганических солей и воды и непроницаемы для белков и полисахаридов. Этот эффект является одной из причин неравномерного распределения ионов вне и внутри клетки.
Похожие работы
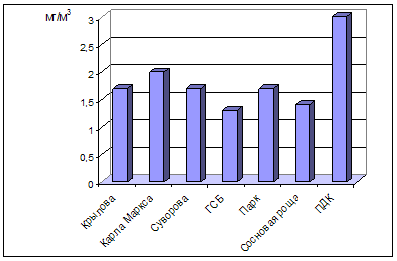
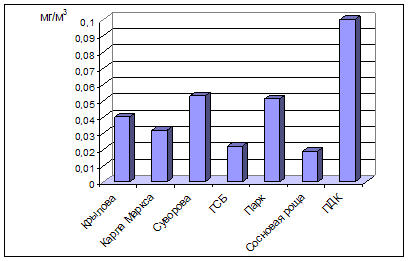
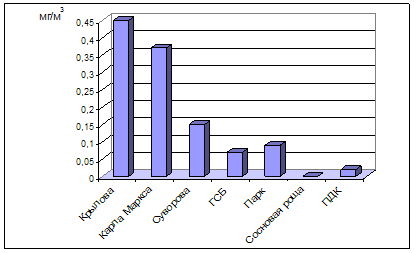
... , относится к среднеповреждаемым видам (степень повреждения до 40%). Аналогичное наблюдение провели В.М. Ионин и В.Ф. Колташева (1961). Авторы не рекомендуют использовать рябину обыкновенную как устойчивый вид при загрязнении атмосферного воздуха выбросами промышленных предприятий. (Кулагин, 1974). Тома считает, что рябина обыкновенная способна к длительному сопротивлению в условиях задымления ( ...
... . ЛИТЕРАТУРА: 1. Курс низших растений //Под ред. М. В. Горленко – М.: Высш. школа, 1981. 2. Жизнь растений, т. 1–3, - М.: Просвещение, 1974-77. 3. Н. Грин, У. Стаут, Д. Тейлор. Биология, т. 1-3. – М.: Мир, 1990. 4. Н.П.Горбунова , Е.С.Клюшникова, Н.А.Комарницкий. и др. Малый практикум по низшим растениям. – М.: Высш. школа, 1976. 5. Русанов В. А. Низшие растения. Методические указания ...
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...
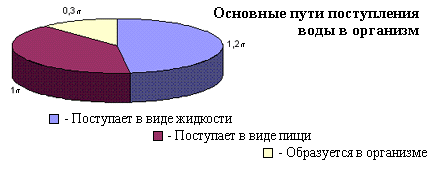
... в процессе жизнедеятельности получает из вне и выделяет наружу одинаковое количество воды. Вода, питьевой режим, вода в организме человека, баланс воды в организме, вода и здоровье, чистая питьевая вода, минеральная вода, вода и полезные минералы, микроэлементы, макроэлементы, водный баланс, водно-солевой баланс, водно-солевой обмен. При нарушении этого баланса в ту или иную сторону наступают ...
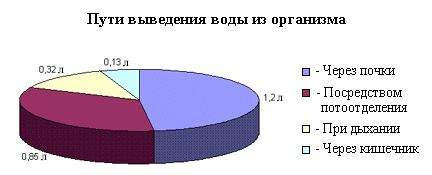
0 комментариев