Реферат
по теме:
«Подгруппа углерода. Углерод.»
ученицы 9-г класса
средней школы №9
Слабодчиковой Валентины
Учитель:
Белокопытов Ю. С.
Июнь 1999
г. Чехов
Содержание.
1. Общая характеристика элементов подгруппы углерода..............................................................................3
2. Аллотропные видоизменения углерода..............................................................................6
3. Адсорбция..........................................................................9
4. Список использованной литературы....................................................................10
Общая характеристика элементов подгруппы углерода.
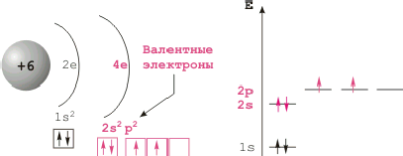
Главную подгруппу IV группы периодической системы Д. И. Менделеева образуют пять элементов - углерод, кремний, германий, олово и свинец. В связи с тем, что от углерода к свинцу радиус атома увеличивается, размеры атомов возрастают, способность к присоединению электронов, а следовательно, и неметаллические свойства будут ослабевать, легкость же отдачи электронов - возрастать. Уже у германия проявляются металлические свойства, а у олова и у свинца они преобладают над неметаллическими. Таким образом, углерод и кремний относят к неметаллам, германий причисляют как к металлам, так и к неметаллам, а олово и свинец - металлы.
Германий по внешнему виду похож на металлы, но хрупок. Как и кремний, германий принадлежит к полупроводникам, т. е. к веществам, занимающим промежуточное положение между непроводниками электрического тока, или изоляторами (многие неметаллы), и проводниками (металлы). В качестве полупроводника германий широко применяется в радиоэлектронике.
Простые вещества, образованные оловом и свинцом- следующими элементами подгруппы, проявляют уже все типичные свойства металлов: металлический блеск, высокую электрическую проводимость и теплопроводность, пластичность. Как правило, олово и свинец образуют соединения, в которых они проявляют степени окисления +2 и +4. На внешнем энергетическом уровне атомов элементов главной подгруппы IV группы содержатся четыре электрона: два спаренных s-электрона и два неспаренных р-электрона. Поэтому при образовании соединений атомы этих элементов могут или отдавать все четыре электрона, проявляя высшую степень окисления +4, или принимать четыре электрона, проявляя при этом степень окисления -4.
Среди элементов IV группы наибольшее значение имеют углерод, входящий в состав всех живых организмов, и кремний - важнейший элемент земной коры.
Двухвалентные соединения для кремния менее характерны, чем для углерода. Это связано с меньшим значением энергии возбуждения атомов кремния благодаря большей удаленности наружных электронов от ядра. При обычных условиях углерод и кремний очень инертны и практически не взаимодействуют ни с какими простыми и сложными веществами.
При обычных условиях углерод и кремний очень инертны и практически не взаимодействуют ни с какими простыми и сложными веществами. Исключение составляет аморфный кремний, реагирующий с фтором.
При нагревании углерод и кремний взаимодействуют с галогенами, с элементами подгруппы серы, азотом, водородом и многими металлами. В последнем случае образуются соединения, называемые карбидами и силицидами. С углеродом и кремнием взаимодействуют лишь некоторые кислоты, являющиеся сильными окислителями. Например, в присутствии окислителей (KClO3, MnO2) аморфный углерод растворяется в концентрированных азотной и серной кислотах при нагревании. Кремний же растворяется лишь в смеси азотной и плавиковой кислот:
3Si + 18HF + 4HNO3 = 3H2SiF6 + 4NO + 8Н2О
Щелочи переводят кремний в соли кремниевой кислоты с выделением водорода:
Si + 2КОН + H2O= К2Si03 + 2Н2
С водой углерод и кремний реагируют лишь при высоких температурах:
С + Н2О ®¬ СО + Н2
Si + ЗН2О = Н2SiO3 + 2Н2
Первая из этих реакций имеет большое практическое значение. Она лежит в основе процесса газификации твердого топлива.
Углерод в отличие от кремния непосредственно взаимодействует с водородом:
С + 2Н2 = СН4
Реакция осуществляется при нагревании в присутствии катализатора (мелкий раздробленный никель). Продукт взаимодействия — метан — является первым членом ряда предельных углеводородов, состав которых выражается формулой CnH2n+2.
Аналогично углероду кремний тоже образует с водородом соединения, но они менее устойчивы. Надежно идентифицированы только шесть низших гомологов предельного ряда. Их называют силанами. Простейший представитель моносилан SiH4 имеет строение, аналогичное СН4. Силаны - крайне реакционноспособные соединения, воспламеняющиеся на воздухе. Низкая прочность связи Si—Si (DH = -220 кДж/моль) по сравнению со связью С—С (DH = -340 кДж/моль) обусловила возможность образования лишь ограниченного числа силанов по сравнению с углеводородами.
Склонность углерода к образованию полимерных цепей объясняет то обстоятельство, что он в обычных условиях тверд, нелетуч и химически инертен.
При нагревании на воздухе углерод и кремний сгорают с образованием оксидов. Однако процессы окисления идут по-разному. При недостатке кислорода углерод образует оксид углерода (II), а при избытке — оксид углерода (IV). Кремний с кислородом во всех случаях образует оксид кремния (IV). Оксид кремния (II) может быть получен лишь косвенным путем:
Si + SiO2 =2SiO.
В природе кремнезем(SiO2) встречается в виде включений в граниты и другие породы. Такие включения заметны на осколках породы, они напоминают кусочки оплавленного стекла. Освобождаясь при выветривании породы, они скапливаются в руслах рек в виде белого песка. Встречается оксид кремния(IV) и в виде прекрасных кристаллов кварца размером, иногда превышающим человеческий рост. Советские ученые и инженеры разработали методы, позволяющие искусственно выращивать кристаллы кварца длиной до 1,5-2 м.
При плавлении аморфный кварц размягчается постепенно и также постепенно при охлаждении затвердевает. Это облегчает изготовление из кварца изделий, например химической посуды. Кварц очень мало расширяется при нагревании. Поэтому кварцевую посуду можно, раскалив добела, бросить в холодную воду, и она не растрескается.
Оксид кремния (IV) практически нерастворим в воде. Соответствующая ему кремниевая кислота получается вытеснением ее из растворов солей другими кислотами, в том числе и угольной. Обратите внимание, что в растворе угольная кислота вытесняет кремниевую из ее солей, а при прокаливании происходит обратное явление. Первый процесс обусловлен тем, что кремниевая кислота более слабая, чем угольная. Второй же процесс объясняется меньшей летучестью оксида кремния (IV).
Высшие солеобразующие оксиды углерода и кремния довольно сильно отличаются по свойствам. Оксид углерода (IV) - газ, который конденсируется лишь при сильном охлаждении, образуя кристаллическую массу, а оксид кремния (IV), напротив, кристаллическое вещество, встречающееся в природе в виде минерала кварца.
Оксид углерода (IV) растворяется в воде (1:1 по объему), причем он частично взаимодействует с ней, образуя угольную кислоту:
СО2 + Н2О ®¬Н2СО3
Оксид углерода(II) не реагирует ни с водой, ни с растворами щелочей и кислот. Подобно оксиду азота(II) NO, он относится к несолеобразующим оксидам.
Оксид углерода(II) получается при взаимодействии оксида углерода(IV) с сильно раскаленным углем:
С + СО2 = 2CO - 160 кДж
В этом можно убедиться, заглянув в хорошо растопленную печь. Над раскаленными добела углями вспыхивают голубые огоньки. Это пламя оксида углерода(II), сгорающего в воздухе, поступающем через открытую дверцу печи. Когда угли несколько остывают, голубые огоньки исчезают: реакция между углем и оксидом углерода(IV) прекратилась и оксид углерода(II) не образуется.
Теперь понятно, почему сильно раскаленный уголь сгорает синим пламенем, а слабо раскаленный - без пламени.
Оксид углерода(II) содержится в некоторых видах газообразного топлива, в частности генераторном газе.
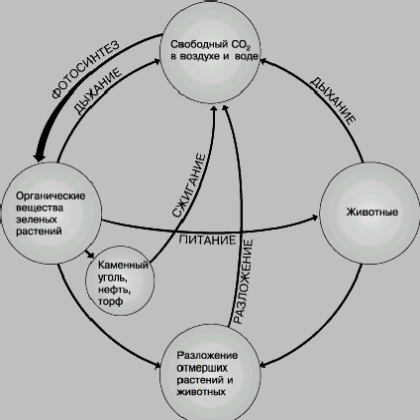
Оксид углерода(IV) образуется в природе при дыхании животных и растений, при гниении органических остатков в почве, при пожарах. Оксид углерода(IV) тяжелее атмосферного воздуха и поэтому может скапливаться в опасных концентрациях в погребах и колодцах. В угольных шахтах из-за медленного окисления угля содержание углекислого газа также выше, чем на открытом воздухе. Служба охраны труда следит за тем, чтобы оно не превышало установленной нормы (30 мг/м3).
Для растений углекислый газ служит источником углерода, и обогащение им воздуха в парниках и теплицах приводит к повышению урожая. Оксид углерода(IV) применяют также для газирования воды и напитков, жидким CO2 заряжают огнетушители. Твердый оксид углерода(IV) под названием сухого льда применяют для охлаждения продуктов. Преимущество сухого льда перед обыкновенным заключается в том, что он поддерживает в окружающем пространстве значительно более низкую температуру и испаряется, не переходя в жидкое состояние.
Растворяясь в воде оксид углерода(IV) почти не соединяется с нею. Его гидроксид - угольная кислота Н2СО3 - существует лишь в момент образования, она практически нацело разлагается на углекислый газ и воду:
Н2СО3 = Н2О + СО2![]()
Учитывая, что угольная кислота является двухосновной, равновесие между различными формами молекул и ионов в водном растворе оксида углерода (IV) можно выразить уравнением:
Н2О + СО2®¬ Н2СО3®¬ H+ + НСО3-®¬ 2H+ + CO32- .
При нагревании оксид углерода (IV) улетучивается, и равновесие смещается влево, а при прибавлении щелочи происходит связывание ионов Н+ и смещение равновесия вправо.
Угольная кислота слабая. В водном растворе соли угольной кислоты гидролизуются. Растворы средних солей карбонатов обладают сильной щелочной реакцией:
CO32- + H2O = HCO3- + OH-
Наиболее распространен в природе карбонат кальция(известняк, мрамор, мел и т.д.). Залежи пород, содержащих карбонат кальция , особенно известняка, встречаются довольно часто. Поэтому одной из задач краеведческой работы в районах с кислыми почвами должны быть поиски месторождений известняка.
Из искусственно получаемых карбонатов большое значение имеет карбонат натрия Na2CO3. Безводный карбонат натрия известен под названием кальцинированной соды, а кристаллогидрат Na2CO3*10H2O - кристаллической соды. Соду применяют для производства мыла, стекла, а в быту для стирки белья.
При насыщении раствора соды углекислым газом она переходит в гидрокарбонат натрия NaHCO3. Гидрокарбонат натрия продают в аптеках и продовольственных магазинах под названием питьевой соды. Ее принимают внутрь при изжоге, вызванной избытком в желудочном соке соляной кислоты. Питьевую соду применяют в кондитерском деле и хлебопечении.
При нагревании она разлагается с выделением углекислого газа и паров воды:
2NaHCO3 = Na2CO3 + H2O![]() + СО2
+ СО2![]()
Поэтому питьевую соду вводят в состав хлебопекарных порошков, добавляемых к тесту. Такое тесто подходит без применения дрожжей и заквасок, наполняясь пузырьками углекислого газа, и выпеченный из него продукт получается пористым и мягким.
Аллотропные видоизменения углерода.
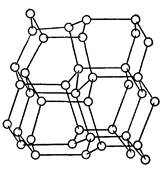
| Рис.1 Модель решетки алмаза.
|
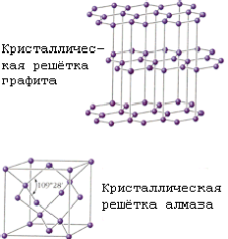
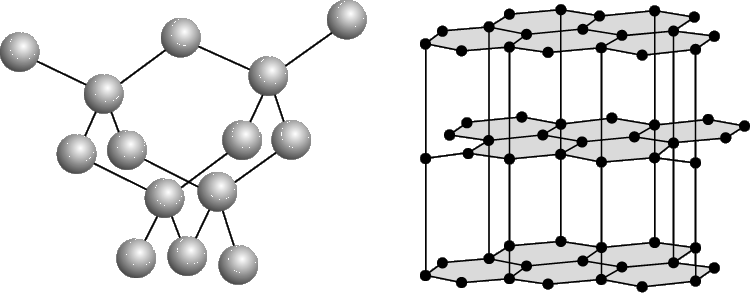
Углерод существует в трех аллотропных модификациях: алмаз, графит и карбин.
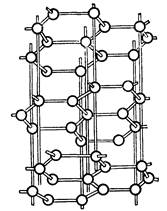
Две основные разновидности углерода - графит и алмаз - существенно отличаются по свойствам. Мягкий графит имеет слоистое строение (рис. 2).Все атомы углерода находятся здесь в состоянии sp2-гибридизации: каждый из них образует три ковалентные связи с соседними атомами, причем углы между направлениями связи равны 120°. Графит электропроводен и хорошо раскалывается по плоскости. В обычных условиях графит и является наиболее устойчивой модификацией. Переход графита в алмаз возможен при очень высоких давлениях (порядка 125000 атм) и температурах (около 3000 °С). Однако исследование этого процесса сначала с теоретических позиций, а затем экспериментальным путем показало, что в присутствии катализаторов (железо, платина) графит превращается в алмаз уже при давлении 60000—80000 атм и температуре 1400—1600 °С. В настоящее время налажено производство искусственных алмазов для технических целей, причем размеры их обычно колеблются от 0,5 до 4 мм; в отдельных случаях удается получить и большие экземпляры. Структура алмаза (рис. 1) типично тетраэдрическая; атомы углерода прочно соединены за счет перекрытия sp3-орбиталей. Хотя в обычных условиях алмаз нестабилен, но практически он может сохраняться неопределенно долгое время. При сильном накаливании алмаза происходит его постепенная графитизация.
Физические свойства алмаза и графита.
| Алмаз | Графит |
| Прозрачен, бесцветен. Не проводит электрический ток, так как нет свободных электронов. Самое твердое из природных веществ. | Непрозрачен, серого цвета с металлическим блеском. Довольно хорошо проводит электрический ток, благодаря наличию подвижных электронов. Скользок на ощупь. Одно из самых мягких среди твердых веществ. |
Алмаз - самое твердое природное вещество. Кристаллы алмазов высоко ценятся и как технический материал, и как драгоценное украшение. Хорошо отшлифованный алмаз - бриллиант. Преломляя лучи света, он сверкает чистыми, яркими цветами радуги.
Размеры мировой добычи алмазов очень незначительны - гораздо меньше, чем благородных металлов - золота и платины. Из алмазов делают наконечники буров для сверления твердых горных пород. Также алмазы применяют для резки стекла и в виде «алмазного инструмента»(резцы, сверла, шлифовальные круги). Алмазным порошком шлифуют бриллианты и твердые сорта стали. Самый крупный из когда-либо найденных алмазов весит 602 г, имеет длину 11 см, ширину 5 см, высоту 6 см. Этот алмаз был найден в 1905 г и носит имя «Кэллиан».
Один из самых крохотных в мире граненых алмазов, весом всего лишь 0,25 мг(в 4000 раз легче копеечной монетки), демонстрировался на всемирной выставке в Брюсселе. Несмотря на ничтожный вес и размер - зернышко объемом 0,07 мм3 ,- искусные руки гранильщика нанесли на нем на нем 57 граней, рассмотреть которые можно только под микроскопом.
| Рис.2 Модель решетки графита.
|
В 1967 г. Б.В. Дерягин и Д.В. Федосеев вырастили на грани алмаза нитеобразный кристалл («алмазные усы»). Рост происходил при высокой температуре, причем источником углерода служил метан; за четыре часа кристаллическая нить вырастала на 1 мм, что, вообще говоря, очень много для процессов такого рода.
Большая часть образцов аморфного угля состоит из искаженных кристаллов графита. Характерное расположение атомов углерода по углам шестиугольника при этом сохраняется.
В решетках графита часто встречаются разнообразные дефекты структуры, как структурные, так и химические, связанные с захватом ионов и атомов. В решетку графита могут внедряться (А. Убеллоде, Ф. Льюис) атомы бора, кислорода, серы и т. п., образующие связи между слоями и влияющие на проводимость графита. Графит образует своеобразные химические соединения, в которых присоединяющиеся частицы размещаются между плоскостями, занятыми атомами углерода.
При нагревании графита в парах щелочных металлов получаются легко окисляющиеся соединения. Так, при 400 °С калий образует соединение C8K. Состав соединений сильно зависит от температуры и изменяется в широких пределах. Известны соединения графита с рубидием, цезием; для натрия и лития четких результатов пока нет; натрий, по-видимому, дает соединение C64Na фиолетового цвета.
Графит дает также соединения с металлами, аммиаком и аминами типа MeC12(NH3)2. Решетка графита во всех случаях расширяется при образовании соединений, и межплоскостное расстояние достигает 0,66 нм, а для метиламинового комплекса лития даже до 0,69 нм. Получены соединения: C9Br, C5CI, C8CI, CF.
Тифлон (CF) серого цвета, изолятор, не похож на другие соединения типа соединений «внедрения». Предполагается образование в нем ковалентных связей фтор - углерод.
Графит раньше применялся как пишущее средство. С XIX века и по сей день используют графитовые электроды в металлургии и химической промышленности, например в производстве алюминия: металл осаждается на графитовом катоде. Сейчас нашли применение графитизированные стали, то есть стали с добавлением монокристаллов графита. Эти стали используют при изготовлении коленчатых валов, поршней и других деталей, где особенно важна высокая прочность и твердость материала.
Графит играет важную роль в электротехнической промышленности и атомной энергетике, где его используют в качестве замедлителя нейтронов. С помощью графитовых стержней регулируют скорость реакции в атомных котлах.
Способность графита расщепляться на чешуйки позволяет делать на его основе смазочные вещества. Графит - прекрасный проводник теплоты, при этом он может выдержать значительные температуры до 3000 °С и выше. К тому же он химически довольно стоек. Эти свойства нашли применение в производстве графитовых теплообменников и в ракетной технике(для изготовления рулей и сопловых аппаратов.
Третья модификация - карбин- была открыта в начале 1960-х годов. Карбин представляет собой порошок глубокого черного цвета с вкраплением более крупных частиц. Электроны в атоме углерода в карбине имеют sp-гибридизацию, т.е. это цепочечный полимер, который встречается в виде двух форм.
Оказалось, что карбин - самая термодинамически устойчивая форма элементарного углерода. В тех условиях, при которых графит переходит в алмаз за 30 минут, карбин не изменяется и после 15 часов выдержки.
Тогда же, в начале 1960-х годов, был открыт и так называемый зеркальный углерод, имеющий, как и графит, слоистое строение, но связи между слоями здесь не слабые межмолекулярные, как в графите, а химические, более прочные. Одна из важнейших особенностей зеркального углерода (кроме твердости, стойкости к высоким температурам и т. д.) - его биологическая совместимость с живыми тканями.
Адсорбция.
Свободный углерод (в виде, например, древесного угля) не только нелетуч, но и неплавок. Поэтому в таком угле сохраняется тонкопористое строение древесины, все тончайшие каналы, по которым в дереве перемещались растворы минеральных солей. Если измерить поверхность всех частиц, находящихся в угольном порошке массой 1 г, или всех пор и каналов в 1 г древесного угля, получится площадь во много десятков и даже сотен квадратных метров.
Поместим в колбу, содержащую воздух с примесью оксида азота (IV), кусочки угля или всыплем в нее толченый уголь. Бурая окраска газа исчезнет: оксид азота (IV) поглотится углем. Нагреем уголь, и оксид азота (IV) в колбе появится вновь. Взболтаем с угольным порошком раствор лакмуса. Окраска раствора тоже исчезнет, лакмус поглотится углем.
Удержание углем и другими твердыми веществами на своей поверхности газа или растворенного вещества называется адсорбцией.
Чем больше пористость угля, тем больше газа или растворенного вещества он может поглотить, или адсорбировать. Для увеличения пористости угля его активируют повторным нагреванием без доступа воздуха. В результате удаляются остатки продуктов, закупоривающие капилляры в угле.
Уголь адсорбирует все газы, включая инертные, но неодинаково. В частности, чем легче сжижается газ, тем сильнее он адсорбируется. Адсорбированный углем газ можно извлечь из него, нагревая уголь. Этим пользуются для регенерации угля, то есть возвращения ему способности к адсорбции. Уголь применяют в производстве сахара и спирта для очистки их от примесей. В аптеках активированный уголь продают в виде таблеток под названием «карболен». Их принимают внутрь для удаления из желудка растворенных вредных веществ. Активированный уголь используют в фильтрующих противогазах для защиты дыхательных путей от вредных примесей воздуха.
Список использованной литературы.
1. Н. Л. Глинка "Общая химия" Издательство "Химия" Ленинградское отделение 1973 г.
2. В. А. Крицман "Книга для чтения по неорганической
химии" Москва "Просвещение" 1993 г.
3. Т. Е. Рудзитис, Ф. Г. Фельдман " Химия 7- 9" Москва
"Просвещение" 1986 г.
4. Ю. В. Ходаков, Д. А. Эпштейн, П. А. Глориозов "Неорганическая химия 9" Москва "Просвещение" 1987г.
5. Л. А. Николаев " Современная химия" Москва "Просвещение" 1980г.
6. Ю. Д. Третьяков, Ю. Г. Метлин "Основы общей химии" Москва "Просвещение" 1980г.
7. Е. М. Закладный, Н. В. Щеголев "Рассказы о полимерах" Издательство "Советская Россия" 1960.
Похожие работы
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...
... и других пород. Между углекислым газом атмосферы и водой океана, в свою очередь, существует подвижное равновесие. Таблица: Содержание углерода на поверхности Земли и в земной коре (16 км мощности) В т В г на 1 смІ поверхности Земли Животные 5·109 0,0015 Растения 5·10№№ 0,1 Атмосфера ...
... подгрупп одной группы — химические антиподы: для одних должны быть более характерны свойства металлов, а для других — неметаллов. Но при сравнении членов обеих подгрупп можно заметить, что «противоположности» сближаются. У элементов побочной подгруппы все более усиливаются свойства неметаллов, характерные для главной подгруппы, и наоборот. Ванадий в этом отношении служит примером. В высшей ...
... так же как и с атомами водорода, кислорода, азота, серы, фосфора и прочих элементов, входящих в состав органических веществ, может разрушаться под воздействием природных факторов. Поэтому углерод непрерывно круговращается в природе: из атмосферы – в растения, из растений – в животные организмы, из живого – в мертвое, из мертвого – в живое... Четыре валентности атома углерода – как четыре руки. А ...






0 комментариев