Содержание:
| Содержание | 1 стр. |
| Введение | 2 стр. |
| Иммуноферментный анализ | 5 стр. |
| Имммуносенсоры | 13 стр. |
| Методы генного зондирования | 16 стр. |
| Иммуноэлектрофорез и иммуноблоттинг | 20 стр. |
| Критерии положительных и отрицательных реакций в лабораторной диагностике инфекционных заболеваний | 23 стр. |
Введение
Идеология лабораторного анализа в медицине основана на понимании любого заболевания как реакции целого организма. Патологическое изменение функции какого-либо органа, ткани, группы клеток вызывает отклонение от нормальных показателей в работе других органов, тканей, систем. Наряду с неспецифическим, т. е. свойственным для многих видов патологии проявлением таких сдвигов, в большинстве случаев наблюдаются особые, характерные лишь для данного заболевания изменения внутренней среды организма. При инфекционных заболеваниях - это, прежде всего, появление во внутренней среде организма возбудителя или его продуктов (токсины, антигены и т.д.) и иммунный ответ на возбудитель.
В связи с этим иммунодиагностика инфекционных заболеваний может быть разделена на две части. Во-первых, это определение изменения функциональной активности различных компонентов иммунной системы, характерных для здорового организма: изменение количества лимфоцитов различных популяций, их соотношения, активности клеток системы мононуклеарных фагоцитов, концентрации иммуноглобулинов и т.п. Во-вторых, это специфическое распознавание маркеров возбудителя и реагирующих с ним комплементарных структур (прежде всего антител) на основе их взаимодействия с микробными антигенами.
В более широком смысле специфическое распознавание возможно не только с помощью антител, но также и других комплементарных структур, реагирующих с микробными продуктами - различными рецепторами клеточной поверхности, лектинами, участками молекул нуклеиновых кислот и т. п. В той или иной мере эти подходы нашли технологическое осуществление в различных методах. Однако лишь методы анализа на основе реакции с участками нуклеиновых кислот нашли достаточно широкое применение в клинической практике (генное зондирование) и будут описаны более подробно. Оценка состояния иммунной системы при инфекционном процессе может включать в себя следующие методы: определение количества и соотношений Т- и В-клеток, субпопуляций лимфоцитов в периферической крови, активности лимфоцитов в реакции бласттрансформации, определение активности макрофагального звена (хемотаксис, подвижность, фагоцитоз), определение концентрации иммуноглобулинов М, G, А и Е, соотношения концентраций изотипов IgG, определение концентрации лимфокинов, монокинов, интерферонов, состояния местного иммунитета (лизоцим, секреторный IgА) и общих неспецифических гуморальных факторов (система, комплемента, пропердин, трансферрин, церулоплазмин), концентрации тимических гормонов и др.Находят применение и методы комплексной оценки реактогенности иммунной системы по, так называемым, реакциям немедленного типа и реакции гиперчувствительности замедленного типа (кожные пробы при бактериальных инфекциях и микозах, туберкулиновая проба). Весьма перепективна оценка субпопуляционного состава лимфоцитов по специфическим поверхностным маркерам, особенно при использовании иммунофлуоресцентных методов автоматической сортировки клеток. Все перечисленные выше методы позволяют оценить динамику изменений состояний иммунной системы при инфекционном процессе, а при провокационных тестах - выявить специфическую реактивность иммунного ответа. Применение такого рода диагностических процедур демонстрирует индивидуальную реакцию иммунной системы пациента на течение инфекционного процесса, позволяет оценить эффективность применяемых методов лечения и прогнозировать исход заболевания. Однако лишь в некоторых случаях эти методы позволяют определить вид инфекционного агента. Изменение соотношения популяций и субпопуляций лимфоцитов происходит при различных видах инфекционных заболеваний, особенно при хроническом течении инфекции. Так же часто изменяется концентрация неспецифических гуморальных компонентов иммунной системы. Известно, что при некоторых паразитарных заболеваниях резко повышен уровень IgЕ в крови. При острых воспалительных процессах, вызываемых бактериями, растет концентрация С-реактивного белка в крови, тогда как при сходных клинических формах вирусной инфекции такие изменения не наблюдаются. Провокационные методы могут выявить сенсибилизацию к какому-либо инфекционному агенту, однако это может быть результатом изменения общей реактивности организма. Иммунодефицитное состояние, вызванное инфекцией, т.е. синдром вторичного иммунодефицита, является широко распространенным явлением. С другой стороны, при инфекции, вызываемой ретровирусами ВИЧ-1, ВИЧ-2, НTLV-1, НТLV-2 наблюдаются самые разнообразные структурные изменения иммунной системы, сопровождающиеся множественными ассоциированными инфекционными заболеваниями протозойной, бактериальной и вирусной природы.
Наиболее значимыми для специфической диагностики инфекционного процесса стали методы иммунохимического анализа (immunoassay) для определения антигенов и антител.
Условно методы иммунохимического анализа можно разделить на четыре большие группы.
К 1-й группе относятся прямые (непосредственные) методы определения реакции антиген-антитело. Образующийся при этом комплекс антиген-антитело идентифицируется визуально, либо с помощью простых оптических устройств. К таким методам относятся преципитация в растворе (в том числе - реакции турбодиметрии и нефелометрии), в геле, на полимерной пленке,
агглютинация бактериальных клеток, простейших, прямая реакция агглютинации эритроцитов антителами, вирусами.
Ко 2-й группе относятся реакции пассивной агглютинации, т.е. агглютинации частиц, с поверхностью которых связаны антигены или антитела. Такие препараты и получили название диагностикум. К этим методам относятся реакции пассивной гемагглютинации (РНГА) и непрямой геммагглютинации (РНГА), латексагглютинации, коагглютинации, агглютинации частиц бентонита, желатиновых капсул, частиц сефарозы и др.
К З-й группе относятся индикаторные методы, основанные на использовании различного рода меток для выявления реакции антиген-антитело. Наиболее распространены иммуноферментный, иммунофлюоресцентный, радиоиммунологический анализ.
В 4-ю группу можно выделить одно из, бурно развивающихся направлений лабораторного анализа - иммуносенсоры.
Все перечисленные методы применяются не только при диагностике инфекционных и неинфекционных заболеваний человека, но и в ветеринарии, растениеводстве, для контроля загрязнения окружающей среды и т. п.
ИММУНОФЕРМЕНТНЫЙ АНАЛИЗ
Основной отличительной чертой иммуноферментного анализа (ИФА) является то, что ; в качестве индикаторной молекулы, которая позволяет следить за иммунным комплексом, используется молекула фермента. В связи с тем что фермент обладает уникальным свойством модифицировать не одну, как в обычных химических реакциях, а большое число молекул субстрата, т. е. обладает своего рода усиливающим свойством, чувствительность иммуноферментных методик может быть очень высока. В некоторых случаях, как показывают многочисленные сравнительные исследования, она выше чувствительности иммунофлуоресцентных и радиоиммунологических методов.
История создания иммуноферментных методик начинается с момента, когда биохимики начали ковалентно иммобилизовывать («пришивать») молекулы ферментов к молекулам белков и, в частности, к молекулам иммуноглобулинов. Однако потребовалось пять лет для создания методики иммуноферментного анализа именно в том виде, в каком мы используем его в настоящее время. Принципы этого метода следующие:
- комплекс антиген - антитело можно выявить, если ввести в состав одного из участников иммунной реакции (ковалентно «пришить») одну или несколько молекул фермента. Причем эта процедура на промежуточных (в процессе «пришивки») и финальной стадии (конъюгат антигена или антитела с ферментом) не должна изменять иммунные (свойства фермент-меченного участника иммунной реакции;
удобно выявлять иммунный комплекс, используя способность фермента расщеплять субстрат, который при ферментативной модификации изменяет свой цвет. В этом случае для выявления комплекса антиген - антитело обычно используют спектрофотометрию;
- ммунный комплекс можно выявлять с помощью иммуноферментного анализа как в растворе, так и при адсорбции (или ковалентной иммобилизации) на твердом носителе. Различают два принципиально различных типа ИФА - гомогенный и гетерогенный (твердофазный) иммуноферментный анализ.
Гомогенный иммуноферментный анализ (ГИФА) - наиболее простой в методическом отношении вид ИФА. При его постановке один из участников иммунной реакции (обычно это низкомолекулярный антиген) метится ферментом и за ходом формирования комплекса антиген-антитело следят, регистрируя изменение активности фермента.
Такое нарушение ферментативной активности может возникать либо за счет пространственного разобщения фермента и субстрата, либо за счет конформационных изменений в молекуле фермента, сопровождающих формирование иммунного комплекса. ГИФА имеет ряд существенных преимуществ перед другими иммунохимическими методами. Во-первых, высокая экспрессия (весь анализ с помощью ГИФА , занимает минуты и даже доли минут).
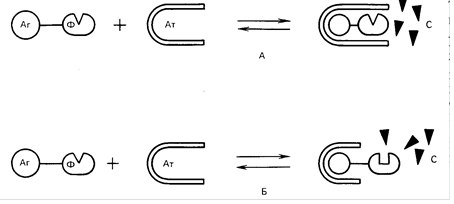
Рис. Варианты гомогенного иммуноферментного анализа (А- эффект разобщения фермента (Ф) и субстрата (С) за счет стерических препятствий при взаимодействии антигена (Аг) и антитела (Ат); Б- эффект изменения конформации фермента при формировании комплекса антиген- антитело.
Во-вторых, метод имеет одну стадию и не требует трудоемких и требующих времени этапов промывки. И наконец, в-третьих, метод требует минимальных объемов (8-50 мкл) и количеств биологического или клинического образца. Однако у метода ГИФА имеется один крайне существенный недостаток - на его основе можно создавать диагностические тест-системы только для низкомолекулярных антигенов. Только, в этом случае антитело, взаимодействуя с антигеном, может эффективно экранировать или модифицировать связанную с этим антигеном молекулу фермента. Именно в связи с этим, ( несмотря на кажущуюся простоту и очевидные преимущества перед другими методами, на основе ГИФА были созданы диагностикумы для выявления только гормонов, пептидов, лекарственных и наркотических веществ и некоторых низкомолекулярных белков.
Гетерогенный (твердофазный) иммуноферментный анализ (ТФИФА или ЕLISА) в последние годы особенно широко используется в биологии и медицине. Как и для других твердофазных методов анализа, характерной особенностью ТФИФА является то, что в процессе проведения анализа один из участников реакции антиген - антитело иммобилизуется на твердом носителе. Эту фиксацию антигена или антител можно осуществлять либо путем их ковалентной «пришивки» к полимерной или стеклянной матрице, либо путем их физической адсорбции на твердом носителе за счет достаточно прочных сил электростатического и ван-дер-ваальсового взаимодействия. Идея иммобилизации иммунного комплекса важна для анализа многокомпонентных смесей макромолекул, когда в системе должны оставаться только те компоненты смеси, которые обладают нужными иммунохимическими свойствами. Именно твердофазные методики позволяют избавиться от балластных, не вошедших в иммунный комплекс антигенов простой промывкой.
Необходимо отметить, что в своей физико-химической основе твердофазный ИФА очень сходен с твердофазным РИА. Отличие касается лишь индикаторных молекул - в ТФИФА это фермент, в твердофазном РИА это радиоактивные изотопы. Остальные же принципы анализа полностью совпадают - в обоих методах используется твердая матрица, на которой адсорбируется иммунный комплекс, и идентичный способ удаления из системы не вошедших в комплекс компонентов диагностикума.
В настоящее время уже опубликованы обзоры, подробно анализирующие схемы проведения диагностических исследований с использованием метода твердофазного ИФА.
Для обнаружения в биологических и клинических образцах бактериальных и вирусных антигенов особенно часто применяется так называемый сэндвич-метод или модифицированный сэндвич-метод. При использовании этих методик на твердую подложку (обычно полистирол) сорбируются последовательно первичные антитела, выявляемый антиген и вторичные антитела. В случае двойного сэндвич-метода ферментная метка вводится в состав вторичных антител, в случае модифицированного двойного сэндвич-метода вторичные антитела (немеченые) «проявляются» антивидовыми меченными ферментом иммуноглобулинами. Особая популярность последней разновидности ТФИФА объясняется тем, что для выполнения методики нет необходимости синтезировать специфические для каждого конкретного антигена конъюгаты (меченные ферментом антитела).
В последние годы были разработаны методики ТФИФА, использующие в качестве «проявляющих» конъюгатов молекулярные комплексы ферментов с белком А золотистого стафилококка. Как известно, это белок взаимодействует с высокой константой связывания с тяжелой цепью (Fс-фрагментами) иммуноглобулинов. Это позволяет построить диагностические системы, где - в качестве «проявляющего» агента используются не антивидовые антитела, а белок А. В этом случае, однако, возникают некоторые трудности, связанные с неспецифичностью белка А, который взаимодействует с Fс-фрагментами любых антител. Если использовать обычную сэндвич-методику, заменив лишь антивидовой конъюгат на конъюгат на основе белка А, последний будет взаимодействовать не только со вторичными антителами, но и с первичными иммуноглобулинами, давая положительную реакцию, даже если проба не содержит искомого антигена. В этом случае имеется несколько вариантов решения проблемы. Во-первых, в качестве первичных антител в методике можно использовать иммуноглобулины, с которыми белок А взаимодействует слабо (например, с мышиными иммуноглобулинами). Во-вторых, возможна прямая адсорбция антигена на полистирол, когда первичные антитела просто не используются. И, наконец, в качестве первичных антител можно применять не полные молекулы иммуноглобулинов, а молекулы, лишенные Fс-фрагментов, - так называемые Раb2 -фрагменты. В этом последнем случае дополнительным удобством методики будет являться то, что для конструирования диагностической системы можно будет использовать не две сыворотки, полученные от разных животных, а одну. Именно в связи с этими обстоятельствами в настоящее время разработано и разрабатывается большое число диагностических методик, использующих конъюгаты на основе белка А.
Построение диагностикумов для серодиагностики бактериальных и вирусных заболеваний, выявление и идентификация с их помощью антител в биологических и клинических образцах проводится аналогичным образом. Обычно приготовляется так называемый иммуносорбент - антиген, иммобилизованный на твердом носителе (либо за счет его прямой сорбции на твердую матрицу, либо за счет ковалентной «пришивки» к этой матрице, либо за счет иммуносорбции на иммобилизованные первичные антитела). Затем исследуемая сыворотка, содержащая или не содержащая выявляемые антитела, контактирует с иммуносорбентом. Степень адсорбции специфических к иммобилизованному антигену иммуноглобулинов обычно определяется с помощью антивидовых конъюгатов. Использование антивидовых антител к различным классам иммуноглобулинов позволяет выявить в исследуемом образце не только специфические к использованному антигену антитела, но и провести их изотиповой анализ.
Конкретные методики диагностики и серодиагностики заболеваний бактериальной и вирусной природы, использующие иммуноферментные подходы, отличаются многими параметрами, в частности, типом и формой адсорбента, на котором иммобилизуется иммунный комплекс. В качестве твердофазного носителя может использоваться целый ряд полимеров: полиметилметакрилат., и нейлон, тефлон, полипропилен и др. Однако наиболее часто в качестве адсорбента в настоящее время применяется полистирол и поливинилхлорид. Для удобства проведения анализа эти адсорбенты производятся в виде многолуночных плашек, шариков или палочек. Использование плашек, изготовленных из оптически прозрачного полистирола или поливинилхлорида позволяет проводить все операции ТФИФА, включая конечное фотометрирование хромофорной субстратной смеси. Не менее существенным преимуществом полистироловых плашек перед другими формами адсорбента является возможность автоматизации практически всех операций анализа, включая трудоемкие этапы промывки лунок и внесения в них однотипных реагентов.
Следует отметить, что использование полистироловых плашек для целей ТФИФА имеет и некоторые недостатки - высокие требования к чистоте полимерного материала и точности изготовления плашек и нерентабельность их использования для одиночных анализов.
Большое внимание при постановке ТФИФА обычно уделяется правильному выбору фермент-субстратной системы. В современных диагностических иммуноферментных тест-системах используется большое число разнообразных ферментов и субстратов. Выбор той или иной фермент-субстратной пары для использования в конкретной тест-системе на основе ТФИФА диктуется несколькими соображениями. Во-первых, обращается внимание на стабильность в процессе анализа и хранения как крайне чувствительного к структурным внутримолекулярным перестройкам конъюгата, так и во многих случаях светочувствительного хромофорного или флуорохромного субстрата. Во-вторых, это отсутствие используемого в диагностикуме фермента или субстрата (свободного или связанного) в биологических или клинических образцах, которые предстоит анализировать. В-третьих, наличие соответствующей регистрирующей аппаратуры (спектрофотометра или спектрофлуориметра). И, наконец, в-четвертых, выбор той или иной фермент-субстратной пары диктуется естественным желанием экспериментатора или клинициста иметь в руках систему, обладающую максимальной специфичностью и чувствительностью.
Таблица: Фермент-субстратные системы, наиболее часто используемые в твердофазном ИФА
| Фермент | Субстрат | Способ | Длина волны наблюдения (н/м) | Чуствительность нг/образец |
| Щелочная фосфатаза | Паранитрофенилфосфат 4-метилумбеллиферил-фосфат Н-аденозинмонофосфат | Фотометрия Флуорометрия Радиометрия | 400,405 450(360) - | 0,5-20 10-4-10-2 10-2 |
| Пероксидаза | 5- аминосалициловая кислота Ортотолуидин(ОТ) 0ртофенилендиамин(ОФД) Ортодианизидин (ОД) Парагидроксифенилпропио - новая кислота | Фотометрия -//- -//- -//- Флуорометрия | 450,474,520 630 450,492 400 405(320) | 100 - 2,5 20 5*105 |
| b -галактозидаза | Ортонитрофенил-b-D-галактозид 4-метилумбеллиферил-b-D-галактозид Флуоресцеин-ди (b-галактозид) | Фотометрия Флуорометрия Флуорометрия | 410,420 450(360) 450(360) | 0,01-10 10-6—10-2
2*10-2 |
*Для фотометрических измерений указаны только наиболее часто используемые длины волн наблюдения; для флюорометрических измерений - длины волн флюоресценции и возбуждения (в скобках).
Специфичность диагностической системы не зависит от выбора фермент-субстратной пары и определяется в основном чистотой и гомогенностью используемых при конструировании диагностикума препаратов антигенов и антител. Использование в ТФИФА не гетерогенных антиген-содержащих препаратов и даже не очищенных бактерий и вирусов, а индивидуальных бактериальных и вирусных белков - вот единственный, хотя и трудоемкий путь повышения специфичности диагностических систем. То же можно сказать и о препаратах, используемых в ТФИФА иммуноглобулинов, - желательно использовать не цельные сыворотки и даже не суммарные гаммаглобулиновые фракции этих сывороток, а аффинноочищенные или моноклональные антитела.
Особой популярностью в настоящее время у нас в стране пользуются иммуноферментные конъюгаты на основе пероксидазы хрена. Это, вероятно, сиязано с доступностью сырья для выделения этого фермента, относительно легкостью очистки, достаточно высокой стабильностью , и большим числом хромофорных и флуорохромных субстратов.. Тем не менее следует подчеркнуть, что два других достаточно часто используемых в ТФИФА фермента - щелочная фосфатаза и b-галактозидаза - в некоторых случаях имеют целый ряд преимуществ перед пероксидазой. Это, во-первых, высокая стабильность, растворимость и нетоксичность субстратов, а, во-вторых, возможность использования относительно недорогих флуорохромных субстратов, применение которых резко повышает чувствительность анализа.
Определенное значение для реализации максимальной чувствительности ТФИФА имеет правильный выбор субстрата. Наряду с естественным желанием использовать субстраты с высокой удельной хромофорной активностью (высокий коэффициент молярной экстинкции окрашенного конечного продукта) необходимо принимать во внимание такие важные факторы, как рвстворимость субстрата и продуктов его ферментативной модификации в условиях проведения анализа и стабильность этих субстратов при хранении и в процессе эксперимента.
Чувствительность диагностических систем на основе ТФИФА лишь частично зависит от типа выбранной при конструировании диагностикума фермент-субстратной пары. В основном эта чувствительность определяется другими факторами, которые трудно учесть: способом синтеза конъюгата, гомогенностью и удельной активностью используемых для такого синтеза антител и антигенов, а также многочисленными па.раметрами проведения анализа (способом иммобилизации выявляемого антигена или антител, степенью их солюбилизации в биологическом или клиническом образце и т. д.). Именно в связи с этим в литературе приводится такой широкий диапазон пределов чувствительности для уже разработанных методик ТФИФА. На основании анализа этих данных трудно рекомендовать при конструировании вновь создаваемых твердофазных иммуноферментных систем наилучший фермент и наулучший субстрат. Следует лишь отметить, что с помощью использованных ранее фермент-субстратных пар метод ТФИФА позволяет выявить в исследуемом образце нанограммовые количества антигена при использовании хромофорных субстратов и пикограммовые количества антигена при применении флюорохромных субстратов.
Если при конструировании новой системы на основе ТФИФА невозможно или нежелательно использование коммерческих универсальных конъюгатов (антивидовых фермент-меченных антител), то встает вопрос о синтезе конъюгата на основе выбранных фермента и антител. Как уже указывалось, наиболее специфичные и высокоактивные конъюгаты могут быть получены на основе только максимально очищенных белковых ингредиентов. Однако в связи с относительной сложностью и трудоемкостью работ по тщательной очистке бактериальных и вирусных антигенов в настоящее время при разработке иммуноферментных систем часто используются либо цельные сыворотки, либо суммарные фракции иммуноглобулинов, содержащие в своем составе как специфические, так и балластные антитела. Антигены также часто не подвергаются надлежащей очистке и используемый при конструировании диагностикума белок составляет лишь небольшой процент от суммарного белка. В связи с этим резко повышается вероятность неспецифических реакций, особенно опасных при высокой чувствительности, которой обладают ИФ-методики.
Большое значение для успешного использования ТФИФА в микробиологических и вирусологических исследованиях имеет правильная интерпретация полученных результатов. Это особенно важно при использовании клинического материала, когда понятия «контроль» и «опыт» часто определяются с большой долей субъективизма. Для тестирования положительных проб вначале ставят 6-8 тестов на образцах, взятых от заведомо здоровых людей и определяют среднюю оптическую плотность контроля и стандартное отклонение при естественном разбросе данных за счет различных методических погрешностей. Проба обычно считается положительной, если отклонение ее оптической плотности от контроля в 3 раза превышает стандартное.
Иммуносенсоры
Впервые принцип иммуносенсоров был использован М. Аizawа и соавт. (1977), когда они сконструировали мембрану, способную на иммунологический ответ. В настоящее время опубликовано несколько сообщений об использовании аналогичного подхода для определения различных микробных антигенов или антител к ним [Horbach Е. еt аl, 1989, Parry R. еt аl., 1990].
Принцип методов, основанных на иммуносенсорной технологии, заключается в изменении физико-химических свойств мембраны или другого носителя, связанного с антителами или антигенами. Уменьшение мембранного потенциала, изменение оптических или химических свойств среды, прилегающей к носителю, выявляются с помощью специального электрода или оптического устройства и выражаются в виде электрического сигнала.
Существует два основных типа иммуносенсоров, различающихся по особенностям определения реакции антиген - антитело. 1 тип - так называемый немеченый иммуносенсор. Такое устройство состоит из металлического электрода для потенциометрии, покрытого полупроницаемой полимерной мембраной с иммобилизованными на ней молекулами антител (или антигена). В результате реакции с искомым комплементарным веществом образуются иммунные комплексы на поверхности мембраны. Это приводит к изменению заряда мембраны и ее поверхностного потенциала. Изменение разности потенциалов и определяется электродом.2 тип - меченый иммуносенсор. В этом случае на мембране также иммобилизуются антитела или антиген, но реакция определяется по изменению проводимости (амперметрия). Для этого используют кислородный электрод, реагирующий на изменение концентрации О2 после реакции антител с антигеном, меченым ферментом (например, каталазой). Конкуренция искомого антигена с известным количеством меченого конъюгата дает изменение проводимости раствора в области мембраны, что реализуется в виде электрического сигнала на выходе электрода. В другой модификации результат цветной ферментативной реакции может быть определен и с помощью оптического устройства.
Для оценки результатов реакции в двух описанных типах иммуносенсоров значительно реже используют пьезоэлектрический эффект, измерение температурных колебаний и некоторые другие способы, менее разработанные в сравнении с электрохимическими и оптическими.
Особенностью иммуносенсоров, отличающей их от других систем иммунохимической диагностики, является то, что информация о возникновении иммунного комплекса непосредственно реализуется в виде физического сигнала - изменения разницы потенциалов, оптической плотности, силы тока и т. п.
Одним из первых применений иммуносенсоров было измерение количества антител при сифилисе. Для этого на полупроницаемой мембране электрода связывали антигены трепонемы и инкубировали его в растворе сыворотки крови. Изменения разницы потенциалов наблюдали вплоть до разведения положительной контрольной сыворотки 1:800, причем, увеличение сигнала соответствовало повышению концентрации антител. Важно то, что после отмывания иммуносенсор можно использовать вновь. Аналогичный подход был применен для определения антител другой специфичности (к групповым антигенам крови) и альбумина. Более сложное строение иммуносенсора увеличивает чувствительность анализа. Так при использовании меченого иммуносенсора достигается чувствительность до 0,1 нг белка/мл. Имеются данные об определении таким методом HBs-антигена с помощью I-электрода и антител к HBs-антигену, меченых пероксидазой [Аizawа М., 1987]. Устройство, включающее стеклянную матрицу, активированную различными вирусными антигенами (биочип) было использовано для серологической диагностики вирусных заболеваний [Ноrbach Е. еt аl., 1989]. Предприняты попытки определять с помощью иммуносенсоров продукты синтеза некоторых грибов (охратоксин А), клетки С. Albicans.
Хотя в настоящее время отсутствуют коммерческие образцы иммуносенсоров для диагностики инфекционных заболеваний, следует обратить внимание на основные этапы использования подобных устройств.
Опыт использования аналогичных систем для определения глюкозы в крови, гормонов, низкомолекулярных веществ позволяет разделить процесс анализа на три этапа:
1 - подготовка образца для анализа
Некоторые типы иммуносенсоров способны взаимодействовать непосредственно с биологическим материалом. Однако чаще всего используется предварительно отделенная центрифугированием плазма или сыворотка крови, разведенная специальным раствором.
2 - проведение аналитической процедуры
Помещая каплю раствора на микроэлектрод, или опуская электрод в исследуемый образец, создается контакт реагентов. Время достижения равновесия от нескольких секунд (для низкомолекулярных веществ) до нескольких минут (для высокомолекулярных агентов, антигенов, клеток). Результат определяется по разнице в показаниях с референс-электродом или по изменению сигнала после реакции. Результат может быть выражен в систематических единицах (милливольт, миллиампер), либо с помощью микропроцессора трансформирован в единицы концентрации искомого агента, в соответствии с предварительным калиброванием.
3 - регенерация иммуносенсора
Для повторного или многократного использования иммуносенсора необходимо освободить его рабочую поверхность от веществ, активно или пассивно сорбированных в ходе анализа. Наиболее простой способ регенерации состоит в интенсивном последовательном промывании иммуносенсора раствором с кислым значением рН и буферным раствором с высокой ионной силой. Для некоторых типов иммуносенсоров до сих пор не найдено оптимальных условий регенерации, не снижающих их чувствительность. В этих случаях используют сменные одноразовые мембранные элементы.
В ближайшее время будут созданы надежные портативные иммуносенсоры для диагностики наиболее распространенных инфекционных заболеваний, как это сделано уже для анализаторов глюкозы.
МЕТОДЫ ГЕННОГО ЗОНДИРОВАНИЯ
Интенсивное развитие молекулярной биологии и создание совершенной методической базы генетических исследований явились основой генетической инженерии. В области диагностики возникло и бурно развивается направление по определению специфических нуклеотидных последовательностей ДНК и РНК, так называемое генное зондирование. В основе подобных методик лежит способность нуклеиновых кислот к гибридизации - образованию двухцепочных структур за счет взаимодействия комплементарных нуклеотидов (А-Т, Г-Ц). Для определения искомой последовательности ДНК (или РНК) специально создается, так называемый, зонд полинуклеотид с определенной последовательностью оснований. В его состав вводят специальную метку, позволяющую идентифицировать образование комплекса. Схема реакции представлена на рисунке.
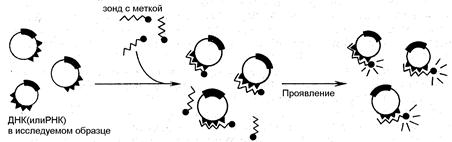
Рис. Схема реакции генного зондирования для обнаружения в образцах ДНК или РНК микроба специфическим меченым зондом.
Хотя генное зондирование нельзя отнести к методам иммунохимического анализа, основной его принцип (взаимодействие комплементарных структур) методически реализуется теми же способами, что и индикаторные методы иммунодиагностики. Кроме того, методы генного зондирования позволяют восполнить информацию об инфекционном агенте в отсутствии его фенотипической экспрессии (вирусы, встроенные в геном, «молчащие» гены).
Первые сообщения об использовании зондов были связаны с чисто исследовательскими задачами молекулярной биологии - контролем наличия тех или иных последовательностей ДНК в общем пуле клеточной ДНК. Различают несколько разновидностей генного зондирования: гибридизация по Саузерну (анализ ДНК), Nothern-блот (анализ РНК), точечная гибридизация, гибридизация in situ. (на срезе, в мазке)
Для проведения анализа ДНК пробу подвергают денатурации с целью получения одноцепочных структур, с которыми и реагируют молекулы ДНК- или РНК-зонда. Для приготовления зондов используют либо различные участки ДНК (или РНК), выделенные из естественного источника (например, того или иного микроорганизма), как правило представленные в виде генетических последовательностей в составе векторных плазмид, либо химически синтезированные олигонуклеотиды. В некоторых случаях в качестве зонда применяют препараты геномной ДНК, гидролизованной на фрагменты, иногда - препараты РНК, особенно часто - рибосомальная РНК [Stull T.1988].
В качестве метки используют те же индикаторы, что и при различных видах иммунохимического анализа: радиоактивные изотопы, флуоресцеины, биотоп (с дальнейшим проявлением комплексом авидин-фермент) и т. п.
Порядок проведения анализа определяется свойствами имеющегося зонда. В исследовательских лабораториях используют ДНК-зонды, приготовленные самостоятельно и меченые, как правило, радиоактивным фосфором (32Р). В настоящее время все чаще применяются коммерческие наборы, содержащие все необходимые ингредиенты.
В большинстве случаев процедуру проведения анализа можно разделить на следующие стадии: подготовка образцов (в том числе экстракция и денатурация ДНК), фиксация пробы на носителе (чаще всего - полимерный мембранный фильтр), предгибридизация, собственно гибридизация, отмывание несвязавшихся продуктов, детекция. При отсутствии стандартного препарата ДНК- или РНК-зонда предварительно проводится его получение и введение метки.
Для подготовки пробы может быть необходимо предварительное «подращивание» исследуемого материала для идентификации отдельных колоний бактерий или увеличения концентрации вирусов в клеточной культуре. Проводится и непосредственный анализ образцов сыворотки крови, мочи, уретральных соскобов, форменных элементов крови или цельной крови на присутствие инфекционного агента. Для освобождения нуклеиновых кислот из состава клеточных структур проводят лизис клеток, а в некоторых случаях очищают препарат ДНК с помощью фенола. Денатурация ДНК, т. е. переход ее в одноцепочную форму, происходит при обработке щелочью. Затем образец нуклеиновых кислот фиксируют на носителе - нитроцеллюлезной или нейлоновой мембране, обычно путем инкубации от 10 мин до 4 час при 80 С0 в вакууме. Далее, в процессе предгибридизации достигается инактивация свободных мест связывания для уменьшения неспецифического взаимодействия зонда с мембраной. Процесс гибридизации занимает от 2 до 20 ч, в зависимости от концентрации ДНК в образце, концентрации используемого зонда и его размера.
После окончания гибридизации и отмывания несвязавшихся продуктов проводится детекция образовавшегося комплекса. Если в состав зонда входит радиоактивная метка, то для проявления реакции мембрану экспонируют с фотопленкой (ауторадиография). Для других меток используют соответствующие процедуры. Например, известен метод определения модифицированных участков ДНК с помощью антител [Stollar В., Rashtchian А., 10987], введением в состав зонда низкомолеку лярных компонентов (биотин, дигоксин и т. п.) с последующим проявлением конъюгатом авидин-фермент, антитело - фермент [van Brunt J., Klausner A. 1987].
Первые сообщения о коммерческих образцах наборов для генного зондирования появились в 1986 г. - ими стали наборы для определения М.pneumoniae, L.pneumoniae. Затем появились наборы для индентификации других патогенов, в том числе - вируса иммунодефицита человека.
В настоящее время ведутся интенсивные разработки по упрощению процедуры генного зондирования до одной - двух стадий процесса. Предприняты попытки отказаться от сорбции материала на мембране [Edelstein Р., 1986].
Наиболее перспективным является получение нерадиоактивных (так называемых - холодных) зондов. На этой же основе развивается методика гибридизации, позволяющая устанавливать наличие патогена в препаратах срезов, пунктатов ткани, что особенно важно при патоморфологическом анализе (гибридизация in situ).
Существенным этапом в развитии методов генного зондирования явилось использование полимеразной реакции амплификации (РCR). Этот подход позволяет увеличить концентрацию определенной (заранее известной) последовательности ДНК в пробе за счет синтеза многочисленных копий in vitro. Для проведения реакции к исследуемому образцу ДНК добавляют препарат фермента ДНК-полимеразы, избыток дезоксинуклеотидов для синтеза и, так называемые, праймеры - два типа олигонуклеотидов величиной 20-25 оснований, соответствующих концевым участкам интересующей последовательности ДНК. Один из праймеров должен быть копией начала участка считывания кодирующей цепи ДНК при направлении считывания 5-3, а второй - копией противоположного конца некодирующей цепи. Тогда при каждом цикле полимеразной реакции происходит удвоение количества ДНК-копий.
Для осуществления связывания праймеров необходима денатурация ДНК (плавление) при 94°С с последующим доведением смеси до 40-55°С. В первом сообщении, описывающем метод, полимеразу добавляли вновь после каждого взаимодействия праймеров с ДНК, так как фермент не выдерживал нагревания до 940. В настоящее время чаще используют ДНК- полимеразу термофильной бактерии Т.aquaticus, выдерживающую такую температуру и имеющую максимум активности при 7()°С.
Для проведения реакции сконструированы программируемые инкубаторы микропроб, позволяющие легко чередовать изменения температуры, оптимальной для каждого этапа реакции.
Реакция амплификации позволяет существенно повысить чувствительность анализа при генном зондировании, что особенно важно при низкой концентрации инфекционного агента. Особое значение этот подход приобрел при диагностике СПИДа и некоторых других вирусных инфекций. Причем в этих случаях впервые была показана возможность амплификации и для РНК-содержащих вирусов (непосредственно, или через провирусную ДНК) [Реаkе I., 1989].
Одним из существенных достоинств генного зондирования с амплификацией является возможность исследования субмикроскопического количества патологического материала. Так уже показана возможность генетического анализа материала единственной волосяной сумки, взятой из человеческой кожи, или нескольких десятков буккальных клеток, полученных простым полосканием полости рта [Lench N. еt аl., 1988].
Другой особенностью метода, более важной для анализа инфекционного материала, является возможность выявления скрытых (молчащих) генов. Например, выявление гена холерного токсина в штаммах без его фенотипического проявления, позволяет сделать важные выводы при эпидемиологическом анализе [Гинцбург А. Л., 1988].
Методы, связанные с использованием генного зондирования безусловно, будут более широко внедряться в практику диагностики инфекционных заболеваний по мере их упрощения и удешевления.
ИММуноэлектрофорез и ИММУНОБЛОТТИНГ
Иммуноэлектрофорез помогает идентифицировать антигены по электрофоретической подвижности, особенно в том случае, когда в образце присутствуют и другие антигены. С помощью данного метода в клинической иммунологии полуколичественно определяют концентрацию иммуноглобулинов и идентифицируют миеломные белки.
На основе сочетания электрофореза с иммуноперципитацией разработано несколько удачных
методов, в каждом из которых перемещение антигена в электрическом поле приводит к его контакту с антителами. Встречный иммуноэлектрофорез может применяться для определения антигенов, мигрирующих в агаре к положительно заряженному электроду. Данный метод занимает меньше времени и более чувствителен, чем двойная диффузия по Ухтерлони. Его применяют для идентификации антигенов вируса гепатита В и соответствующих антител, антител к ДНК при системной красной волчанке, аутоантител к растворимым ядерным антигенам при коллагенозах, а также антител (преципитинов) к Aspergillus при аллергическом бронхолегочном аспергиллезе. Ракетный электрофорез-это количественный метод, предусматривающий внесение антигена в гель, содержащий антитела. Линия преципитации имеет форму ракеты , длина которой определяется концентрацией антигена. Как и встречный электрофорез, это-быстрый метод, но и здесь антиген должен перемещаться к положительно заряженному электроду. Таким образом, ракетный электрофорез подходит для белков, например альбумина, трансферрина и церулоплазмина, в то время как концентрацию иммуноглобулинов обычно определяют методом простой радиальной иммунодиффузии. Один из наиболее удачных вариантов ракетного электрофореза - двухмерный или перекрестный иммуноэлектрофорез Лорелла. При этом на первом этапе смесь антигенов электрофоретически разделяют в геле агарозы. Затем разделенные белки вновь заставляют диффундировать в геле под влиянием электрического поля в другом
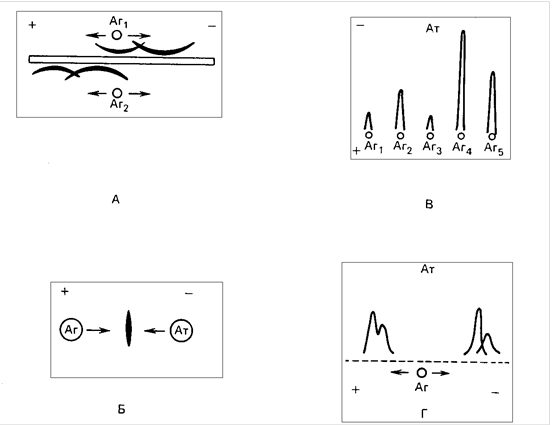
Рис. Виды иммуноэлектрофореза А- простой иммуноэлектрофорез; Б- встречный иммуноэлектрофорез; В - ракетный иммуноэлектрофорез; Г - двумерный иммуноэлектрофорез. Стрелки - направление движение АГ и АТ в электрическом поле.
направлении, перпендикулярном первому. Таким образом удалось количественно определить каждый из антигенов смеси. Наиболее впечатляющий пример- это оценка степени конверсии СЗ в инактивированную форму СЗс, которая часто происходит при обострении в сыворотке больных системной красной волчанкой или синовиальной жидкости пораженных суставов в острой фазе ревматоидного артрита, а также в других случаях.
Иммуноблоттинг
После разделения сложной смеси белков методом электрофореза в полиакриламидном или ага- розном геле их можно перенести из геля на
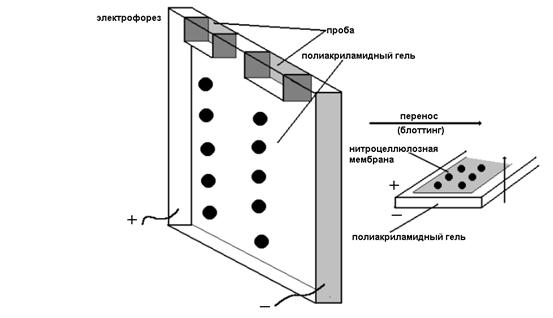 Рис. Схема иммуноблотинга
Рис. Схема иммуноблотинга
микропористую нитроцеллюлозную мембрану. Далее неспецифически связанные с мембраной антигены могут быть идентифицированы с помощью меченых антител. Данный метод получил широкое распространение. Например, он используется для идентификации компонентов нейрофиламентов, которые предварительно разделяют в полиакриламидном геле в присутствии додецилсульфата натрия (ДСН).
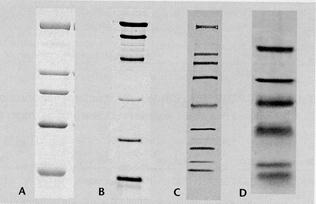
Рис. Пример иммуноблотинга
Разумеется, если антиген необратимо денатурируется ДСН, то такая методика использоваться не может. Если белки антисывороткк разделить изоэлектрофокусированием, а затем перенести (это и называется блоттингом) на мембрану, то с помощью меченого антигена можно установить и так называемый спектротип антисыворотки, т.е. определить изотип антител, взаимодействующих с данным антигеном.
Схема: Основные методы окраски в иммуноблотинге (Western-blot).
КРИТЕРИИ ПОЛОЖИТЕЛЬНЫХ И ОТРИЦАТЕЛЬНЫХ РЕАКЦИЙ В ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ
Проблема дифференциации положительного и отрицательного результата не является специфической для медицины, а пути ее разрешения лежат в области математической статистики. Тем не менее, следует обсудить некоторые практические вопросы, с которыми встречаются врачи при использовании различных методов лабораторной диагностики, в том числе - иммунохимического анализа при инфекционных заболеваниях.
Основным противоречием, возникающим при анализе лабораторных данных и приводящим к совершенствованию известных и разработке новых методов диагностики, является несоответствие между целью медицинской диагностики как таковой, т. е. стремлением врача определить, чем болен пациент и целью того или иного метода (установление какого-либо параметра внутренней среды организма). Поэтому любой метод иммунохимического анализа должен рассматриваться лишь как часть общей диагностической процедуры. Ни один из этих методов не может быть использован вне клинической интерпретации. Ложноположительные или ложноотрицательные выя реакции при лабораторном анализе имеют значение не только для самого пациента. Такая ситуация при СПИДе, например, оказалась опасной и в социальном и в эпидемиологическом аспекте.
В лабораторном анализе при характеристике аналитической процедуры принято указывать количественные показатели метода: чувствительность, воспроизводимость, точность и др. Однако при определенных взаимодействиях между организмом и инфекционным агентом может возникнуть ситуация, когда высокочувствительный метод не позволяет получить достоверную информацию о причине заболевания. Например, определение антител любыми совершенными методами не дает информацию в случае выраженной иммуносупрессии гуморального ответа.
Для того, чтобы выразить возможность использования симптома (результата иммунохимического анализа) для диагностики определенного заболевания можно определить понятия чувствительности и специфичности анализа, в сравнении с контрольной группой здоровых людей, как частоту положительных и отрицательных реакций.
число положительных реакций у больных с подтвержденным диагнозом
Чувствительность=---------------------------------------------------------------------
число обследованных больных с подтвержденным диагнозом
число отрицательных реакций в контрольной группе
Специфичность = -------------------------------------------------------------------------
число обследованных пациентов в контрольной группе
Эти параметры могут быть использованы при сравнении эффективности каких-либо методов. Однако для применения их на практике необходимо уточнить принципы формирования опытной и контрольной групп, а также оценить, какое значение имеют вычисленные параметры для оценки случайно выбранных неизвестных образцов. Правильное решение указанных вопросов и позволяет перейти к разработке критериев положительной и отрицательной реакции.
Для формирования опытной группы больных с инфекционной патологией, как правило, используют больных, у которых обнаружен искомый инфекционный агент другими методами - бактериологическими, вирусологическими и т. п. В случае инфекции, вызываемой условнопатогенными микроорганизмами используют количественные или функциональные критерии. В зависимости от целей анализа, группа может быть более или менее однородной по другим признакам данного заболевания - особенностям течения и тяжести инфекционного процесса, возрасту больных, сопутствующему лечению (прежде всего - введению антибиотиков).
Формирование контрольной группы из здоровых лиц является наиболее частым, но не единственным способом. Если анализируемый метод будет применен для дифференциального анализа _ сходных заболеваний, вызываемых разными микроорганизмами, более важным является подбор группы с заболеванием, которое следует исключить при установлении диагноза. Например, при острой пневмонии, вызванной различными возбудителями (Str. Pneumoniae, H. influenzae) для оценки чувствительности и специфичности, например, метода определения антигенов пневмококка, следует сформировать контрольную группу из больных с заболеванием, вызванным гемофильной палочкой. Вышеуказанное важно учитывать при разработке методов диагностики. Однако и при использовании этих методов следует иметь представление о причинах возникновения и возможной интерпретации ложноположительных и ложноотрицательных реакций. При анализе образцов от пациентов с неизвестным диагнозом следует учитывать дополнительные параметры, производные от чувствительности и специфичности анализа.
Ожидаемая ценность Число положительных результатов в опытной группе
положительного =-------------------------------------------------------------------
результата Число положительных результатов в обеих группах
Ожидаемая ценность Число отрицательных результатов в опытной группе
отрицательного =-------------------------------------------------------------------
результата Число отрицательных результатов в обеих группах
В целом, чем выше чувствительность и специфичность анализа, тем выше ценность положительного и отрицательного результатов. Однако для случайно взятых образцов значение ожидаемой ценности результатов будет зависеть от частоты данного заболевания в популяции (преваленс). Например, при чувствительности и специфичности метода равных 99% и частоте заболевания 0,1% количество больных на 100 000 пациентов составит 100, из них положительная реакция будет у 99. Однако у пациентов без данного заболевания (всего их 99 900) будет в 100 случаях также выявлена положительная реакция. Таким образом, ценность положительного результата составит 99/(100+99) 50%, а отрицательного - 99 80ОД99 800+1) 100%. В случае же, если в данной популяции частота заболевания более высока, то и ценность положительного результата выше. Например, при частоте в 10%, соответствующие значения ценности положительного результата - 91,70/0, а отрицательного - 99,9%.
Влияет ли выбор критерия оценки положительного и отрицательного результата на чувствительность и специфичность анализа?
При оценке того или иного метода диагностики врач, как правило, пользуется критериями, специально выработанными для данного метода, реже - собственным опытом. В качестве критерия установления положительного или отрицательного результата может выступать параметр в виде концентрации вещества (в сравнении с концентрацией в норме). Могут быть использованы безразмерные величины, выражающие отношение определяемого показателя к нормальной величине. Иногда критерием служат единицы активности материала и характеристики активности специально введенных меченых молекул (флуохромы, изотопы и т. п.).
Наиболее часто определение критерия положительной реакции связано с анализом образцов из опытной и контрольной групп, описанных выше. Определение значений чувствительности и специфичности при разных способах оценки позволяет выявить критерий, соответствующий максимальному значению вычисленных величин.
Принципиальное значение для определения этих критериев имеет аналитическая вариабельность метода, т. е. величина расхождения между значениями, полученными при многократных измерениях одной и той же пробы. Допускается, что этот параметр должен составить не более 10% среднего значения измеряемой величины, но не больше 25% ширины интервала величин, полученных в контрольной группе [Власов В. В., 1988].
Большое разнообразие методов и реакций, применяемых в иммунохимическом анализе отражает различия в течениии инфекционных процессов, многообразие возбудителей и условий взаимодействия между микро- и макроорганизмом. Но также, как не может существовать единственного средства лечения всех болезней, нет панацеи и в диагностическом смысле.
Итак, проведение аналитических процедур при подозрении на инфекционное заболевание, должно быть направлено на обнаружение патогенного агента (вируса, бактерии, простейшего и т. п.), а также иммунологического ответа макроорганизма на этот агент. Классическая триада Коха в подавляющем большинстве случаев является недостижимым условием диагностики вирусных и бактериальных заболеваний, в меньшей степени - паразитарных. Многочисленные исследования бессимптомного носительства вирусов и бактерий убеждают в том, что обнаружение микроба является лишь одним из признаков, которые должны учитываться врачом при постановке диагноза. Ситуацию осложняют частые смешанные инфекции (ассоциации типа вирус - вирус, бактерия - бактерия и вирус - бактерия). Кроме того, иммунный ответ на инфекционный агент не во всех случаях носит регулярный характер (первичные и вторичные иммунодефициты). С другой стороны, современный человек иммунизируется достаточно большим количеством вакцин, что может маскировать развитие сопутствующей инфекции. В связи с этим, процесс установления диагноза, в том числе с помощью иммунохимических методов, следует рассматривать как вероятностный. Привлечение дополнительной информации (расширение симптоматики) можно считать способом увеличения вероятности установления правильного диагноза. Для инфекционных заболеваний, несмотря на конкретный тип или вид возбудителя, можно назвать три основных процесса, которые определяют вероятность идентификации этиологического агента:
- наличие в макроорганизме или на ограничивающих его покровах генетического материала микроорганизма, продукты которого прямо или опосредовано повреждают функциональные структуры макроорганизма;
- определение в макроорганизме или на ограничивающих его покровах этих биологически активных продуктов микроорганизма, приводящих к проявлению симптомов, характерных для данного заболевания;
- изменение состояния иммунной системы макроорганизма под действием микробных продуктов, направленное на их нейтрализацию.
Очевидно, что ни один из этих признаков не выявляется в 100% случаях в любой стадии и разновидности инфекции определенного типа. Так, на стадии выздоровления сами микробы и многие их продукты могут не определяться. Иногда развернутая клиническая картина является следствием воздействия на макроорганизм микроба, который быстро элиминируется из организма. При этом, в одних случаях невозможно достоверно определить генетический материал микроба, а в других - уже нейтрализованный антигенный материал. Иммунный ответ, как уже отмечалось выше, может развиваться лишь через несколько суток после начала болезни. Следовательно, в начальной стадии болезни определение, например, наличия антител затруднительно. Но тем не менее наличие в течение определенного периода времени одного, двух или всех трех рассмотренных признаков пропорционально ведет к увеличению вероятности того, что данный микроб является возбудителем. И наоборот, если ни один их этих признаков не наблюдается, то эта вероятность стремится к нулю.
Рассматривая примеры использования различных методов для специфической диагностики инфекционных заболеваний можно отметить, что коммерческие препараты, используемые в мире для этих целей, относятся в основном к методам агглютинации, преципитации, нейтрализации вирусов, ингибирования гемагглютинации, пассивной гемагглютинации, коагглютинации, латексагглютинации, реакции связывания комплемента, иммунофлуоресценции, ИФА. Значительно реже для этих целей используют радиоиммунологический анализ, метод генного зондирования, а коммерческие иммуносенсоры и липосомальные методы еще только разрабатываются. Хотя в научной литературе есть сообщения о разных видах иммунохимического анализа, описанных или не упомянутых в настоящей главе, немногие методы стали общепринятыми.
Для бактериальных инфекций в некоторых случаях сохраняется использование методов прямой агглютинации бактерий для идентификации их чистой культуры (при респираторных, кишечных инфекциях) либо определение
Таблица: Возможности использования коммерческих препаратов для различных методов лабораторной диагностики при инфекциях у человека.
| Метод | Определяемый компонент | Инфекционная патология(возбудитель) |
| Прямая агглютинация | Антигены, антитела | Кишечные инфекции (Sallmonella, Shigella, Escherichia, Proteus, Brucella),Респираторная инфекция (B. Pertussis, Legionella, N.meningitidis, S.Pneumoniae, Staphylococcus, Streptococcus), Listeria monocytogenes, T.gondii |
| Торможение прямой гемагглютинации | Антитела | Вирусы ЕСНО-коксаки, гриппа, парагриппа, паротита, кори, реовирусы |
| Нейтрализация | Антитела | М.Pneumoniae, Вирусы ЕСНО-коксаки, аденовирусы, гриппа, парагриппа, полимиелита, реовирусы |
| Перциптация | Антигены, антитела | Гистоплазмоз, кокцидиоидомикоз, бластомикоз, аспергиллез. кандидоз, сифилис |
| Коааглютинация | Антигены | Кишечные инфекции (Shigella, энтеротоксикогенные E. Coli), менингит (N.meningitidis, S.Pneumoniae, H. Influenzae) |
| Латексагглютинация | Антигены, антитела | менингит (N.meningitidis, S.Pneumoniae, Streptococcus, H.Influenzae ), E. Coli, S.aureus, Cl. Perfingens, эхинококкоз, мононуклеоз, краснуха, криптококкоз, цитомегаловирус. |
| РПГА | Антитела | Yersinia, Staphylococcus, мононуклеоз, краснуха, трипаносомоз, шистомоз, лейшманиоз, эхинококкоз, амебная дизентерия |
| Реакция связывания комплемента | Антитела | Большинство патогенных вирусов, бактерий, Chlamidia, М.Pneumoniae, рикетсии, Р.Capsulatum, B.dermatitidis, C.immitis, Aspergillus |
| Иммунфлуоресценция | Антигены, антитела | Aденовирусы, Вирусы ЕСНО-коксаки, цитомегаловирус, вирус простого герпеса, гриппа, краснухи, гепатита В, М.Pneumoniae, Большинство патогенных бактерий, E.Histolytica |
| Иммуноферментный анализ | Антигены, антитела | Большинство патогенных бактерий, вирусов, грибы, простейшие |
| Генные зонды | Нуклеиновые кислоты | М.Pneumoniae, L.Pneumoniae, Aденовирусы, Вирусы ЕСНО-коксаки, гепатита A и В, вирус простого герпеса, ВИЧ-1, ВИЧ-2, папиломавирус |
антител (кишечные инфекции), хотя значение этих реакций в сравнении с другими более чувствительными, постепенно снижается. Такая же закономерность наблюдается и при использовании методов прямой агглютинации при паразитарных заболеваниях.
Для вирусных инфекций аналогом является метод прямой гемагглютинации. Однако, из-за его относительно невысокой специфичности, практически более важным является метод ингибирования (торможения) реакции гемагглютинации с целью определения антител к вирусу. Для этих же целей используют метод нейтрализации вирусов, однако он более трудоемок из-за необходимости поддержания культуры вируса.
На смену этим реакциям при бактериальных, вирусных и паразитарных инфекциях приходят методы коагглютинации (определение антигенов) и латексагглютинации (определение антигенов, либо антител). Эти методы находят все большее практическое применение, особенно при диагностике менингитов, респираторных и некоторых кишечных инфекций. Реакция пассивной агглютинации по-прежнему популярна при диагностике паразитарных заболеваний, реже при определении антител к вирусам (краснуха, мононуклеоз).
Реакция связывания комплемента используется для определения антител при большинстве видов инфекций, а особенно широко - при вирусных заболеваниях и болезнях, вызываемых риккетсиями, микоплазмами и т. п. Однако в последнее десятилетие этот метод вытесняется ИФА.
Иммунофлюоресцентный метод для определения антигенов и антител в силу своей универсальности также распространен при различных видах инфекционной патологии. В обычных вариантах он основан на микроскопии и визуальном наблюдении. Это одновременно и недостаток (субъективная оценка) и достоинство (наглядность), что в значительной мере руководит при его выборе врачом, в зависимости от целей анализа. Модификации последних лет, основанные на инструментальном учете, вместе с ИФА теснят другие иммунохимические методы.
Радиоиммунологический анализ для диагностики инфекций применяется для подтверждения некоторых форм гепатита В, а также СПИДа. Расширение области его использования в практике диагностики инфекционной патологии мало вероятно.
Иммуноферментный анализ для определения антигенов и антител к микроорганизмам находит все более широкое применение в практике. В настоящее время по частоте применения он не уступает, а в многих случаях (гепатиты, СПИД) превосходит другие методы иммунохимического анализа. При бактериальных, вирусных, паразитарных заболеваниях с его помощью определяют различные антигены микробов и антитела к ним, относящиеся к разным классам иммуноглобулинов.
Практически важным при выявлении антигена любым методом иммунохимического анализа является представление о природе искомого антигена. В некоторых случаях система анализа ориентирована лишь на определенный тип антигена, характерный для определенного типа инфекции. Например, при диагностике коклюша можно определять различные компоненты бактерии - ЛПС, различные белки и т. д. Однако наиболее существенно выявление коклюшного токсина. Вирусы, вызывающие у человека СПИД (ВИЧ-1 и ВИЧ-2) имеют общие антигены с вирусами лейкоза крупного рогатого скота, но диагностически значимо определять специфические гликоп- ротеины gp 24, gp 120 и т. д. То же относится и к определению антител. При бактериальном эндокардите, вызываемом S.aureus диагностически более значимы антитела к тейхоевым кислотам, а при респираторной стафилококковой инфекции - антитела к поверхностным антигенам. При использовании того или иного набора для проведения иммунологического анализа следует определять для какого типа заболевания определяемый признак является информативным, т. е. увеличивающим вероятность точного диагноза.
Следовательно, в результате рассмотрения всего многообразия методов иммунохимической диагностики, можно заключить, что необходимым является использование различных методов, оптимальный набор которых зависит от конкретной патологии. Так для острой респираторной инфекции кроме классических бактериологического и вирусологического анализа можно рекомендовать метод латексагглютинации для определения антигенов, иммунофлуоресцентный метод для подтверждения, иммуноферментный для определения антител. При СПИДе проводится определение вируса и антител к нему иммуноферментным методом (иногда скрининг - методом латексаг- глютинации) с подтверждением иммуноферментным (вестерн-блат), либо радиоиммунологическим методом.
Цели непосредственного анализа диктуют наиболее приемлемые варианты обследования и уровень сложности методов. Для массового скрининга необходимы простые, но надежные и чувствительные методы (латексагглютинация, гомогенный ИФА, иногда РПГА), позволяющие проводить десятки и сотни анализов в сутки. Для установления первичного диагноза в поликлиническом лечебном заведении, для анализа образцов в лаборатории СЭС необходимы относительно простые методы, но с более высокими показателями чувствительности (ИФА, РИА). При обследовании пациента в специализированной клинике комплекс таких методов должен быть как можно более широким, включая и длительные наблюдения динамики развития процесса, иммуногистологический анализ (в том числе - иммунофлуоресцентный), генное зондирование и т. д.
Последовательное применение изложенных принципов, на наш взгляд, позволит наиболее эффективно использовать преимущества высокочувствительных и информативных методов иммунохимического анализа для диагностики инфекционных заболеваний человека.
Список литературы:
1. Ройт А. “Основы иммунологии” Мир 1990 г.
2. Руководство “Иммунология инфекционного процесса” Москва 1994 г.
3. В.Г. Галактинов “Графические модели в иммунологии” Медицина 1986 г.
4. Р.В. Петров “Иммунология” Медицина 1987 г.
5. А.М. Егоров “Теория и практика иммуноферментного анализа” Высшая школа 1991 г.
6. У.П. Коллинз “Новые методы иммуноанализа” Мир 1991 г.
7. Каталог фирмы Biorad 1996 г.
8. Материалы занятий и лекции по микробиологии 1995 - 1996 год.
Похожие работы
... , чем при легочном, точку над i в установлении этиологии процесса ставит пробное лечение – сперва альтернативных болезней, а затем и туберкулеза. Клиника офтальмотуберкулеза. Туберкулез глаз относится к тяжелым заболеваниям органа зрения, характеризующимся упорным течением и, как правило, тяжелыми последствиями со стойким снижением зрения. Даже окончательная приостановка воспалительного процесса ...
... на его течение профессиональные вредности и стрессовые ситуации. Все это необходимо учитывать при диагностике и лечении атопического дерматита у пациентов разных возрастных группК л и н и ч е с к и е ф о р м ы а т о п и ч е с к о г о д е р м а т и т а. Единой классификации форм атопического дерматита в литературе нет. Многие авторы, в зависимости от возраста больных выделяют несколько форм ...
... дня после появления сыпи. Диспансеризация: Не проводится Специфическая профилактика В стадии разработки. Неспецифическая профилактика Изоляция больных из коллектива. МАЛЯРИЯ Малярия – инфекционная болезнь, протекающая длительно, характеризующаяся периодическими приступами лихорадки, увеличением печени, селезенки, прогрессирующей анемией. Клиническая диагностика Инкубационный период при ...
... группах населения; значения альтернативной медицины в борьбе с этим страшным недугом и в повседневной жизни, была подготовлена специальная анкета (приложение №1) и проведен социологический опрос на тему "Нетрадиционная медицина в лечении рака". В опросе принимали участие респонденты разного возраста, которые входили в три разных возрастных группы. Первая группа включала молодых людей до 20 лет; во ...
0 комментариев