Зиганшина С.Х., Хурсан С.Л., Назаров А.М., Калиниченко И.А.
Методом импульсного фотолиза и кинетической спектрофотометрии исследованы кинетические закономерности реакции бензофеноноксида (БФО) с рядом спиртов (метанол, этанол, изо-пропанол, н-бутанол, изо-бутанол, изо-пентанол, циклогексанол, ментол, трифенилметанол, фенилметанол, адамантанол и вода) в растворе ацетонитрила и бензола.
БФО получали импульсным фотолизом растворов дифенилдиазометана, насыщенных кислородом воздуха [1]:
| Ph2CN2 1Ph2C: 3Ph2C:+O2 Ph2COO+Ph2CN2 Ph2COO+Ph2COO Ph2COO+ROH |
| 1Ph2C:+N2 3Ph2C: Ph2COO Ph2C=O+N2 2Ph2C=O=O2 продукты | (1) (ST, TS) (2) (3) (4) (5) |
Начальная концентрация Ph2CN2 во всех случаях составляла 1.8.10-4 моль/л. Все исследования проводились при комнатной температуре. За расходованием БФО следили спектрофотометрически в растворе ацетонитрила на максимуме поглощения (410 нм), в бензоле - 415 нм [1].
Согласно схеме, убыль оптической плотности A, соответствующая расходованию БФО, описывается уравнением:
|
| (I) |
где коэффициент экстинкции ![]() =1900 л/моль.см [1], длина кюветы l=10 см, k4 - константа скорости реакции рекомбинации БФО. В ацетонитриле k4=1.8.107 л/моль.с и в бензоле k4=7.107 л/моль.с [2].
=1900 л/моль.см [1], длина кюветы l=10 см, k4 - константа скорости реакции рекомбинации БФО. В ацетонитриле k4=1.8.107 л/моль.с и в бензоле k4=7.107 л/моль.с [2].
Методом нелинейного регрессионного анализа, используя известные значения А0 и k(2), находили константы k(1), линейно зависящие от концентрации ROН. Из тангенса угла наклона этих зависимостей определяли абсолютные константы скорости взаимодействия БФО со спиртами k5 (табл.).
Таблица. Абсолютные константы скорости реакции Ph2COO c ROH (293 К).
| R | [ROH], моль/л | k5, л/моль·с | pK [3] | IP | |
| CH3CN | C6H6 | ||||
| H2O | 1.10-2. 7.10-1 | (4.7 | – | 15.7 | 12.17 |
| MeOH | 1.10-2. 7.10-1 | (1.0 | (1.3 | 16 | 10.82 |
| i-PrOH | 5.10-3.1 | (1.2 | (5.3 | 18 | 10.10 |
| EtOH | 1.10-2. 1 | (1.8 | (1.0 | 18 | 10.41 |
|
| 6.10-3. 4.10-1 | (2.9 | (2.0 | 19 | |
| i-BuOH | 1.10-2. 1 | (1.8 | (1.4 | 10.02 | |
| н-BuOH | 1.10-2. 5.10-1 | (2.2 | (1.0 | 9.99 | |
| i-C5H11OH | 5.10-3. 3.10-1 | (2.3 | (7 | 9.78 | |
| ц-C6H13OH | 5.10-3. 4.10-2 | (4.8 | (3 | 9.75 | |
|
| 4.10-3. 5.10-2 | (7 | (2.5 | 9.09 | |
| Ph3COH | 1.10-2. 3.10-1 | (4 | – | 19 | |
| PhCH2OH | 2.10-4.1.10-2 | – | (2.4 | 18 | 8.26 |
Как видно из таблицы, константа скорости БФО со спиртами в бензоле в среднем на порядок выше, чем в ацетонитриле для всех ROH. Аналогичное влияние растворителей на константу скорости рекомбинации БФО описано в работе [2]. Это связано с экстра-поляризацией карбонилоксида в полярном ацетонитриле, что приводит к усилению степени сольватации БФО и понижению его реакционной способности.
Для объяснения влияния природы спирта на кинетику реакции с БФО были исследованы зависимости логарифма константы скорости реакции k5 от кислотности спирта (pK), а также от потенциала ионизации ROH (IP).
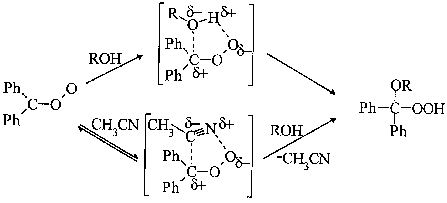
С ростом кислотности спиртов по шкале Мак-Ивена (падение pK) наблюдается уменьшение константы скорости взаимодействия БФО со спиртом в среде ацетонитрила, а в бензоле удовлетворительная корреляция отсутствует. С ростом потенциала ионизации спирта IP константа скорости реакции уменьшается как в ацетонитриле, так и в бензоле. Эти результаты свидетельствуют об электрофильной атаке карбонилоксидом молекулы спирта и согласуются с литературными данными об электронной природе исследуемой реакции, полученными методом хемилюминесценции [4]. Можно предположить, что реакция протекает по механизму внедрения карбонилоксида по связи O-H спирта, причем в лимитирующей стадии реакции осуществляется образование химической связи между атомом углерода БФО и атомом кислорода гидроксильной группы. Замедление реакции в среде CH3CN, по-видимому, связано с образованием прочного комплекса между БФО и молекулой растворителя, что понижает реакционную способность карбонилоксида в исследуемой реакции. Предполагаемый механизм реакции представлен на схеме.
С другой стороны, известно [5], что диметилкарбонилоксид реагирует со спиртами как нуклеофил, что, по-видимому, связано с преимущественно бирадикальной природой данного карбонилоксида. Несомненно, электронная природа карбонилоксидов заслуживает дальнейшего внимательного изучения.
Схема
Список литературы
Назаров А.М., Чайникова Е.М., Хурсан С.Л. и др. // Изв. РАН. Сер. хим. 1998. № 7. С. 1329-1332.
Nazarov A.M., Chainikova E.M., Khursan S.L. et al. // React. Kinet. Catal. Lett. 1998. V. 65. № 2. P. 311-314.
McEwen W.K. // J. Am. Chem. Soc. 1936. V. 58. P. 1124.
Назаров А.М. Дисс. … докт. хим. наук. Уфа: ИОХ УНЦ РАН, 2000.
Yamamoto Y., Niki E., Kamiya Y. // Bull. Chem. Soc. Jpn. 1982. № 55. P. 2677-2
0 комментариев