Самарская государственная экономическая академия
Реферат (отработка семинара №7).
Первое начало термодинамики.
Выполнил: студент СГЭА факультета
систем управления группы М.О.-1
1 курса Манагаров Р.И.
Проверил: Мирошников Юрий Фёдорович
Самара 2002
Закон представляет формулировку принципа сохранения энергии для термодинамических
систем. Он формулируется следующим образом:
При переходе системы из состояния A в состояние B сумма работы и теплоты, полученных системой от окружающей среды, определяется только состояниями A и B; эта сумма не зависит от того, каким способом осуществляется переход из A в B.
Это означает, что существует такая величина E, характеризующая внутреннее состояние системы, что разность ее значений в состояниях A и B определяется соотношением
| EB–EA = Q–L , | (1) |
где (–L) – работа, совершенная средой над системой, а Q – количество тепла, полученное системой от окружающей среды (количество энергии, передаваемое системе термическим образом, т.е. в форме, отличной от работы).
Величина E называется внутренней энергией системы.
Для бесконечно малого изменения состояния
| dE = δ Q–δ L , | (2) |
или, используя выражение для δ L,
| dE = δ Q–PdV . | (3) |
Таким образом, изменение внутренней энергии системы равно сумме полученного тепла и совершенной над системой работы. (1)
Пример: Рассмотрим систему, состоящую из определенного количества воды в сосуде. Энергию системы можно увеличить двумя путями. Первый: можно нагревать сосуд на огне. При этом объем воды почти не увеличивается, т.е. dV = 0 и, следовательно, работа не производится. Второй путь: опустим в воду установку с вращающимися лопастями и путем трения увеличим температуру воды до того же значения, что и в первом случае. Конечные состояния системы и приращения ее энергии в обоих случаях одни и те же, но во втором случае увеличение энергии обусловлено работой.
Эквивалентность теплоты и механической работы становится особенно ясной, если рассмотреть циклический процесс. Так как начальное и конечное состояния цикла одинаковы, то изменение энергии равно нулю (EA = EB) и, следовательно,
| L = Q , | (4) |
т.е. работа, совершенная системой во время цикла, равна количеству теплоты, поглощенному системой. (4)
Теплота измеряется в единицах энергии – эргах, джоулях и калориях. Соотношение между джоулем и калорией имеет вид
| 1 кал = 4.18 Дж . | (5) |
Это – механический эквивалент теплоты.
Величины Q и L не являются функциями состояния системы; они зависят от способа перехода из состояния А в В. Соответственно этому δ Q и δ L не являются полными дифференциалами. Это обстоятельство и отмечается использованием символа δ, а не d. (1)
Применим первый закон к системам типа однородной жидкости, состояния которых определяются двумя из трех переменных P, V и T. В этом случае любая функция состояния системы и, в частности, внутренняя энергия E будет функцией двух переменных, выбранных в качестве независимых.
Чтобы избежать неправильного толкования того, какая переменная является независимой при вычислении частной производной, будем заключать символ частной производной в скобки и помещать внизу скобок ту величину, которая при частном дифференцировании остается постоянной. Таким образом,
| (∂ E/∂ T)V |
означает частную производную E по T при постоянном V; причем T и V взяты в качестве независимых переменных. Эта производная отличается от частной производной (∂ E/∂ T)P , при взятии которой остается постоянным давление P. (3)
Рассмотрим теперь бесконечно малый процесс, т.е. процесс, при котором независимые переменные изменяются на бесконечно малые величины. Для такого процесса 1-й закон термодинамики можно переписать в виде
| δ Q = dE+P dV | (6) |
Если в качестве независимых взять переменные T и V, то E = E(T, V) и, следовательно,
|
|
Соотношение принимает тогда вид:
|
| (7) |
Если считать независимыми переменными T и P, то
|
|
и принимает вид
|
| (8) |
Теплоемкость тела определяется как отношение бесконечно малого количества поглощенной теплоты к бесконечно малому изменению температуры, вызванному этой теплотой.
Очевидно, что величина теплоемкости зависит от того, нагревается ли тело при постоянном объеме или при постоянном давлении. Обозначим символами cV и cP теплоемкости при постоянном объеме и при постоянном давлении соответственно. Поскольку при V = const, dV = 0, то
|
| (9) |
Подобным же образом из (8) получается выражение для cP:
|
| (10) |
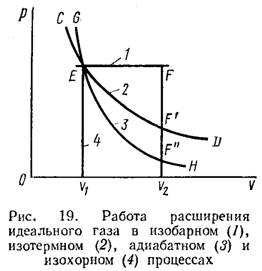
Второй член в формуле для cP связан со слагаемым PdV, т.е. описывает эффеккт, оказываемый на теплоемкость работой, которую система совершает во время расширения. В (9) подобного члена нет, поскольку объем остается постоянным и работа не совершается. (1)
Во многих случаях удобно пользоваться понятием молярной теплоемкости. Молярной теплоемкостью называется теплоемкость одного моля вещества. Молярные теплоемкости при постоянном V и при постоянном P определяются формулами (9) и (10), если вместо произвольного количества вещества взять 1 моль:
|
| (11) |
знак ![]() сверху означает, что взят 1 моль вещества. (2)
сверху означает, что взят 1 моль вещества. (2)
В случае газа можно конкретизировать зависимость внутренней энергии E от переменных T и V, определяющих его состояние. В дальнейшем мы докажем, что энергия идеального газа определяется температурой T и не зависит от объема V: E = E(T). Для реальных газов это утверждение выполняется приближенно. Для определения зависимости E(T) воспользуемся результатами опыта, согласно которым теплоемкость газов очень слабо зависит от температуры. Можно предположить, что для идеального газа она строго постоянна. Тогда интегрирование уравнения
|
| (12) |
при условии CV = const дает:
|
| (13) |
где E0– константа, представляющая энергию газа при абсолютном нуле.
Внутренняя энергия N молей газа
| E = N(CVT+E0) . | (14) |
Для идеального газа 1-й закон термодинамики принимает вид
|
| (15) |
Из этого уравнения легко получить соотношение между молярными теплоемкостями CV и CP. Для этого перейдем от переменных T и V к переменным T и P. Это можно сделать, если взять дифференциалы от обеих частей уравнения состояния для 1 моля идеального газа
|
| (16) |
что дает
|
|
Выражая отсюда ![]() и подставляя в (15), получаем
и подставляя в (15), получаем
|
|
Отсюда можно легко найти CP. Поскольку при P = const дифференциал dP = 0 , то
|
| (17) |
т.е. разность между молярными теплоемкостями газа при постоянном давлении и при постоянном объеме равна газовой постоянной R . (1)
Литература:
1.Мякишев Г.Я., Буховцев Б.Б. Физика 10 кл.
2.Шахмаев Н.М. Физика 10 кл.
3.Свитков Л.П. Термодинамика и молекулярная физика 1970г.
4.Билимович Б.Ф. Тепловые явления в технике1981г.
Похожие работы
... газов в результате реакции. Величина Δn может иметь положительное и отрицательное значения, в зависимости от того, увеличивается или уменьшается число молей газов во время процесса. Применение первого начала термодинамики к процессам в любых системах. Закон Гесса Примем, что единственным видом работы, которая совершается системой, является работа расширения. Подставляя уравнение (II, 5) в ...
... F(P, V, T) = 0. (1.4) Параметры состояния ТС должны быть одинаковыми по всему её объёму. В таком случае её состояние вполне определяется заданием двух параметров, а третий является их функцией: P = F1(V, T); V = F2(P, T); T = F3(P, V). (1.5) Уравнение состояния идеального газа: для единичной массы ТС: Pv = RT; (1.6) для массы ТС: PV = MRT. (1.7) Уравнение состояния для реальной ТС: ...
... эффекта термодинамического процесса (2.5). Запишем: . (2.16) Выражение (2.16) и подобные ему, некоторые авторы называют обобщенной формулировкой I и II начала термодинамики. Преобразуем дифференциал , и подставим его в (2.5): . Из последнего равенства следует: , , . (2.17) Учитывая, что ...
... , или термодинамическое равновесие, при котором движение частиц хаотично. Максимальная энтропия означает полное термодинамическое равновесие, что эквивалентно хаосу. Часто второе начало термодинамики преподносится как объединенный принцип существования и возрастания энтропии. Принцип существования энтропии формулируется как математическое выражение энтропии термодинамических систем в условиях ...
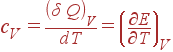
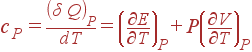
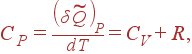
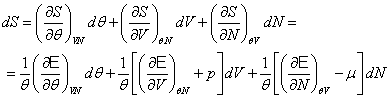
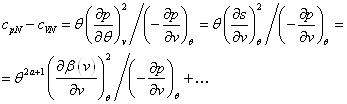
0 комментариев