Доктор медицинских наук В. И. Кулинский
ВведениеНейротрансмиттеры (НТ) — это химические передатчики сигналов между нейронами и от нейронов на эффекторные (исполнительные) клетки. Именно НТ создают возможность объединения отдельных нейронов в целостный головной мозг и позволяют ему успешно выполнять все его многообразные и жизненно необходимые функции.
Нейротрансмиттеры делят на нейромедиаторы — прямые передатчики нервного импульса, дающие пусковые эффекты (изменение активности нейрона, сокращение мышцы, секрецию железы), и нейромодуляторы — вещества, модифицирующие эффект нейромедиаторов. Соотношение концентраций и активности нейромедиаторов определяет функциональное состояние большинства постсинаптических клеток. Нейромодуляторы обычно действуют более локально — в определённых зонах мозга.
Общая характеристика нейротрансмиттеров|
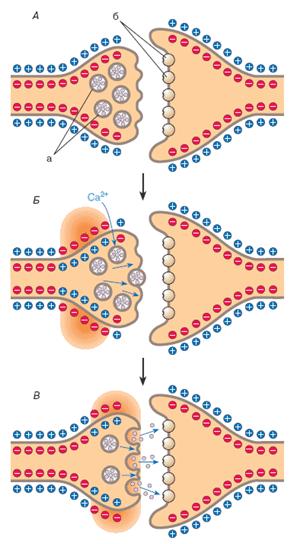
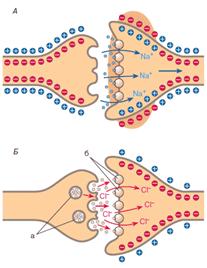
Рис. 1. Освобождение нейротрансмиттера (НТ) из везикул и его выход в синапс (по [7]): А — состояние покоя, а — везикулы нейротрансмиттера, б — его рецепторы; Б — приход в нервное окончание потенциала действия и вызванный им транспорт в нерв ионов Са 2+; В — освобождение НТ из везикул в синапс с последующим взаимодействием с рецепторами постсинаптической клетки. |
Большинство НТ синтезируются в нейронах. Затем они транспортируются в особые везикулы (пузырьки) в обмен на накопленные там ионы Н + (аккумуляция протонов в везикулах осуществляется особой Н +–АТФазой за счёт энергии АТФ). Эти везикулы расположены в нервном окончании (рис. 1, А), НТ хранятся в них в очень высоких концентрациях (до 100–500 мМ). Когда распространяющийся по нерву потенциал действия приходит в зону везикул, он открывает потенциалзависимые Са 2+-каналы, ионы Са 2+ входят в нервные клетки (Б), что приводит к выбросу из них НТ в синапс (В). Синапс — это щель шириной 10–50 нм между двумя нейронами или нейроном и другой клеткой. Встречаются, но гораздо реже (не у млекопитающих) электрические синапсы шириной всего 2 нм. В головном и спинном мозге нейроны образуют синапсы с большим количеством других нейронов, а в периферической нервной системе — с эффекторными клетками. Первая клетка (это всегда нейрон) называется пресинаптической, вторая — постсинаптической. Очевидно, что нейромедиатор образуется и выделяется в синапс пресинаптическим нейроном; нейромодулятор, вероятно, может образовываться и глией — другим типом клеток нервной системы, выполняющим защитные, поддерживающие и трофические функции; глия может также участвовать в инактивировании НТ. Различают возбуждающие и ингибирующие, или тормозящие, НТ (табл. 1), эффекты первых преобладают в состоянии бодрствования животных и высокой функциональной активности мозга, вторых — в покое и особенно во время спокойного сна без сновидений. По химической структуре НТ можно разделить на пять классов: 1) аминокислоты, 2) амины и их производные, 3) нейропептиды, 4) нуклеозиды и нуклеотиды, 5) стероиды. Последние два класса пока представлены единичными веществами.
Все НТ диффундируют через синапс и на наружной стороне плазматической мембраны постсинаптической клетки связываются со своими специфическими рецепторами. Образование НТ-рецепторного комплекса изменяет функциональное состояние клетки. Следовательно, эффект НТ не требует его проникновения через мембрану — внутрь клетки поступает не сам НТ, а сигнал, возникающий при связывании НТ с рецептором. Восприятие, преобразование, усиление и передачу сигнала внутрь клетки и затем внутрь её органелл осуществляют сигнал-трансдукторные системы (СТС). Рецепторами нейромедиаторов являются регуляторные субъединицы быстрых ионных (Na +- или Сl – ) каналов — это ионотропные рецепторы. Эффекты нейромодуляторов реализуются намного более сложными СТС, включающими рецепторы, ГТФ-зависимые G-белки, мембранные ферменты, Са 2+- или К +-каналы, вторые посредники и их белковые рецепторы (чаще всего протеинкиназы) — это метаботропные рецепторы. Разные механизмы реализации сигналов определяют временные различия: нейромедиаторы действуют за время нервного импульса — миллисекунды (быстрые ответы клеток), модуляторы — за секунды или минуты, такие эффекты называют медленными. Действие НТ в синапсе чаще всего прекращается его быстрой инактивацией путём Na +-зависимого обратного захвата пресинаптическим нейроном или глией (аминокислоты, моноамины) с последующим входом в пресинаптические везикулы в обмен на накопленные там ионы Н +. Известна также инактивация путём ферментного метаболизма прямо в синапсе (ацетилхолин разрушается ацетилхолинэстеразой постсинаптической мембраны) или диффузии за пределы синапса (катехоламины).
| Таблица 1. Структура низкомолекулярных нейтротрансмиттеров | ||
| Характер действия | Основная функция | |
| возбуждение | ингибирование | |
| Нейромедиаторы |
|
|
| Нейромодуляторы |
|
|
Главные медиаторы головного мозга — аминокислоты. К возбуждающим относятся глутамат и аспартат. При освобождении в синапс (см. рис. 1, В) они через ионотропные рецепторы (регуляторные субъединицы каналов) открывают быстрые натриевые каналы (рис. 2, А). Это приводит к быстрому входу в постсинаптический нейрон ионов Na + (в межклеточной жидкости концентрация Na + намного больше, чем внутри клетки).
|
Рис. 2. Последствия взаимодействия нейромедиатора с рецепторами постсинаптической клетки (по [7]): А — открытие возбуждающим медиатором Na +-каналов постсинаптического нейрона с его деполяризацией и генерацией в нём потенциала действия; Б — открытие ингибируюшим медиатором Сl – -каналов постсинаптического нейрона с его гиперполяризацией, а — везикулы ГАМК или глицина, б — рецепторы. |
Это деполяризует плазматическую мембрану (изменяет отрицательный заряд на её внутренней поверхности на положительный) и в результате вызывает возбуждение нейрона. Возбуждающие аминокислоты необходимы для всех основных функций головного мозга, включая поддерживание его тонуса, бодрствования, психологической и физической активности, регуляцию поведения, обучение, память, восприятие чувствительных и болевых импульсов. Но всё хорошо в меру. Существуют тяжёлые болезни, вызванные слишком большим освобождением глутамата в синапс. Это характерно для эпилепсии. Избыток глутамата в синапсе приводит к перевозбуждению мозга вплоть до развития тяжёлого судорожного приступа. При ишемии (нарушении кровоснабжения) головного мозга в синапс выделяется так много глутамата, что он вызывает чрезмерное накопление ионов Са 2+ в постсинаптическом нейроне и его повреждение (нейротоксическое действие) — возникает инсульт („удар“). Человек может стать инвалидом из-за ухудшения интеллекта, нарушения речи или плохой работы конечностей.
Ещё один возбуждающий медиатор — ацетилхолин, активирующий ионотропные N-холинорецепторы с открытием тех же быстрых натриевых каналов. Через эти рецепторы ацетилхолин участвует в функциях базальных (подкорковых) ганглиев головного мозга, связанных с регуляцией двигательной активности и мышечного тонуса. Кроме того, в периферической нервной системе ацетилхолин через N-холинорецепторы стимулирует вегетативные ганглии и вызывает сокращение скелетных мышц.
Главный ингибирующий нейромедиатор головного мозга — гамма-аминомасляная кислота (ГАМК). Очень интересно, что она образуется из главного возбуждающего медиатора глутамата путём его декарбоксилирования. Связывание ГАМК с ионотропными ГАМКА-рецепторами (субъединицами хлоридных каналов) приводит к их открытию и быстрому входу в постсинаптический нейрон ионов Cl – (рис. 2, Б). Эти ионы вызывают гиперполяризацию (увеличение отрицательного заряда на внутренней стороне плазматической мембраны) и в результате — торможение функций нейрона. Оно столь же необходимо для всех функций головного мозга, как и возбуждение. По сути самое главное для мозга — это не концентрация и действие одного медиатора, а баланс возбуждающих и тормозящих регуляторов.
Есть лекарства, активирующие ГАМКА-рецепторы: барбитураты (фенобарбитал) и бензодиазепины (диазепам), они обладают успокаивающим (транквилизаторы), снотворным и даже наркотическим действием. Любые нарушения баланса нейромедиаторов могут помешать нормальной работе мозга — вспомним вредное действие избытка глутамата при эпилепсии и инсульте. Большинство противоэпилептических лекарств так или иначе стимулирует ГАМКергическую систему, что восстанавливает баланс возбуждающих и тормозящих медиаторов. При попадании в рану возбудителя столбняка он образует токсин, который выключает систему ГАМК. Она не может работать — и тогда активирующие аминокислоты, не встречая противодействия, вызывают перевозбуждение, что приводит к появлению судорог и смерти.
Аминокислота глицин — основной ингибирующий нейромедиатор спинного мозга. Он действует по аналогичному механизму, а антагонистом его рецепторов является стрихнин. Отравление последним прекращает действие глицина, эффекты возбуждающих медиаторов становятся преобладающими, что приводит к судорогам.
НейромодуляторыПрежде всего к ним относятся все рассмотренные нами нейромедиаторы, но их модулирующие эффекты реализуются не через ионо-, а через метаботропные рецепторы. Ацетилхолин через М-холинорецепторы включает три разные СТС, что снижает уровень цАМФ (циклического аденозинмонофосфата), открывает К +-каналы и вызывает накопление липидных вторых посредников и затем ионов Са 2+. Через М-рецепторы (их в мозге больше, чем N-рецепторов) ацетилхолин стимулирует образование условных рефлексов и память. Неудивительно, что при болезни Альцгеймера (основной формы старческого слабоумия) ранняя гибель холинергических нейронов сочетается с ухудшением памяти. Через эти же рецепторы ацетилхолин реализует активность мотонейронов спинного мозга и регуляцию внутренних органов парасимпатическими нервами.
ГАМК и её синтетические агонисты через оба типа своих рецепторов (ГАМКА и ГАМКВ) вызывают один и тот же основной эффект — снижают активность головного мозга. В случае метаботропных ГАМКВ-рецепторов это опосредовано тремя разными G-белокзависимыми СТС: происходит снижение концентрации ионов Са 2+ (а также цАМФ), что ингибирует освобождение многих НТ; открытие К +-каналов с выходом ионов К + из нейрона (концентрация К + в клетке намного больше, чем в межклеточной жидкости) приводит к гиперполяризации нейрона и его торможению.
Существует большое количество специализированных нейромодуляторов. В головном мозге из прогестерона (стероидного гормона жёлтого тела яичников и плаценты) образуются активирующие мозг модуляторы — нейростероиды. В отличие от большинства стероидных гормонов они действуют не путём проникновения в ядро клетки и соединения с ядерными рецепторами, а в результате активации ГАМКА-рецепторов нейронов. Снижение нейростероидов за две недели до месячных вызывает предменструальный синдром с характерной для него раздражительностью, а большой избыток при беременности прогестерона может способствовать уменьшению возбудимости головного мозга.
Описанные выше три типа СТС опосредуют действие и некоторых других ингибиторных модуляторов, в том числе пока единственного нуклеозидного НТ — аденозина. Через свои А1-рецепторы он снижает концентрацию ионов Са 2+ в нейронах, что ингибирует освобождение многих НТ, снижает тонус головного мозга, способствует утренней вялости, нежеланию вставать и работать. Когда мы пьём кофе или чай, содержащийся в них кофеин блокирует рецепторы аденозина и в результате мешает его тормозному действию. Человек взбадривается, чувствует прилив сил и энергии.
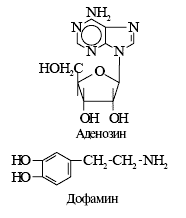
Очень важный класс нейромодуляторов — моноамины: катехоламины (КА) и индолилалкиламины. КА синтезируются из аминокислоты тирозина, активность ключевого фермента синтеза тирозингидроксилазы увеличивается системой цАМФ — протеинкиназа А. КА обеспечивают функционирование симпатико-адреналовой системы. Дофамин освобождается в основном в синапсах базальных ядер головного мозга, норадреналин — в стволе мозга и окончаниях симпатических нервов, адреналин секретируется мозговым веществом надпочечников. Дофамин — тормозной модулятор, снижающий эффекты возбуждающего медиатора ацетилхолина. У пожилых людей нередко возникает паркинсонизм — гибель нейронов, синтезирующих дофамин. Это приводит к тому, что ацетилхолин проявляет избыточную активность. Возникает скованная походка, дрожание пальцев, лицо становится маскообразным, не выражающим эмоций. Разработаны лекарства, позволяющие лечить эту болезнь путём увеличения синтеза дофамина или введения проникающих в головной мозг агонистов его рецепторов. Однако эффекты дофамина намного сложнее. Он способствует как повышенному настроению и эмоциональному удовлетворению, так и нестандартной активности головного мозга (в том числе, вероятно, и творческой). И снова заметим, что всё хорошо в меру. Многие наркотические вещества ингибируют обратный захват нейронами дофамина, что приводит к его избыточному накоплению в синапсе. В патогенезе одной из двух основных форм главного психического заболевания — шизофрении важное значение придают увеличенному действию дофамина. Во всяком случае большинство эффективных при шизофрении лекарств (нейролептики) блокируют рецепторы дофамина. Нобелевская премия по физиологии и медицине 2000 года присуждена за исследования по дофамину.
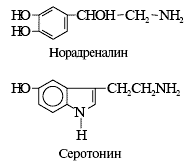
Второй КА — норадреналин вызывает накопление в клетке ионов Са 2+ (через α1-адренорецепторы) и цАМФ (через β-адренорецепторы). Активируется ретикулярная формация ствола, что тонизирует головной мозг, включая кору больших полушарий. Это стимулирует память, целесообразное поведение, эмоции и мышление. Введение веществ, которые уменьшают накопление КА в нервных клетках (резерпин), резко снижает активность мозга. Подобные лекарства вводят буйным психическим больным, а также при отлове зверей (выстрел ампулой с таким веществом). КА тесно связаны с отрицательными эмоциями. Норадреналин выделяется из симпатических нервных окончаний в синапс и затем в кровь при гневе, ярости, психологической мобилизации; он снижает депрессию (подавленность, тоску, мрачную настроенность). Третий КА — адреналин освобождается из мозгового вещества надпочечников при страхе и депрессии. Люди с преимущественным освобождением норадреналина успешно работают лётчиками, разведчиками, монтажниками-высотниками, хирургами. У людей с преобладанием адреналиновой реакции при малейшей трудности всё валится из рук, выводит из равновесия. Им легче трудиться в спокойной обстановке — канцелярскими работниками, философами, терапевтами.
КА особенно важны при стрессе: они активируют процессы распада и выработки энергии, вызывают освобождение других гормонов стресса, особенно глюкокортикостероидов, стимулируют основные физиологические системы и в результате увеличивают устойчивость организма.
Однако те же КА через α2-адренорецепторы снижают концентрации ионов Са 2+ и цАМФ, что приводит к уменьшению выделения норадреналина и других НТ. Эта отрицательная обратная связь предупреждает перевозбуждение, снижает тонус головного мозга. В отличие от ситуации с ГАМК один и тот же НТ — норадреналин через разные СТС может давать противоположные эффекты. Конечный результат зависит от преобладания в данном отделе мозга той или иной СТС и/или её фунциональной активности.
ГАМК, аденозин и селективные агонисты α2-адренорецепторов реализуют, в том числе и у млекопитающих, другую приспособительную стратегию — толерантную. Для неё характерно снижение потребления О2, температуры тела и катаболизма с уменьшением активности головного мозга и других физиологических систем. В результате значительно увеличивается устойчивость организма ко многим экстремальным факторам [2]. Обе стратегии связаны не только с НТ, но и с дистантными и местными гормонами.
Индолилалкиламины образуются из аминокислоты триптофана: серотонин — в стволе головного мозга и энтерохромаффинных клетках кишечника, мелатонин — в эпифизе (шишковидной железе). Серотонин снижает агрессивность, страх, депрессию, стимулирует пищевое поведение, сон и впадение в зимнюю спячку, увеличивает пищевые и снижает болевые условные рефлексы, способствует обучению и лидерству. Мелатонин преимущественно освобождается ночью и способствует сну (теперь его применяют как снотворное), тормозит выделение гонадотропных гормонов. Оба индолилалкиламина снижают половую активность.
Обмен моноаминов нарушен при депрессиях, которые распространяются всё шире. Они мучительны и могут привести к самоубийству. Депрессии особенно часто поражают творческих людей. Блокаторы обратного захвата моноаминов нейронами и ингибиторы моноаминоксидазы, метаболизирующей катехоламины и серотонин, снижают инактивирование моноаминов, их уровни в синапсах возрастают. Это даёт чёткий лечебный эффект — снижает депрессию. Очень важные и многообразные функции выполняет ещё одна большая группа НТ — нейропептиды.
ЗаключениеНейротрансмиттеры — химические передатчики сигналов нейронов — разделяются на нейромедиаторы и нейромодуляторы. Первые прямо передают нервные импульсы, вторые модифицируют действие медиаторов. НТ выделяются в синапс, взаимодействуют со своими специфическими рецепторами и через СТС меняют функции постсинаптической клетки. Главные медиаторы головного мозга — возбуждающие (глутамат, аспартат) и ингибирующие (ГАМК, глицин) аминокислоты, соотношение их концентраций и активности в основном определяет функциональное состояние большинства нейронов. Нейромодуляторы обычно действуют более локально — в определённых зонах мозга и создают дополнительные вариации, обогащающие спектр физиологического состояния нейронов. Эти функции выполняют как те же нейромедиаторы (но через другие рецепторы и СТС), так и специализированные нейромодуляторы (аденозин, катехоламины, индолилалкиламины, нейростероиды). В целом множественность НТ и многообразие их действия, включая как совпадение, так и противоположность эффектов, обеспечивают функционирование самого сложного органа нашего организма — центральной нервной системы, объединение отдельных нейронов в целостный головной мозг и успешное выполнение всех его разнообразных и жизненно необходимых функций.
Список литературы1. Кулинский В.И. Передача и трансдукция гормонального сигнала в разные части клетки // Соросовский Образовательный Журнал. 1997. № 8. С. 14–19.
2. Кулинский В.И. Две стратегии выживания организма // Энциклопедия „Современное естествознание“: В 10 т. М.: Наука; Флинта, 1999. Т. 2: Общая биология. С. 252–254.
3. Нейрохимия / Под ред. И.П. Ашмарина, П.В. Стукалова. М.: НИИ биомедхимии РАМН, 1996. 469 с.
4. Раевский К.С., Георгиев В.П. Медиаторные аминокислоты: Нейрофармакологические и нейрохимические аспекты. М.: Медицина, 1986. 239 с.
5. Сергеев П.В., Шимановский Н.Л., Петров В.И. Рецепторы физиологически активных веществ. 2-е изд. М.; Волгоград, 1999. 639 с.
6. Ткачук В.А. Молекулярные механизмы нейроэндокринной регуляции // Соросовский Образовательный Журнал. 1998. № 6. С. 16–20.
7. Garrett R.H., Grisham Ch.M. Molecular Aspects of Cell Biology. Fort Worth. Philadelphia etc.: Saunders Coll.Publ., 1995. P. 1180–1
Похожие работы
... эффект ?-сон индуцирующего пептида при гипокинетическом стрессе // Укр.биохим.-1991.-63.-№1.-С.34-37. 118.Механизмы развития стресса // Сб.статей.- Кишинев: Штиинца.- 1987.-222с. 119.Митюшина Н.В. Влияние энкефалинов на активность ферментов обмена регуляторных пептидов в головном мозге и периферических тканях крыс // дис. на соиск. степени.канд.биол.наук.- Пенза.-1999 120.Наркевич В.Б. ...
... 4,8±0,6 Аспарагиновая кислота + аспарагин 4,8–5,8 0,4–0,7 6,0±1,5 6,3±0,8 ГАМ К 1,9–2,4 Следы 3,1 + 1,1 4,1±0,4 Из других путей метаболизма аминокислот, которые играют относительно небольшую роль в энергетическом метаболизме головного мозга, можно упомянуть превращение аспартата и аспарагина в оксалоацетат, а также аланина и серина – в пируват. Очень невелико и значение аминокислот как ...
... установленным, что многие случаи психических расстройств, асоциального поведения, снижения интеллектуальных способностей обусловлены дефектами развития головного мозга до рождения. НЕКОТОРЫЕ КРИТЕРИИ РАЗВИТИЯ ГОЛОВНОГО МОЗГА. Оценка состояния головного мозга прижизненно может осуществляться при помощи наборов различных тестов, характеризующих интеллект, особенности психики, способность к ...
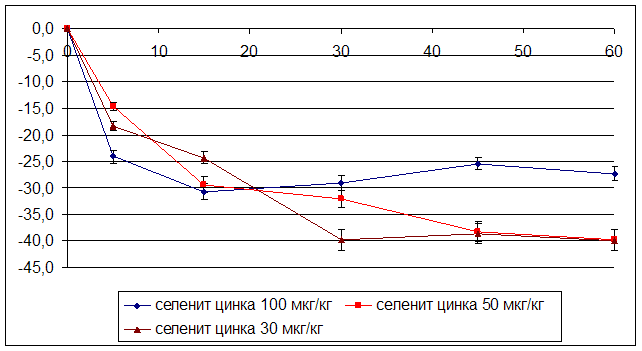
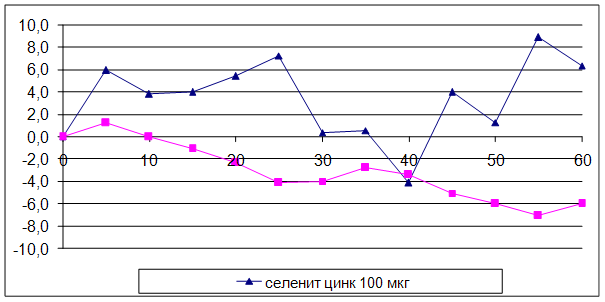
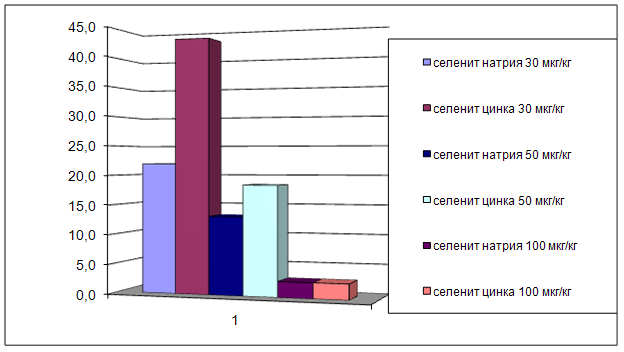
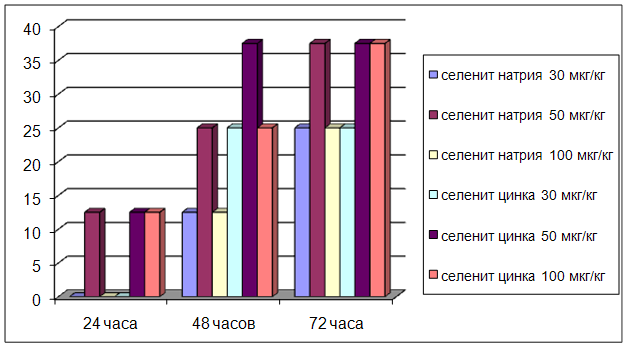
... на мозговой кровоток, динамику развития постишемических феноменов и психоневрологический статус остаётся неизученным. Указанные обстоятельства и послужили основанием для сравнительного изучения влияния селенита натрия и селенита цинка на системную гемодинамику и мозговой кровоток в условиях нормы и при патологических состояниях. ГЛАВА 2 МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ 2.1 Изучение острой ...
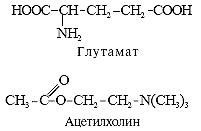
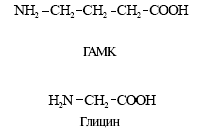
0 комментариев