Литий (лат. Lithium), Li, химический элемент с атомным номером 3, атомная масса 6,941. Химический символ Li читается так же, как и название самого элемента.
Литий встречается в природе в виде двух стабильных нуклидов 6Li (7,52% по массе) и 7Li (92,48%). В периодической системе Д. И. Менделеева литий расположен во втором периоде, группе IA и принадлежит к числу щелочных металлов. Конфигурация электронной оболочки нейтрального атома лития 1s22s1. В соединениях литий всегда проявляет степень окисления +1.
Металлический радиус атома лития 0,152 нм, радиус иона Li+ 0,078 нм. Энергии последовательной ионизации атома лития 5,39 и 75,6 эВ. Электроотрицательность по Полингу 0,98, самая большая у щелочных металлов.
В виде простого вещества литий — мягкий, пластичный, легкий, серебристый металл.
Физические и химические свойства: из металлов литий самый легкий, его плотность 0,534 г/см3. Температура плавления 180,5°C, температура кипения 1326°C. При температурах от –193°C до температуры плавления устойчива кубическая объемно центрированная модификация лития с параметром элементарной ячейки а = 0,350 нм.
Из-за небольшого радиуса и маленького ионного заряда литий по своим свойствам больше всего напоминает не другие щелочные металлы, а элемент группы IIA магний (Mg). Литий химически очень активен. Он способен взаимодействовать с кислородом (O) и азотом (N) воздуха при обычных условиях, поэтому на воздухе он быстро окисляется с образованием темного налета продуктов взаимодействия:
4Li + O2 = 2Li2O,
6Li + N2 = 2Li3N
При контактах с галогенами литий самовоспламеняется при обычных условиях. Подобно магнию (Mg), нагретый литий способен гореть в CO2:
4Li + CO2 = C + 2Li2O
Стандартный электродный потенциал Li/Li+ имеет наибольшее отрицательное значение (E°298 = –3,05 B) по сравнению со стандартными электродными потенциалами других металлов. Это обусловлено большой энергией гидратации маленького иона Li+, что значительно смещает равновесие в сторону ионизации металла:
Li-твердый <> Li+раствор + e–
Для слабо сольватирующих растворителей значение электродного потенциала лития соответствует его меньшей химической активности в ряду щелочных металлов.
Соединения лития — соли — как правило, бесцветные кристаллические вещества. По химическому поведению соли лития несколько напоминают аналогичные соединения магния (Mg) или кальция (Ca). Плохо растворимы в воде фторид LiF, карбонат Li2CO3, фосфат Li2PO4, хорошо растворим хлорат лития LiClO3 — это, пожалуй, одно из самых хорошо растворимых соединения в неорганической химии (при 18°C в 100 г воды растворяется 313,5 г LiClO3).
Оксид лития Li2O — белое твердое вещество — представляет собой типичный щелочной оксид. Li2O активно реагирует с водой с образованием гидроксида лития LiOH.
Этот гидроксид получают электролизом водных растворов LiCl:
2LiCl + 2H2O = 2LiOH + Cl2 + H2
LiOH — сильное основание, но оно отличается по свойствам от гидроксидов других щелочных металлов. Гидроксид лития уступает им в растворимости. При прокаливании гидроксид лития теряет воду:
2LiOH = Li2O + H2O
Большое значение в синтезе органических и неорганических соединений имеет гидрид лития LiH, который образуется при взаимодействии расплавленного лития с водородом (H):
2Li + H2 = 2LiH
LiH — ионное соединение, строение кристаллической решетки которого похоже на строение кристаллической решетки хлорида натрия NaCl. Гидрид лития можно использовать в качестве источника водорода для наполнения аэростатов и спасательного снаряжения (надувных лодок и т.п.), так как при его гидролизе образуется большое количество водорода (1 кг LiH дает 2,8 м3 H2):
LiH + H2O = LiOH + H2
Он также находит применение при синтезе различных гидридов, например, борогидрида лития:
BCl3 + 4LiH = Li[BH4] + 3LiCl.
Литий образует соединения с частично ковалентной связью Li—C, т. е. литийорганические соединения. Например, при реакции иодбензола C6H5I с литием в органических растворителях протекает реакция:
C6H5I + 2Li = C6H5Li + LiI.
Литийорганические соединения широко используются в органическом синтезе и в качестве катализаторов.
История открытия: литий был открыт в 1817 году шведским химиком и минералогом А. Арфведсоном сначала в минерале петалите (Li,Na)[Si4AlO10]. Свое название получил из-за того, что был обнаружен в «камнях» (греч. Litos — камень). Характерное для соединений лития красное окрашивание пламени впервые наблюдал немецкий химик Х. Г. Гмелин в 1818 году. В этом же году английский химик Г. Дэви электролизом расплава гидроксида лития получил кусочек металла. Получить свободный металл в достаточных количествах удалось впервые только в 1855 году путем электролиза расплавленного хлорида:
2LiCl = 2Li + Cl2
Получение: в настоящее время для получения металлического лития его природные минералы или разлагают серной кислотой (кислотный способ), или спекают с CaO или CaCO3 (щелочной способ), или обрабатывают K2SO4 (солевой способ), а затем выщелачивают водой. В любом случае из полученного раствора выделяют плохо растворимый карбонат лития Li2CO3, который затем переводят в хлорид LiCl. Электролиз расплава хлорида лития проводят в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси). В дальнейшем полученный литий очищают методом вакуумной дистилляции.
Нахождение в природе: литий довольно широко распространен в земной коре, его содержание в ней составляет 6,5·10–3% по массе. Как уже упоминалось, основные минералы, содержащие литий, — это петалит (содержит 3,5-4,9 % Li2O), сподумен (6-7 % Li2O), лепидолит (4-6 % Li2O) и амблигонит LiAl[PO4] — 8-10 % Li2O. В виде примеси литий содержится в ряде породообразующих минералов, а также присутствует в рапе некоторых озер и в минерализованных водах. В морской воде содержится около 2·10–5 % лития.
Применение: из лития изготовляют аноды химических источников тока, работающих на основе неводных твердых электролитов. Жидкий литий может служить теплоносителем в ядерных реакторах. С использованием нуклида 6Li получают радиоактивный тритий:
63Li + 10n = 31H + 42He.
Литий и его соединения широко применяют в силикатной промышленности для изготовления специальных сортов стекла и покрытия фарфоровых изделий, в черной и цветной металлургии (для раскисления, повышения пластичности и прочности сплавов), для получения пластичных смазок. Соединения лития используются в текстильной промышленности (отбеливание тканей), пищевой (консервирование) и фармацевтической (изготовление косметики).
Биологическая роль: литий в незначительных количествах присутствует в живых организмах, но, по-видимому, не выполняет никаких биологических функций. Установлено его стимулирующее действие на некоторые процессы в растениях, способность повышать их устойчивость к заболеваниям.
В организме среднего человека (масса 70 кг) содержится около 0,7 мг лития. Токсическая доза 90-200 мг.
Особенности обращения с литием: как и другие щелочные металлы, металлический литий способен вызывать ожоги кожи и слизистых, особенно в присутствии влаги. Поэтому работать с ним можно только в защитной одежде и очках. Хранят литий в герметичной таре под слоем минерального масла. Отходы лития нельзя выбрасывать в мусор, для уничтожения их следует обработать этиловым спиртом:
2С2Н5ОН + 2Li = 2С2Н5ОLi + Н2
Образовавшийся этилат лития затем разлагают водой до спирта и гидроксида лития Li
Похожие работы
... древние предки наших народов, жившие 2500—3000 лет тому назад, располагали хорошо налаженными литейными ремеслами и выявили разностороннее мастерство в сложном деле литья удил. БРОНЗОВОЕ ЛИТЬЕ ДРЕВНЕЙ ГРУЗИИ Особенность истории металлургии некоторых закавказских народов заключается в строгом, последовательном чередовании основных эпох и этапов ее развития (использование самородной меди, ...
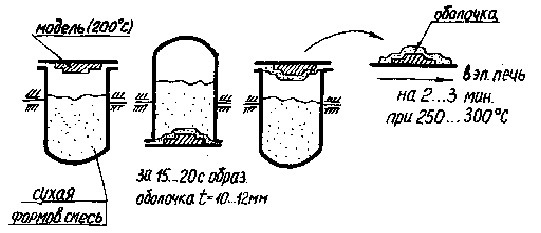
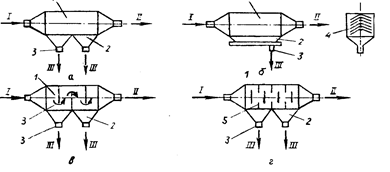
... обеспечивает невысокое качество поверхности (ниже Rz =320 мкм), низкую точность (ниже 16 квалитета), трудно автоматизируется и не обеспечивает удовлетворительные условия труда. Для получения более высоких качественных показателей применяют литье в формы из жидких самоотвердевавщих смесей (ЖСС). Этот способ литья применяют в любом виде производства. Формовочная смесь состоит из связки - жидкой ...
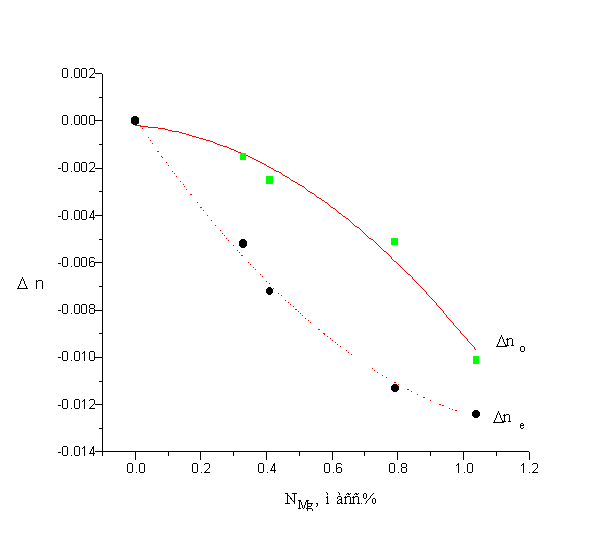
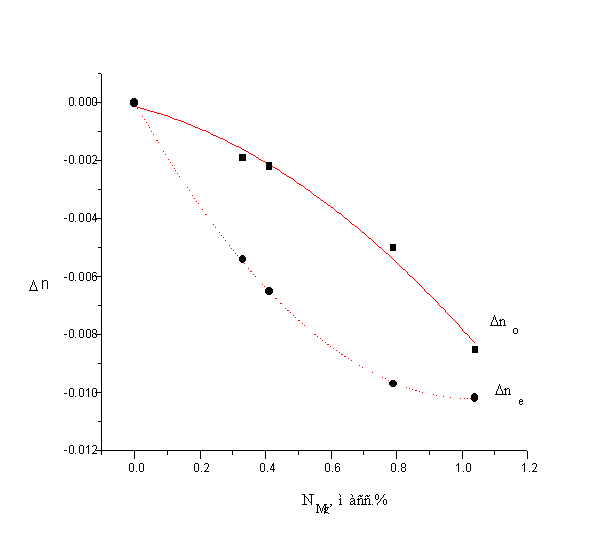
... частотно-угловом интервале. Глава 4. Исследование характеристик кристаллов методом активной спектроскопии. Четырехволновое рассеяние света возбуждалось в кристаллах ниобата лития, легированных магнием Mg:LiNbO3 c концентрацией примеси Мg 0.68масс.% и 0.79масс.% (кристаллы No.4,5). Данные по показателям преломления в видимой и ближней ИК области для кристалла No.4 были получены путем ...
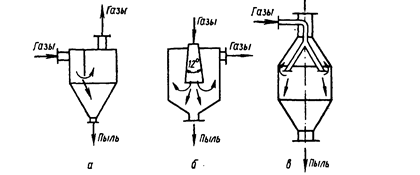
... концентрация пыли в выбросах цеха снизится и будет находится в пределах показателя ПДВ или будет превышать его незначительно. 6.3 Описание технологической схемы очистки выбросов цеха литья пластмасс В цехе литья пластмасс основными источниками загрязнения атмосферного воздуха являются термопластавтоматы в количестве 12 штук и сушильные шкафы, в которых ведется подготовка материала к ...

0 комментариев