Van der Waals (23.11.1837–8.03.1923)
Нидерландский физик Ян Дидерик Ван-дер-Ваальс, лауреат Нобелевской премии по физике за 1910 год за работы над уравнением состояния газов и жидкостей (уравнение Ван-дер-Ваальса). Это самая известная его достижение, хотя он вывел и более сложные уравнения состояния реальных газов и жидкостей, используя идею кластеров молекул в жидкости.
Подробная биографияЯн Дидерик Ван-дер-Ваальс родился в Лейдене (Нидерланды) 23 ноября 1837 года.
Его отец - плотник Якобус Ван-дер-Ваальс, мать - Элизабет Ван-дер-Ваальс (Элизабет Ван-ден-Бург).
Окончив начальную и среднюю школу в Лейдене, Ян стал учителем начальной школы.
С 1862 по 1865 годы он посещал Лейденский университет как вольнослушатель.
В 1864 году Ван-дер-Ваальс получил удостоверение учителя средней школы по математике и физике и стал преподавать физику сначала в Девентере (в 1864 году), а затем в Гааге, где в 1866 году стал директором школы.
Ван-дер-Ваальс женился на Анне Магдалене Смит в 1864 году. Она скончалась, когда три их дочери и сын были еще очень юными, и он никогда уже не женился.
В 1873 году он закончил аспирантскую работу по физике и получил степень доктора в Лейдене.
Его докторская диссертация была посвящена непрерывности газообразного и жидкого состояний и получила горячее одобрение со стороны Джеймса Клерка Максвелла, одного из величайших физиков XIX века, который сказал о работе Ван-дер-Ваальса, что она поставила его имя в один ряд с самыми выдающимися именами в науке. Эта диссертация была переведена на немецкий и французский языки и утвердила репутацию Ван-дер-Ваальс как блестящего физика. Она определила предмет его исследований до конца научной деятельности.
Через четыре года после получения докторской степени он стал первым профессором физики во вновь организованном Амстердамском университете, где и оставался вплоть до самого ухода в отставку в 1908 году, передав свое дело сыну.
Идеи Ван-дер-Ваальса возникли под влиянием написанной в 1857 году статьи немецкого физика Рудольфа Юлиуса Эмануэля Клаузиуса, который внес большой вклад в кинетическую теорию газов. По этой теории, молекулы газа быстро движутся в разных направлениях, их удары о стенки содержащего их сосуда определяют давление газа, а средняя скорость молекул (их кинетическая энергия) прямо связана с температурой. Клаузиус показал, как можно использовать эту теорию, чтобы вывести закон, найденный экспериментально в 1662 году (когда еще не было известно о молекулах) Робертом Бойлем, ирландским физиком и химиком. Закон Бойля утверждает, что для заданной массы газа при постоянной температуре произведение давления на объем постоянно. Если, например, объем уменьшается из-за того, что в цилиндр вдвигается поршень, то давление возрастает в такой степени, чтобы сохранялось постоянным данное произведение.
Позднее, в XIX веке, французские физики Жак Александр Сезар Шарль и Жозеф Луи Гей-Люссак, показали, что при постоянном давлении отношение объема к абсолютной температуре сохраняет постоянное значение. Этот закон тоже можно непосредственно вывести из кинетической теории.
Эти два закона можно объединить в одном уравнении состояния, которое справедливо при не слишком большой плотности: p V = R T, где p – давление, V – объем, Т – абсолютная температура (то есть температура, отсчитанная от абсолютного нуля, T0 = –273°C, a R – постоянная для всех газов величина.
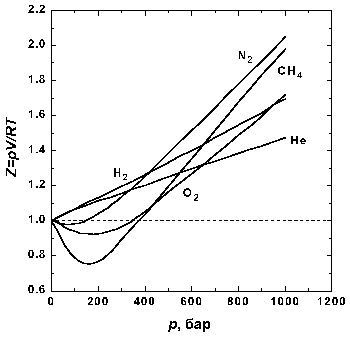
Было известно, что это уравнение не совсем точно, причем в разной степени для различных газов и различных условий. Газы, которые удовлетворяют этому уравнению, называют идеальными (в отличии от реальных газов). Исследуя возможные источники погрешностей ("неидеальности"), Ван-дер-Ваальс заметил, что уравнение основывалось на двух предположениях: что молекулы действуют как точечные массы (что приблизительно соответствует действительности, если они удалены друг от друга) и что молекулы не оказывают воздействия друг на друга (за исключением соударений). Он ввел конечный объем для каждой молекулы и силу притяжения между молекулами (не уточняя ее природы), которая сокращала увеличивающееся расстояние, в виде некоторых коэффициентов уравнения, зависящие от газа. (Это слабое притяжение нехимической природы между молекулами до сих пор часто называют силами Ван-дер-Ваальса.)
Ван-дер-Ваальс модифицировал уравнение состояния идеального газа, приблизив его к реальному: (p + α / V2 ) ( V – β) = R T, где α выражает взаимное притяжение молекул газа (деленное на V2, чтобы учесть ослабление этой силы в большем объеме, т.е. при большем среднем расстоянии между молекулами), а β выражает молекулярный объем молекулы. Как α, так и β принимают разные значения для разных газов.
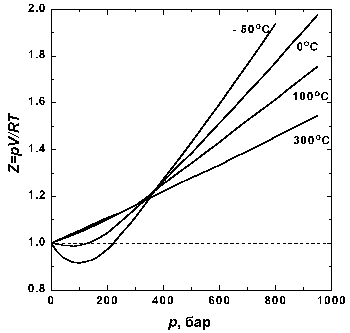
Хотя уравнение Ван-дер-Ваальса и не удовлетворяло полностью экспериментальным данным, оно явилось существенным улучшением более простого закона и обладало важными следствиями. Притяжение между молекулами приводит к тому, что Ван-дер-Ваальс назвал внутренним давлением, которое стремится удержать молекулы вместе. По мере того как объем уменьшается под действием внешнего давления, внутреннее давление возрастает гораздо быстрее внешнего. Если оно окажется равным или превысит внешнее давление, то молекулы сцепятся друг с другом и уже не смогут более менять свой объем при дальнейшем увеличении давления. Газ превратится в жидкость.
Эти рассуждения подтвердили убеждение Ван-дер-Ваальса, что между газообразным и жидким состояниями нет существенной разницы. Те же самые силы и эффекты молекулярного объема действуют в обоих случаях. Различие свойств газов и жидкостей связано с различием в величине, а не в типе сил и объемных эффектов. Просто молекулы могут располагаться ближе или дальше друг от друга.
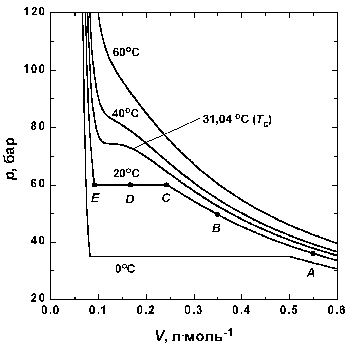
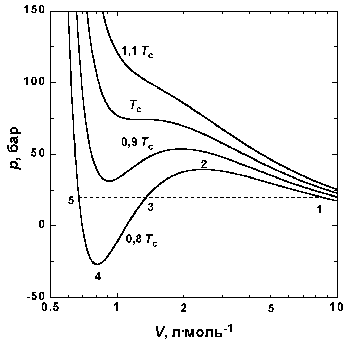
Уравнение Ван-дер-Ваальса значительно прояснило обнаруженное ранее существование критической температуры, различной для разных газов, выше которой газ, независимо от величины давления, нельзя было перевести в жидкое состояние. Критическая температура связана с критическим объемом и критическим давлением, которые вместе определяют критическую точку, совокупность специальных значений температуры, давления и объема, при которых нет видимой грани между газом и жидкостью: при этих условиях оба состояния примерно одинаковы, резкого перехода между ними нет. Ван-дер-Ваальс использовал критическую точку для того, чтобы вывести уравнение, в котором переменные температура, давление и объем выражаются через их значения в критической точке. В результате получилось универсальное соотношение, применимое ко всем газам и зависящее в каждом случае только от критической температуры, давления и объема, а не от природы газа.
В 1880 году Ван-дер-Ваальс опубликовал свое наиболее важное открытие – закон соответственных состояний. Согласно этому закону, если поведение некоторого газа и соответствующей жидкости известно при всех температурах и давлениях, то состояние любого другого газа или жидкости можно вычислить для любой температуры и давления при условии, что известно их состояние при критической температуре. Этот закон не является совершенно точным описанием чрезвычайно сложного характера поведения реальных газов и жидкостей, однако он достаточно точен, чтобы приближенно определить условия, необходимые для сжижения газов, имея неполные экспериментальные данные.
Используя этот закон, шотландский физик Джеймс Дьюар в 1898 году получил жидкий водород, а нидерландский физик Хейке Камерлинг-Оннес в 1908 году получил жидкий гелий.
Ван-дер-Ваальс пытался уточнить уравнение состояния реального газа и жидкости, вводя переменный объем молекул. Он предположил, что молекулы способны образовывать кластеры, которые затем ведут себя как единые молекулы большего размера. Этот кластер мог содержать любое число одиночных молекул, значит, газ способен превратиться в сложную смесь. Более точные описания оказались слишком сложными, поэтому чаще пользуются более простым, хотя и менее точным уравнением Ван-дер-Ваальса.
Ван-дер-Ваальс получил в 1910 году Нобелевскую премию по физике "за работу над уравнением состояния газов и жидкостей".
По словам Оскара Монтелиуса, члена Шведской королевской академии наук, сказанным им во время презентации лауреата, "исследования Ван-дер-Ваальса имеют огромное значение не только для чистой науки. Современное конструирование холодильных установок, которые ныне являются столь мощным фактором нашей экономики и индустрии, базируется в основном на теоретических исследованиях награжденного".
Невысокий человек, ведший скромный образ жизни, Ван-дер-Ваальс проводил свободное время, играя в бильярд, читая или раскладывая пасьянс.
Он умер в Амстердаме 8 марта 1923 года.
Ван-дер-Ваальс получил почетную докторскую степень Кембриджского университета. Кроме того, он являлся членом Нидерландской королевской академии наук и искусств и был избран иностранным членом Французской академии наук, Берлинской королевской академии наук, Московского императорского общества естествоиспытателей, Британского химического общества и американской Национальной академии н
Похожие работы
... причинами отклонений свойств реальных газов от свойств идеального газа оказываются взаимное притяжение молекул и наличие у них собственного объема. Наиболее ярко межмолекулярное притяжение в реальных газах проявляется в их способности к конденсации – переходу в жидкое состояние. Конденсация. При понижении температуры или повышении давления наблюдаются отклонения от законов идеального газа. Когда ...
... что разрешало противоречие между результатами Гей-Люссака и Дальтона. Успехи учения об атомно-молекулярном строении вещества, в особенности, газов, безусловно, оказало влияние на становление термодинамики и молекулярной физики и способствовало развитию механической теории теплоты. Во второй половине 18 века господствовала теория теплорода, но уже в начале 19 века она стала уступать свои позиции ...
0 комментариев