С.Ю. Елисеев
Общие представленияПо способности атомов соединяться друг с другом в длинные цепи углерод занимает особое положение в периодической системе. Углерод может соединяться почти со всеми химическими элементами с образованием молекул цепной и циклической (кольчатой) структуры самых различных размеров. В состав цепей и циклов молекул органических соединений, кроме атомов С, могут входить Н, О, S, N, P, As, Si, Ge, Sn, Pb, B, Ti и другие элементы.
Органическая химия – это химия соединений углерода, атомы которого связаны с атомами других элементов ковалентными, преимущественно мало поляризованными связями.
Органические соединения, или соединения углерода, отличаются от неорганических многочисленностью и многообразием превращений. Если неорганических соединений насчитывается порядка 200 тысяч, то органических соединений известно свыше 2 миллионов.
Законы химии управляют поведением как неорганических, так и органических веществ. Однако органические соединения имеют ряд отличительных особенностей. Так, большинство неорганических соединений – тугоплавкие вещества, а для органических соединений характерно состояние газов, жидкостей и низкоплавких твердых тел; большинство неорганических соединений не горючи, органические легче окисляются и горят, чем неорганические.
К низкомолекулярным относят органические соединения с длиной цепи от 2 до 50 углеродных атомов, к высокомолекулярным – с длиной цепи порядка 200-200000 углеродных атомов и молекулярным весом порядка 104-106 у.е.
Органические соединения при длине цепи порядка 200 атомов углерода обладают уже смолоподобными и каучукоподобными свойствами.
Если цепи атомов кислорода, азота, фосфора, серы, бора и других элементов мало устойчивы, то длинные цепи атомов углерода в силу большой энергии С-С - связи (339 КДж) - весьма устойчивы.
Области применения Лекарственные вещества.Высокомолекулярные органические соединения: синтетические смолы и органическое стекло; пластические массы (пластмассы) и синтетические волокна; синтетический каучук.
Красящие вещества (красители).
Гербициды (вещества, уничтожающие сорняки).
Инсектициды и фунгициды (вещества, уничтожающие, соответственно насекомых и грибы).
Дефолианты (вещества, ускоряющие опадение листьев; применение их укоряет созревание хлопчатника и облегчает машинную уборку).
Десиканты (соединения, способствующие высушиванию растений на корню).
Витамины (сложные физиологически активные органические вещества, отсутствие которых в пище человека или животных ведет к нарушению нормальных функций организма).
Ферменты (сложные органические соединения, являющиеся биологическими катализаторами, вызывающими процессы брожения, расщепления жиров, белков и т.п.)
Консерванты (органические вещества, предохраняющие от закисания и порчи вина, соки, варенья, маринады и другие пищевые продукты).
Органическая химия достигла огромных успехов в изучении состава и переработке каменного угля, нефти и природного газа; таким образом, она тесно связана с угольной, нефтяной и газовой отраслями промышленности, обеспечивающими с одной стороны, получение различных видов топлива, с другой – сырьем различные производства. Так, каменный уголь используют не только как топливо, путем переработки из него добывают необходимый для металлургии кокс, а так же светильный газ и каменноугольный деготь. Последний, свою очередь служит источником для получения многочисленных органических соединений, необходимых для синтеза ВМС, красителей, лекарственных и взрывчатых веществ и т.п. Из нефти путем её перегонки получают различные виды горючего, смазочные материалы и другие ценные продукты. Природный газ, особенно попутный нефтяной газ, также представляет собой ценное химическое сырье и топливо, используемое как в промышленности, так и в быту.
Теория химического строенияСоздана в 1858-1861 г.г. в русским химиком А. М. Бутлеровым.
Основные положения теории химического строения:
Молекулы веществ - представляют собой реально существующие материальные частицы, обладающие определенным химическим строением. Т.е. атомы, образующие их, соединяются друг с другом в определенной, характерной для каждого вещества последовательности и взаимно влияют друг на друга.
Строение молекул вещества познаваемо и может быть установлено путем изучения свойств вещества, продуктов его превращений, а также путем его разложения и синтеза.
Свойства вещества определяются его качественным и количественным составом и химическим строением его молекул. Вещества, имеющие одинаковые состав и молекулярный вес, но различное строение, отличаются по своим свойствам; в этом заключается явление изомерии.
Взаимное влияние атомов, образующих молекулу, определяет реакционную способность каждого из них; химический характер одних и тех же атомов в различных молекулах зависит от того, с какими атомами они связаны в данной молекуле.
Углерод в органических соединениях, как правило, четырехвалентен; атомы его способны соединяться не только с другими атомами, но и друг с другом, образуя цепи; последние могут замыкаться с образованием циклов. Это свойство углерода и явление изомерии и обуславливают многообразие органических веществ.
В развитии и обосновании теории химического строения большую роль сыграли русские химики – ученики и последователи А.М. Бутлерова: В.В. Марковников, А.М. Зайцев, Е.Е. Вагнер, Н.Д. Зелинский, М.И. Коновалов, А.Е. Фаворский и др.
Электронное строение органических соединений Характер связей в органических соединенияхДля молекул органических соединений наиболее характерны ковалентные связи. Как известно, атом углерода имеет четыре валентных электрона. В соответствии с его положением в периодической системе элементов (2 период, I группа, порядковый номер 6) углерод прочно удерживает электроны в своем внешнем слое и в то же время не склонен отнимать электроны у других атомов. Поэтому связь атомов углерода с атомами различных элементов и друг с другом осуществляется путем образования обобщенных пар, т.е. при помощи ковалентных связей. Электронные структурные формулы, например, простейших углеводородов – метана и этана – имеют следующий вид (для сравнения рядом с ними приведены обычные структурные формулы):
Н Н Н Н Н Н
. . ½ . . . . ½ ½
Н : C : Н Н¾C¾Н Н : C : C : Н Н¾C¾C¾Н
. . ½ . . . . ½ ½
Н Н Н Н Н Н
Рис. 1 Электронная и обычная структурные формулы метана и этана.
Атом углерода, как правило, образует четыре ковалентные связи, т.к. только в этом случае у него создается устойчивый восьмиэлектронный внешний слой. Этим объясняется то, что в большинстве случаев валентность углерода равна четырем. В молекуле метана углерод образует ковалентные связи с четырьмя атомами водорода, у каждого из которых создается устойчивый двухэлектронный слой. В молекуле этана одна из электронных пар осуществляет ковалентную связь между двумя углеродными атомами.
Из сопоставления электронных формул метан и этана с обычными структурными формулами следует, что каждая простая связь между атомами осуществляется одной обобщенной электронной парой. Соответственно в веществах с кратными связями двойная связь возникает вследствие образования соединяющимися атомами двух, а тройная – трех обобщенных электронных пар. Электронные структуры и обычные структурные формулы, например, этилена и ацетилена имеют вид:
Н Н
. . . . Н Н
C::C >C = C< Н : C:::C : Н H¾C º C¾H
. . . . Н Н
Н Н
Н2С = СН2 НС º СН
Рис. 2. Электронная и обычная структурные формулы метана и этана.
Состояние валентных электронов в атоме углерода
Из курса неорганической химии известно, что электронная структура невозбужденного атома углерода может быть выражена формулой 1s22s22p2, т.е. во втором (внешнем) электронном слое у него два спаренных (с противоположными спинами) s- электрона и только два неспаренных p-электрона, которые могут участвовать в образовании ковалентных связей. Следовательно, углерод должен был бы проявлять валентность, равную двум, однако в большинстве своих соединений он четырехвалентен – образует четыре ковалентные связи. Это объясняется тем, что при затрате некоторой энергии происходит "расспаривание" 2s- электронов: один из них переводится на свободную орбиту подуровня 2p, и атом переходит в возбужденное состояние (2s22p2 2s12p3), или графически:
| 2p | 2p | ||||||||||||||
|
| 2s | 2s | |||||||||||||
|
| С | C* |
нормальное состояние возбужденное состояние
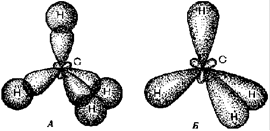
Таким образом, у атома углерода, участвующего в образовании четырех ковалентных связей, во внешнем электронном слое, как было показано ранее, четыре валентных электрона. Состояние их не одинаково. Один из них (s- электрон), двигаясь вокруг ядра образует шаровое облако (рис.3), подобное облаку электрона в атоме водорода (s-состояние электрона). Облака трех других электронов (p- электроны) имеют форму объемных восьмерок (гантелей) с "перетяжкой" в области ядра и ориентированных в трех взаимно перпендикулярных направлениях (p- состояния электрона).
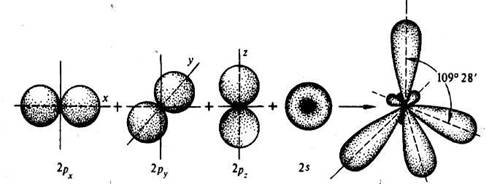
Рис. 3. Негибридизованные 2р(x y z) (а, б, в) и 2s орбитали (г) атома углерода и орбитали атома углерода в состоянии sp3-гибридизации (д).
Когда углерод, проявляя валентность четыре, соединяется простыми (ординарными) связями с четырьмя другими атомами, электронная плотность облаков всех четырех валентных электронов перераспределяются. Происходит гибридизация одного s- состояния и трех p- состояний электронов. В результате во внешнем электронном слое связанного углеродного атома возникают четыре одинаковых гибридных состояния. Занимая эти состояния, валентные электроны образуют гибридные облака, имеющие вид деформированной восьмерки (Рис.3 д), большая часть которой направлена от ядра по линии связи с другим атомом.
Такое состояние валентных электронов атома углерода называют sp3- гибридизацией (первое валентное состояние углерода). Все четыре гибридных облака имеют определенную направленность в пространстве под углом 109о28' друг к другу, что соответствует о тетраэдрической направленности связей атома углерода.
Образование простых связейКак показано ранее, простая ковалентная связь между атомами образуется парой обобщенных электронов. Образование этой пары в свете представлений квантовой механики заключается во взаимном перекрывании облаков электронов, осуществляющих связь; перекрывание происходит при сближении атомов на определенное расстояние. Между этими атомами на прямой, соединяющей их центры, возникает наибольшая электронная плотность (область максимального перекрывания облаков). К этой области повышенной плотности отрицательного заряда притягиваются положительно заряженные ядра атомов, следствием чего и является возникновение химической cвязи.
На рис. 4 представлены схемы образования некоторых связей. Простая связь между атомами водорода и углерода H-C (или H:C) является следствием перекрывания шарообразного облака электрона атома водорода и гибридного облака одного из валентных электронов атома углерода. Простая связь между двумя углеродными атомами C—C (или C:C) осуществляется вследствие перекрывания двух гибридных облаков углеродных атомов.
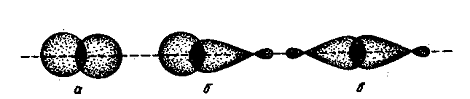 |
Рис. 4. Различные виды перекрывания орбиталей при образовании
s-связей: а- перекрывания 1s - орбиталей атомов водорода (Н — Н);
б- перекрывание 1s-орбитали атома водорода с гибридной орбиталью атома углерода (С—Н); в- перекрывание двух гибридных орбиталей атомов углерода (С—С).
Связи указанного типа, в которых максимальное перекрывание электронных облаков осуществляется на линии между центрами атомов, называются s-связями, а электроны, участвующие в их образовании, s - электронами. Каждая ковалентная связь характеризуется определенным расстоянием между ядрами соединенных атомов. Это расстояние называется межъядерным расстоянием, или длиной связи. Длина простой связи C—C составляет 1,54 А (0,154 нм).
Образование двойных связейДвойная связь, например связь C=C, образована двумя обобществленными электронными парами C::C. Но состояние каждой из них не одинаково. Например, в молекуле этилена H2C=CH2 при образовании двойной связи в каждом из атомов углерода образуется лишь три гибридных состояния - в результате гибридизации s- состояния и двух p- состояний (sp2- гибридизация). В этом случае у каждого углеродного атома одно из p- состояний не участвует гибридизации и остается неизменным.
Три гибридных облака каждого из углеродных атомов этилена участвуют в образовании трех s-связей (второе валентное состояние углерода). В этилене всего пять s-связей (четыре C—H и одна С—С). Все они расположены в одной плоскости, каждая под углом 120о к соседней связи (рис. 5):
Таким образом, одна из электронных пар двойной связи между атомами углерода осуществляют обычную s-связь, вторая электронная пара образуется электронами не участвующими в гибридизации и сохранившими p-состояние. Облака этих электронов, сохранившие форму объемных восьмерок, направлены перпендикулярно к плоскости, в которой расположены s-связи молекулы этилена и перекрываются над и под этой плоскостью.
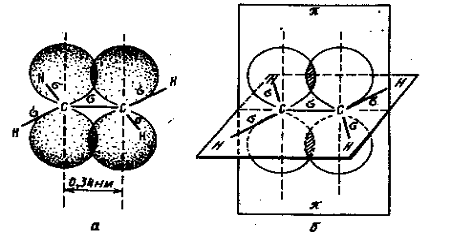 |
Рис. 5. Перекрывание двух негибридизованных 2р-обриталей в молекуле этилена: а- объемное изображение перекрывающихся негибридизованных 2р-орбиталей; б- схематическое изображение этих орбиталей на плоскости.
Связь, осуществляемую такой парой электронов, называют p-связью, а образующие ее электроны - p- электронами. Как показано на рис. 6 , p-связь возникает в плоскости, перпендикулярной плоскости расположения s-связей.
Двойная связь, являющаяся сочетанием s- и p-связей, по характеру существенно отличается от простой связи. Центры углеродных атомов в этилене находятся на расстоянии 1,34 А (0,134 нм), т.е. длина двойной связи несколько меньше, чем простой.
Образование тройных связейТройная связь CºC образована тремя парами обобществленных электронов C:::C. Состояние этих пар не одинаково, так же как в случае двойной связи. Одна из них представляет собой s-связь, две другие - p-связи. Поясним это на примере ацетилена HCºCH. При образовании тройной связи в каждом углеродном атоме гибридизируется одно s- и одно p- состояния электронов (sp-гибридизация). У каждого углеродного атома образуется два гибридных состояния, а два p- состояния не участвуют в гибридизации и сохраняют свою конфигурацию (рис. 6).
Два гибридных облака каждого атома С в ацетилене участвуют в образовании двух s-связей (третье валентное состояние углерода). В ацетилене всего три s-связи (одна C—C и две C—H), расположенные на одной прямой. В результате же перекрывания облаков электронов, сохранивших p-состояние, возникают две p-связи, образованны и двух взаимно перпендикулярных плоскостей (рис. 6). Тройная связь в ацетилене имеет длину 1,20 А (0,120 нм), т.е. углеродные атому сближены еще больше, чем в случае двойной связи.
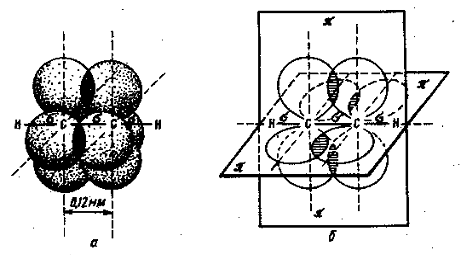 |
Рис. 6. Перекрывание четырех негибридизованных 2р-орбиталей в молекуле ацетилена: а- объемное изображение четырех перекрывающихся 2р-орбиталей; б- схематическое изображение этих орбиталей в двух взаимно перпедикулярных плоскостях. Изомерия
Еще в 1814 г. французский ученый Гей-Люссак установил, что некоторые вещества при одном и том же качественном и количественном составе обладают различными физическими и химическими свойствами. Например, состав C2H6O и, соответственно, молекулярный вес 46,07 имеют два различных изомерных органических вещества: этиловый спирт – жидкость, кипящая при 78,4 оС, смешивающаяся с водой в любых соотношениях, и диметиловый эфир – газ, почти не растворимый в воде и существенно отличающийся от этилового спирта по химически свойствам.
Это явление, заключающееся в существовании нескольких химических соединений с одинаковым качественным и количественным составом, но отличных по физическим и химическим свойствам, было названо изомерией. Указанные соединения получили название изомеров.
Сущность явления изомерии была раскрыта в теории Бутлерова. Выяснилось, что изомерия обусловлена различным химическим строением, т.е. различием в порядке соединения атомов в молекулах при одном и том же составе и молекулярном весе веществ.
Для каждого из трех простейших углеводородов (метана, этана и пропана) возможно по одной структурной формуле:
H H H H H H
ï ï ï ï ï ï
H¾C¾H; H¾C¾C¾H; H¾C¾C¾C¾H.
ï ï ï ï ï ï
H H H H H H
В молекуле пропана четвертый углеродный атом может быть присоединен либо к одному из двух крайних углеродных атомов, либо к среднему. Цепь из четырех атомов углерода, как видим, дает начало двум изомерным молекулам состава C4H10 с различными углеродными скелетами:
H H H H H H H
ï ï ï ï ï ï ï
H¾C¾C¾C¾C¾H (1), H¾C¾¾C¾¾C¾H (2)
ï ï ï ï ï ï ï
H H H H H H¾C¾H H
ï
H
изображаемым сокращенно:
CH3—CH2—CH2—CH3 (1), CH3—CH—CH3 (2).
ï
CH3
Первый изомер углеводорода бутана C4H10 имеет прямую (нормальную) цепь. Второй изомер – изобутан – разветвленную цепь атомов углерода.
Для углеводорода пентана C5H12 различия в последовательности связи углеводородных атомов приводят к образованию трех изомеров:
нормальный пентан изопентан
СН3—СН2—СН2—СН2—СН3 СН3—СН—СН2—СН3
СН3 ½
½ СН3
тетраметилметан СН3—С—СН3
½
СН3
С увеличением числа атомов углерода в молекуле резко возрастает число изомеров. Известны все 9 структурных изомерных гептанов C7H16, предсказанных теорией химического строения. Для углеводородов C10H22 возможно 75 структурных изомеров, для C11H24 159 изомеров, для C12H26 802 изомера, для C14H30 1858 изомеров, для – C20H42 366319 изомеров.
Явление изомерии – одна из важнейших причин существования большого числа органических соединений.
Свойства органических соединений зависят от присутствия – функциональных групп (—ОН у спиртов; >С=О у альдегидов и кетонов; —СООН у карбоновых кислот; —NH2 у аминосоединений; F, Cl, Br, J у галогенпроизводных и так далее). Функциональные группы обуславливают важнейшие свойства и прежде всего химическое поведение молекул. Изучение спектров молекул показало, что функциональные группы имеют характеристические частоты, мало отличающиеся для отдельных представителей каждого класса органических соединений.
Изомерия характерна не только для линейных, но и для циклических молекул:
СН3
![]()
![]() Циклогексан СН2 метилциклопентан ½
Циклогексан СН2 метилциклопентан ½
![]()
![]()
![]()
![]() СН2 СН2 СН
СН2 СН2 СН
![]()
![]() СН2 СН2
СН2 СН2
![]()
![]() СН2 СН2
СН2 СН2
СН2 СН2—СН2
Структурная изомерия может иметь место и при одинаковом углеродном скелете, если функциональные группы занимают различное положение в молекуле. Порядок связи атомов в молекуле пропана выражается одной структурной формулой: CH3—CH2—CH3. Замещение одного из атомов водорода пропана гидроксильной группой приводит к получению двух изомерных спиртов:
CH3—CH2—CH2OH (1) CH3—CHOH—CH3 (2)
пропиловый спирт изопропиловый спирт
Эти структурные изомеры отличаются положением в молекуле функциональной гидроксильной группы, характерной для класса спиртов.
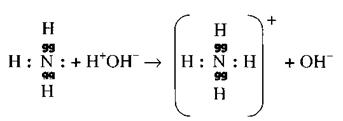
Взаимное влияние атомовХимическое поведение – реакционная способность одного и того же атома, изменяющаяся в различных молекулах под влиянием непосредственно связанных с ним атомов, а также под влиянием отдаленных атомов и атомных групп.
![]()
![]() Так, например, атом водорода в соединении с хлором, кислородом и азотом (H—Cl, H—O—H, N— ) проявляет различные свойства. Водород соляной кислоты сильно поляризован (протонирован) и легко замещается металлами, водород воды менее сильно поляризован и поэтому замещается только активными металлами и, наконец, водород аммиака очень слабо протонирован и может быть замещен лишь самыми активными металлами. Различное влияние атомов Cl, O и N на процесс протонизации – причина различной активности атомов водорода в рассматриваемых молекулах.
Так, например, атом водорода в соединении с хлором, кислородом и азотом (H—Cl, H—O—H, N— ) проявляет различные свойства. Водород соляной кислоты сильно поляризован (протонирован) и легко замещается металлами, водород воды менее сильно поляризован и поэтому замещается только активными металлами и, наконец, водород аммиака очень слабо протонирован и может быть замещен лишь самыми активными металлами. Различное влияние атомов Cl, O и N на процесс протонизации – причина различной активности атомов водорода в рассматриваемых молекулах.
Влияние атомов кремния и углерода в молекулах тетрахлоридов- кремния SiCl4 и углерода CCl4 проявляется в различном химическом поведении в этих соединениях атомов хлора. Так, при действии воды в молекуле SiCl4 атомы хлора очень легко замещаются на гидроксильные группы, тогда как в молекуле ССl4 обмена атомов хлора на гидроксильные группы не происходит.
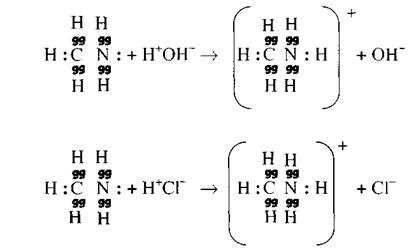
Атом каждого элемента влияет определенным образом на химическое поведение других атомов, составляющих молекулу, и вместе с тем, сам подвергается влиянию всей молекулы в целом. Теория химического строения не только раскрыла единство части и целого в молекуле и в химическом взаимодействии непосредственно связанных друг с другом атомов, но и указала на существование в молекулах химического влияния атомов, непосредственно не связанных друг с другом. Например, в молекулах хлорэтана (хлористого этила) CH3—CH2—Cl и хлорэтилена (хлористого винила) CH2=CH—Cl различное влияние на атом хлора этильной (CH3—CH2—) и винильной (CH2=CH—) групп обуславливает и различную его реакционную способность. Если в хлорэтане атом хлора весьма подвижен и обладает высокой реакционной способностью, то в молекуле хлорэтилена атом хлора инертен.
Структурные формулы выявляют главные, непосредственные связи и сильные химические взаимодействия атомов в молекуле, характеризуя основные особенности ее химического строения и реакционной способности.
Главная заслуга в становлении законов и правил взаимного влияния атомов в молекуле принадлежит В.В. Марковникову (1837-1904).
ТаутомерияБутлеров рассматривал химическую связь как особый вид движения атомов. Он полагал, что молекулы находятся в постоянном движении и превращении, подвергаясь многообразным внутренним перестройкам. В свете теории Бутлерова представления об устойчивости и неустойчивости изомерных форм молекул являлся чисто формальным, т.к. в некоторых случаях изомерные молекулы настолько легко переходят друг в друга, что оба изомера находятся в состоянии подвижного равновесия
СН3—С—СН2—СООС2Н5 <=> СН3—С=СН—СООС2Н5,
½½ ½
О ОН
кетонная форма енольная форма
ацетоуксусный эфир
а в других, наоборот, равновесие между изомерами сильно или почти полностью сдвинуто в сторону одного из них
![]()
![]()
![]()
![]() СН3 СН3
СН3 СН3 ![]()
![]() СН3 СН3
СН3 СН3
СH ¾¾¾¾® СBr
½ ¬ ½
СН2Br СН3.
Взаимные превращения изомеров могут осуществляться без какого-либо внешнего воздействия, и, наоборот, иногда требуются интенсивные внешние воздействия (катализаторы) для того, чтобы вызвать обратимые переходы изомеров друг в друга.
Распространенное в органической химии явление, заключающееся в существовании двух или нескольких изомерных форм молекул, находящихся в состоянии динамического равновесия, называется таутомерией. В настоящее время установлено, что между явлениями изомерии и таутомерии нет резкой границы. Исследования показали, что при одних внешних воздействиях вещества могут быть вполне устойчивыми изомерами, тогда как при других – таутомерами.
Общие представления о стереохимииДальнейшим развитием теории строения явилось создание стереохимии – учения о пространственной структуре органических молекул. В 1874г. голландский химик Я. Вант-Гофф и французский химик Ле-Бель одновременно и независимо друг от друга высказали гипотезу о том, что молекулы органических веществ имеют пространственное, объемное строение.
Пространственное строение молекул обусловлено тем, что валентные связи углеродного атома расположены не в плоскости, а определенным образом направлены в пространстве; атом углерода, связанный с четырьмя одновалентными атомами или атомными группами, является как бы центром тетраэдра – четырехгранной пирамиды (рис. 7), а его валентные связи направлены к вершинам тетраэдра (H). В этих вершинах помещаются соединенные с атомом углерода одновалентные атомы или атомные группы. В результате молекулы органических веществ имеют объемность, пространственное строение.
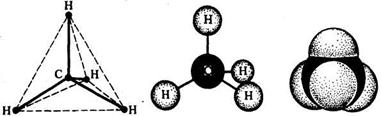
Рис. 7 Модели пространственного строения молекулы метана:
А – тетраэдрическая; б – шаростержневая; в – по Бригдебу.
Оказалось, что и при одинаковой последовательности связей в молекулах, возможна изомерия, обусловленная различным расположением атомов в пространстве. Этот вид изомерии называется пространственной изомерией или стереоизомерией.
Стереоизомеры могут содержать асимметричный атом углерода, соединенный с четырьмя различными атомами или атомными группами (рис. 8). Органические вещества, содержащие асимметричный углеродный атом, существуют в виде двух изомерных молекул с различным пространственным расположением атомов. Эти стереоизомерные молекулы относятся друг к другу как предмет к зеркальному изображению и называются энантиомерами (асимметричный атом углерода в формулах обозначается звездочкой):
CH3—C*HOH—COOH молочная кислота
Стереоизомеры, обладая одинаковыми химическими и физическими свойствами, отличаются между собой оптической активностью, т.е. по отношению к поляризованном свету. Каждый из них вращает плоскость поляризованного луча в противоположном направлении, являясь оптическим антиподом.
Поляризация связейКогда ковалентной связью соединяются одинаковые атомы, обобщенная электронная пара в равной степени принадлежит им обоим. Иначе обстоит дело, если ковалентной связью соединены атомы различных элементов,
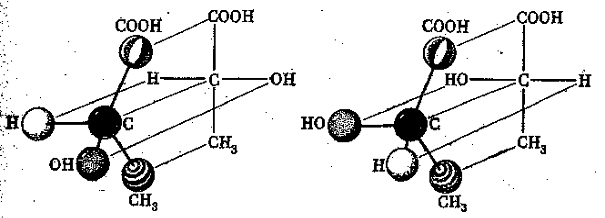 |
Рис. 8 Энантиомеры молочной кислоты.
обладающие различной электроотрицательностью (ЭО) (т.е. способностью притягивать обобщенные электроны, образующие ковалентную связь). В этом случае обобщенная электронная пара оказывается в той или иной мере смещенной (оттянутой) сторону более ЭО- атома. В результате у этого атома возникает некоторый (избыточный или частичный) отрицательный заряд, а у атома, от которого электронная пара оттянута, - равный по величине положительный заряд. Связь между такими атомами является поляризованной связью.
Так, например, в молекуле хлора обобщенная электронная пара в одинаковой мере принадлежит обоим атомам, в молекуле же органического вещества – хлористого метила CH3Cl пара электронов, осуществляющая связь между хлором и углеродом, смещена в сторону несколько более электроотрицательного хлора (и условно может быть изображена d+ и d-):
Cl : Cl H3Cd+ : Cld- H3Cd+ ® Cld-
I II III
У хлора возникает некоторый отрицательный заряд, у углерода – положительный, ковалентная связь между этими атомами в хлористом метиле поляризована. Как показано в формуле II, частичные заряды атомов, соединенных поляризованной связью, принято обозначать греческой буквой d (дельта) со знаком плюс и знаком минус соответственно. Смещение электронной пары в поляризованной простой ковалентной связи обычно обозначают стрелкой на середине черточки, выражающей эту связь, как представлено в формуле III.
Чем более поляризована связь, т.е. чем больше осуществляющая ее пара смещена к одному из атомов, тем больше эта связь по своему характеру приближается к ионной связи и тем выше реакционная способность соединенных такой связью атомов.
Степень поляризации связи между двумя атомами, а следовательно, и ее прочность, зависят от влияния других соединенных с ними атомов или атомных групп. В частности, связь С—С между двумя формально одинаковыми углеродными атомами, может быть поляризованной, если каждый из них в свою очередь соединен с различными атомами или группами. Особенно склонны к поляризации двойные и тройные связи.
В молекулах с двойными связями p-электроны, образующие p-связь, смещены в направлении более электроотрицательного атома:
![]()
![]()
![]()
R2C=O, R2C=CH2, R3C—N=O.
Изогнутая стрелка указывает направление смещения p-связей.
Взаимодействие электронов p-связей с электронами остальных участков ненасыщенной молекулы вызывает ее электрическую асимметрию.
В молекулах соединений с кратными связями p-связи значительно легче поляризуются, чем s-связи. В результате поляризации атомы, связанные двойной связью, приобретают частичные (неполные) электрические заряды:
R2Cd+=Od- R2Cd+=CH2d- R3C—Nd+=Od-
Молекулы, содержащие две или несколько чередующихся двойных связей, разделенных s-связью, называются сопряженными системами:
![]()
![]()
![]()
![]()
>C=C—C=C< >C=C—C=O >C=C—N=O
ú ú ú ú ú
В сопряженных системах электроны p-связей находятся в поле всех углеродных ядер и поэтому изменение распределения электронов в одной части молекулы вызывает перегруппировки электронов во всех других ее частях, как в едином целом.. Такой тип взаимодействия атомов называют сопряжением связей.
Органические молекулы с достаточно хорошо развитой системой сопряженных связей проявляют полупроводниковые свойства.
Индуктивный эффект и типы заместителейРазвивающаяся на основе современной квантовой механики электронная теория позволила глубже подойти к закономерностям взаимного влияния атомов в молекулах. Рассматривая проявления взаимного влияния атомов как результат различных типов смещения электронов межатомными связями, можно объяснить направление многих реакций и превращений молекул.
В молекулах, построенных из одинаковых атомов и атомных групп, электронная пара ковалентной связи равномерно распределена между ядрами (остовами атомов):
Cl—Cl; Br—Br; CH3—CH3
Взаимное влияние атомов обусловливает полярность и поляризуемость связей в органических молекулах. Электрическая асимметрия ковалентной связи в органических молекулах, построенных из атомов с различной ЭО, изменяет состояние связей и заряды всех атомов молекулы.
Если в органической молекуле атом водорода заменить на атом, обладающим более высоким сродством к электрону, то этот атом не только оттягивает пару общих электронов с непосредственно связанных углеродных атомов, но и вызывает смещение электронных пар у более удаленных атомов:
С®С¾®С—¾®Х
Этот тип взаимного влияния атомов называется индукдуктивным эффектом. Индуктивный эффект атомов и атомных групп может быть отрицательным (—J) и положительным (+J). Эталоном сравнения является водород, индуктивный эффект которого принят за нуль. –J - эффект проявляют заместители, обладающие большим сродством к электрону, чем водород. +J - эффект проявляют заместители с меньшим электронным сродством:
Y—CR3 H—CR3 X—СR3
+J - эффект стандарт —J - эффект
(Y=Si /1,8/; P/2,1/) (H=0 /ЭО=2,1/) (X=N/3,0/; O/3,5/; F/4,0/; Cl/3,0/)
При индуктивном эффекте взаимное влияние атомов передается вдоль углеродной цепи с силой, затухающей по мере удаления от атома, притягивающего или отталкивающего электроны.
Сопоставление констант диссоциации органических кислот позволяет раскрыть индуктивное влияние заместителей на силу кислот. Так, в хлоруксусной кислоте атом хлора и карбоксильная группа имеют отрицательный индукционный (—J) - эффект и потому оттягивают к себе электроны. Влияние атома хлора через углеродную цепь на карбоксильную группу усиливают протонирование атома водорода этой группы и тем самым увеличивает диссоциацию кислоты.
Если константа диссоциации уксусной кислоты К=1,82×10-5, то у хлоруксусной кислоты она в 85 раз больше (К=155×10-5). Дальнейшее замещение атомов водорода в углеводородном радикале уксусной кислоты атомами хлора с (—J) - эффектом вызывает резкое повышение кислотных свойств:
Уксусная кислота CH3—CОOH 1,82×10-5;
Монохлоруксусная кислота CH2Cl—CОOH 155×10-5;
Дихлоруксусная кислота CHCl2—CОOH 5000×10-5;
Трихлоруксусная кислота CCl3—CОOH 30000×10-5.
Если заместители, обладающие (-J)-эффектом, отделены от карбоксильной группы увеличивающимся числом метиленовых групп, которые являются плохими проводниками электронных влияний, то диссоциация кислот должна уменьшиться. Константы диссоциации a-, b- и g-хлормасляных кислот показывают постепенное затухание индукционного эффекта по цепи атомов:
a-хлормасляная кислота CH3—CH2—CHCl—CОOH 139×10-5;
b-хлормасляная кислота CH3—CHCl—CH2—CОOH 8.9×10-5;
g-хлормасляная кислота СН2Cl—CH2—CH2—CОOH 3×10-5.
Величина (—J)-эффекта возрастает с увеличением номера группы периодической системы и уменьшается для элементов одной и той же группы с повышением порядкового номера элемента. При этом атомы, обладающие кратными связями, сильнее притягивают электроны, чем соответствующие атомы с ординарными связями.
Величина (+J)-эффекта возрастает с повышением порядкового номера элемента.
Поляризуемость связей зависит от энергетического состояния электронов и тем больше, чем больше главное квантовое число (n) элементов, участвующих в образовании связи. Подвижность электронов одного и того же квантового уровня определяется орбитальным квантовым числом (l).
Реакции органических веществ![]() Изучение химического поведения – реакционной способности органических веществ показало, что разрыв ковалентной связи между атомами может осуществляться так, что электронная пара остается у одного их двух ранее связанных атомов:
Изучение химического поведения – реакционной способности органических веществ показало, что разрыв ковалентной связи между атомами может осуществляться так, что электронная пара остается у одного их двух ранее связанных атомов:
![]() А : В ¾® А+ + :В-
А : В ¾® А+ + :В-
Такой тип разрыва ковалентной связи, приводящий к возникновению свободных ионов, называется гетеролитическим расщеплением.
Образование ковалентных связей в ходе гетеролитических реакций происходит путем передачи электронных пар свободным органическим анионам:
![]()
![]()
![]()
![]()
![]()
![]() А : В + С : Д ¾® А : Д + С : В
А : В + С : Д ¾® А : Д + С : В
Большинство реакций между органическими соединениями являются гетеролитическими реакциями. Если ионные реакции неорганических молекул обычно протекают мгновенно, то ионные реакции органических молекул могут протекать медленно по стадиям.
Так, например, взаимодействие нейтральной или слабополярной молекулы А—В с ионами С+ и :Д-![]() состоит из следующих трех стадий:
состоит из следующих трех стадий:![]()
![]()
![]()
А—В ¾® А+ + :В- (I) Д:- + А+ ¾® А—Д (II)
В:- + С+ ¾® С—В (III)
Реакционная способность молекул, участвующих в гетеролитических реакциях, обусловлена полярностью, поляризуемостью и сопряжением их связей. Вместе с тем, направление и скорость реакций зависят от природы атакующего органическую молекулу реагента, природы растворителя, действия катализаторов и других факторов.
Полярные реагенты разделяются на нуклеофильные и электрофильные. Нуклеофильные, или электронодонорные, реагенты отдают свои электроны углеродному атому в органической молекуле, образуя с ним химическую связь. Электрофильные, или электроноакцепторные, реагенты приобретают электроны от углерода органической молекулы, образуя с ним химическую связь.
Нуклеофильными реагентами являются отрицательно заряженные ионы, молекулы с неподеленными парами электронов, молекулы с сильно поляризованными или легко поляризуемыми связями:
J-, Br-, Cl-, OH-, OR-, CN-, H2O, NH3, ROH.
К электрофильным реагентам относятся положительно заряженные ионы, молекулы с незаполненными электронными оболочками, молекулы галогенов, карбонильные соединения, ацетиленовые углеводороды:
Н+ или Н3O+, NH4+, NO2+, NO+, F2, Cl2, Br2, J2, AlCl3, BF3, RHal, R2C=O, —C=C— .
Нуклеофильные реагенты отдают электроны, и потому, их можно рассматривать, как восстановители. Электрофильные реагенты оттягивают электроны и тем самым проявляют окислительные свойства. Подобно процессам окисления и восстановления нуклеофильные и электрофильные реакции взаимно связаны.
Существуют все ступени перехода от восстановителей к окислителям и от нуклеофильных реагентов к электрофильным. В зависимости от условий и от природы атакующего реагента одни и те же вещества проявляют либо нуклеофильные (восстановительные), либо электрофильные (окислительные) свойства.
Например, молекула акролеина CH2=CH—CH=O может по связи С=С присоединять как нуклеофильный реагент – гидросульфит натрия, так и электрофильный реагент – молекулу хлора:
![]()
![]()
![]()
![]() О О
О О
H2C=CH—C—H + NaHSO3 ¾® CH2—CH2—C—H
ú
![]()
![]()
![]()
![]() О SO3Na О
О SO3Na О
H2C=CH—C—H + Cl2 ¾® CH2Cl—CHCl—C—H
В первом случае молекула акролеина проявляет электрофильные, а во втором – нуклеофильные свойства. Такие реагенты, как аммиак и вода, в зависимости от условий реакции и природы взаимодействующего с ними вещества, проявляют нуклеофильные и электрофильные свойства.
Гомолитическое расщепление ковалентной связи происходит вследствие разрыва электронной пары:
А : В --- А× + ×В
Гомолитическая диссоциация молекул обычно вызывается термическим и фотохимическим разложением органических веществ. Фотоны с достаточной энергией превращают молекулы в свободные радикалы. Поэтому действие света, равно как и облучение УФ-лучами, инициирует процесс гомолитической диссоциации молекул. В результате гомолитических реакций образуются свободные радикалы.
Свободные радикалы представляют собой электронейтральные частицы с неспаренными электронами. Свободные радикалы подобно свободным одновалентным атомам, обладая большой энергией, являются малоустойчивыми и крайне реакционноспособными частицами. Они не могут существовать длительное время и легко взаимодействуют не только друг с другом (рекомбинация свободных радикалов), но с недиссоциированными молекулами с образованием устойчивых соединений. Однако, существуют и долгоживущие свободные радикалы с сопряженной системой связей.
В настоящее время установлено, что многие органические реакции (окисления, галогенирования, нитрования и другие) протекают с образованием свободных радикалов.
Радикальные реакции обычно являются цепными реакциями, т.к. взаимодействие свободного радикала с молекулой приводит к образованию нового свободного радикала или атома с развитием цепи химических превращений. Примером цепных радикальных реакций является реакция взаимодействия галогенов с углеводородами при освещении:
Сl : Cl + hn ® 2Cl× инициирование цепи
CH4 + Cl× ® ×CH3 + HCl î развитие или рост
×CH3 + Cl2 ® CH3Cl + Cl× ì цепи
Обрыв цепи происходит вследствие исчезновения из газовой фазы свободных радикалов в результате их рекомбинации:
Cl× + Cl× = Cl2 î
×CH3 + ×CH3 = C2H6 ì обрыв цепи
Причиной обрыва цепи являются также столкновения радикалов со стенками сосуда и с молекулами примесей.
При взаимодействии свободных радикалов или атомов с молекулами с двойными связями происходит гомолитический разрыв p-связи и образование нового свободного радикала:
Br2 + hn ® Br× + Br×
Br× + >C=C< ® >CBr—C<
>CBr—C< + Br× ® >CBr—CBr<
Энергия, необходимая для разрыва p-связи (пары электронов), тем меньше, чем больше устойчивость образующегося при этом свободного радикала.
Радикальные реакции – преимущественно реакции автокаталитические. Они играют первостепенную роль в процессах полимеризации, ведущих к получению ценнейших полимерных материалов.
Классификация органических реакцийПо конечному результату:
А) реакции присоединения (R—CH=CH2 + Br2 ® R—CHBr—CH2Br);
Б) реакции отщепления (элиминирования)
(R—CHBr—CH2—R' + KOH ® R—CH = CH—R' +KBr + H2O)
В) реакции замещения (RH + Cl2 ® RCl + HCl)
Г) реакции изомеризации (CH3—CH2—CH2—CH3 ® CH3—CH—CH3
ï
По механизму протекания: CH3
А) Гетеролитические (полярные и ионные) реакции
Нуклеофильные реакции (R :Cl + :OH- ® R : OH + :Cl-)
Электрофильные реакции ( R—NH2 + H+ ® R—NH3+)
Б) Гомолитические (радикальные) реакции
Сl : Cl + hn ® 2Cl×
CH4 + Cl× ® ×CH3 + HCl
×CH3 + Cl2 ® CH3Cl + Cl×
3) По количеству молекул, участвующих в элементарной стадии, протекаю-
щей с наименьшей скоростью:
Мономолеклярные,
Бимолекулярные и т.д.
Эти классы реакций неразрывно связаны между собой, ибо реакции присоединения могут протекать по электрофильному, нуклеофильном или радикальному механизму, а реакции нуклеофильного замещения при насыщенном атоме углерода могут осуществляться посредством мономолекулярного, либо бимолекулярного механизма.
Классификация органических соединений
Органические соединения делят на три большие группы:
Органические соединения с открытой цепью (ациклические) атомов углерода (алифатический или жирный ряд). К этой группе органических соединений относят углеводороды и их производные, не содержащие в молекулах колец, или циклов.
Алифатические соединения подразделяются на насыщенные (или
предельные), содержащие в молекулах ординарные углерод- углеродные связи, и ненасыщенные (или непредельные - олефины), содержащие в
молекулах двойные и тройные углерод - углеродные связи.
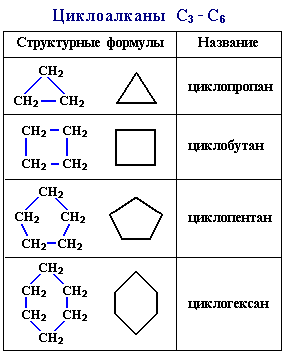
Карбоциклические (алициклические) соединения – органические
соединения, содержащие замкнутые в кольцо цепи атомов углерода:
Алициклические могут быть соединениями – насыщенными (циклопропан,
циклобутан, циклопентан и т.д.) и ненасыщенные;
Ароматические соединения, содержащие бензольное ядро (и другие соединения отвечающие правилу ароматичности Хюккеля). Часто к ароматическим соединениям относят только соединения с бензоидной системой связей, т.е. арены (бензол и полициклические соединения, построенные из конденсированных бензольных колец) и их замещенные.
Гетероциклические соединения – соединения, в построении колец которых
Участвуют не только атомы углерода, но и атомы других химических
элементов.
Органические соединения образуют гомологические ряды. Каждый последующий член гомологического ряда отличается от предыдущего на метиленовую группу CH2, которая называется гомологической разностью. Гомологические ряды объединяют органические соединения с общими химическими свойствами и сходным химическим строением.
Список литературыПисаренко А.П., Хавин З.Я. Курс органической химии. М., Высшая школа,
1975. 510 с.
Нечаев А.П. Органическая химия. М., Высшая школа, 1976. 288 с.
Артеменко А.И. Органическая химия. М., Высшая школа, 2000. 536 с.
Березин Б.Д., Березин Д.Б. Курс современной органической химии. М., Высшая школа, 1999. 768 с.
Ким А.М. Органическая химия. Новосибирск, Сибирское университетское издательство, 2002. 97
Похожие работы
... деятельность. Поиск методов и форм обучения, способствующих воспитанию творческой личности, привел к появлению некоторых специфических способов обучения, одним из которых являются игровые методы. Реализация игровых методов обучения при изучении химии в условиях соблюдения дидактических и психолого-педагогических особенностей, повышает уровень подготовки учащихся. Слово «игра» в русском языке ...
... пластмасс различного назначения. Приводимый ниже материал предназначен для студентов химического отделения, специализирующихся по органической химии и химии и физике высокомолекулярных соединений, а также может быть полезен аспирантам, инженерам и научным работникам. 2.1 Метод изучения релаксации напряжения Явление релаксации - это процесс перехода из неравновесного в равновесное состояние ...
... - С=С - Н + ЗН2 Эта реакция дегидрирования (отщепления водорода) имеет большое промышленное значение, так же как и дегидрирование других предельных углеводородов, в том числе этана С2Н6: Углеводороды нормального строения под влиянием катализаторов и при нагревании подвергаются реакциям изомеризации и превращаются в углеводороды разветвленного строения: пентан 2-метилбутан Применение метана ...
... весь цилиндр. Это опыт демонстрирует одну из биологических функций железа. По химической природе, каталаза – геминовый фермент, содержащий железо. [3] 2. Разработка темы «Основания» в курсе неорганической и органической химии 2.1 Урок по теме «Основания» Цели урока: познакомить учащихся с новым классом химических соединений – основаниями, их свойствами (отношение к воде, действие на ...



0 комментариев