Марфенин Н. Н.
Отличительной чертой данного типа строения колоний является не прекращающееся после образования гидранта функционирование зоны роста, благодаря чему: 1) большая часть гидрантов колонии оказывается сосредоточенной в узком поверхностном слое” наиболее благоприятном для ловли добычи, и 2) оказывается возможным увеличение размеров гидрантов. Проведенный анализ позволяет считать, что к данному типу строения колонии относятся все Athecata, имеющие побеги.
У гидроидов известно четыре типа колоний (Наумов, 1960; Kuhn” 1914; Hyman, 1940), которые выделяют по характеру роста и ветвления (расположению зон роста и почкования). По степени усложнения они располагаются в ряд: стелющиеся колонии; моноподиальные с терминально расположенными зооидами; симподиальные и моноподиальные с терминально расположенными верхушками роста. Анализируемый в настоящей статье тип строения колонии—второй в приведенном ряду— занимает среднее положение по степени сложности наряду с симподиальными колониями. Однако если симподиальные колонии и моноподиальные с терминально расположенными верхушками роста представляют, несомненно, одну ветвь усложнения организации колониальных гидроидов, то моноподиальные колонии с зооидными зонами роста должны быть отнесены к другому направлению эволюции.
Морфофункциональный анализ помогает выявить особенности каждого из этих направлений. Однако прежде необходимо уточнить характеристику типа организации, который вслед за Кюном (Kuhn, 1914) принято называть “моноподиальные колонии с терминально расположенными гидрантами”, или, по Д. В. Наумову (I960), “моноподиальные колонии с зооидными зонами роста и почкования”. Это и является основной задачей данной работы. Вторая задача—попытаться определить специфику положения рода Tubularia в данном типе строения колонии.
По биологии и морфологии Tubularia имеется довольно много исследований. Однако, кроме нескольких работ (Agassix, 1862; Allman,, 1871; Mackic, 1966), они в основном касаются либо эмбриогенеза и морфогенеза (Ciamician, 1879; Lowe, 1926; Berrill, 1952; Fennhoff, 1978), либо оседания личинки (Pyefinch, Downing, 1949; Hawes, 1958), либо регенерации (Barth, 1944; Steinberg, 1954; Tardent, 1963), либо электрофизиологии, связанной с поведением гидрантов (Josephson, 1965, 1974). В результате строение колонии осталось описанным весьма фрагментарно.
Исследование было проведено в июле— сентябре 1978 г. на Беломорской биостанции Московского университета (Великая Салма Ругозерской губы Кандалакшского залива).
Автор благодарит своих коллег, с которыми он совершал погружения в подводный мир, за помощь в освоении методов подводных исследований.
Материал и методыTubularia larynx Ellis et Solander, 1786 относится к семейству Tubulariidae подотряда Athecata. В районе исследований на Белом море колонии были обнаружены по бокам желоба Великой Салмы на глубине около 20 м на ракушечнике.
С помощью легководолазной техники были проведены наблюдения за поведением гидрантов и положением колоний иа течении, распределением колоний по дну, характером сопутствующей фауны, особенно гидроидов, а также был осуществлен сбор необходимого материала.
В лаборатории колонии содержались в кристаллизаторах с аэрацией при различных температурах в диапазоне от 11° до 17°. Смену воды и кормление свежевылупившимися науплиусами Artemia осуществляли ежедневно. Методика культивирования соответствовала описанной нами ранее (Бурыкин с соавт., 1984).
Результаты Строение колонии и его экологическое значение.Заросли Т. larynx обычно имеют вид полусферического густого куста с радиусом около 5—10 см (рисунок, 1; см. также Allman, 1871). Хэйвс (Hawes, 1955) описывает колонии с высотой побегов до 17,5 см.
Поверхность такого куста сплошь покрыта гидрантами. Ближе к центру зарослей гидрантов значительно меньше. Крепится куст к субстрату нитевидной гидроризой, которая, однако, может занимать площадь во много раз меньшую, чем поверхность самого куста.
При первом рассмотрении куст кажется одной колонией. Однако это не соответствует действительности. Перед нами ассоциация множества разновозрастных колоний, которые возникли в результате оседания на перисарк старших колоний их личинок— актинул. Изучение начальных этапов формирования такой ассоциации помогает представить, как это происходит, и выяснить строение отдельной колонии.
Как известно, актинулы значительно отличаются по своей морфологии от типичных личинок кишечнополостных—планул. При их формировании сразу образуется венчик аборальных и зачатки оральных щупалец (Тихомиров, 1887). У актинул изначально нет ресничного эпителия (Van de Vyver, 1968), и поэтому они не плавают, а падают на дно. Я заметил, что венчик аборальных щупалец помогает им при скатывании с гидранта зацепиться за субстрат—часто за перисарк своей же или соседней колонии. Исследователи, специально изучавшие процесс оседания актинул, отмечают, что прикрепление личинки к субстрату происходит лишь через несколько часов, а часто и через сутки (Pyefinch, Downing, 1949; Hawes, 1958). В это время личинка действительно удерживается на субстрате своими аборальными щупальцами (Hawes, 1958).
Прикрепившись аборальным концом, актинула начинает расти (рисунок, 2). Завершается формирование гидранта, одновременно с его увеличением удлиняется его ножка, которая становится фактически стволом колонии. Рост ствола происходит в его дистальной части (зоне роста) — непосредственно под гидрантом. Эта особенность и послужила для выделения данного типа колоний — моноподиального с зооидньши зонами роста. Таким образом, гидрант, венчая собой ствол, все время перемещается по направлению роста последнего. Старые крупные гидранты вследствие этого оказываются на поверхности колонии, а не у ее основания.
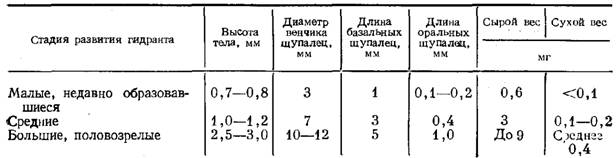
По мере удлинения ствола его диаметр несколько возрастает. Ствол проросшей актинулы всего 0,12—0,18 мм в диаметре, а у взрослой колонии—до 0,5 мм. Гидранты также постепенно увеличиваются в размерах (таблица). Окончательные размеры ствола и гидрантов у Т. larynx существенно превосходят типичные для гидроидов. Получается, что за счет прочного кожистого перисарка и значительного диаметра ствол может до некоторых пределов противостоять течению, удерживая довольно тяжелые крупные гидранты высоко над субстратом.
Боковые ветви на стволе образуются, как правило, не ближе 8 мм от гидранта (рисунок, 3). Расстояния между боковыми ветвями на стволе непостоянные—в среднем около 4мм, но могут быть и в несколько раз больше. О слабой степени разветвленпости колонии свидетельствует также количественный показатель В/С — отношение числа всех ветвей в колонии к суммарной протяженности ее гидрофитона (ценосарка). Этот показатель для маленьких колоний с 50—100-мм гидрофитоном составлял всего около 0,1 ветви/мм, тогда как, например, у Obelia loveni он 0,25—0,45 ветви/мм (Марфенин, Косевич, 1984).
Диаметр боковой ветви исходно всегда меньше, чем у той, от которой она отходит, но по мере роста он, как и у ствола, постепенно возрастает. Для последующего анализа важно, что гидрант образуется не сразу, а лишь когда боковая ветвь вырастет до 3—5 мм, а то и больше. Следовательно, зона роста может временно находиться апикально, напоминая типичную верхушку роста столона у гидроидов. Принципиальное отличие ее от последней в том, что у верхушки роста столона зоной морфогенеза является ее проксимальная часть, в то время как у ветви Tubularia терминальная. В период дифференцировки гидранта дистальный конец ветви остается столоновидным, т. е. отсутствует расширение, столь характерное для Thccaphora. Поэтому и гидрант образуется первоначально очень малых размеров.
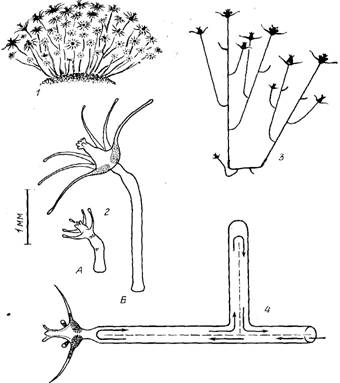
Tubularia larynx Ellis et Solander, 1786: 1— общий вид зарослей в форме полусферического куста; 2 — рисунок осевшей актинулы через сутки (А) и первичного гидранта, выросшего из нее, через неделю (В); 3 — схема строения небольшой колонии; 4 — схема перемещения гидроплазмы (стрелками) в ценосарке колонии (пунктиром изображен мезентерий); диаметр ствола завышен. Масштаб относится к 2
Размеры и вес гидранта у Т larynx, образовавшегося во взрослой колонии, на трех этапах его роста (выборка при взвешивании — 10 гидрантов)
Далее рост боковой ветви осуществляется так же, как и ствола, т. е. удлинение ее происходит непосредственно под гидрантом, а сам гидрант постепенно увеличивается в размерах. Со временем и боковая ветвь также начинает ветвиться. Определенной ориентации ветвления нет, хотя иногда ветви отходят преимущественно от одной стороны ствола, а иногда поочередно от противоположных. Возможны и другие варианты.
Первоначально боковая ветвь перпендикулярна к той, от которой она отходит, но затем она загибается вверх. Эксперименты с регенерировавшими кусками ствола показали, что переворачивание такой модельной колонии гидрантом вниз приводит по мере дальнейшего роста к изгибанию ствола вместе с венчающим его гидрантом вверх. Вследствие этой особенности большинство ветвей колонии оказывается ориентированной более-менее параллельно друг другу (рисунок, 3).
Скорости роста всех ветвей и ствола примерно одинаковы и составляли около 0,5 мм/сут при температуре 12°, что соответствует данным Маки (Mackie, 1966) для Т. сгосеа при 14°—1 мм/сут. Из-за сходства скоростей роста и определенного порядка образования ветвей на некотором расстоянии от апикально расположенного гидранта длина ветвей пропорционально возрастает в проксимальном направлении, а венчающие их гидранты оказываются примерно на одном уровне. Эта особенность морфологии и роста колонии у Т. larynx объясняет, почему в кусте гидранты расположены преимущественно на его поверхности или вблизи ее (рисунок, 7).
Гидрориза у Т. larynx морфологически слабо отличается от побегов. Столоны лишь некоторое время стелются по субстрату, а затем теряют с ним связь и превращаются в стволы побегов. При этом на их верхушках роста формируются терминальные гидранты. Благодаря тому, что столоны ветвятся чаще, чем стволы и ветви побегов, в среднем через каждые 2 мм, связь колонии с субстратом обеспечивается достаточно прочная, несмотря на то, что площадь, занятая гидроризой, относительно мала. По данным Берилла (Berrill, 1952). у Т. сгосеа гидрориза клубковидная. В зрелых колониях верхушки роста столонов встречаются редко.
Кроме функции прикрепления к субстрату гидрориза у Т. larynx выполняет и другую важную функцию—хранение клеточного материала в период переживания колонией неблагоприятных условий. На Белом море всю долгую зиму с октября по июнь колонии Т. larynx существуют в форме столонов и остатков стволов, причем в первых сосредоточен основной клеточный материал, за счет которого и начинается рост колонии летом следующего года.
Как известно (Тихомиров, 1887; Наумов, 1960; Allman, 1871; Hyman 1940), гидранты рода Tubularia обладают двумя венчиками щупалец — оральным и аборальным (или базальным), причем последний расположен в нижней трети гидранта и обладает значительно более длинными щупальцами, чем оральный венчик. Венчик базальных щупалец имеет в основании хорошую опору в виде кольца энтодермальной паренхимы (Тихомиров, 1887). Нетрудно увидеть в этом приспособление для обитания на сильном течении. Кроме того, при определенной концентрации гидрантов, расположенных на поверхности куста, они поддерживают друг друга.
Мы видим, что значительные размеры гидрантов, наличие у них двух венчиков щупалец, определенная закономерность ветвления и роста ветвей, обеспечивающая расположение гидрантов примерно на одном уровне, своеобразный ограниченный рост гидроризы, способствующий концентрации колонии на одном месте,— все это оказывается функционально связанным друг с другом, обеспечивающим в совокупности приспособление этого вида к обитанию на течении. Лишь немногие виды гидроидов способны вместе с Т. larynx противостоять течению в желобе Великой Салмы; это—Hydrallmania falcata (L.), Abietinaria abietina (L.), Sertularia mirabilis (Verrill).
Функциональные особенности.Транспорт гидроплазмы со взвешенными в ней частицами пищи и клетками в гастроваскулярной полости ценосарка происходит у гидроидов рода Tubularia только благодаря работе ресничного эпителия энтодермы, что заметили еще Листер и Альман (Lister, 1834; Allman, 1871). Это принципиально отличает их от абсолютного большинства других колониальных гидроидов, у которых основную роль в транспорте гидроплазмы играют пульсации верхушек роста и гидрантов. При этом гидроплазма перемещается сплошным потоком в канале ценосарка попеременно то в одном, то в противоположном направлениях, а скорость течения гидроплазмы все время меняется.
У Т. larynx полость ценосарка разделена продольным тонким мезентерием на два, а местами на три канала, что позволяет гидроплазме двигаться по ним в противоположных направлениях. Скорость течения всегда постоянна—около 0,1 мм/с. В концевых отделах ценосарка (верхушках роста или под гидрантами) течения разворачиваются, переходя из восходящего потока в нисходящий (рисунок, 4). Пройти мимо места ответвления боковой ветви течение гидроплазмы, как правило, не может — оно обязательно направляется в боковую ветвь и, лишь обойдя ее, возвращается к месту ответвления, после чего и продолжает путь далее по ценосарку ствола. На рисунке, 4 представлена схема перемещения гидроплазмы на участке колонии, которая дает достаточно полное представление о том, что происходит в целой колонии. Остается добавить, что продольный мезентерий, благодаря наличию которого возможно существование такой разновидности распределительной системы, выглядит весьма примитивным. Он неодинаковой толщины, местами перфорирован (что позволяет потокам гидроплазмы все же сообщаться друг с другом) , делит трубку ценосарка на неравные ло объему части так, что преимущество может оказаться то у одного, то у другого канала. Наконец, даже число каналов на небольшом отрезке ствола может варьировать. Такая неопределенность почти по всем морфологическим характеристикам продольного мезентерия позволяет считать, что у Т. larynx мы имеем дело с его примитивным вариантом.
Если проследить путь пищи, вышедшей из гидранта в полость ценосарка, то мы увидим, что она в первую очередь оказывается доставленной в ближайшую к гидранту и, следовательно, самую молодую боковую ветвь. В верхушке роста этой ветви или в только что возникшем на ее конце гидранте пища может осесть. Если этого не происходит, то она переносится гидроплазмой проксимально, попадает снова в ствол и, продолжая по нему путь, оказывается в следующей боковой ветви.
Уже этот фрагмент пути пищи в колонии показывает, что в большей колонии гидрант, выдавивший полупереваренную пищу в полость ценосарка, фактически навсегда ее лишается. Вернуться к нему она может,. лишь обогнув всю колонию. Невероятно, чтобы за это время она не была где-либо использована.
Гидрант у Tubularia выполняет почти все основные функции жизнедеятельности: добывание пищи, се переваривание и усвоение, рост колонии, формирование половых продуктов и размножение, за исключением прикрепления к субстрату и хранения клеточного материала в период переживания неблагоприятных условий.
Такое сосредоточение различных функций в гидранте имеет свои функциональные и экологические последствия. При изменении режима питания, а именно уменьшении рациона, все ветви колонии продолжают некоторое время по инерции расти, расходуя небольшие клеточные запасы. Это приводит к тому, что ценосарк вблизи зон роста истончается и в конце концов рвется. Это явление наблюдается у различных гидроидов. В результате фрагментации ценосарка вблизи зоны роста его концевые; участки, т. е. верхушки роста, оказываются изолированными от колонии. Рост ветвей прекращается, а вместе с этим прекращается и сам процесс истончения ценосарка. Обычно колонии страдают от подобной перестройки незначительно. У Т. larynx тот же процесс истончения и фрагментации ценосарка вблизи зон роста приводит к изоляции терминально расположенных гидрантов от колонии. В результате этого гидранты целиком отваливаются.
Это похоже на процесс фрустуляции (Иванова-Казас, 1977) за тем исключением, что колония лишается значительной, если не большей, части клеточного материала, сосредоточенной в столь крупных гидрантах (таблица). Мои расчеты показывают, что один крупный гидрант равнозначен по своей массе 5 см ствола.
При вымете актинул отделение гидрантов от колонии происходит у Т. larynx и без видимой связи со сменой режима питания. Очевидна экологическая целесообразность этого явления. Отделившиеся гидранты могут существовать несколько дней и даже неделю. В течение этого срока гидранты постепенно редуцируются. Они перестают питаться, даже если пища имеется, и не могут надежно прикрепиться к субстрату, так как не регенерируют ценосарк. В то же время процесс завершения формирования актинул и их вымет продолжается (возможно, за счет использования запасов кольца многослойной энтодермы в основании базальных щупалец). Так, по данным Хэйвса (Hawes, 1958) до 1/5 актинул Выходит из гонофоров после отделения гидрантов. Для вида, не имеющего активно плавающих личинок, распространение их на отделившихся гидрантах безусловно играет важную роль.
ОбсуждениеОсновными признаками моноподиалького типа строения колоний с зооидными зонами роста традиционно принято считать: терминальное положение гидрантов, локализацию зон роста проксимальнее гидрантов, а зон ветвления (почкования) проксимальнее зон роста (Наумов, 1960;Klihn, 1914; Hyman, 1940).
Примечание: зоны роста не являются ограниченными зонами пролиферации, как, .считалось раньше (Кйhn, 1914; Hyman, 1940). Механизм обеспечения зон роста клеточным материалом для надстраивания имеющегося тела оказывается сложнее и скорее всего связан с миграцией клеток (Braverman, 1974). Однако для обсуждаемых в данной статье вопросов это не имеет значения. При описании морфологии колонии прежде всего важно расположение зон роста и продолжительность их функционирования при условии, что они действительно имеют определенные границы, т . е. локальны.
Недостаток этой емкой характеристики в том, что она не дает представления о широте возможных вариаций данного типа строения колонии, а следовательно, и о границах того множества видов, которые ей соответствуют.
На примере типичного представителя данного типа строения колонии — Tubularia larynx — удается несколько конкретизировать данную характеристику.
Из приведенных выше результатов изучения морфологии колонии Т. larynx следует, что зоны роста не всегда представляют собой проксимальную часть тела гидранта. Обычно боковые ветви и стволы всех побегов, кроме материнского, после своего возникновения некоторое время растут, не образуя гидрантов. Даже в пределах одной колонии этот период может значительно варьировать по продолжительности. Дистальнее зоны роста находится верхушка, которая со временем дифференцируется в гидрант. Также обстоит дело и в симподиальных колониях, но у последних рост ветви прекращается после образования на ее верхушке гидранта, а у обсуждаемого типа строения рост продолжается, причем происходит не только удлинение ствола, но и увеличение размеров гидранта. Эта подробность существенно расширяет перечень видов, которые должны быть отнесены к данному типу строения колоний.
Если к тому же добавить, что место локализации зоны ветвления не связано каким-либо определенным расстоянием от терминально расположенного гидранта, а лишь предпочтительно находится дистальнее ближайшей к гидранту ветви, то тогда становится совершенно очевидно, что все Athecata, обладающие побегами, относятся к данному типу строения колонии. У одних (Согупе, некоторые Eudendrium) побеги разветвлены относительно редко и слабоупорядоченно, а у других (Cordylophora cas-pia Pallas и Perigonimus megas Kinne) ветвление более упорядоченное и частое. Также варьирует и продолжительность роста ветвей до дифференцировки на них гидрантов и после образования последних, а также увеличение размеров самих гидрантов,
Например, у Perigonimus megas Kinne ветви 1-го порядка растут нормально, а ветви 2-го порядка в большинстве случаев прекращают расти сразу после образования на их дистальных концах гидрантов. То же самое наблюдается и у некоторых колоний Cordylophora caspia Pall. В результате гидранты оказываются расположенными не по поверхности кустовидного побега, а равномерно внутри его, что больше напоминает моноподиальные колонии с терминально расположенными зонами роста или симподиальные колонии.
Можно привести и еще примеры, доказывающие, что ,в пределах данного типа колоний возможны весьма широкие вариации в строении. Однако общей конструкционной основой остается все же сохранение зоны роста под гидрантом после его сформирования. С этих позиций Т. larynx представляет собой простой и удачный объект.
Продолжение функционирования зон роста после образования терминально расположенных гидрантов дает моноподиальным колониям определенные экологические преимущества. Сохранение терминального положения гидрантов и появление новых боковых ветвей только вблизи их приводят к тому, что основная часть взрослых гидрантов оказывается сосредоточенной в узком поверхностном слое побега (рисунок, /), т. е. в самом благоприятном для ловли добычи районе того пространства, которое занимает побег. Кроме того, такое расположение гидрантов значительно увеличивает вероятность выживания в биоценозах обрастания, в которых одни организмы оказываются погребенными под другими.
Обсуждая на примере Т. larynx общие закономерности строения мо-ноподиальных колоний с терминально расположенными гидрантами, нельзя в то же время забывать, что группа гимнобластических гидроидов состоит из нескольких весьма различающихся подгрупп, что послужило причиной повышения в последнее время ранга подотряда Athecata до подкласса (Petersen, 1979). Не исключено, что эти подгруппы произошли независимо от общего примитивного предка, так что процесс становления и эволюции колониального строения шел параллельно.. Несмотря на безусловное сходство по ряду рассмотренных выше принципиальных моментов в строении колоний , у Tubularia, Coryne, Bougainvillia, Eudendrium, у каждой группы есть свои особенности, которые ярче всего проявляются у тубуляриоморфных гидроидов.
В предыдущей главе они были довольно подробно освещены. Это 1) специализированная личинка — актинула; 2) своеобразный план строения гидранта с проксимально смещенным венчиком хорошо развитых базальных щупалец и кольцом энтодермальной паренхимы в его основании; 3) необычная распределительная система, основанная на перемещении гидроплазмы в ценосарке только ресничками; 4) наличие в полости ценосарка дополнительных усложняющих ее структур (продольные мезентерии),
Все эти особенности связаны с наличием энтодермальной паренхимы,. которая обеспечивает опору тубуляриоморфным гидроидам. Она особенно развита у крупных одиночных форм, таких, как Corymorpha nutans, Tubularia indivisa и др. У них полость ценосарка заполнена энтодермальной паренхимой, в которой проходят многочисленные продольные каналы (Allman, 1871). Своеобразный одиночный гидроид Fukaurahydra anthoformis Yamada, 1977 (Yamada et al., 1977) с энтодермальной паренхимой, лишенной каналов, возможно, похож на общего предка тубуляриоморфных гидроидов.
С крупными размерами гидроида связана, вероятно, и его необычная личинка — актинула. Некоторые авторы представляют актинулу образцом примитивной личинки у гидроидов (Hand, 1959; Rees, 1966). Необоснованность этой точки зрения была убедительно показана В. Н. Беклемишевым (1964). Скорее напротив, актинула — даже не личинка в прямом смысле этого слова (ВегпП, 1952), а недоразвитый гидрант. Я присоединяюсь к этому мнению. Чем больше сам гидроид, тем крупнее личинка ему необходима. Как было показано выше, актинула обеспечивает формирование крупного гидранта на длинной и одновременно довольно толстой ножке.
Необычная распределительная система, которая может функционировать без пульсаций ценосарка, имеется только у тубуляриоморфных гидроидов. Очевидно, такая система возникла независимо, как приспособление к осуществлению транспорта пищи в ценосарке с энтодермальной паренхимой и пониженной вследствие этого эластичностью стенок.
В отличие от ценосарка, у гидрантов и бластостилей Т. larynx имеются регулярные пульсации (Марфенин, 1981; Josephson, 1965, 1974). Однако по моим расчетам их не хватило бы для проталкивания гидроплазмы по ценосарку с сечением 0,5 мм более, чем на 2—3 мм. Следовательно, пульсаторная распределительная система вообще должна была бы быть малоэффективной у гидроидов с сечением ценосарка более 0,2—0,3 мм.
Таким образом, можно считать, что специфические морфологические и физиологические особенности гидроидов рода Tubularia связаны с их относительно крупными размерами и наличием энтодермальной паренхимы, что в свою очередь позволило использовать экологические преимущества строения колонии с терминально расположенными крупными гидрантами на сильном течении.
Список литературыБеклемишев В. И. Основы сравнительной анатомии беспозвоночных. I. Проморфология.М.: Наука, 1964.
Бурыкин Ю. Б., Марфенин. Н. Н„ Карлсен А. Г. Опыт содержания морского колониального гидроида Dynamena pumila (L.) в лабораторных условиях.—Науч. докл. высш. школы. Биол. науки, 1984, № 1, с. 102.
Иванова-Казас О. М. Бесполое размножение животных. Л.: Изд-во Ленинградского ун-та. 1977.
Марфенин Н. Н. Некоторые особенности пищеварения в гидрантах у различных колониальных гидроидов,— Журн. общ. биол., 1981, т. 42, № 3, с. 399.
Марфенин. Н. Н., Косевич И. А. Морфология колонии у гидроида Obelia loveni (Allm.)(Campanulariidae).—Вестн. МГУ, сер. 16. Биология, 1984, № 2, с. 37.
Наумов Д. В. Гидроиды и гидромедузы морских солоноватоводных и пресноводных бассейнов СССР. М.—Л.: Изд-во АН СССР, 1960.
Тихомиров А. А. К истории развития гидроидов.—Изв. О-ва любителей естествознания,антропологии и этнографии, 1887, т. 50, вып. 2 (прилож, 1), с. I-
Agassiz L. Contribution to the natural history of the United States. Pt. 4. Boston, 1862.
Ailman G. J. A monograph of the Gymnoblastic or Tubularian hydroids. L., 1871.
Barth L. G. The determination of the regeneration in Tubularia.—Physiol. Zool., 1944,v. 17, № 4, р. 355.
Berrill N. J. Growth and form in gymnoblastic hydroids. V. Growth cycle in Tubularia.—J. MorphoL, 1952, v. 90. № 3, р. 583.
Braverman M. The cellular basis for colony form in Podecoryne carnea.— Amer. Zool.,1974. v. 14. № 2. р. 673.
Ciamician J. Ueber den feineren Bau und die Entwicklung" von Tubularia mesembryanthemum AlIman—Z. Wiss. Zool.. 1879, В. 32, .No 2, S. 323.
Fennhoff F.-3. Die Gonophorenbildung und Embryonalentwicklung der Hydroide Tubularia crocea Agassiz.—Zool. Jahrb. Abt. Anat. und Ontog. Tiere, 1978, В. 100, № 3,S. 433.
Hand С. On the origin and phylogeny of the coelenterates.—Syst. Zool., 1959, v. 8(4),p. 191.
Hawes F. B. Notes on the variation occurring in Tubularia larynx (Ellis and Solander).—J. Mar. Biol. Ass., U. K., 1955, v. 34, № 2, p. 333.
Hawes F. В. Preliminary observations on the settlement of the actinula larva of the Tubularia larynx (Ellis and Solander).—Ann. Mag. nat. Hist., Ser. 13, 1958, v. 1,p. 147.
Hyman L. H. The Invertebrates: Protozoa through Ctenophora. N. Y.: McGraw-Hill, 1940, p. 400.
Josephson R. K. The coordination of potential pacemakers in the hydroid Tubularia.—Amer. Zool., 1965, v. 5, p. 483. Josephson R. K. The strategies of behavioral control in a coelenterate.— Amer. Zool., 1974, v. 14, N3, р. 905.
K.uhn Л, Entwicklungsgeschichte und Verwandschaftsbeziehungen der Hydrozoen. I. Die Hydroiden.— Ergebn, Fortsch. Zool. (Jena), 1914, В. 4, р. 1.
Lister S. S. Some observations on the structure and functions of tubular and cellular Polypi, and of Ascidiae.—Philosoph. Trans., 1834, v. 116, (For the year v. 124), pt. 2,p. 365.
Lowe E. The embriology of Tubularia larynx (Allm.).—Quart Journ. Micr. Sci., 1926, v. 70, p. 599.
Mackie G. 0. Growth of the hydroid Tubularia in culture.—In: The Cnidaria and their evolution. (Symp. of Zool. Soc, London, № 16)/Ed. Rees W. J., New-York, Acad.Press, 1&66, p, 397.
Petersen K. W. Development of coloniality in Hydrozoa,— In: Biol. and Syst. Colon.Organ. Proc. Int. Symp. Durham, 1976. L., 1979, p. 105.
Pyeffinch K.. A., Downing F. S. Notes on the general biology of Tubularia larynx Ellis and Solander.—J. Mar. Biol. Ass. U. K. 1949, v. 28, № 1, p. 21.
Rees W. J. The evolution of the Hydrozoa.—In: The Chidarian and their evolution (Symp.of Zool. Soc. London, No 16)/Ed. Ress W. J., New—York, Acad. Press, 1966, p. 199.
Steinberg M. Studies on the mechanism of physiological dominance in Tubularia.—J. ExptI Zool., 1954, v. 127. № 1, р. 1.
Tardent P. Regeneration in the Hydrozoa.—Biol. Rev., 1963, v. 38, № 3, p. 293.
Van de Vyver G. Etude du development embryonnaire de hydraires athecates (Gymnoblastiques) a gonophores. II, Formes a actinulas.—Arch. Biol., 1968, t. 79. p. 327.
Yamada M„ Konno K.., Kubota S. On an new Athccate hydroid, Fukaurahydra anthoformis n. gen. n. sp., from Northen Japan.—Proc. Japan. Acad., 19'77, v. 53, № 3, p.
0 комментариев