Атомы объединяются в молекулы благодаря химическим связям. Причем участвуют в образовании этих связей электроны, находящиеся во внешнем слое этих атомов. Существует несколько теорий, описывающих процесс связывания. Одна из них — теория валентных связей, в соответствии с которой связи между атомами образуются, когда атомы обмениваются электронными парами из перекрывающихся орбиталей. Другая — теория молекулярных орбиталей.
Такого рода приблизительные теории полезны, поскольку мы получаем простой, интуитивно понятный способ представления физических процессов. С другой стороны, современные компьютеры дают нам возможность с высокой точностью вычислить энергии связи, однако такие вычисления ничуть не приближают нас к пониманию того, что же происходит, когда атомы соединяются. Роль теорий как раз в том и состоит, чтобы дать нам это понимание.
В основе теории молекулярных орбиталей лежит представление о том, что электронная орбиталь в атоме описывается волновой функцией (см. Уравнение Шрёдингера). Теория объясняет, как при протекании химической реакции атомные орбитали преобразуются в молекулярные. Подобно большинству известных нам типов волн, волновые функции электронов в орбиталях претерпевают интерференцию. Оказывается, орбитали в молекулах можно, с хорошим приближением, представить как результат интерференции волновых функций атомов.
Например, рассмотрим, что происходит при взаимодействии двух атомных орбиталей соседних атомов. Если в области перекрывания орбиталей волновые функции претерпевают конструктивную интерференцию, электроны большую часть времени проводят между ядрами, притягивая атомы друг к другу. С другой стороны, если интерференция в области перекрывания деструктивная, электронная плотность между ядрами равна нулю, и между атомами возникает результирующая сила отталкивания. Таким образом, две атомные орбитали объединяются с образованием двух молекулярных орбиталей: одна стремится связать атомы (связывающая молекулярная орбиталь), а другая — оттолкнуть их (разрыхляющая молекулярная орбиталь). И их взаимодействие определяет, будет ли образована стабильная молекула.
Чтобы понять, как работает эта модель, попробуем разобраться, почему водород образует молекулу из двух атомов, а гелий — из одного. В образовании связи между двумя атомами водорода участвуют по одному электрону от каждого атома, а на низшей (связывающей) молекулярной орбитали как раз есть место для двух электронов. Электроны основное время находятся между ядрами, значит атомы притягиваются и молекула водорода может образоваться. У гелия же в образовании связи между двумя атомами участвуют четыре электрона, поэтому заняты как связывающая, так и разрыхляющая атомные орбитали. Численные вычисления показывают, что в этом случае будет преобладать эффект отталкивания, и, даже если молекулы гелия образуются, они будут крайне нестабильны. Поэтому молекула газа гелия состоит из одного ат
Похожие работы
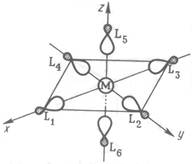
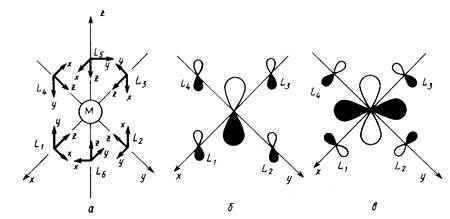
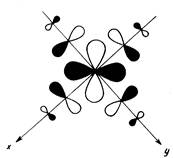
... Особенная и чрезвычайно широкая область координационных соединений металлов представлена пи-комплексами — соединениями, в которых центральный атом образует многоцентровые связи с лигандами в результате обобществления своих d-орбиталей с делокализованными пи-орбиталями лигандов. Прототипом пи-комплексов являются более простые алкеновые комплексы металлов, первый представитель которых — ...
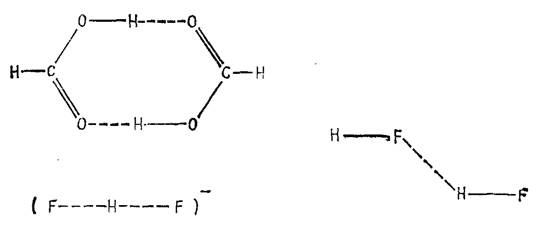
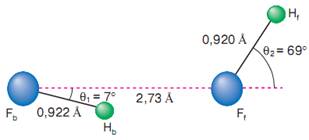
... В действительности геометрия двух компонентов, составляющих комплекс, немного отличается от их геометрии в изолированных состояниях [6]. Таблица 1.1 Энергии димеризации некоторых газофазных димеров с водородной связью [6] Димер Энергия димеризации, кДж/моль-1 (HF)2 29±4 (H2O)2 22±6 (NH3)2 19±2 (HCl)2 9±1 (H2S)2 7±1 1.3 Димер HF 1.3.1 Геометрическая ...
... (например, АЭС), с сельским хозяйством, с обезвреживанием промышленных отходов, охраной природы и др. История неорг. химии тесно связана с общей историей химии, а вместе с ней – с историей естествознания и историей человеческой цивилизации. Этапными для развития неорг. химии явились работы И. Берцелиуса, который в 1814 опубликовал таблицу атомных масс. А. Авогадро и Ж. Гей-Люссак открыли ...
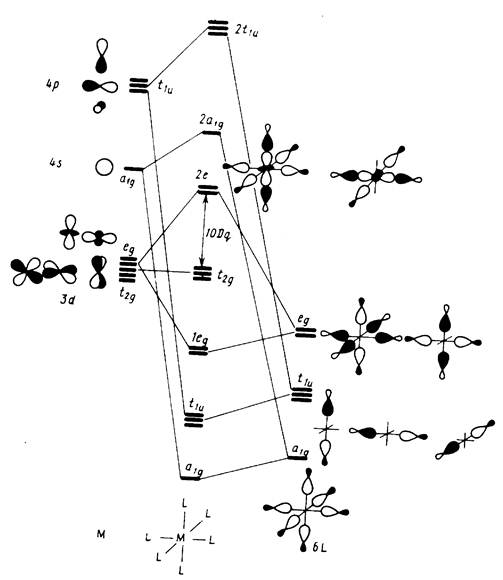
... , что одноэлектронный гамильтониан можно привести к форме, полностью независимой от состояний всех прочих электронов оболочки. Такой гамильтониан называется эффективным одноэлектронным, и он приводит к простейшей одноэлектронной схеме полуэмпирической теории МО ЛКАО. При таком подходе исследование ограничено и не может выйти за пределы набора орбиталей единственной «пробной» частицы, и лишь из их ...


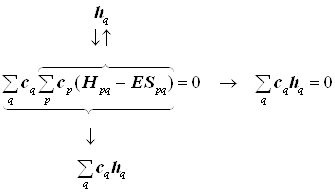
0 комментариев