Гомогенное химическое равновесие
Контрольная работа
Вариант№1
1. Рассчитайте сродство (-ΔrGt) железа к кислороду воздуха, Po2=2,0266*104Па при 1000К, если константа равновесия реакции 2Fe+O2![]() 2FeO при этой температуре равна 2,450*1020 Па-1 .
2FeO при этой температуре равна 2,450*1020 Па-1 .
2. Константа равновесия реакции H2+I2![]() 2HI при 717К равна 46,7. Определите кол-во разложившегося HI при нагревании 1моль HI при 717К.
2HI при 717К равна 46,7. Определите кол-во разложившегося HI при нагревании 1моль HI при 717К.
3. Вычислите при температуре 298К константу равновесия реакции CO+0,5O2=CO2 по стандартной энергии Гиббса.
Критерии оценивания
Данная к/р оценивается в 45 баллов. №1-10 баллов, №2-15 баллов, №3-20 баллов.
Наиболее характерные ошибки:
- использование неправильных размерностей величин;
- ошибки при выводе ур-ния Кс реакции;
- неправильное решение квадратного ур-ния и использование его отрицательных корней (для нахождения кол-ва моль прореагировавшего в-ва);
- ошибки при счёте;
- использование неверных справочных значений(необходимо использовать величины, выраженные в Дж/моль, Дж/моль*К или кДж/моль);
- следует учесть, что энтальпия реакции образования простых веществ равна 0;
- для расчета стандартной энергии Гиббса необходимо значение энтропии реакции перевести в кДж/моль;
- если реакция проводится в стандартных условиях, то необходимо использовать PO=0,101Мпа=101,3кПа.
Решение задач
№1.
2Fe+O2![]() 2FeO
2FeO
ΔG=-RTlnKp+RTПі(Pνіі исх.)
ΔG=-8,314*1000ln(2,450*1020)+8,314*1000ln(2,0266*104)= -390324-82447=-472,77 кДж/моль.
Ответ. (-ΔrGt)=472,77 кДж/моль.
№2
2HI![]() H2+I2
H2+I2
исх. 1моль 0 0
Реак. 2х х х
Равн. 1-2х х х
Кс=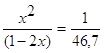
46,7x2=1-4x+4x2
42,7x2+4x-1=0
D=186,8
x1=![]() (моль)
(моль)
2x=0,227 (моль)
Ответ. Разложилось 0,227 моль HI.
№3
![]()
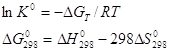
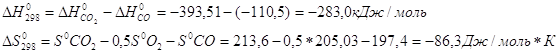
Все необходимые значения станд.![]() для CO2 , O2 и CO берутся из справочника физико-химических величин.
для CO2 , O2 и CO берутся из справочника физико-химических величин.
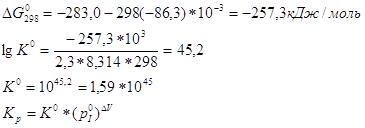
ΔV-приращение числа молей во время реакции.
Для реакции CO+0,5O2=CO2
ΔV=1-(1+0,5)= -0,5
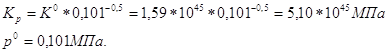
Ответ. ![]()
Индивидуальное задание
Вариант№5
1. По значениям изобарных потенциалов в справочнике [M.] определите константу равновесия при температуре 298К для реакции:
![]()
2. При окислении SO2 в SO3 в газовой фазе установилось хим. равновесие:
![]()
Как будет влиять на это равновесие увеличение давления и добавление азота, не участвующего в реакции? Ответ дать на основании термодинамич. соотнош. И пользуясь принципом Ле-Шателье.
3. Если нагреть 0,746 кг йода и 0,0162 кг водорода в закрытом сосуде ёмкостью 1 м3 до 693К, то при достижении равновесия образуется 0,721 кг йодистого водорода. Сколько йодистого водорода получится, если к исходной смеси добавить 0,1 кг йода и 0,005 кг водорода?
4. Процесс получения водяного газа идёт по ур-нию ![]() . При 1000К конст. равновесия равна 1,45. Какой состав должна иметь исходная смесь, сост. из водяного пара и СО, чтобы при 1000К равновесная смесь содержала по объёму 25%СО2 и 25%Н2 ?
. При 1000К конст. равновесия равна 1,45. Какой состав должна иметь исходная смесь, сост. из водяного пара и СО, чтобы при 1000К равновесная смесь содержала по объёму 25%СО2 и 25%Н2 ?
5. При Т=1396К и Р=1,0133*105 н/м2 степень диссоциации водяного пара на водород и кислород равна 0,567*10-4 , а степень диссоциации двуокиси углерода на окись углерода и кислород при тех же условиях -1,551*10-4. Определить на основании этих данных состав водяного газа, образующегося при указанной температуре из равных объёмов окиси углерода и водяного пара.
6. При температуре 1500К и давлении 0,1013 МПа степень диссоциации водяного пара ![]() =1,9*10-4. Выразить для реакции горения водорода
=1,9*10-4. Выразить для реакции горения водорода ![]() константу равновесия Кр через степень диссоциации водяного пара и вычислить Кр при 1500К.
константу равновесия Кр через степень диссоциации водяного пара и вычислить Кр при 1500К.
7. Для реакции ![]() определите Кр при 600К, если при 298К константа равновесия этой реакции равна 1,0*105.
определите Кр при 600К, если при 298К константа равновесия этой реакции равна 1,0*105.
Справочник [M.] –краткий справочник физико-химических величин. под ред. К.П.Мищенко и А.А.Равдия, М.,Госхимиздат, 1967г.
Критерии оценивания
Данное индивидуальное задание оценивается в 110 баллов.
№1,2 -10 баллов;
№4,6 -15 баллов;
№3,5,7 -20 баллов;
Наиболее характерные ошибки:
- использование неверных справочных данных;
- ошибки при выводе ур-ния Кс и Кр для исследованной реакции;
- ошибки при вычислении равновесной концентрации вещества;
- использование неверных корней квадратного уравнения(полученное значение корней квадратного уравнения необходимо сопоставлять с условием задачи, чтобы не получить отрицательные значения концентраций);
- ошибки при счёте;
- при расчёте по уравнению реакции необходимо учитывать коэффициенты, стоящие перед веществом;
- необходимо все единицы измерения выражать в СИ (как например, парциальное давление газов в н/м2);
- нужно использовать значения температуры процесса в К для расчёта ![]() ;
;
- ошибки могут быть при неверной трактовке уравнения Менделеева-Клапейрона (следует учесть число моль-n);
-следует отличать равновесные и неравновесные процессы и учитывать правильность их написания;
- справочные данные должны соответствовать необходимому в-ву, которое указано в условии задачи;
- ошибки также возникают при переводе моль в кмоль, кал в Дж.
Решение задач
№1
В справочнике физико-химических величин [M.], находим значения ![]() :
:
| Реакция | Знач. |
|
| -1577,46 -370,62 -3094,00 |
Используя уравнение:
![]()
Δn- изменение числа молей газообразного конечного и начального продуктов реакции.
Кр и парц. давления выражены в н/м2.
и ур-ние ![]() определим значение
определим значение ![]() реакции:
реакции:
![]()
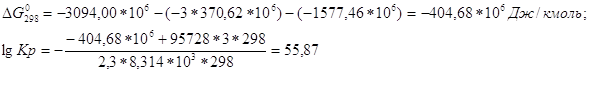
Ответ.lg Kp=55,87.
№2
В данной реакции ΔV=2-3=-1, поэтому выражение для Кх примет вид:
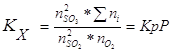
Из уравнения видно, что с увеличением давления р увеличивается константа равновесия Кх, поскольку Кр не зависит от давления. Увеличение Кх произойдёт за счёт увеличения числителя и за счёт уменьшения знаменателя. При отсутствии инертной примеси азота ![]() равна сумме молей веществ в равновесной смеси, которая при смещении равновесия изменяется незначительно, поэтому числитель увеличивается в основном за счёт увеличения
равна сумме молей веществ в равновесной смеси, которая при смещении равновесия изменяется незначительно, поэтому числитель увеличивается в основном за счёт увеличения ![]() ; одновременно должны уменьшатся
; одновременно должны уменьшатся ![]() и
и ![]() в знаменателе. Отсюда делаем вывод, что с ростом давления р в равновесной системе кол-во SO3 возрастает, равновесие сдвинется вправо, выход серного ангидрида увеличится. С увеличением кол-ва азота увеличивается сумма
в знаменателе. Отсюда делаем вывод, что с ростом давления р в равновесной системе кол-во SO3 возрастает, равновесие сдвинется вправо, выход серного ангидрида увеличится. С увеличением кол-ва азота увеличивается сумма ![]() , что влечёт за собой уменьшение
, что влечёт за собой уменьшение ![]() . Равновесие сдвинется влево, выход SO3 уменьшится.
. Равновесие сдвинется влево, выход SO3 уменьшится.
Принципа смещения равновесия Ле Шателье приводит с к следующим качественным выводам. Т.к. реакция образования SO3 из SO2 и O2 идёт с уменьшением объёма, то при увеличении давления, т.е. при сжатии реагирующей смеси, процессом ослабляющим сжатие, будет процесс, приводящий к уменьшению числа молекул в реагирующей смеси. Таким образом, при увеличении давлении реакция сдвинется слева на право и выход SO3 возрастёт.
Увеличение содержания азота при постоянном общем давлении ведёт к разбавлению реагирующей смеси, что равноценно уменьшению давления при отсутствии азота, т.е. приведёт к сдвигу равновесия справа налево, выход то равноценно уменьшению давления при отсутствии азота, ведёт к разбавлению реагирующей смесию числа молекул в реагирующей сSO3 уменьшится.
№3
Реакция протекает по уравнению:
H2+I2![]() 2HI
2HI
Константа равновесия этой реакции может быть выражена уравнением:
![]()
Для определения величины константы равновесия необходимо определить состав равновесной газовой смеси.
H2 и I2 реагируют с образованием HI, то в равновесной смеси исходное кол-во будет меньше, чем в исходной.
Исходная концентрация H2 и I2 :
![]()
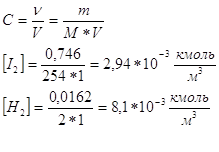
Конц. получ. HI в равновесной смеси:
![]()
Реакция протекает при постоянном давлении, тогда:
H2+I2![]() 2HI
2HI
1кмоль 1кмоль 2кмоль
(2,82кмоль 2,82 кмоль 5,64 кмоль)*10-3![]()
След., в равновесной смеси останется:
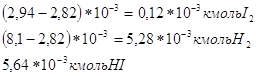
Данные вещества находятся в V=1м3, поэтому
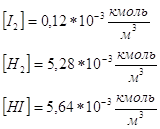
Используя полученные концентрации, определим константу равновесия:
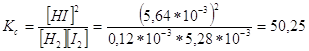
При добавлении к исх. смеси 0,100кг I2 и 0,005 кг H2 установ. равнов., но Кс не изменится. Обозначим новую равновесную конц.[HI]=x, тогда равнов. конц. [I2 ] и [H2] будут равны:
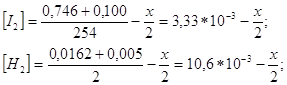
Получим уравнение:
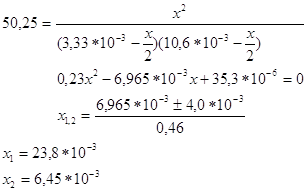
Х1 не имеет физ.смысла, т.к.конц. H2 и I2 будут иметь отрицательные значения.След., ![]() . Т.к. V=1м3, тогда
. Т.к. V=1м3, тогда
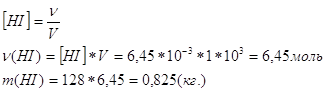
Ответ. ![]()
№4
Напишем содержание компонентов в процентах в равновесной смеси:
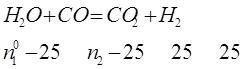
Для рассматриваемой реакции ![]()
Подставим содержание веществ (в молях) в выражение для константы равновесия:
![]()
откуда
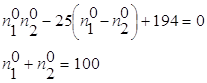
т.к. в ходе реакции число молей в системе не меняется. Исключая из этих уравнений ![]() , получим уравнение:
, получим уравнение:
![]()
Его решение даёт два действительных корня:![]() . Это означает, что в исходной смеси СО(г) по объёму может быть 36,1 или 63,9% и, соответственно, Н2О(г) 63,9 или 36,1%.
. Это означает, что в исходной смеси СО(г) по объёму может быть 36,1 или 63,9% и, соответственно, Н2О(г) 63,9 или 36,1%.
№5
Реакция образования водяного пара протекает по уравнению:
![]()
Константа равновесия равна:
![]()
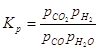
Диссоциация двуокиси углерода:
2CO+O2=2CO2
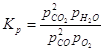
Диссоциация водяного пара:
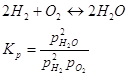
Равновесная концентрация кислорода в данных реакциях одинакова, тогда:
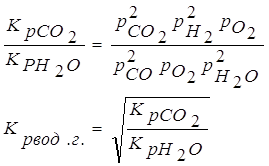
Выразим константу равновесия реакции диссоциации воды и двуокиси углерода через общее давление и степень диссоциации:
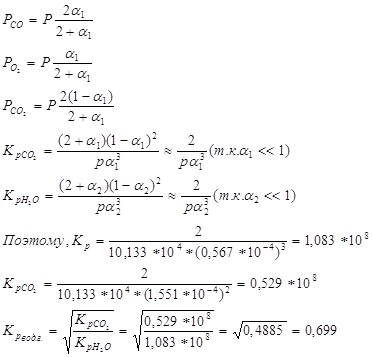
По условию начальные об. конц. воды и укиси углерода равны 50об.%, обозначим конц. образ. Н2 и СО2 в сост. равновесия x об.%, получим:![]()
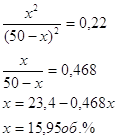
Состав водяного газа имеет вид:
![]()
Ответ. 15,95 об.%
№6
Напишем равновесные числа молей реагентов, выраженные через степень диссоциации ![]() :
:
![]()
n0 –начальное количество (число молей) водяного пара.
Константа равновесия этой реакции будет выражаться уравнением:
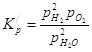
Выразим парциальные давления реагентов через общее давление Р, общее число молей ![]() и степень диссоциации
и степень диссоциации ![]() . Находим:
. Находим:
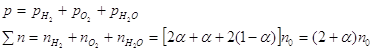
Парциальные давления реагентов вычисляются по уравнению ![]() :
:
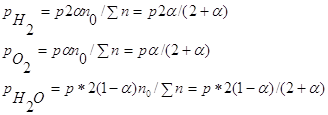
Таким образом, 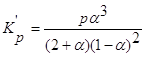
Т.к.![]() можно считать
можно считать![]() и
и ![]() , поэтому
, поэтому
![]()
Для обратной реакции, т.е для реакции горения водорода при 1500К, получим:
![]()
Ответ. ![]()
№7
Зависимость теплового эффекта от температуры опред. законом Кирхгоффа:
![]()
По справочнику [M] находим зависимость теплоёмкости веществ от температуры
| Вещество | Зависимость теплоёмкости от температуры, Дж/кмоль*град | |||
|
|
|
|
| |
|
| 44,14 | 9,04 | - | -8,54 |
|
| 29,10 | -0,84 | - | - |
|
| 27,63 | 5,02 | - | - |
|
| 30,12 | 11,30 | 2,01 | - |
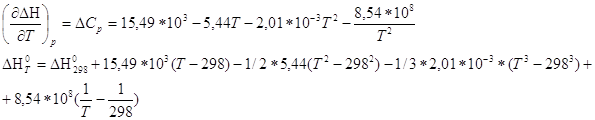
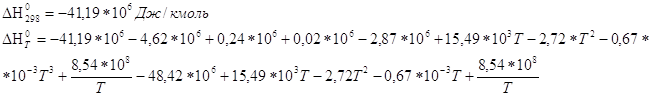
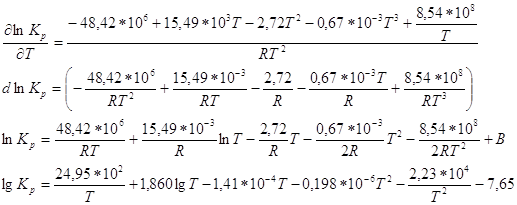
По уравнению находим Кр при 600К:
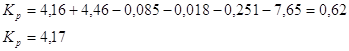
Ответ. ![]()
Тест
В вопросах 1-10 необходимо выбрать правильный ответ (он может быть только один).
1. При наступлении состояния химического равновесия протекают следующие процессы:
а) число молекул веществ, составляющих химическую систему увеличивается во времени при неизменных внешних условиях;
б) число молекул веществ, составляющих химическую систему остаётся постоянным во времени при неизменных внешних условиях;
в) число молекул веществ, составляющих химическую систему, уменьшается во времени при неизменных внешних условиях.
2. Для реакции: ![]() протекающей в изобарно-изотермических условиях, общее выражение для изменения энергии Гиббса имеет вид:
протекающей в изобарно-изотермических условиях, общее выражение для изменения энергии Гиббса имеет вид:
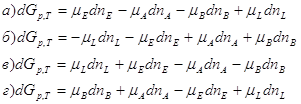
3. Для состояния химического равновесия характерно:
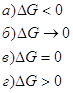
4. Уравнение изотермы химической реакции имеет вид:
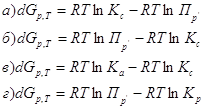
5. Для реакции: ![]()
Константа равновесия, выраженная через парциальные давления газов, записывается так:
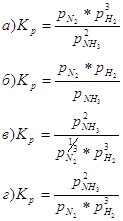
6. Какое из выражений соответствует уравнению изобары химической реакции:
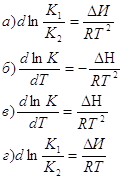
7. Стандартная константа равновесия связана с константой равновесия Кр соотношением:
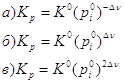
![]()
8. Для реакции в газовой фазе, протекающей без изменения числа молей (Δν=0) характерно:
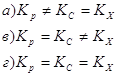
9. Связь между Кр и Кс химической реакции выражается уравнением:
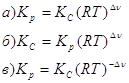
10. В общем виде Кх для реакции: ![]() можно выразить так:
можно выразить так:
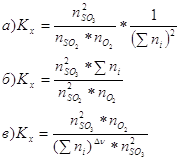
Правильные ответы:
| № вопроса | Ответ |
| 1. | б) |
| 2. | в) |
| 3. | в) |
| 4. | г) |
| 5. | г) |
| 6. | в) |
| 7. | б) |
| 8. | в) |
| 9. | а) |
| 10. | б) |
Каждый правильный ответ на один вопрос оценивается в 1 балл. В результате, ответив на 10 вопросов, можно получить 10 баллов.
В вопросах 11-20 необходимо установить соответствие. (например 1б, 2а,3г)-верный ответ может быть только один.
11. Из уравнения изотермы химической реакции ![]() видно, что величина и знак энергии Гиббса реакции зависят от Пр’ и Кр ( при Р=const, T=const), как:
видно, что величина и знак энергии Гиббса реакции зависят от Пр’ и Кр ( при Р=const, T=const), как:
1.ΔG<0
2. ΔG=0
3. ΔG>0
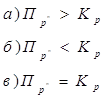
12. Для данных реакций укажите соответствующие им константы равновесия Кс:
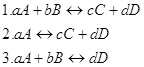
![]()
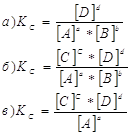
13. Определите зависимость между значением энергии Гиббса реакции и характером протекающего процесса:
1.ΔG<0 а) реакция достигла состояния
2. ΔG=0 равновесия;
3. ΔG>0 б) процесс необратимый
самопроизвольный;
в) процесс необратимый
несамопроизвольный
14. Определите изменение числа молей (Δν) для следующих реакций:
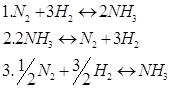
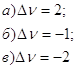
15. Для реакции : ![]() константа равновесия равна
константа равновесия равна ![]() , то при увеличении давления будут наблюдаться следующие процессы:
, то при увеличении давления будут наблюдаться следующие процессы:
1.Δν>0 а) Кх уменьшается
2.Δν<0 б) Кх не изменяется
3.Δν=0 в) Кх увеличивается
16. Определите Кх для реакции в идеальной и реальной газовой смеси:
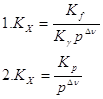
а) идеальная газовая смесь
б) реальная газовая смесь
17. Из приведённых уравнений выберите то, которое является изотермой, изохорой, изобарой химической реакции:
1. уравнение изохоры![]()
![]()
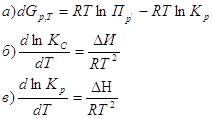
химической реакции
2. уравнение изобары
химической реакции
3. уравнение изотермы
химической реакции
18. Для данных уравнений реакции в смеси идеальных газов определите соотношение между значениями стандартной энергией Гиббса:
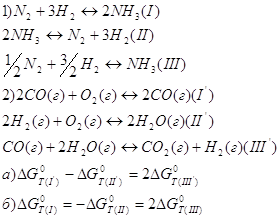
19. Укажите верное выражение для Кх, Кс и Кm при рассмотрении равновесия химической реакции в идеальном растворе:
![]()
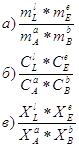
20. Установите, как будет влиять тепловой эффект реакции на константу и состояние равновесия химической реакции:
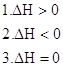
а) константа равновесия не изменится, и состояние равновесия останется неизменным;
б) равновесие сдвинется в сторону исходных веществ;
в) константа равновесия увеличится, и равновесие сдвинется вправо.
Правильные ответы
| № вопроса | ответ |
| 11. | 1б2в3а |
| 12. | 1б2в3а |
| 13. | 1б2а3в |
| 14. | 1в2а3б |
| 15. | 1а2в3б |
| 16. | 1б2а |
| 17. | 1б2в3а |
| 18. | 1б2а |
| 19 | 1в2а3б |
| 20. | 1в2б3а |
Каждый правильный ответ на 1 вопрос оценивается в 1 балл. Ответив на 10 вопросов можно получить 10 баллов. Если в ответе одна половина соответствия букв и цифр верна, а другая нет, то такой ответ не учитывается и оценивается в 0 баллов.
В вопросах 21-30 пропущено слово-ответ, его необходимо записать (ввести) в правильном числе и падеже.
21.
Похожие работы
... ; 2) при увеличении давления равновесие смещается в сторону образования меньшего числа молекул газа; 3) нагревание смещает равновесие в сторону эндотермической реакции, охлаждение – в сторону экзотермической реакции. Практическая часть Скорость химических реакций в гомогенной системе изучается на примере взаимодействия растворов серной кислоты и серноватистокислого натрия (тиосульфата): ...
... целесообразной также и автоматизация самого процесса получения экспериментальных данных. В следующей главе будет рассмотрена аппаратная часть комплекса для кинетических измерений. ГЛАВА 2. ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ КИНЕТИКИ БЫСТРЫХ РЕАКЦИЙ В РАСТВОРЕ Среди различных способов изучения кинетики быстрых реакций выделяется группа методов, отличающаяся некоторыми общими особенностями ...
... образования продуктов реакции равна скорости их превращения в исходные реагенты. Химическое равновесие является динамическим, то есть его установление не означает прекращения реакции. Признаки истинного химического равновесия: состояние системы остается неизменным во времени при отсутствии внешних воздействий; состояние системы изменяется под влиянием внешних воздействий, сколь малы бы они ни были ...
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...

0 комментариев