Навигация
Ассоциации иммуногенетической системы HLA с развитием туберкулеза
Федеральное агентство по образованию РФ
Государственное образовательное учреждение
высшего профессионального образования
Курсовая работа по иммунологии
на ТЕМУ: "Ассоциации иммуногенетической системы HLA с развитием туберкулёза"
Челябинск 2006
СОДЕРЖАНИЕ
Введение
Глава 1. Физиологическая роль главного комплекса гистосовместимости человека
Глава 2. Ассоциация туберкулёза с различными генетическими факторами
Глава 3. Персистентные бактериальные инфекции: интерфейс патогена и иммунная система хозяина
3.1 Персистентные микобактериальные инфекции
3.2 Выживание микобактерий
3.3 Выживание внутри макрофагов
3.4 Иммунный ответ на персистирующие микобактерии
Глава 4. CD-1 и CD-1-рестриктированные Т-клетки при инфекциях, вызванных внутриклеточными бактериями
4.1 Атигенпрезентующие молекулы
4.2 Презентация микобактериальных липидов группой I CD1 молекул
4.3 Внутриклеточная локализация CD1 молекул
4.4 Рецептор для транспорта АГ
4.5 CD1d и NКТ-клетки при инфекциях
4.6 αGalCer специфически активирует CD1d iNКТ-клетками
Глава 5. Отличительные частоты генотипа цитокинов среди канадских аборигенов и кавказских популяций
Глава 6. Ассоциация туберкулёза со специфичностями гена HLA-DR-B1 в различных регионах Тувы
Глава 7. Распределение антигенов комплекса HLA у больных туберкулёзом и здоровых лиц в татарской популяции
Заключение
Приложения
Список литературы
ВВЕДЕНИЕ
Туберкулез является проблемой мирового масштаба. По данным ВОЗ, одна треть населения мира инфицирована Mycobacterium tuberculosis. В 1998 году было зарегистрировано 8 млн. новых случаев клинического туберкулеза и 1,9 млн. смертей от заболевания. Ожидается, что к 2010 году в мире будет около 1 млрд. вновь инфицированных, более 200 млн. заболевших, а 70 млн. – умрет от туберкулеза. В России ежегодно инфицируется около 9 тыс. детей (что на порядок выше, чем в других развитых странах), а число больных в 1997 г. по сравнению с 1991 г. возросло в 2,5 раза.
Следует отметить, что не все индивиды после контакта с M. tuberculosis становятся инфицированными. Клинические признаки туберкулеза проявляются только у 10 % инфицированных. В настоящее время стало понятно, что развитие инфекции M. tuberculosis и клинический туберкулез обусловлено сложным взаимодействием между биологическими свойствами самого инфекционного агента, средовыми факторами и физиологической индивидуальностью человека.
У большинства людей сразу же после инфекции M. tuberculosis развивается эффективный иммунный ответ, ограничивающий распространение агента. Менее 10 % инфицированных, у которых развивается заболевание, имеют идентифицируемые факторы риска, такие как диабет, СПИД, пожилой возраст. У остальных заболевших развитие туберкулеза, по-видимому, обусловлено комплексных взаимодействием генетических и средовых факторов.
Для каждой популяции мира были обнаружены свои особенности в частотах антигенов HLA и характерные для данной популяции ассоциации с восприимчивостью (или резистентностью) к туберкулёзу лёгких. Поэтому задачей моей курсовой было исследование источников литературы по данной теме и сравнение результатов, полученных в разных опытах.
Глава 1. Физиологическая роль главного комплекса гистосовместимости человека
Регуляция иммунного ответа является одной из основных физиологических функций организма. Эта функция принадлежит генам главного комплекса гистосовместимости человека. При этом следует принять во внимание, что само это название отражает скорее историю открытия данной генетической системы, чем ее основную функцию. Дело в том, что история открытия первых продуктов генов главного комплекса гистосовместимости человека, называемых антигенами HLA (от Human leucocyte antigens), связана именно с появлением и развитием трансплантационной иммунологии, когда возникла необходимость подбора тканесовместимых пар донор и реципиент. Сегодня же мы знаем, что роль системы HLA в отторжении трансплантата является лишь одной из частных физиологических функций этой системы, а основная же ее функция — это регуляция иммунного ответа. В 80-x голах даже дискутировался вопрос о переименовании системы HLА в главный комплекс генов иммунного ответа человека, но учитывая, что старое историческое название давно укоренилось среди иcследователей, решено было не менять его.
По современным представлениям система HLA. обеспечивая регуляцию иммунного ответа, осуществляет такие важнейшие физиологические функций, как взаимодействие всех иммунокомпетентных клеток организма, распознавание своих и чужеродных, в том числе измененных собственных, клеток, запуск и реализацию иммунного ответа и в целом обеспечивает выживание человека как вида в условиях экзогенной и эндогенной агрессии [19].
Все многообразие указанных функций обеспечивается строением главного комплекса гистосовместимости.
Система HLA, открытая более 40 лет назад, по-прежнему остается одной из самых сложных, наиболее хорошо изученных и вместе с тем загадочных генетических структур в геноме человека.
Представления о строении системы HLA развивались и развиваются в течение всего периода ее изучения, однако, за последние годы произошел качественный скачок в развитии этой проблемы. Раньше, когда основным объектом исследовании могли служить только белки — антигены HLA, представления о комплексе генов HLA могли формироваться в основном на анализе косвенных данных, включающих изучение антигенов HLA в популяциях, в семейном анализе, реакциях, субстратом которых были антигены HLA, и т. д. Теперь благодаря развитию молекулярной генетики и иммунохимии появилась возможность не только проводить тонкий анализ антигенов HLA, но и изучить сами гены HLА.
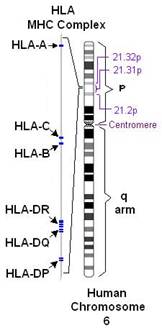
![]() Прежде чем перейти к непосредственному описанию строении генов HLA, следует отметить, что внедрение в исследования системы HLA молекулярно-генетических методов не только позволило конкретизировать представления о системе HLA, но и значительно расширило представления о ее полиморфизме, при этом были открыты многие новые аллели классов I, II и III, и общее количество только известных специфичностей HLA классов I и II увеличилось более чем в 6 раз. Аллельные варианты HLA классов I и II входят в несколько генетических локусов, Так, в классе I имеется 3 локуса HLA: А, В и С. Также к антигенам HLA класса относятся гены локуса MIC - МНС class I chain-related genes (MIC-A и MIC-B). Антигены MIC обладают способностью связывать пептиды и другие короткие лиганды. В настоящее время неясно, являются ли MIС-антигены более древними либо, напротив, происходят от типичных антигенов класса I.
Прежде чем перейти к непосредственному описанию строении генов HLA, следует отметить, что внедрение в исследования системы HLA молекулярно-генетических методов не только позволило конкретизировать представления о системе HLA, но и значительно расширило представления о ее полиморфизме, при этом были открыты многие новые аллели классов I, II и III, и общее количество только известных специфичностей HLA классов I и II увеличилось более чем в 6 раз. Аллельные варианты HLA классов I и II входят в несколько генетических локусов, Так, в классе I имеется 3 локуса HLA: А, В и С. Также к антигенам HLA класса относятся гены локуса MIC - МНС class I chain-related genes (MIC-A и MIC-B). Антигены MIC обладают способностью связывать пептиды и другие короткие лиганды. В настоящее время неясно, являются ли MIС-антигены более древними либо, напротив, происходят от типичных антигенов класса I.
В последнее время обнаружено, что антигены MIC-A участвуют в активации взаимодействия ТсR-молекулы МНС в развитии T-клеточно-опосредованной цитотоксичиости и активности НК-клеток, тем самым, в частности, играя роль в обеспечении противоракового иммунитета.
В классе II основными локусами HLА являются DR, DQ и DP, а также открытые в более позднее время DM, LMP и ТАР. Три последних локуса обеспечивают такие важнейшие функции, как процессииг и экспрессия антигенов HLA на поверхности клеток. Класс III включает в себя гены, кодирующие факторы комплемента, фактор некроза опухолей и некоторые другие.
Физиологическая функция аллелей и кодируемых ими антигенов HLA, относящихся к различным классам HLA, в значительной степени различается. Так, антигены HLA классов I и II принимают участие во взаимодействии между иммунокомпетентными клетками в процессе иммунного ответа. Но антигенам класса I принадлежит также и физиологическая функция обеспечения взаимодействия между всеми другими ядросодержащими клетками организма, вплоть до взаимодействия нейрон-синапс. Тем самым с помощью системы HLA обеспечивается целостное функционирование не только иммунной системы человека, но и организма в целом [19].
Что касается обеспечения развития самого иммунного ответа, то роль антигенов системы HLA здесь первостепенна. Дело в том, что именно молекулы антигенов HLA обеспечивают презентацию, т. е. представление иммунодоминантных пептидов, являющихся продуктом внутриклеточного протеолиза чужеродных антигенов, против которых и будет индуцирован, а затем и разовьётся иммунный ответ. Этой функции антигенов системы НLA способствует само строение ее молекул, которое, несмотря на выраженное различие в структуре молекулы антигенов HLA классов I и II, позволяет образовать на внешнем ее конце так называемую пептидсвязывающую бороздку, в которой и удерживается представляемый для распознавания пептид.
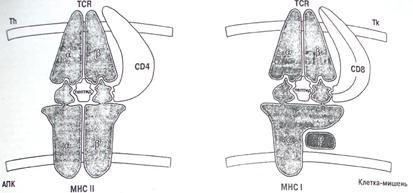
Общим для антигенов классов I и II является следующее. Антиген представляющая клетка осуществляет свое специфическое взаимодействие, представляя пептид в контексте собственной HLA-молекулы, идентичной таковой на клетке, воспринимающей информацию. Именно за открытие этого феномена, названного феноменом двойного распознавания, Цинкернагель и Догерти получили Нобелевскую премию. Действительно, этот феномен явился ключевым моментом и понимании основ физиологической регуляции иммунного ответа. Антигены HLA класса II обеспечивают взаимодействие антигенпрезентирующей клетки с Т-хелпером, а антигены HLА класса I - с Т-эффектором/киллером. Помогают им в этом различные молекулы корецепторы — CD4 для Т-хелперов и CD8 для Т-киллеров. Естественно, что различным явится и эффект этого взаимодействия. Так, распознавание пептидов в контексте молекулы HLA класса II ведет к формированию популяции Тх1 и Тх2-клеток, одни из которых индуцируют развитие гуморального иммунного ответа, а другие, явятся необходимым компонентом в индукции Т-киллеров. Что же касается антигенов гистосовместимости класса I, то Т-киллер, индуцированный против иммунодоминантного пептида, экспрессированного на поверхности клеток-мишеней в контексте антигенов HLA класса I, идентичного таковым, экспрессированным на Т-киллере, уничтожит их.
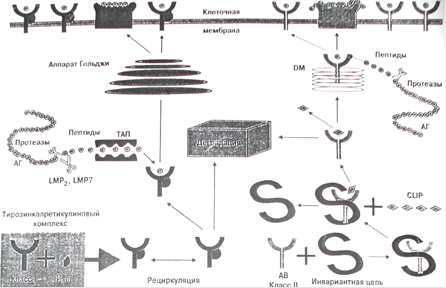
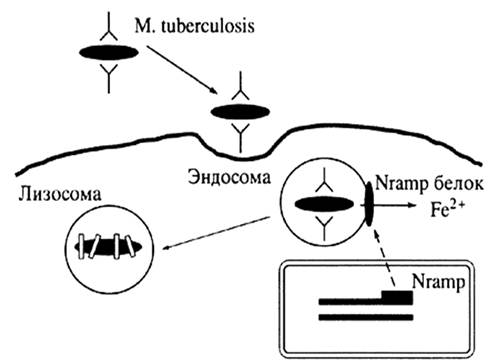
Молекулы МНС класса I синтезируются в цитозоле клетки, где до появления соответствующего пептида находятся в связи с так называемым тирозин-калретикулиновым комплексом (рис. 1). После связывания с пептидом происходят высвобождение и транспорт молекул HLA на поверхность клеток с участием кодируемых МНС "пептидных насосов" ТАР (от транспортеров, ассоциированных с антигенным процессингом).
В 1993 г было показано, что гетеродимеры TAPI и ТАР2 участвуют в окончательной сборке молекул антигенов класса I и презентации ими эндогенных пептидов. Молекулы, кодируемые геном TAP2, находятся в неравновесном сцеплении с антигенами HLA-DR и между генами ТАР1 и ТАР2 имеется высокая частота рекомбинаций. Установлено, что некоторые мутации в районе генов HLA-TAP ведут к потере презентирующей функции антигенов гистосовместимости класса I. Вполне возможно, что с нарушением антигенпрезентирующей функции TАР может быть связан высокий уровень ассоциации между аллелями гена ТАР1 и предрасположенностью к развитию такого аутоиммунного заболевания, как инсулинзависимый сахарный диабет. В го же время имеется исследование о том, что один из аллелей ТАР 1-локуса, а именно R659Q, для которого характерен дефект транскрипции РНК, выявляется на клетках мелкоклеточного рака легких. Наконец, имеются данные о том, что при синдроме Луи-Бар, характеризующемся наличием "голых Т-лимфоцитов", нарушение экспрессии антигенов НLA класса I связано именно с гомозиготным состоянием аллелей гена ТАР2.
В отличие от молекулы класса I обе цепи молекулы МНС класса II синтезируются в эндоплазматическом ретикулуме, откуда после их временного соединения с третьей инвариантной цепью они транспортируются в эндоцитарный компартмент, где они или встречаются и затем связываются с пептидом, или же (если этого не произошло) деградируют в лизосомах (рис. 1). После связи с пептидом, заменяющим инвариантную цепь, молекулы МНС класса II переходят на клеточную мембрану. Вытеснение пептидом инвариантной цепи молекул HLA класса II обеспечивают белки, кодируемые также системой HLA и названные HLA-DM. Эти белки катализируют замену "временного" пептида инвариантной цепи на специфический пептид.
Как указывалось выше, в целом связь между молекулами HLA и пептидами имеет много общего для антигенов HLA классов I и II. Однако и здесь имеются серьёзные отличия.
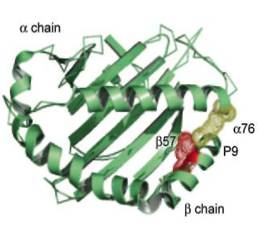
![]() Так пептид удерживается в связывающей складке молекулы HLA класса I как за счет связи его N- и С-концов с определенным мотивом "аллель-специфического" участка МНС, так и за счет связи боковых цепей пептида с боковыми карманами молекулы МНС. Длины пептидов, связывающихся с молекулой HLA класса I, — 8—10 аминокислот.
Так пептид удерживается в связывающей складке молекулы HLA класса I как за счет связи его N- и С-концов с определенным мотивом "аллель-специфического" участка МНС, так и за счет связи боковых цепей пептида с боковыми карманами молекулы МНС. Длины пептидов, связывающихся с молекулой HLA класса I, — 8—10 аминокислот.
![]() Пептиды, связывающиеся с молекулой HLA класса II, более гетерогенны - 9—25 аминокислот. Списывающая бороздка молекул HLА класса II в отличие от класса I "открыта" для связывания с двух сторон, что создает возможность большего полиморфизма в связях HLA + пептид. Более того, в молекуле класса II зоны связывания могут выходить даже за связывающую складку. Все это дает возможность "аккомодации" более широкого спектра пептидов к молекулам HLA класса II по сравнению с таковыми класса I.
Пептиды, связывающиеся с молекулой HLA класса II, более гетерогенны - 9—25 аминокислот. Списывающая бороздка молекул HLА класса II в отличие от класса I "открыта" для связывания с двух сторон, что создает возможность большего полиморфизма в связях HLA + пептид. Более того, в молекуле класса II зоны связывания могут выходить даже за связывающую складку. Все это дает возможность "аккомодации" более широкого спектра пептидов к молекулам HLA класса II по сравнению с таковыми класса I.
Переход исследований HLA на молекулярно-генетический уровень позволил по-новому взглянуть на физиологическую функцию системы HLA. Так, молекулы МНС приобретают стабильную форму и соответствующую трехмерную конфигурацию только после того, как в связывающий сайт ее складки встраивается пептид. Только после этого молекула МНС способна мигрировать на поверхность клетки, где она готова выполнить свои функции. Удаление пептида из пептидсвязывающей структуры МНС, экспрессированной на клеточной мембране, нарушает ее трехмерную конфигурацию, лишая возможности функционировать, и ведет к распаду. Комплекс МНС + пептид является чрезвычайно стабильным, очищается и кристаллизируется в единой структуре. Этот комплекс остается на поверхности клетки в течение нескольких недель, что позволяет многим "проходящим" Т-клеткам сканировать представляемый собственной молекулой МНС пептид. Наконец, каждый пептид связывается (и удерживается в складке) с инвариантным участком, характерным для каждого из аллелей молекулы МНС и имеющим определенный мотив аминокислотных остатков, участвующий и таком связывании. Таким образом, в связь с конкретным пептидом вовлекаются конкретные же участки антигенов — аллельные варианты молекул МНС, что по сути и является основой генетического контроля иммунного ответа.
Имеющаяся в настоящее время возможность анализировать аминокислотные последовательности всех аллельных вариантов антигенов HLA, включая участки, определяющие их специфичность, а также структуру пептидов, определяющих специфичность различных чужеродных агентов, включая болезнетворные, позволяет заранее предсказать соответствие тех или иных иммунодоминантных пептидов тем или иным участкам молекулы МНС. Таким образом, можно заранее предсказать генетический ответ или его отсутствие на тот или иной агент.
В свою очередь это даст возможность не только заранее решить вопрос о том, ответит ли данный индивидуум на вакцинацию против того или иного болезнетворного агента, но и предсказать, насколько этот ответ будет физиологичен, а, следовательно, позволит прогнозировать возможность развития ряда заболеваний аутоиммунного генеза (например, ревматоидный артрит и инсулинзависимый сахарный диабет), в генезе которых, возможно, лежит также комплементарность иммунодоминантных пептидов инфекционных агентов конкретным эпитопам аллелей НLА.
Экстремальный аллельный полиморфизм системы HLA является "мощным механизмом вариабельности и естественного отбора" человека как вида и позволяет ему противостоять постоянно эволюционирующему множеству патогенов. Доказательством этому в историческом плане может служить почти полное вымирание целых народов (в частности, американских индейцев в период открытия Америки), обладающих - как мы точно теперь знаем - весьма низким по сравнению с другими этническими группами полиморфизмом системы HLA.
В последние годы стадо известно, что полиморфизм системы HLA. помимо ранее установленного межрасового и межэтнического различия, имеет также и внутриэтнические различия. Следует отметить, что молекулярно-генетический уровень генотипирования позволяет сегодня вплотную приблизиться к пониманию генетически обусловленной физиологической резистентности человека к определенным заболеваниям на популяционном уровне.
Генам главного комплекса гистосовместимости, помимо вышеописанной физиологической функции генетического контроля специфического иммунного ответа, принадлежит ещё ряд важнейших физиологических функций. Описанию одной из них (генетическому контролю качества иммунного ответа) была посвящена работа, недавно опубликованная в Российском физиологическом журнале им. И. М Сеченова. Речь идет об ассоциированном с системой HLA контроле активности различных субпопуляций иммунокомпетентных клеток, что и свою очередь существенным образом сказывается на конечном уровне, т е. на качестве иммунного ответа человека. При этом, естественно, следует помнить, что эта функция является "вторичной" и реализуется только в случае, если организм человека генетически способен отвечать на данный агент. Предпосылкой развития данного направления можно считать предположение, выдвинутое W. Bodmer и J. Bodmer еще в 1978 г. о том, что на формирование HLA-профиля европеоидной популяции в значительной степени оказали влияние имевшие место в средние века эпидемии таких заболеваний, как чума, оспа, холера и т д. В результате этого среди выживших оказался значительный процент людей с определенными HLA-генотипами, в первую очередь с генотипом HLA-A1 В8 DR3 [10]. Этот генотип, как предположил W. Bodmer, обеспечивает более высокую резистентность к инфекционным заболеваниям и является на сегодняшний день генетическим маркером европеоидной популяции. Следует отметить, что это предположение было подтверждено на примере недавних вспышек брюшного тифа в Суринаме, когда среди выживших европеоидов значительный процент составили лица с гаплотипом HLA-A1 В8 DR3. Одновременно с этим W. Bodmer высказал справедливое предположение, что реализации этого эффекта могла быть связана только с ассоциациями между конкретными HLA-спецнфичностями и HLA-гаплотипами и иммунным ответом. Учитывая тот факт, что с одними и теми же гаплотипами HLA оказалась связана устойчивость к самым различным инфекционным агентам, логично было предположить, что подобного рода ассоциация с HLA может быть связана не только с самой генетически обусловленной отвечаемостью к конкретному инфекционному агенту, но и с теми звеньями иммунного ответа, которые принимают участие в его реализации, т. е. в конечном эффекте. Именно это в настоящее время и подразумевается под качеством иммунного ответа.
К настоящему времени достаточно хорошо известно, что между отдельными HLA-специфичностями и HLA-гаплотипами существуют положительные и отрицательные ассоциации с теми или иными показателями иммунного статуса, как то количество и функциональная активность клеток CD4+ CD8+, ЕКК, фагоцитирующей функции нейтрофилов и т. д. Следует, однако, отметить, что абсолютное число работ в этом направлении ранее выполнялось при изучении кавказоидной популяции.
В последние годы удалось показать, что ассоциированные с HLA показатели иммунного статуса могут различаться а разных этнических группах. Примером этого может быть исследование ассоциаций между отдельными параметрами иммунного статуса и HLA-специфичностями в двух этнических группах — русские (кавказоиды), буряты (ориенты).
Следует отметить, что исследование данной физиологической функции системы НLA, несмотря на то что оно стало развиваться относительно недавно, является весьма перспективным как в фундаментальном аспекте — в плане установления молекулярных механизмов указанных ассоциаций, так и в практическом, поскольку это направление имеет значение в плане прогноза возможности неблагоприятных воздействий (в том числе техногенных) окружающей среды на представителен различных этнических групп [19].
Глава 2. Ассоциация туберкулёза с различными генетическими факторами
Туберкулез вызывается микобактериями туберкулеза, медленно растущими кислотоустойчивыми бациллами. Воскоподобная клеточная стенка микобактерий, которая состоит из нескольких гликолипидов, таких как липоарбиноманнан и фосфоинозитолманнозид и длинной цепочки жирных кислот (50-80 атомов углерода) ответственны за медленный рост, кислотоустойчивость, устойчивость ко многим обычным антибиотикам и дезинфектантам. Отдельные вирулентные факторы не были описаны, но это может измениться, так как недавно был расшифрован геном микобактерий туберкулеза. Вдобавок, усилия должны быть направлены на определение функциональной нагрузки генома и белков Mycobacterium tuberculosis. Это связано с тем, что срочно необходима вакцина лучшая, чем ВЦЖ с её низкой эффективностью. Данная вакцина должна достигнуть сильного цитотоксического и воспалительного Т-клеточного ответа для уничтожения туберкулезных бацилл.
Понимание важной роли генетических факторов в развитии туберкулеза пришло в первую очередь из эпидемиологических и близнецовых исследований. Так, в нескольких работах было показано, что степень устойчивости к M. tuberculosis у человека коррелируется с регионом его происхождения – предки более предрасположенных к заболеванию индивидов чаще всего происходил из областей, где туберкулез не распространен. Кроме того, частота клинического туберкулеза особенно высока во время эпидемий в популяциях, ранее не встречавшихся с данной инфекцией, в частности, у американских и канадских индейцев.
Опубликованы исследования генов, ответственных за предрасположенность к туберкулезу у человека. Так, у жителей Камбоджи была показана ассоциация аллеля HLA-DQB1*0503 II с заболеванием. Во многих популяциях предрасположенность к проказе ассоциирована с HLA-DQB2. С проказой ассоциирован также полиморфизм в области промотора гена TNFA.
Показано, что с туберкулезом связаны три точечные замены в гене белка, связывающего маннозу (MBL). Причем частота этих вариантов была достаточно высока как у европеоидов, так и у африканцев и австралийских аборигенов.
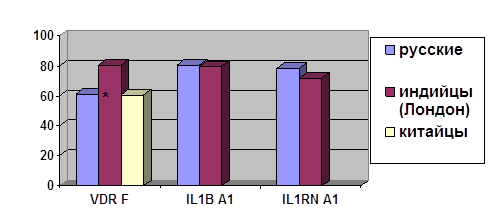
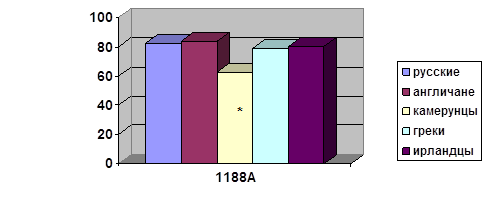
В последнее время получены доказательства связи туберкулеза с полиморфизмом гена рецептора к витамину D (VDR). Показаны ассоциации с туберкулезом полиморфизма генов, кодирующих интерлейкин-1β (ILIB) и его рецепторный антагонист (ILIRA). Ведутся исследования также и других генов, рассматриваемых как кандидаты на роль генов предрасположенности к туберкулезу, исходя из их функции (NOS2, TLR, NAT2, GST) [1].
Вместе с тем существуют четкие причинно-следственные отношения между редкими менделирующими иммунодефицитами по Т-клеткам или фагоцитам и тяжелыми формами туберкулеза. Пациенты с такими заболеваниями в значительной степени чувствительны к инфекции не только M. Tuberculosis, но и другими микроорганизмами.
На основании имеющихся на сегодняшний день данных сформулировано предрасположение о непрерывном спектре генетического контроля предрасположенности к туберкулезу у человека: моногенные формы – варианты с эффектом главного гена (олигогенные формы) – полигенная подверженность. Прогресс в молекулярно-генетических исследованиях предрасположенности к заболеванию будет, вероятно, возможен только при комплексном анализе. Возможно, на всех уровнях генетического контроля участвует один ген, имеющий редкие мутации, ответственные за менделирующие тяжелые фенотипы, относительно редкие варианты, обусловливающие основной эффект, и распространенные в популяциях полиморфизмы, в умеренной степени определяющие риск развития заболевания [8].
Поиск такого гена (генов) – на сегодняшний день актуальная задача. Кроме того, важным представляется изучение функционального полиморфизма известных генов-кандидатов туберкулеза в популяциях различного этнического состава с разной частотой заболевания.
Глава 3. Персистентные бактериальные инфекции: интерфейс патогена и иммунная система хозяина
Персистентные бактериальные инфекции включают в себя M. tuberculosis, Salmonella enterica и др., которые являются значительной проблемой для здоровья населения. Увеличивается количество лекарственно-устойчивых штаммов M. tuberculosis и S. typhi. M. tuberculosis и S. typhi вызывают заболевания, часто ассоциированные с HIV инфекцией.
Когда патогенный микроорганизм впервые инфицирует своего хозяина, обычно происходит драматическая активация врожденного и адаптивного иммунного ответов, что приводит к проявлению симптомов болезней. Адаптивная иммунная система хозяина обычно очищает организм от внедрившегося патогенна. Хотя некоторые патогенные бактерии способны поддерживать инфекционный процесс у млекопитающих даже при развитии воспаления, специфических антимикробных механизмов и сильного адаптивного иммунного ответа; в дальнейшем развивается персистентная инфекция. Микобактерии туберкулеза вызывают длительную инфекцию и могут служить причиной острых или хронических заболеваний; они также могут бессмысленно персистировать и реактивироваться в дальнейшем [3].
Персистентная колонизация бактериями происходит без видимых клинических проявлений. Хотя даже при отсутствии клинических симптомов инфекция несет некоторый риск для хозяина. Индивиды, зараженные микобактериями туберкулеза, рискуют при реактивации патогенна заразиться активной формой туберкулеза, которая опасна для жизни. Длительная персистенция бактерий в привилегированной нише хозяина – макрофагальной вакуоли – вызывает несколько фундаментальных биологических вопросов. Например, каков репликативный и метаболический статус бактерии во время бессимптомной персистенции, и как им так долго удается избежать действия иммунного ответа хозяина. Сейчас начинают понимать бактериальные и факторы хозяина, которые вовлечены во взаимодействие патоген-хозяин в течение персистирующей инфекции.
Возможность вызывать персистирующие инфекции – фундаментальный аспект взаимодействия между многими различными вирусными, бактериальными патогенами и их хозяином-млекопитающим.
Похожие работы
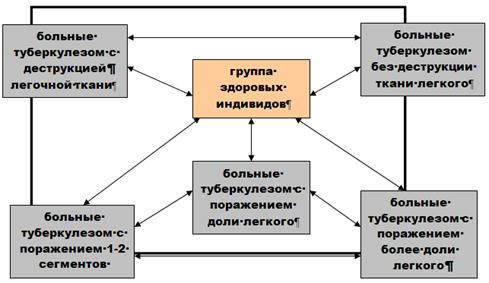
... их гаплотических сочетаний у больных туберкулезом представителей русской этнической группы Челябинской области При сравнительном анализе особенностей распределения специфичностей генов HLA II класса у больных туберкулезом и здоровых представителей русской этнической группы Челябинской области были установлены следующие факты: у больных туберкулезом и здоровых пациентов были выявлены различия в ...
... препаратов. Установлена связь полиморфизма 313A>G гена GSTP1 с изменчивостью уровня аланинаминотрансферазы (р=0,021). 7. Выявлены различия в структуре генетической подверженности к бронхиальной астме и туберкулезу по генам ферментативной системы метаболизма ксенобиотиков: гены GSTM1, CYP2E1 и CYP2C19 связаны с бронхиальной астмой и значимыми для заболевания качественными и ...
... о связи между частотой аллелей генов-кандидатов ТБ и особенностями распространения этого инфекционного заболевания. Выводы Выявлены особенности в распределении частот аллелей, изученных генов–кандидатов подвержености к туберкулезу, у русских жителей г. Томска по сравнению с другими популяциями мира. При сравнении с тувинцами показаны отличия в распределении генотипов и частот аллелей по всем ...
... фиброза и деформации лёгочной ткани. Фиброзно-кавернозный туберкулёз значительно хуже подвергается заживлению, чем кавернозный. Цирротический туберкулёз. Цирротический туберкулез лёгких характеризуется развитием в лёгочной ткани грубого, деформирующего орган склероза (цирроза), бронхоэктатических, посткавернозных типа кист полостей, эмзифематонных булл или каверн без признаков прогрессирования. ...
0 комментариев