Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования
Самарский государственный технический университет
Кафедра: «Органическая химия»
АМИЛОВЫЙ ЭФИР АЗОТИСТОЙ КИСЛОТЫ
Выполнил:
Руководитель:
Самара, 2007 г.
Содержание
Введение
Общие сведения
Практическое применение
Амилнитрит, как противоядие при отравлениях
Проблема нитратов и нитритов
Методика синтеза
Литературный обзор.
Неорганические нитриты
Органические нитриты
Нитросоединения
Способы получения нитросоединений
Реакции нитросоединений
Амины
Основность аминов
Методы получения
Реакции аминов
Диазо- и азосоединения
Реакции солей арилдиазония
Выводы
Список литературы
Введение
Общие сведенияАмилнитрит C5H11NO2 (изоамиловый эфир азотистой кислоты). Молекулярная масса (в а. е. м.): 117,15. Температура кипения (в °C): 104. Прозрачная желтоватая, легкоподвижная, весьма летучая жидкость фруктового запаха. Легко воспламеняется. Очень мало растворим в воде; смешивается во всех соотношениях со спиртом, эфиром, хлороформом. Плотность 0,8528 (20°C, г/см3).
Практическое применение Амилнитрит, как противоядие при отравлениях
Амилнитрит является основным представителем органических нитритов. Еще в конце 60-х годов прошлого века было обнаружено свойство этого соединения вызывать при вдыхании паров расширение кровеносных сосудов и купировать приступы грудной жабы (стенокардии). Уже в те годы было рекомендовано больным грудной жабой смачивать кусочек ткани несколькими каплями (5 – 10) амилнитрита и вдыхать его пары. Препарат начинал действовать через 30 - 60 с. Одновременно с прекращением загрудинных болей отмечалось покраснение лица и развивалась головная боль (в связи с расширением сосудов мозга). С появлением нитроглицерина и обнаружением его эффективности при стенокардии, амилнитрит в связи с выраженными побочными явлениями и кратковременностью действия, стали назначать реже. В настоящее время амилнитрит как антиангинальное средство практически не применяется. Лишь в исключительных случаях, при отсутствии других антиангинальных средств, он может быть временно использован для купирования приступов стенокардии. Вместе с тем амилнитрит, нашел применение как противоядие при отравлении синильной кислотой и ее солями, что объясняется способностью амилнитрита (и других нитритов) образовывать в крови метгемоглобин, связывающий ион СN, и предупреждать этим поражения тканевых дыхательных ферментов. Применяют амилнитрит путем вдыхания после нанесения его на носовой платок, небольшой кусок ваты или марли. Назначают взрослым по 2 - 3 капли, детям (старше 5 лет) - по 1 – 2 капли. Высшие дозы для взрослых (для вдыхания): разовая 0,1 мл (6 капель); суточная 0,5 мл (30 капель). При отравлениях цианидами его применяют повторно в указанных выше дозах (до общей дозы 0,5 – 1 мл). Противопоказания такие же, как для нитроглицерина. Форма выпуска: в обычных ампулах и в ампулах с ватно-марлевой оплеткой (по 0,5 мл). Вскрытие ампул сопровождается легким взрывом в связи с давлением паров, образующихся в ампуле при хранении и нагревании. Пары амилнитрита образуют с воздухом взрывоопасные смеси. Хранение: список Б. В запаянных ампулах в прохладном, защищенном от света месте.
Проблема нитратов и нитритовПроблема нитратов активно обсуждается общественностью нашей страны. Попробуем разобраться в этом вопросе и мы. Нитраты – соли азотной кислоты, например NaNO3, KNO3, NH4 NO3, Mg(NO3)2. Они являются нормальными продуктами обмена азотистых веществ любого живого организма – растительного и животного, поэтому «безнитратных» продуктов в природе не бывает. Даже в организме человека в сутки образуется и используется в обменных процессах 100 мг и более нитратов. Из нитратов, ежедневно попадающих в организм взрослого человека, 70% поступает с овощами, 20% – с водой и 6% – с мясом и консервированными продуктами. При потреблении в повышенных количествах нитраты в пищеварительном тракте частично восстанавливаются до нитритов (более токсичных соединений), а последние при поступлении в кровь могут вызвать метгемоглобинемию. Кроме того, из нитритов в присутствии аминов могут образоваться N-нитрозамины, обладающие канцерогенной активностью (способствуют образованию раковых опухолей). При приеме высоких доз нитратов с питьевой водой или продуктами через 4–6 ч появляются тошнота, одышка, посинение кожных покровов и слизистых, понос. Сопровождается все это общей слабостью, головокружением, болями в затылочной области, сердцебиением. Первая помощь – обильное промывание желудка, прием активированного угля, солевых слабительных, свежий воздух. Безопасная доля нитратов, допустимая суточная доза нитратов для взрослого человека составляет 325 мг в сутки. Как известно, в питьевой воде допускается присутствие нитратов до 45 мг/л. Рекомендуемое потребление продуктов питания, где используется питьевая вода (чай, первые и третьи блюда), примерно 1,0–1,5 л, максимум – 2,0 л в день. Таким образом, с водой взрослый человек может употребить около 68 мг нитратов. Следовательно, на пищевые продукты остается 257 мг нитратов. Исследования показали, что токсическое действие нитратов пищевых продуктов проявляется слабее, чем содержащихся в питьевой воде, примерно в 1,25 раза. Фактически безопасно с пищевыми продуктами потреблять 320 мг нитратов в сутки. Для овощей и фруктов установлены следующие значения предельно допустимых концентраций нитратов.
Предельно допустимые концентрации нитратов продуктах растениеводства
| Продукт | Содержание, мг/кг |
| Kартофель | 250 |
| Kапуста белокочанная ранняя | 900 |
| Kапуста бело-кочанная поздняя | 500 |
| Морковь ранняя | 400 |
| Морковь поздняя | 250 |
| Томаты | 150/300 |
| Огурцы | 150/400 |
| Свекла столовая | 1400 |
| Лук репчатый | 80 |
| Листовые овощи | 2000 |
| Перец сладкий | 200 |
| Kабачки | 400 |
| Дыни | 90 |
| Арбузы | 60 |
| Виноград | 60 |
| Яблоки, груши | 60 |
Основные источники пищевых нитратов – практически это исключительно растительные продукты. В животных продуктах (мясо, молоко) содержание нитратов весьма незначительно. Максимальное накопление нитратов происходит в период наибольшей активности растений при созревании плодов. Чаще всего максимальное содержание нитратов в растениях бывает перед началом уборки урожая. Поэтому недозрелые овощи (кабачки, баклажаны) и картофель, а также овощи раннего созревания могут содержать нитратов больше, чем достигшие нормальной уборочной зрелости. Кроме того, содержание нитратов в овощах может резко увеличиться при неправильном применении азотистых удобрений (не только минеральных, но и органических). Например, при внесении их незадолго до уборки.
Определение нитритов в растениях
Оборудование и реактивы. Лезвие, пипетка, дифениламин (кристаллический), серная кислота (конц.), раствор стрептоцида (таблетку 0,5 г растворить в 50 мл аптечной соляной кислоты), раствор антипирина (одну таблетку растворить в 50 мл аптечной соляной кислоты).
В результате участия ферментов и углеводов в растениях происходит восстановление нитратов до аммиака через нитриты:
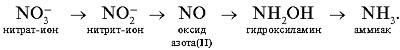
Образующийся аммиак взаимодействует с органическими кислотами, в результате получаются аминокислоты:
NH3 + органическая кислота ![]() аминокислота.
аминокислота.
Однако избыточное количество нитратов не восстанавливается и, попадая в организм человека, оказывает неблагоприятное воздействие на него. При попадании в желудочно-кишечный тракт человека нитраты превращаются в нитриты, которые вызывают отравление организма: появляется головокружение, снижается работоспособность, увеличивается содержание в крови молочной кислоты, холестерина, белков, блокируется гемоглобин, т.к. нитриты могут вступать во взаимодействие с ним, образуя метгемоглобин. В результате нарушается тканевое дыхание. При больших дозах развивается «синюха» и наступает смерть. Для проведения качественной пробы на присутствие нитритов в растениях на поверхность свежего среза наносят несколько кристалликов дифениламина и смачивают их двумя каплями концентрированной серной кислоты. Интенсивное синее окрашивание среза указывает на наличие большого количества нитритов, розовое – на небольшое их содержание и отсутствие окрашивания – на отсутствие нитритов или на очень незначительное их содержание. Для определения нитритов и нитратов можно воспользоваться доступными аптечными препаратами: антипирином (пирамидон) и стрептоцидом, которые выполняют функцию восстановителя, при этом появляется характерное окрашивание. Для исследования были взяты овощи, выращенные на собственном земельном участке и купленные в магазине. Обнаружено, что томаты, бананы, груши и огурцы не содержат нитратов и нитритов. Персики, капуста, редис, перец, яблоки содержали небольшое количество нитритов. А баклажаны, морковь и апельсины содержали очень большое количество нитритов. Значит, употреблять их в пищу нежелательно. Если в продукции присутствует избыток нитритов, зелень – петрушку, укроп, салат и другое – необходимо поставить, как букет, в воду на прямой солнечный свет. В таких условиях нитраты в листьях в течение 2–3 ч полностью перерабатываются и потом практические не обнаруживаются. После этого зелень можно без опасений употреблять в пищу. Свеклу, кабачки, капусту, тыкву и другие овощи перед приготовлением необходимо нарезать мелкими кубиками и 2–3 раза залить теплой водой, выдерживая по 5–10 мин. Нитраты хорошо растворимы в воде, особенно теплой, и вымываются из овощей. Варка овощей снижает содержание нитратов на 50 и даже 80%. Квашение, соление, маринование также уменьшают содержание нитратов в овощах. А вот сушка, приготовление соков и пюре, наоборот, повышают концентрацию нитратов. Владение информацией о накапливании нитратов в растениях и о превращении нитратов в нитриты и N-нитрозамины поможет вам правильно питаться и сохранить свое здоровье.
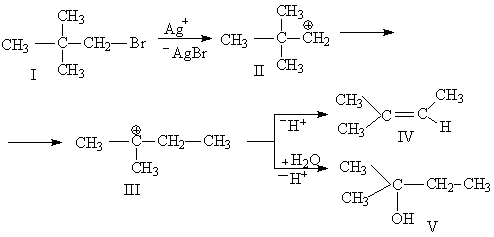
Методика синтеза![]()
Реактивы: амиловый спирт 77 г, нитрит натрия 38 г, серная кислота концентрированная 25 г, бикарбонат натрия 1 г, сульфат натрий, безводный 1 г, хлористый натрий.
Аппаратура.
Колба круглодонная, трехгорлая емк. 500 мл. Воронка капельная. Воронка Бюхнера. Прибор для перегонки в вакууме. Мешалка.
В круглодонную трехгорлую колбу, снабженную мешалкой, капельной воронкой и термометром, достигающим почти до дна колбы, помещенную в охладительную смесь, вливают раствор 38 г (0,55 моля) нитрита натрия в 150 мл воды. Когда температура раствора понизится до 0°, к нему по каплям приливают смесь 15 мл воды, 25 г (0,5 моля) концентрированной серной кислоты и 77 г (0,5 моля) амилового спирта. Колебания температуры не должны превышать ± 1°, приливание смеси к раствору нитрита длится около 2 часов. После 15-часового стояния отфильтровывают выделившийся осадок сульфата натрия, в делительной воронке отделяют слегка желтоватый слой амилнитрита от воды (примечание 1), промывают его раствором бикарбоната натрия, раствором хлористого натрия, сушат безводным сульфатом натрия и перегоняют в вакууме: т. кип. 29°/40 мм рт. ст., 104°/760 мм рт. ст.
Выход – 45 г (80% от теоретического).
Примечание
Вдыхание паров амилнитрита вызывает головные боли и боли в сердце. Его следует хранить в сухом и холодном месте не более двух недель с момента получения. Продукты разложения амилнитрита содержат воду, окислы азота, амиловый спирт и полимеры валерианового альдегида
Литературный обзор. Неорганические нитриты
Неорганические нитриты, соли азотистой кислоты HNO2. Используют прежде всего нитриты щелочных металлов и аммония, меньше – щелочно-земельных и Зd-металлов, Рb и Ag. О нитритах остальных металлов имеются только отрывочные сведения.
Нитриты металлов в степени окисления +2 образуют кристаллогидраты с одной, двумя или четырьмя молекулами воды. Нитриты образуют двойные и тройные соли, напр. CsNO2xAgNO3 или Ba(NO2)2•Ni(NO2)2•2KNO3, а также комплексные соединения, например Na3[Co(NO2)6].
Кристаллические структуры известны лишь для нескольких безводных нитритов. Анион NО2-- имеет нелинейную конфигурацию; угол ONO 115°, длина связи N—О 0,115 нм; тип связи М—NО2 ионно-ковалентный.
СВОЙСТВА НЕКОТОРЫХ НЕОРГАНИЧЕСКИХ НИТРИТОВ
Показатель KNO2 AgNO2 Ca(NO2)2 Ba(NO2)2
Сингония Моноклинная Ромбическая Кубическая Гексагональная
Темп. пл., °С 440 120 220 277
(с разд.) (с разл.)
Р-римость
в воде,г в 100 г 306,7 0,41 84,5 67,5
(20°С) (25°С) (18°С) (20°С)
Хорошо растворимы в воде нитриты К, Na, Ва, плохо – нитриты Ag, Hg, Сu. С повышением температуры растворимость нитритов увеличивается. Почти все нитриты плохо растворимы в спиртах, эфирах и малополярных растворителях.
Нитриты термически малоустойчивы; плавятся без разложения только нитриты щелочных металлов, нитриты остальных металлов разлагаются при 25-300°С. Механизм разложения нитриты сложен и включает ряд параллельно-последовательных реакций. Основные газообразные продукты разложения – NO, NO2, N2 и О2, твердые – оксид металла или элементный металл. Выделение большого количества газов обусловливает взрывное разложение некоторых нитритов, например NH4NO2, который разлагается на N2 и Н2О.
Характерные особенности нитритов связаны с их термической нестойкостью и способностью нитрит-иона быть как окислителем, так и восстановителем, в зависимости от среды и природы реагентов. В нейтральной среде нитриты обычно восстанавливаются до NO, в кислой окисляются до нитратов. Кислород и СО2 не взаимодействуют с твердыми нитритами и их водными растворами. Нитриты способствуют разложению азотсодержащих органических веществ, в частности аминов, амидов и др. С органическими галогенидами RX нитриты реагируют с образованием как нитритов RONO, так и нитросоединений RNO2.
Промышленное получение нитритов основано на абсорбции нитрозного газа (смеси NO + NO2) растворами Na2CO3 или NaOH с послед, кристаллизацией NaNO2; нитриты остальных металлов в промышленности и лабораториях получают обменной реакцией солей металлов с NaNO2 или восстановлением нитратов этих металлов.
Анализ нитритов на нитрит-ион основан на его восстановлении сплавом Деварда (50% Сu, 45% А1, 5% Zn) до NH3 и поглощении NH3 титрованными растворами кислот.
Нитриты применяют для синтеза азокрасителей, в производстве капролактама, в качестве окислителей и восстановителей в резинотехнике, текстильной и металлообрабатывающей промышленности, как консерванты пищевых продуктов. Нитриты, например NaNO2 и KNO2, токсичны, вызывают головную боль, рвоту, угнетают дыхание и т.д. При отравлении NaNO2 в крови образуется метгемоглобин, повреждаются мембраны эритроцитов. Возможно образование нитрозаминов из NaNO2 и аминов непосредственно в желудочно-кишечном тракте.
Органические нитритыОрганические нитриты, эфиры азотистой кислоты HNO2. Содержат одну или несколько групп —О—N=O, связанных ковалентной связью с атомом углерода органического радикала. Низшие алкилнитриты – газы, остальные – бесцветные или желтоватые жидкости, не растворимые в воде, смешиваются с обычными органическими растворителями. Органические нитриты более летучи, чем изомерные им нитросоединения. Физические свойства некоторых органические нитритов приведены в таблице.
СВОЙСТВА НЕКОТОРЫХ ОРГАНИЧЕСКИХ НИТРИТОВ
Соединение Т.кип, °С ![]()
![]()
Метилнитрит CH3ONO - 12 0,991
Пропилнитрит C3H7ONO 48,5 0,935 1,3604
Бутилнитрит C4H9ONO 77,8 0,8823 1,3768
Изобутилнитрит C4H9ONO 67 0,8699 1,3715
Изопентилнитрит (изоамил-
нитрит) (CH3)2CHCH3CH2ONO 99,2 0,8828 1,3918
Вращение вокруг связи О—N заметно заторможено (барьер вращения ∆G* 34 кДж/моль), поэтому s-циc- и s-транс-конформеры спектрально различимы. ИК спектр органических нитритов имеет характеристические полосы 1613-1625 и 1653-1681 см-1 (N=O) соотв. для s-цис- и s-транс-форм.
При комнатной температуре органические нитриты медленно разлагаются, на свету низшие органические нитриты могут взрываться. В кислой среде легко гидролизуются; это позволяет использовать органические нитриты в качестве мягких нитрозирующих агентов (для получения малостабильных солей диазония, дезаминирования алкиламинов, нитрозирования фенолов и СН-кислот и т.п.). Органические нитриты, имеющие активированный атом Н при β-углеродном атоме, могут отщеплять HNO2, например:
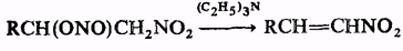
При действии N2O5 органические нитриты окисляются в нитраты, при действии гидразина или LiAlH4 восстанавливаются в соответствующие спирты. Органических нитриты, содержащие в молекуле более трех атомов С, претерпевают фотохимическую перегруппировку в нитрозосоединения (Бартона реакция), напр.:
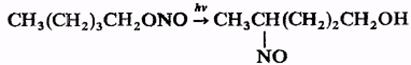
Реакция идет стереоселективно и используется для введения функциональных групп в неактивные участки сложных молекул, например, стероидов.
Получают органические нитриты взаимодействием спиртов с различными нитрозирующими агентами [NaNO2/H2SO4, NaNO2/Al2(SO4)3, оксиды азота, NOCl/пиридин, NOBF4] или взаимодействием алкилгалогенидов с солями HNO2 (наряду с нитросоединениями).
Органические нитриты – высокотоксичные соединения. Этил- и пентилнитриты учащают пульс, понижают кровяное давление, окисляют гемоглобин в метгемоглобин. Органических нитриты обладают сосудорасширяющим и спазмолитическим действием. Изопентилнитрит - противоядие при отравлении синильной кислотой и ее солями.
Органические нитриты – полупродукты в органическом синтезе.
НитросоединенияНитросоединениями называют производные углеводородов, в которых один или несколько атомов водорода замещены на нитрогруппу -NO2. В зависимости от углеводородного радикала, к которому присоединена нитрогруппа, нитросоединения делятся на ароматические и алифатические. Алифатические соединения различают как первичные 1°, вторичные 2 ° и третичные 3°, в зависимости от того к 1 °, 2 ° или 3° атому углерода присоединена нитрогруппа.
Нитрогруппу не следует путать с нитритной группой -ONO. Нитрогруппа имеет следующее строение:
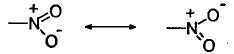
Наличие полного положительного заряда на атоме азота обусловливает наличие у нее сильного -1-эффекта. Наряду с сильным -1-эффектом нитрогруппа обладает сильным -М-эффектом.
Способы получения нитросоединенийНитрование углеводородов.

Ароматические нитросоединения получают, как правило, прямым нитрованием аренов и ароматических гетероциклических соединений. Нитрометан также может быть получен нитрованием метана.
Синтез нитросоединений из галогенуглеводородов
![]()
Синтез нитрометана из хлоруксусной кислоты
Нитрометан обычно получают из хлоруксусной кислоты по следующей схеме:
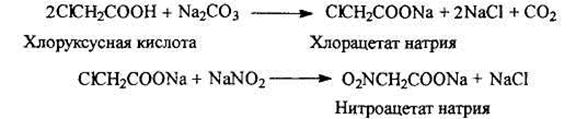
Таутомерия алифатических нитросоединений
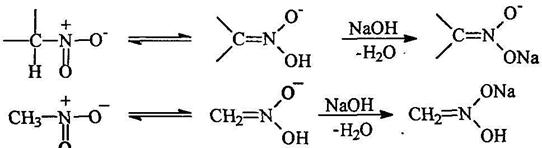
![]()
![]() Вследствие сильных электроноакцепторных свойств нитрогруппы а-атомы водорода обладают повышенной подвижностью и поэтому первичные и вторичные нитросоединения являются С-Н-кислотами.
Вследствие сильных электроноакцепторных свойств нитрогруппы а-атомы водорода обладают повышенной подвижностью и поэтому первичные и вторичные нитросоединения являются С-Н-кислотами.
Конденсация алифатических нитросоединений с альдегидами
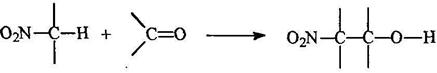
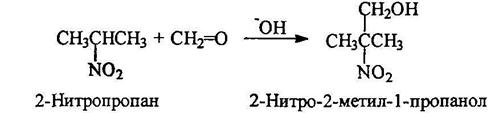
Практическое значение имеет триметилолнитрометан, получаемый из нитрометана и формальдегида:
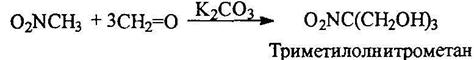
Ароматические нитросоальдегиды конденсируются с нитрометаном с отщеплением воды:
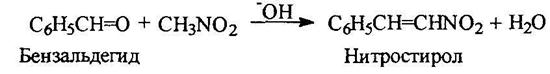
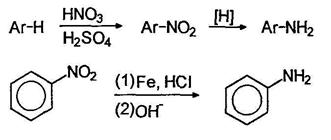
Восстановление нитросоединений.
Важнейшее практическое значение имеют реакции восстановления нитрогруппы в нитроаренах. В зависимости от рН среды и используемого восстановителя могут быть получены различные продукты. В нейтральной и щелочной среде активность обычных восстанавливающих агентов по отношению к нитро соединениям меньше, чем в кислой среде. Характерным примером может служить восстановление нитробензола цинком. В избытке соляной кислоты цинк восстанавливает нитробензол в анилин, в то время как в буферном растворе аммонийхлорида - в фенилгидроксиламин:
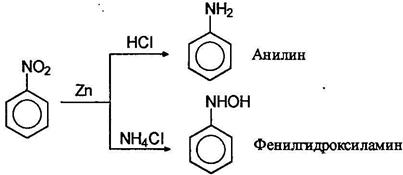
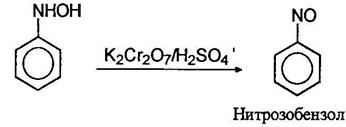
Фенилгидроксиламин далее может быть окислен до нитрозобензола:
Восстановлением нитробензола хлоридом олова (II) получают азобензол, а цинком в щелочной среде - гидразобензол; восстановлением спиртом в щелочной среде можно получить азоксибензол:
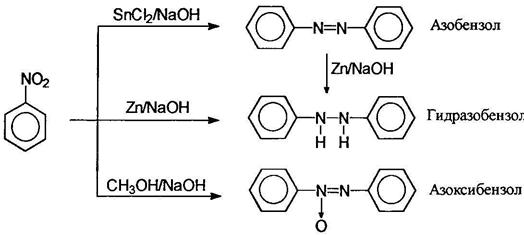
Азоксибензол получают обработкой нитробензола раствором щелочи в метаноле, при этом метанол окисляется в муравьиную кислоту. В кислой среде арилгидроксиламины подвергаются перегруппировке:
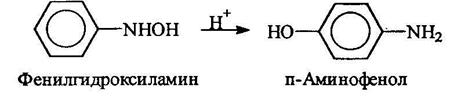
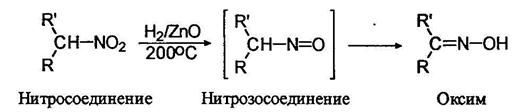
Известны методы неполного восстановления и нитроалканов:
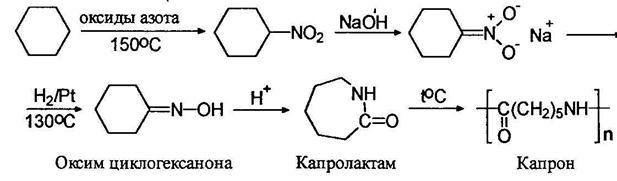
На этом основан один из промышленных методов получения капрона. Нитрованием циклогексана получают нитроциклогексан, который восстановлением переводят в оксим циклогексанона и далее с помощью перегруппировки Бекмана – в капролактам и полиамид – исходное вещество для приготовления волокна – капрона:
По систематической номенклатуре амины называют путем добавления приставки амин к названию углеводорода. По рациоальной номенклатуре их рассматривают как алкил или ариламины.
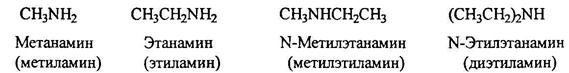
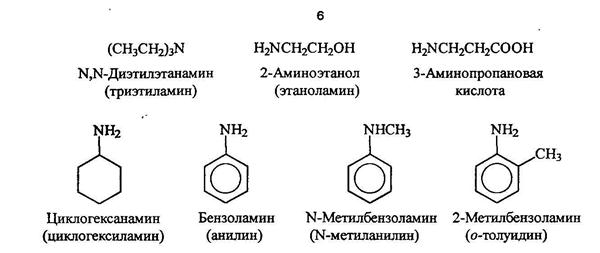
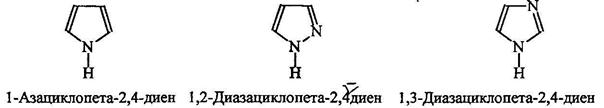
Гетероциклические амиы называют по соответствующему углеводороду вставляя приставку аза-, диаза- или триаза для обозачения количества атомов азота.
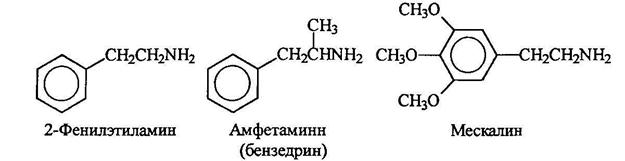
Аминами являются многие биологически активные соединения, обладающие, например, физиологическим и психологическим действием. Некоторые из них являются производными 2-фенилэтиламинна. Амфетамин является мощным стимулятором. Мескалин является галюциногеном.
Адреналин и норадреналин являются гормонами, поступающими в кровь, когда животные ощущают опасность. Адреналин вызывает повышение кровяного давления, учащение пульса и расширение подходов к легким. Норадреналин также повышает кровяное давление. Он участвует в передаче импульса от ондого конца нервного волокна к другому.
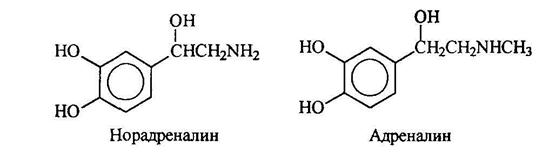
Серотонин поддерживает нормальный уровень умственной деятельности. Предполагается, что шизофрения связана с нарушением метаболизма серотонина.
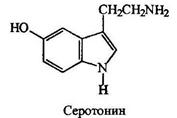
Аммиак и амины благодаря наличию на их атомах азота неподеленной пары электронов обладают нуклеофильными свойствами, т.е. предоставляют эту пару обедненному электронами атому углерода. Они способны предоставлять ее и протону, т.е. обладать основностью.
Все простейшие алифатические амины взаимодействуя с водой генерируют гидроксид-анион и, следовательно, окрашивают лакмус в синий цвет:
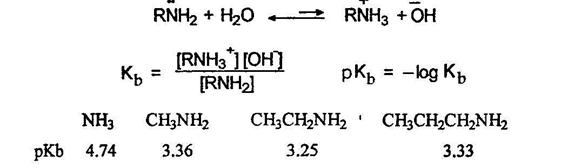
Подобно аммиаку амины при действии минеральных кислот превращаются в соли:
Основные свойства аминов обусловлены способностью свободных (неподеленных) электронов атомов азота присоединять протон.
![]()
Основность аминов тем выше, чем больше электронная плотность на атоме азота (чем выше электронодонорный характер атома азота).
Алифатические амины - более сильные основания, чем аммиак, поскольку алкильные группы обладают +1-эффектом. Их основность последовательно возрастает при переходе от первичных аминов ко вторичным, но несколько падает при переходе к третичным.
Нуклеофильность и основность аминов изменяются, как правило, симбатно: они уменьшаются с уменьшением электроннной плотности на атоме азота или при его пространственном экранировании и увеличиваются с увеличением электронной плотности на атоме азота или с увеличением его доступности. В качестве примера можно привестиосновность метиламинов. По силе основности они располагаются в следующий ряд:
![]()
Влияние пространственного фактора на основность и на нуклеофильность аминов наглядно демонстрируется сравнением свойств некоторых вторичных аминов.
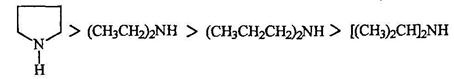
Анилин и другие ароматические амины являются слабыми основаниями. В отличие от алифатических аминов они не окрашивают водные растворы лакмуса в синий цвет, т.е. не генерируют гидроксид-анион при взаимодействии с водой. Анилин не образует солей с такими слабыми кислотами, как угольная, синильная, сероводород и др. Гидрохлорид анилина гидролизуется в воде, а сульфат анилина в воде не растворим.
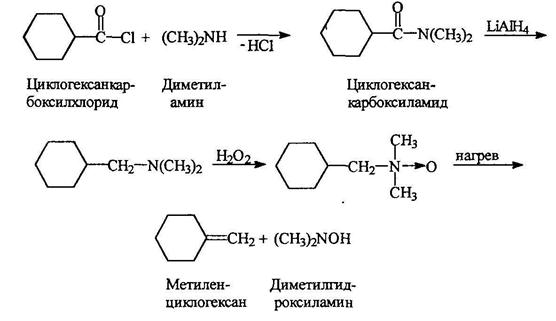
2.2. Методы полученияВосстановление нитросоединений
Восстановление ароматических нитросоединений в сочетании с нитрованием аренов является главным способом получения аминов.
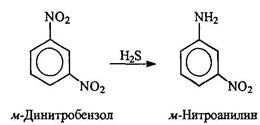
Использование в качестве восстановителя сероводорода позволяет восстанавливать одну из нитрогрупп в динитроаренах:
Аммонолиз галогенуглеводородов
Наиболее очевидный путь синтеза аминов заключается в алкилировании аммиака или амина алкилгалогенидами. Однако, при проведении этой реакции возможно многократное алкилирование: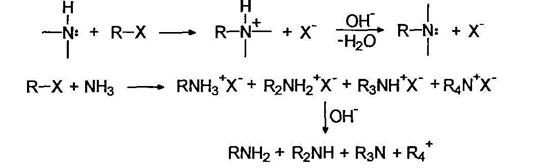
Недостатком этой реакции является то, что ее трудно остановить на какой-либо стадии. Первичные амины все же можно получать при использовании большого избытка аммиака, например:
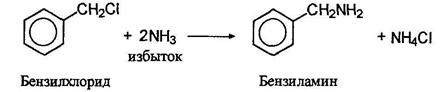
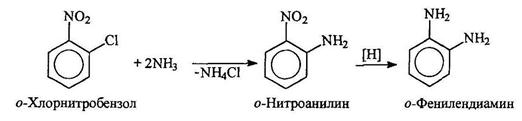
Ароматические амины тоже можно получать из арилхлоридов и аммиака, но для этого требуются очень жесткие условия. Однако, если в орто- и пара-положениях к хлору находятся такие сильно электроноакцепторные группы, как нитрогруппа, замещение происходит сравнительно легко, например:
Алкилирование аммиака и аминов спиртами. Так получают метиламины:
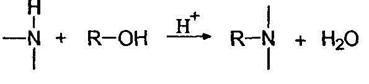
В промышленности алкилирование аммиака проводится первичными спиртами в присутствии хромита меди или окиси алюминия и других катализаторов при ЗОО°С. При этом образуется смесь аминов, которую далее разделяют ректификацией:
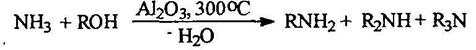
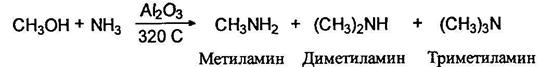
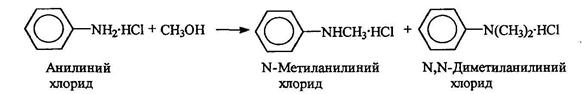
Алкилирование анилина обычно ведется спиртами в присутствии кислот, причем получают смесь N-алкил- и диалкиланилинов:
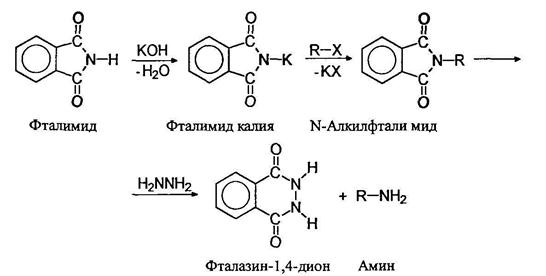
Фталимидный метод Габриэля.
Аммонолиз алкилгалогенидов и алкилирование аммика спиртами приводят к образованию смесей аминов, разделение которых представляет большую трудность. Индивидуальные первичные амины можно получать фталимидным методом Габриэля:
Восстановление алкилазидов
Восстановление алкилазидов, получаемых взаимодействием алкилгалогенидов с азидом натрия также приводит к образованию индивидуальных первичных аминов:
![]()
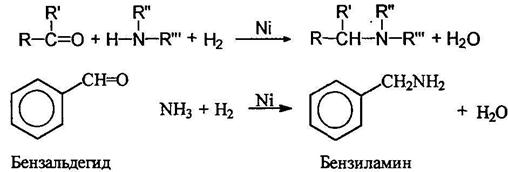
Восстановительное аминирование альдегидов и кетонов
Многие альдегиды и кетоны превращаются в амины при нагревании с аммиаком и водородом в присутствии катализатора гидрирования:
Расщепление амидов по Гофману
Реакция проходит по следующему механизму:
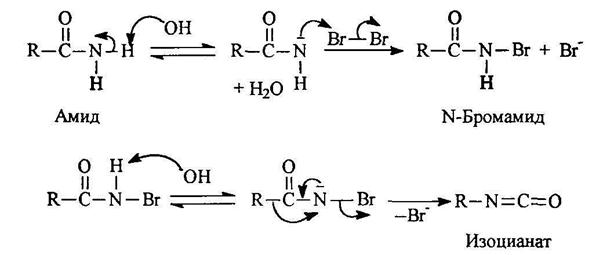
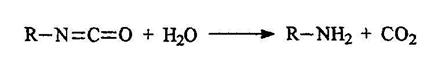
Первичные амины могут быть получены при действии на амиды брома в щелочной среде:
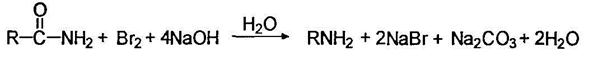
![]() Восстановление нитрилов
Восстановление нитрилов
Нитрилы при действии восстановителей или водорода в присутствии катализаторов превращаются в первичные амины:
![]()
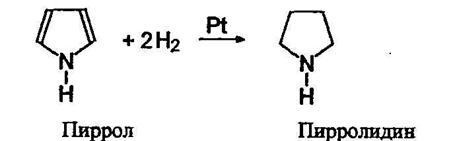
![]() Гидрирование азотсодержащих гетероциклических соединений
Гидрирование азотсодержащих гетероциклических соединений
При гидрировании пиррола образуется пирролидин;
Пиридин восстанавливается водородом в момент выделения в пиперидин:
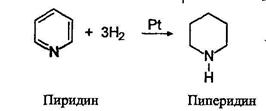
Алкилирование алкилгалогенидами (реакция Меншуткина)
Амины бурно реагируют с алкилгалогенидами, образуя смеси аминов и солей четвертичных аммониевых оснований:
![]()
Соли четвертичных аммониевых оснований переводят в щелочной среде в сами основания. Последние можно выделить, обрабатывая соль четвертичного аммониевого основания влажным оксидом серебра:

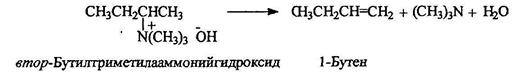
Термическое разложение четвертичных аммониевых оснований (по Гофману) приводит к образованию алкенов с крайним расположением двойной связи:
Окисление
Третичные амины могут быть окислены пероксидом вродорода или надкислотами в N-оксиды:
![]()
Реакция проводится в метаноле при обычной температуре. При нагревании N-оксиды расщепляются с образованием алкена и дизамещенного гидроксиламина:
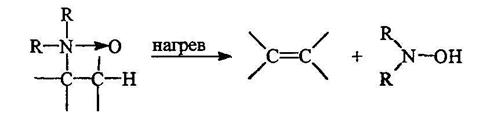
При этом метильные группы при атоме азота не затрагиваются. Этим пользуются при получении алкенов определенного строения (реакция Коупа):
Ацилирование
Подобно аммиаку первичные и вторичные амины реагируют с ацильными соединениями:
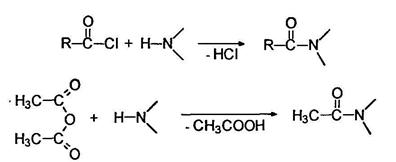
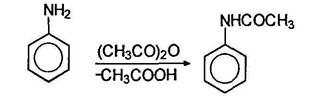
Так, при действии на анилин уксусного ангидрида образуется ацетанилид:
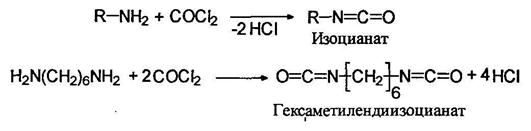
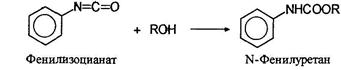
Изоцианаты
При действием на первичные амины фосгена (фосгенирование) образуются изоцианаты:
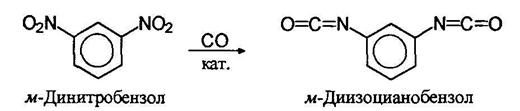
В последнее время изоцианаты стали получать действием на нитро со единения окиси углерода в присутствии катализатора:
При взаимодействии изоцианатов со спиртами образуются карбаматы или уретаны:
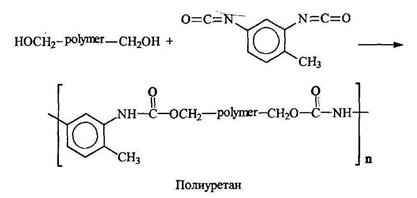
![]()
![]()
![]() Эластомерное волокно лайкра (спандекс) получают при переработке полиуретана, синтезируемого из гексаметилендиизоцианата и 1,4-бутандиола:
Эластомерное волокно лайкра (спандекс) получают при переработке полиуретана, синтезируемого из гексаметилендиизоцианата и 1,4-бутандиола:
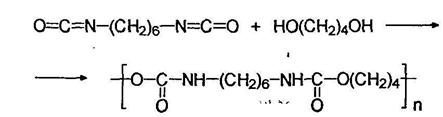
Образование шиффовых оснований
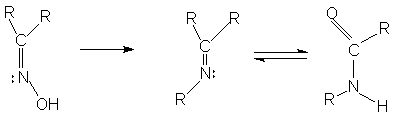
При слабом нагревании ароматических первичных аминов с ароматическими альдегидами легко получаются так называемые основания Шиффа. В такую же реакцию первичные амины вступают не только с альдегидами, но и с некоторыми кетонами. Общее название образующихся продуктов - азометины. При действии разбавленных кислот азометины подвергаются гидролизу.
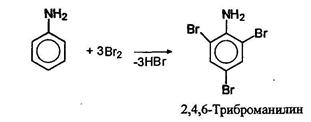
Замещение ароматических аминов в кольцо
Амино и алкиламиногруппы -NH2, -NHR и -NR являются сильными ориентантами первого рода. Активация бензольного кольца аминогруппой столь велика, что при галогенировании ароматических аминов атомы галогенов стремятся занять все орто- и пара-положения:
Ацетамидогруппа -NHCOCH3 также является ориентантом первого рода, хотя и более слабым, чем аминогруппы. Один атом галогена можно ввести, если аминогруппу предварительно проацилировать, а затем снять ацильную группу гидролизом:
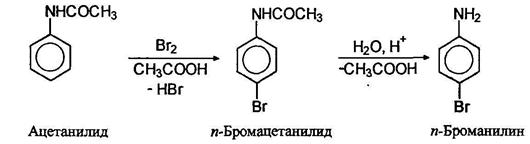
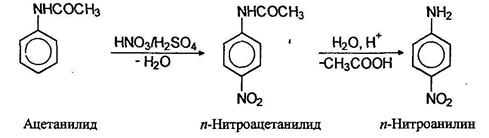
Нитрование аминов сопровождается их окислением, поэтому перед нитрованием аминогруппу защищают, переводя ее в амидную группу, полученный нитроамид далее гидролизуют в нитроамин:
![]() При сульфировании анилина концентрированной серной кислотой сначала образуется сульфат анилиния, при нагревании которого до 180-200°С образуется л-изомер анилинсульфокислоты (основной продукт), называемой сульфаниловой кислотой:
При сульфировании анилина концентрированной серной кислотой сначала образуется сульфат анилиния, при нагревании которого до 180-200°С образуется л-изомер анилинсульфокислоты (основной продукт), называемой сульфаниловой кислотой:
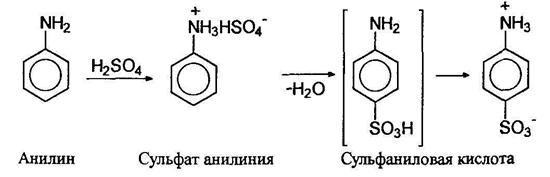
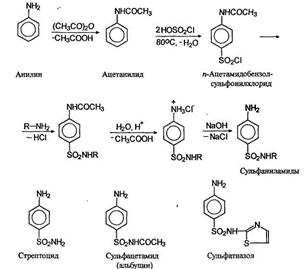
Молекула сульфаниловой кислоты включает и основание, и кислоту, и поэтому она существует в виде диполярного иона (цвиттериона). Сульфаниловая кислота имеет большое значение как элемент структуры сульфамидных препаратов, являющихся производными амида сульфаниловой кислоты (сульфаниламида). Их получают по схеме:
Взаимодействие аминов с азотистой кислотой
Азотистая кислота сама по себе при обычной температуре неустойчива, поэтому ее генерируют в момент проведения реакции из солей:
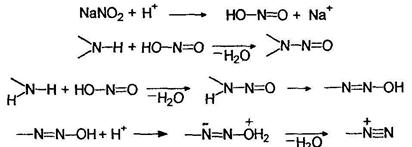
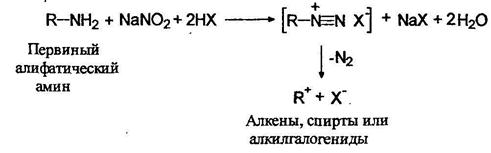
Первичные (1°), вторичные (2 °) и третичные (3°) амины как жирного, так и ароматического рядов различаются по своему поведению в реакциях с азотистой кислотой. Первичные алифатические амины реагируют с азотистой кислотой с образованием совершенно неустойчивых солей диазония, разлагающихся с выделением азота и образованием карбокатионов:
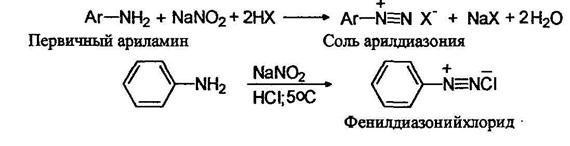
Первичные ароматические амины реагируют с азотистой кислотой с образованием относительно устойчивых солей диазония:
Названия солей диазония образуются путем добавления окончания диазоний к названию арильного радикала с указанием названия аниона. При взаимодействии вторичных алифатических и ароматических аминов с азотистой кислотой реакция останавливается на стадии образования нитрозоминов:
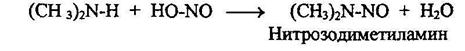
При нагревании ароматических нитрозоаминов они изомеризуются с переходом нитрозогруппы от азота к кольцу (перегруппировка Фишера-Хеппа):
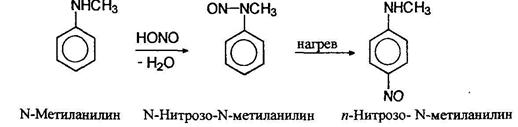
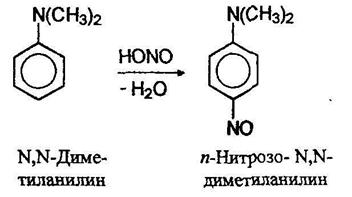
Третичные алифатические амины на холоде образуют с азотистой кислотой соли. Третичные жирноароматические амины при действии азотистой кислоты претерпевают реакцию замещения в кольцо с образованием окрашенных в зеленый цвет нитрозоариламинов:
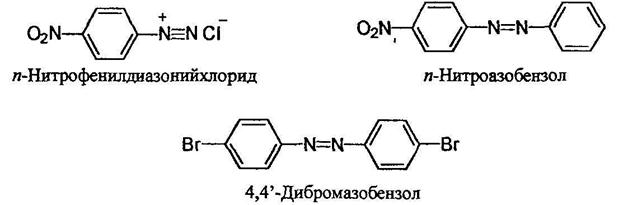
Органические соединения, содержащие в молекуле два атома азота, связанные кратной связью и не входящие в циклическую систему, могут относиться как к азо-, так и диазо соединениям. В случае диазосоединений два атома азота соединены лишь с одним углеводородным радикалом Ar-N2+Cr, а в случае азосоединений - с двумя Ar-N=N-Ar Азосоединения интенсивно окрашены. В зависимости от структуры молекулы они могут быть окрашены в интенсивно желтый, оранжевый, красный, синий или даже зеленый цвет. Примерно половина используемых в настоящее время красителей являются азокрасителями. Диазосо единения называют как соли арилдиазониев. Азосоединения называют двумя путями - как производные азобензола;
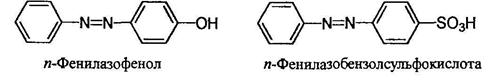
Более сложные соединения называют, рассматривая арилазогруппу Ar-N=N- как заместитель:
Все реакции солей арилдиазониев можно разделить на две группы: реакции с выделением азота и реакции без выделения азота.
Реакции замещения
Диазогруппа может быть замещена на разнообразные группы, это является одним из самых лучших путей введения функциональных групп в ароматическое ядро:
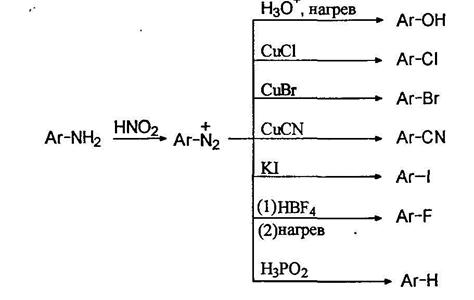
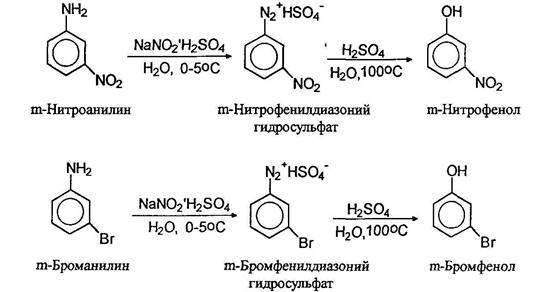
При нагревании водных растворов сульфатов диазониев происходит отщепление азота и образуются фенолы. Таким образом можно получать фенолы с различными заместителями в ароматическом кольце, например:
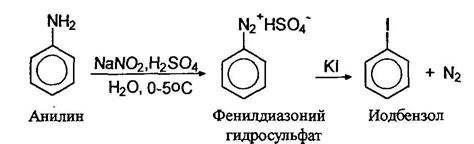
Соли арилдиазониев реагируют с иодидами натрия или калия образуя арилиодиды:
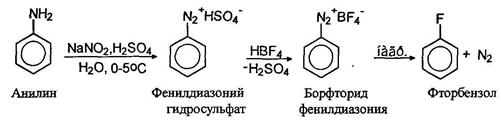
Для замещения диазогруппы на фтор к раствору соли диазония прибавляют тетрафторборную кислоту, при этом осаждается борфториды диазония, которые отфильтровывают, промывают и сушат. При осторожном нагревании борфториды диазония разлагаются с образованием арилфторидов:
Замещение диазогруппы на хлор и бром осуществляется действием на свежеприготовленный раствор соли диазония хлоридом или бромидом одновалентной меди. Считают, что реакция проходит по радикальному механизму (реакция Зандмеера):
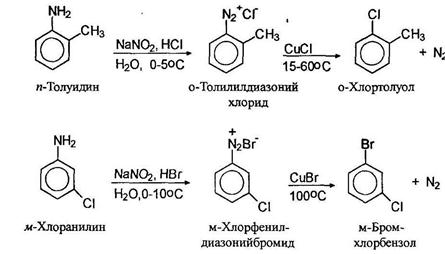
Замещение диазогруппы на нитрильную осуществляется также по реакции Зандмеера использованием цианида одновалентной меди.
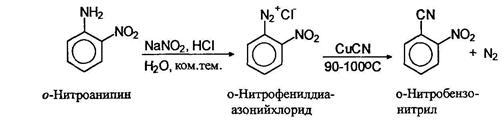
Вместо солей меди (I) в качестве катализатора можно использовать свежеосажденную порошкообразную металлическую медь.
Азосочетание
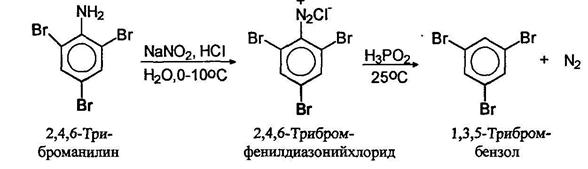
Замещение диазогруппы на водород можно осуществлять с помощью нескольких реагентов. Наиболее широкое применение получила фосфорноватистая (гипофосфористая) кислота. Соли диазония просто оставляют стоять в присутствии фосфорноватистой кислоты. С помощью этой оеакпии удаляют аминогруппу с ароматического кольца.
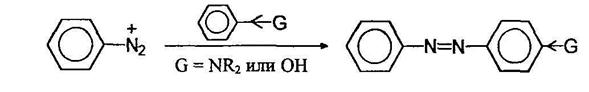
Азосочетанием получают красители. Окрашенные вещества поглощают из падающего на них видимого света некоторые лучи и отражают все остальные - цвет отраженных лучей и определяет окраску вещества. Чем длиннее цепь сопряжения, тем глубже окраска вещества.
Согласно одной из теорий цветности, окрашенное соединение должно содержать так называемую хромофорную группировку - это может быть, например, пара атомов соединенных двойной связью: ОС, C=N, N=N. Очень полезно присутствие в молекуле так называемой ауксохромной группировки, несущей одну или несколько подвижных электронных пар: при ее наличии цвет вещества углубляется. Пример такой групприровки диметиламиногруппа - N(CH3)2- Вот, к примеру, краситель метиловый оранжевый, очень широко применяемый как индикатор на кислоты. Его получают из сульфаниловой кислоты и К,К-диметиланилина:
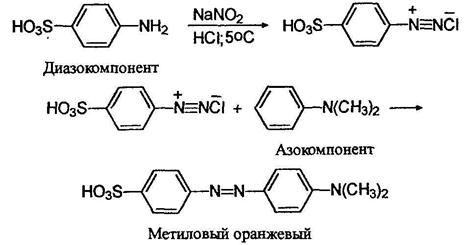
В молекуле этого красителя присутствует хромофорная двойная азот-азотная связь и ауксохромная диметиламиногруппа.
![]() Азокрасители, получаемые диазотированием сульфаниловой кислоты и последующим азосочетанием продукта с азакомпонентами в виде солей широко используются в качестве химических индикаторов.
Азокрасители, получаемые диазотированием сульфаниловой кислоты и последующим азосочетанием продукта с азакомпонентами в виде солей широко используются в качестве химических индикаторов.
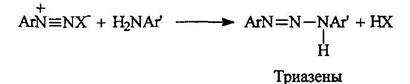
Триазены существуют в двух таутомерных формах:
В средах, близких к нейтральной, катионы диазония электрофильно атакуют неподеленную пару электронов азота первичной аминогруппы. Образующиеся при этом аминоазосоединения называют триазенами.

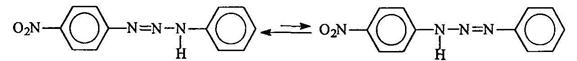
Равновесие смещено в сторону образования триазена, в молекуле которого протон находится у более основного атома азота, т. е. связанного с более электронодонорным радикалом:
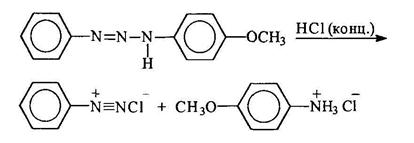
При действии минеральных кислот триазены расщепляются. При этом если триазен несимметричный, расщепление происходит таким образом, что отщепляется амин, являющийся более сильным основанием, а из "азофрагмента" образуется соответствующая соль диазония:
Список литературы
1. "Справочник химика" т.2, Л.-М.: Химия, 1964 стр. 418-419.
2. Бандман А.Л., Волкова Н.В. и др. Вредные химические вещества. Неорганические соединения элементов V–VIII групп. Справочное издание. Под ред. В.А.Филова и др. Л.: Химия, 1989, 592 с
3. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия. – М.: Высш. шк., 1973. - 623 с.
4. Препаративная органическая химия. Изд. 2-е, М., Госхимиздат, 1964.
5. Мельниченко Г.Ф., Кирсанова В.Ф., Биткова Н.П. Выращивание экологически чистой овощной продукции: томаты, перец, баклажаны. Благовещенск, 1993, 62.
6. Богословский Б.Н., Щитова Э.П. Опыты по химии с экологической направленностью. Благовещенск, 1993, 27 с..
7. Терней А. Современная органическая химия: В 2 т. - М.: Мир, 1981. - Т.1 - 670 с; Т.2 - 615 с.
8. В. Ф. Травень. Органическая химия. Том 1. – М.: Академкнига, 2004, - 708 с.
Похожие работы
... на фармакологический эффект, усложняет процесс изыскания новых Л В. Тем не менее современные методы исследования позволили определить предпосылки решения этой важной проблемы. 7 Предпосылки создания новых лекарственных веществ Изыскание новых ЛВ осуществляют различными путями. Ведущим направлением являются исследования в области модификации структуры известных природных БАВ. Одним из ...
... и закрепление знаний учащихся; - умение наблюдать химические явления; - развитие интеллектуальных способностей и формирование абстрактного мышления. [4] 3. Дидактические подходы при изучении темы «Молекулярные перегруппировки» Дидактика – область педагогики, разрабатывающая общую теорию образования и обучения и занимающаяся содержанием образования, закономерностями процесса обучения, ...
... и, конечно же, за многими другими, которые будут получены, — будущее. В этом направлении и работают многие НИИ и исследователи. Аспекты поиска новых лекарств, изыскание новых лекарственных веществ состоит из трех основных этапов: химический синтез, установление фармакологической активности и безвредности (токсичности). Такая стратегия поиска с большой затратой времени, реактивов, животных, труда ...
... . Из других дневных транквилизаторов вы должны знать препарат мебикар. По химической структуре он является производным бициклических бисмочевин. Изучен и внедрен препарат сотрудниками нашей кафедры фармакологии. Препа-рат обладает прекрасным транквилизирующим эффектом, не оказывая снотвор-ного и мышечнорасслабляющего действия, не вызывает каких-либо значитель-ных побочных эффектов (горький вкус - ...
0 комментариев