Навигация
Прямое воздействие галогенов на ароматические углкводороды
1. Прямое воздействие галогенов на ароматические углкводороды.
Галогены могут реагировать с ароматическим углеводородом тремя путями:
а) присоединяться к двойным связям бензольного кольца;
б) замещать водородный атом бензольного конца с образованием галогенарила;
в) замещать водородный атом в алкильной группе боковой цепи с образованием арилалкилгалогенида.
При действии на ароматические углеводороды галогенов (хлор, бром) на холоду в присутствии катализаторов происходит замещение водородных атомов в ядре с выделением гелагеноводородов:
FeCl3
C6H6 + Cl2 → C6H6Cl + HCl
Катализатором при этом обычно является хлорид или бромид железа (ІІІ). В качестве катализаторов могут быть также использованы хлориды других металлов, такие, как AlCl3, SbCl3, SbCl5, а также иод.
Роль катализатора заключается в активации (поляризации) галогена, который осуществляет электрофильное замещение в бензольном ядре. В присутствии FeCl3 хлорирование идет, например, по схеме:
.. .. ..
FeCl3 + :Cl::Cl: ↔ FeCl-4 + Cl:+
۠۠۠ ۠ ۠۠۠۠۠ ۠ ۠ ۠۠
C6H6 + Cl+ → C6H5Cl + H+;
H+ + Cl2 → HCl + Cl+ и т. д.
В боковую цепь можно ввести галоген в отсутствии катализаторов на свету или при нагревании. Механизм замещения в этом случае радикальный. Для толуола эти превращения могут быть выражены схемой:
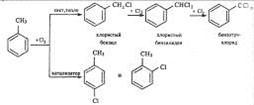
Галогены относятся к заместителям первого рода, и потому при галогенировании бензола второй атом галогена вступает преимущественно в n-положение к первому. Однако галогены в отличие от других заместителей первого рода затрудняют замещение (по сравнению с бензолом).
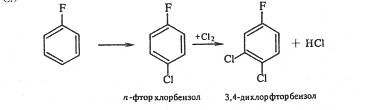
При хлорировании n-фторхлорбензола третий атом галогена вступает в о-положение к хлору, а не к фтору. Следовательно, решающее влияние на порядок замещения оказывает индукционный эффект галогена (о-положение к атому фтора имеет большой положительный заряд, так как –IF > -ICl):
2.Замена аминогруппы галогеном через промежуточное образование диазосоединений. Этот способ позволяет получать любые галогенпроизводные, в том числе и фторпроизводные:
Cu2Cl2
───→ C6H5Cl + N2
HONO + HCl KI
C6H5NH2───→ C6H5N2Cl ────→ C6H5I + KCl +N2
Cu2Br2
───→ C6H5Br + Cu2Cl2 + N2
[C6H5N2]BF4 → C6H5F + N2 + BF3
2.2 Адамантан
Структурные особенности адамантана определяют его необычные физические и химические свойства. Адамантан имеет самую высокую для углеводородов температуру плавления, равную 269°С, и плотность, равную 1,07 г/см3. Он термически устойчив в отсутствии кислорода при нагревании до 660°С. При давлении 20 килобар и температуре 480°С и выше он постепенно графитизируется. Адамантан исключительно стоек к агрессивным химическим средам и не взаимодействует с перманганатом калия, хромовой и концентрированной азотной кислотой даже при повышенной температуре.
В Таблице 1 показана зависимость выхода адамантана от применяемого катализатора.
Таблица 1. Результаты жидкофазной изомеризации ТМНБ в адамантан
| Условия реакции | Выход адамантана, % |
| BF3, HF, 23 ат Н2, 50°С | 73 |
| SbF5, HF, 120°C, 5 ч | 47,2 |
| А1С13, Н2О | 43,2 |
| А1С13, НС1,40 ат Н2, 120°С | 40 |
| А1С13, НС1, трет-С4Н9Сl | 40 |
| BF3, HF | 30 |
| AlCl3, HBr | 15 |
| AICl3 | 15 |
| А1С13 | 15–20 |
| А1Вr3, трет-С4Н9Вг | 25–30 |
Изомеризация ТМНБ в адамантан проводится по схеме:
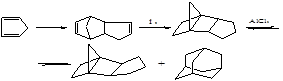
К дальнейшей перегруппировке в адамантан по пространственным соображениям способен только эндо-изомер, а его равновесная концентрация составляет около 0,5 масс. %.
В кинетическом отношении изомеризация эндо-ТМНБ – одна из самых медленных перегруппировок насыщенных углеводородов в этих условиях: геометрическая изомеризация ТМНБ (перегруппировка Вагнера-Меервейна) протекает быстрее примерно в 10000 раз.
Этот способ синтеза стал основой для промышленной технологии адамантана. Легкость такой перегруппировки объясняется, высокой термодинамической стабильностью адамантана, поэтому обработка всех известных изомеров C10H16 кислотами Льюиса неизбежно приводит к этому полициклическому каркасному углеводороду.
Синтез адамантанкарбоновых кислот
Для получения кислот ряда адамантана широко применяют реакцию Коха-Хаафа. В качестве исходных веществ используют адамантан, 1-бром- , 1-гидроксиадамантан, а также нитрат 1-гидроксиадамантана.
Адамантан -1-карбоновая кислота получена при взаимодействии 1-бром- или 1-гидроксиадамантана с муравьиной кислотой в серной кислоте или адамантана с муравьиной или серной кислотой в присутствии третбутилового спирта.
Показано,что максимальный выход адамантан-1-карбоновой кислоты достигается при соотношении AdOH :HCOOH:H2SO4 = 1:1:24. Выход уменьшается при недостатке муравьиной кислоты.
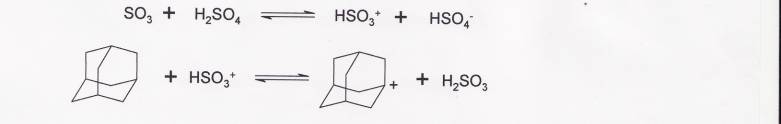
Адамантан-1-карбоновая кислота может быть получена из адамантана в 20%-ном олеуме. Предполагают, что реакция протекает через образование адамантильного катиона
![]()
Для получения карбоновых кислот из адамантана используют его реакцию с СО2 в серной кислоте или олеуме (автоклав ,90-160ºС). При этом образуется смесь адамантан-1-карбоновой и адамантан-1,3-дикарбоновой кислоты в соотношении 1:6.
Синтез (1-адамантил)уксусной кислоты из 1-бром или 1-гидроксиадамантана и дихлорэтилена осуществляют в 80-100%-ной H2SO4 в присутствии BF3 при 0-15ºС. 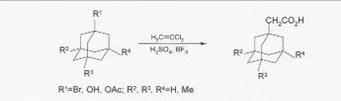
При взаимодействии адамантана и его производных с трихлорэтиленом в присутствии 90%-ной серной кислоты образуются соответствующие α-хлоруксусные кислоты.
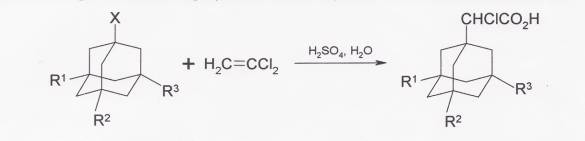
3-алкиладамантан-1-карбоновые кислоты получают из алкиладамантанов в серной кислоте в присутствии третбутилового спирта и 95%-ной муравьиной кислоты.
Нитраты адамантана.
Реакция адамантана с избытком 96-98 %-ной азотной кислоты приводит к 1-нитроксиадамантану в качестве основного продукта реакции 1. 3-динитроксиадамантану.
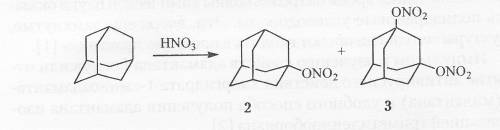
Адамантан со смесью азотной и уксусной кислот взаимодействует с меньшей скоростью, чем с азотной кислотой, и максимальный выход нитрата 80 % достигается за 3 часа. Единственным побочным продуктом реакции является адамантол-1.
Изучение поведения адамантана вазотной кислоте и ее смеси с уксусной кислотой позволило предложить мехагизм образования 1-нитроксиадамантана, включающий стадию генерации адамантильного катиона.
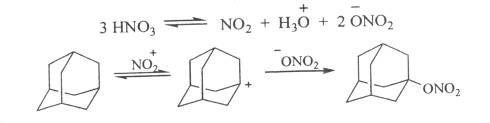
Синтезировать тринитрокси- и тетранитроксипроизводные непосредственно из адамантана не удалось. Соответствующие нитраты были получены нитрованием спиртов смесью азотной кислоты с уксусным ангидридом.
Условия проведения реакции и выход продуктов в реакции 1-R-адамантанов с азотной кислотой
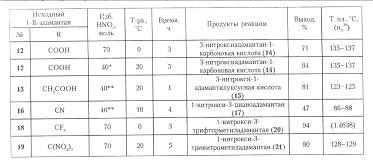

Способ получения нитратов ряда адамантана отличаетя простотой, высоким выходом и экономичностью, поэтому он представляет альтернативу методам получения функциональных производных с использованием бром- и гидроксиадамантанов.
В связи с этим, изучены реакции нитроксипроизводных адамантана и разработаны удобные способы получения арбоновых кислот, спиртов, аминов и других функциональных производных адамантанового ряда.
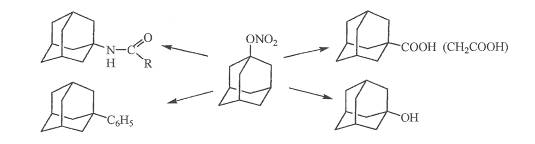
В синтезе адамантанкарбоновой и адамантандикарбоновой кислот выход составляет 94-96 %.
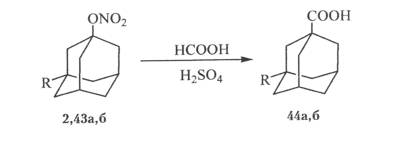
На основе нитрата адамантана был разрабтан способ получения адамантанкарбоновой кислоты через стадию получения 1-гидроксиадамантана. Этот метод получения адамантанкарбоновой кислоты, обеспечивающий высокое качество целевого продукта и экологическую чистоту процесса,был внедрен на АО “Олайнфарм” в производстве “ремантадин”.
3. Обсуждение результатов
Таким образом, в литературном обзоре были рассмотрены различные способы получения галогензамещенных адамантанкароновых кислот, но для синтеза 1-окси-3адамантанкарбоновой кислоты (такого задание на данный курсовой проект) мы выбираем метод получения данного соединения из адамантанкарбоновой кислоты
+ 2НNO3 → + HNO2 + H2O
Данный метод был выбран, потому что он обуславливает наиболее высокий выход и сам процесс синтеза наименее трудоемкий (по сравнению с другими способами получения), а также его легко выполнить в лабораторных условиях.
4. Экспериментальная часть
4.1 Реагенты и оборудование
Азотная кислота, d = 1,5;
Адамантанкарбоновая кислота;
Олеум
+ 2НNO3 → + HNO2 + H2O
Трехгорлая колба, магнитная мешалка, термометр, воронка Бюхнера, колба Бунзена.
4.2Методика эксперимента
К 63 мл (1.5 моль) 98-100%-ной азотной кислоты приливают 2.5 мл олеум (d=1.883) при 30-35º С присыпают 18 г (0.1 моль) 1- адамантанкарбоновой кислоты. Реакционную смесь выдерживают. 1 г при 40º С, охлаждают: выливают в лед. Выпавший осадок отфильтровывают иполучают 21.5 г (89%) нитрата 3-окси-1-адамантанкарбоновой кислоты.
Тпл = 146º С (ацетон)
5. Выводы
1. В данной курсовой работе были рассмотрены данные по синтезу карбоновых кислот алифатического, ароматического и полициклического ряда.
2. На основе анализа литературных данных для выполнения курсового проекта, а именно для синтеза нитрата 1-окси-3-адамантанкарбоновой кислоты, был выбран метод синтеза из адамантанкарбоновой кислоты.
3. В результате проведенного опыта: нитрат 1-окси-3-адамантанкарбоноваой кислоты был синтезироан с выходом 89 % (сырой продукт). Температура плавления соответствует литературным данным.
6.Библиографический список
1. Петров А. А., Бальян Х.В., Трощенко А.Т. Органическая химия. – СПб: Иван Федоров, 2002. – 624 с.
2. H. Stetter, M. Schwarz, A. Hirschhorn Chem/ Ber? 1959,92, №7. Р. 667-672
3. H/ Stetter, J. Mayer Chem. Ber, 1959,92, №7. Р. 667-672.
4.И.К. Моисеев, Н.В. Макарова, М.Н. Земцова. Синтез адамантанкарбоновых кислот//Успехи химии,1999,68,№12. С 1114-1115.
5. Юдашкин А.В., Стулин Н.В., Моисеев И.К. Бифункциональные производные адамантана, Самара 1991.
6. Земцова М.Н. Методические указания к выполнению курсовой работы по органической химии, Самара 2004.
0 комментариев