Навигация
Скорость химической реакции
РАЙОННАЯ НАУЧНАЯ КОНФЕРЕНЦИЯ МОЛОДЫХ ИССЛЕДОВАТЕЛЕЙ «ШАГ В БУДУЩЕЕ»
Скорость химической реакции
г. Заводоуковск, 2008
Введение
Вокруг нас постоянно происходят тысячи химических реакций. Горит костер и горит газ в конфорке газовой плиты, ржавеет железо, молоко превращается в творог, на фотопленке возникают изображения.
Известно, что одни химические реакции протекают за малые доли секунды, другие же за минуты, часы, дни. Некоторые протекают так быстро, что за ними не уследишь. Вот мы зажигаем спичку. Чирк! Воспламеняется от трения о коробку фосфор, входящий в состав спичечной головки, мгновенно появляется пламя. Химическая реакция заняла доли секунды. Дрова в костре тоже сгорают весьма быстро. А превращение древесины доисторических исполинских деревьев в каменный уголь длилось миллионы лет. Взрыв смеси кислорода с водородом происходит практически мгновенно, а превращение графита в алмаз в недрах Земли – очень медленная реакция. Из известных на сегодняшний день реакций самая быстрая протекает в 1040 раз быстрее, чем самая медленная. При этом нельзя ограничиваться чисто качественными реакциями, рассуждать о «быстрых» и «медленных» реакциях.
Знание скоростей химических реакций имеет очень большое практическое и научное значение. Например, в химической промышленности от скорости химической реакции зависят размеры, производительность аппаратов, качество вырабатываемого продукта и в конечном итоге зарплата работников и себестоимость продукции.
В физике скорость передвижения тела узнают, измеряя расстояние, за которое это тело переместилось в определенный промежуток времени. Но химические вещества не всегда перемещаются в пространстве. Часто они просто расходуются в определенном количестве, переходя в продукты реакции за некоторый промежуток времени. А в химии?
Согласно Стандарту образования по химии для основной школы тема «Скорость химической реакции» изучается ознакомительно, да и в старшей школе в связи с сокращением часов на изучение химии данная тема не будет подробно рассмотрена. Поэтому я решила выяснить, что же такое скорость химической реакции и какие факторы влияют на неё.
Цель: определить понятие скорости химической реакции и экспериментально изучить влияние некоторых факторов на скорость химической реакции.
Задачи.
1. Ознакомиться с различными источниками литературы.
2. Дать понятие скорости химической реакции.
3. Найти и разработать методики, позволяющие выяснить влияние на скорость химической реакции:
· катализатора;
· температуры;
· концентрации вещества;
· площади соприкосновения;
· природы реагирующего вещества.
4. Провести практическую часть исследования согласно выбранным методикам.
5. Проанализировать полученный результат и сформировать выводы.
Объект исследования: скорость химической реакции.
Предмет исследования: влияние катализаторов, температуры, концентрации вещества, площади соприкосновения, природы реагирующего вещества и давления.
Методы исследования: анализ литературы, обобщение, сравнение, формулирование выводов, измерение, эксперимент, наблюдение.
Практическая значимость: Разработанные методики позволят сделать уроки химии более интересными и «выйти» за рамки школьного курса для расширения кругозора учащихся.
Описание объекта исследования
Вначале давайте разберемся, что же такое скорость химической реакции. Когда кроликов в клетке вместо свежего сена начинают кормить морковкой, прожорливые животные быстро справляются с огромным количеством пищи. «Скорость еды» определить легко: надо просто знать, сколько моркови убавилось в кормушке за определенный промежуток времени, например за час. Правда и есть другой путь – взвесить кролика перед кормежкой и подсчитать прибавку веса в единицу времени. Но в химии мы имеем дело с частицами, а пересчитать частицы – дело очень трудоемкое. Поэтому такой путь для определения скорости химической реакции неприемлем. С понятием «скорость химической реакции» мы встречались в математике и физике, определить ее можно как отношение пройденного телом пути к времени (υ = s/t).
Подходит ли нам эта формула для определения скорости химической реакции? Конечно, нет. Ведь измерить пройденный путь реакции не удастся.
Скорость – это изменение некоторой величины во времени. Рассмотрим реакцию образования йодоводорода: H2 + I2 = 2HI и попробуем определить скорость этой реакции по расходованию реагентов в единицу времени. Например, так: υ (H2) = m (H2) / ∆ t, v(I2) = m(I2)/∆t, где υ – скорость реакции, m – убыль массы соответствующего реагента, ∆t – отрезок времени. Но υ (H2) не равно υ (I2). Ведь массы водорода и иода, прореагировавших в единицу времени, не равны. Реакция идет в мольном соотношении 1:1, а не в массовом!
Попробуем по-другому: υ (H2) = n (H2)/∆t, υ (I2) = n (I2)/∆t, взяв вместо масс количества веществ. Теперь υ (H2) = υ (I2).
Но если в первом случае мы возьмем убыль числа молей в единицу времени в 1 мл смеси, а во втором – в 1 л смеси, то скорости снова не будут равны! Они зависят от объема. Если проводить одну и ту же реакцию в маленькой пробирке и в большой бочке, то в пробирке прореагирует меньшее количество вещества – просто потому, что там меньше реагента.
А если привести эти выражения к единице объема? υ (H2) = n (H2) / V* ∆t = ∆c (H2) / ∆t, υ (I2) = n (I2) / V * ∆t=∆c (I2) / ∆ t, где ∆c – изменения молярных концентраций соответствующих веществ. Тогда υH2 = υ I2 = υ данной реакции! Таким образом, конечное определение будет: скорость химической реакции – это изменение молярной концентрации одного из участвующих в реакции веществ в единицу времени: v = c/t [моль / литр*сек].
Следовательно, чтобы определить, с какой скоростью протекает химическая реакция, нужно знать: а) какое количество вещества (моль) образуется (для продукта реакции) или расходуется (для исходного вещества); б) за какое время происходит этот процесс; в) в каком объеме протекает реакция.
Но данное определение справедливо для гомогенных реакций. Гомогенные реакции бывают такими:
ü во-первых, это реакции взаимодействия газов с получением газообразных продуктов, например, реакция водорода и кислородом с получением водяного пара: 2Н2 (г)+ О2 (г) = 2 Н2О (г).
ü во-вторых, взаимодействие веществ в растворе с образованием продуктов, тоже хорошо растворимых, например взаимодействие гидросульфата натрия с гидроксидом натрия и воды:
NaHSO4 + NaOH = Na2SO4 + 2 H2O
Совсем иначе обстоят дела с гетерогенными реакциями – в тех случаях, когда реагирующие вещества отделены друг от друга «границей фаз». Например, твердого вещества и газа: S + O2 = SO2; твердого вещества и жидкости: Fe + 2HCl = FeCl2 + H2; двух несмешивающихся жидкостей: C3H7Br + KCN (водн.) = C3H7CN + KBr(водн.).Скорость гетерогенной реакции определяется как изменение количества вещества в единицу времени на единицу поверхности:

Раздел химии, изучающий скорость химической реакции, называют химической кинетикой.
От чего же зависит скорость реакции?
· В первую очередь – от природы веществ: одни вещества реагируют мгновенно, другие – медленно.
· Затем – от концентрации реагентов: чем она больше, тем чаще будут сталкиваться частицы.
· В-третьих, повышение температуры также будет ускорять реакцию: чем выше температура, тем легче частицам образовывать активированный комплекс и преодолеть энергетический барьер.
· Для гетерогенных реакций самый важный фактор – площадь контакта реагентов (она
напрямую зависит от степени измельчения).
· Наконец, в присутствии веществ-катализаторов тоже достигается рост скорости реакции.
Рассмотрим более подробно каждый из факторов.
Влияние концентраций веществ на скорость химической реакции
Чтобы вещества прореагировали, необходимо, чтобы их молекулы столкнулись. Очевидно, что вероятность столкновения молекул прямо пропорциональна количеству молекул реагентов в единице объема, т.е. молярным концентрациям реагентов.
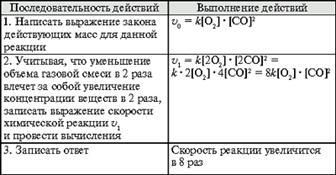
В середине XIX в. (1865 г. – Н.Н. Бекетов, 1867 г. – К. Гульдберг, П. Вааге) был сформулирован основной постулат химической кинетики, называемый также законом действующих масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных коэффициентам перед формулами веществ в уравнении реакции: υ = k [A]а * [B] b, для реакции aA + bB = cC + dD, где υ – скорость химической реакции; [А] – концентрация вещества А; [В] – концентрация вещества В; k – константа скорости реакции (коэффициент пропорциональности); а и b – коэффициенты в уравнении реакции.
Если [А]= [В]= 1 моль/л, то скорость химической реакции (υ) равна константе (k). Константа скорости реакции зависит от природы реагирующих веществ, температуры, но не зависит от концентрации вещества.
Например, напишем кинетическое уравнение для реакции синтеза аммиака
N2 (г) + 3 H2 (г) ↔ 2 NH3 (г): υ = k [N2] * [H2] 3.
В закон действующих масс не входят концентрации твердых веществ, т. к. реакции с твердыми веществами протекают на их поверхности, где «концентрация» вещества постоянна.
Влияние поверхности соприкосновения реагентов на скорость химической реакцииСкорость гетерогенной реакции прямо пропорциональна площади поверхности соприкосновения реагентов. Но в этом определении есть нюансы. Твердые вещества, участвующие в гетерогенной реакции, для увеличения скорости взаимодействия измельчают, чтобы увеличить площадь поверхности частиц. Например, уголь для приготовления пороха растирают в порошок. Жидкость для реакции с газом распыляют в мельчайшие капельки: так, дизельное топливо (смесь углеводородов) впрыскивают в камеру, где оно встречается с воздухом, через специальное устройство, обеспечивающее распыление.
Влияние природы реагентов на скорость химической реакции
Константа скорости реакции зависит в первую очередь от природы реагирующих веществ. Калий быстрее взаимодействует с водой, чем натрий, а литий – еще медленнее натрия. Водород реагирует с кислородом очень быстро (часто со взрывом), а азот с кислородом – крайне медленно и лишь в жестких условиях (электрический разряд, высокие температуры).
Под «природой реагирующих веществ» понимают:
1. для веществ молекулярного строения – тип химических связей в молекулах реагентов, прочность связей. Чтобы молекула прореагировала, связь в ней необходимо разорвать.
2. для веществ немолекулярного строения (ионный или атомный кристалл) – строение кристаллической решетки, ее прочность.
3. для веществ, у которых «молекула» состоит из одного атома (например, металлы, благородные газы) – строение электронной оболочки атома, прочность связывания внешних электронов.
4. для молекул сложной формы – вероятность благоприятного для реакции взаимного расположения реагентов при соударении.
![]() Влияние температуры на скорость химической реакции
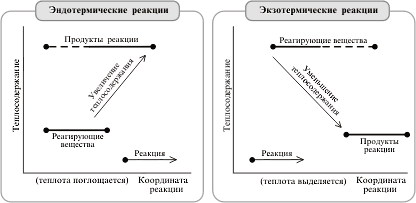
Влияние температуры на скорость химической реакции
При повышении температуры скорость химических реакций обычно возрастает. Это объясняется теорией активации: энергия необходимая для активирования молекул, называется энергией активации (Е акт).
Молекулы
![]()
Неактивные Активные
(Энергия молекул меньше (Энергия молекул
энергии активации: больше энергии активации:
Е мол ‹ Е акт) Е мол › Е акт)
С повышением температуры увеличивается число активных молекул, поэтому увеличивается скорость реакции.
Зависимость скорости химической реакции от температуры определяется правилом Вант-Гоффа: при повышении температуры на 10оС скорость большинства химических реакций увеличивается в 2–4 раза. Это правило математически выражается следующей формулой:
![]()
где γ – температурный коэффициент, который показывает, во сколько раз увеличивается скорость реакции при повышении температуры на 10оС.
Катализ и ингибированиеЕсть вещества, которые влияют на скорость химической реакции, не являясь при этом реагентами. Они принимают в реакции самое непосредственное участие, но в результате реакции остаются неизменными. Такие вещества называются катализаторами, если они ускоряют реакцию, и ингибиторами, если замедляют ее. Механизм действия катализаторов объясняется образованием промежуточных соединений. Например, механизм действия катализатора К в реакции А + В = АВ можно схематически показать так:
![]()
![]() А + К = АК АК + В = АВ + К
А + К = АК АК + В = АВ + К
А + В = АВ (АК – промежуточное соединение).
В присутствии катализатора изменяется путь, по которому происходит суммарная реакция, поэтому изменяется ее скорость. Например: 2SO2 + O2 = 2 SO3 (медленно);
![]() 2SO2 + O2 = 2 SO3 (присутствии катализатора NO – быстро).
2SO2 + O2 = 2 SO3 (присутствии катализатора NO – быстро).
Механизм: 2 NO + O2 = 2 NO 2 (быстро)
NO2 + SO2 = SO3 + NO (быстро). NO – катализатор, NO 2 - промежуточное соединение. (приложение, рисунок 6)
Особый случай катализа – аутокатализ, или ускорение реакции одним из ее продуктов. При этом скорость реакции не уменьшается по мере расходования реагентов, а растет. Так, реакция
2KMnO4 + 5K2SO3 + 3H2SO4 = 2MnSO4 + 6K2SO4 + 3H2Oускоряется по мере накопления ионов Mn2+, образующихся при восстановлении перманганата.
Методика и результаты исследования
Похожие работы
... условия сдвига равновесия вправо .... Глава 2. Прикладные аспекты преподавания темы «Закономерности течения химических реакций» Прикладные аспекты преподавания темы «Закономерности течения химических реакций» на мой взгляд удобнее всего рассматривать на уроках, которые следуют сразу за рассмотрением скорости реакции и химического равновесия, - это производство серной кислоты. 2.1 ...
... ; 2) при увеличении давления равновесие смещается в сторону образования меньшего числа молекул газа; 3) нагревание смещает равновесие в сторону эндотермической реакции, охлаждение – в сторону экзотермической реакции. Практическая часть Скорость химических реакций в гомогенной системе изучается на примере взаимодействия растворов серной кислоты и серноватистокислого натрия (тиосульфата): ...
... , т. е. к увеличению скорости реакции. Количественно зависимость между скоростью реакции и молярными концентрациями реагирующих веществ описывается основным законом химической кинетики — законом действующих масс. Скорость химической реакции при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ. Для мономолекулярной реакции скорость реакции ...
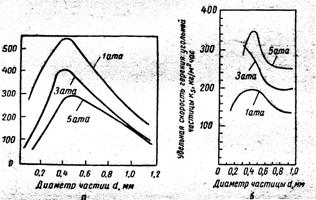
... датчика и осциллографа. Экспериментальные кривые зависимости времени τ горения частиц от давления p, соответствуют теоретической зависимости. Представляют интерес экспериментальные исследования процесса горения отдельной угольной частицы, движущейся в потоке газа. Такого рода опыты проводили Н. И. Сыромятников и 3.И.Леонтьева. После воспламенения частицы наблюдалось замедление скорости ее ...



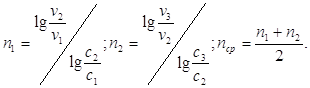
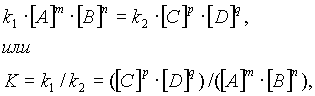
0 комментариев