Навигация
Способы питания микроорганизмов
5. Способы питания микроорганизмов
Для осуществления процессов роста и размножения, т.е. жизнедеятельности, необходимы питательные вещества с окружающей среды.
Поступление питательных веществ в бактериальную клетку происходит без энергетических затрат, за счет пассивной диффузии или облегченной диффузии (с помощью ферментоподобных белков – пермеаз).
Способы питания микроорганизмов очень разнообразны. Нужно отличать три основных способа питания: голофитное, сапрозойное и голозойное.
Голофитное питание осуществляется по типу фотосинтеза растений. Среди микроорганизмов этот способ присущ водорослям, окрашенным формам жгутиковых и некоторым бактериям.
Голозойный способ питания обуславливает развитие у микроорганизмов специальных органоидов для переваривания еды, а в некоторых – и для её захвата. Например, неокрашенные жгутиковые и ресничные у инфузории имеют ротовую пустоту, к которой еда подгоняется соответственно жгутиками и ресничками.
При сапрозойном способе питания полезные вещества попадают в клетку через всю её поверхность, поскольку такие микроорганизмы не имеют специальных органов для захвата еды. Этот способ питания присущ бактериям, микроскопическим грибам, дрожжам.
Необходимое условие – приемная форма питательных веществ, в которой они могут усваиваться микроорганизмом.
6. Изложить принципы стабилизационной обработки воды. Какие химические соединения целесообразно применять для стабилизационной обработки воды замкнутых технологических циклов?
Воды, в которых соблюдается основное карбонатное равновесие, называются стабильными. Они не имеют своего состава при контакте с карбонатами, бетоном, карбонатными защитными пленками. Воды, содержащие избыток свободной угольной кислоты над равновесной, называются агрессивными. При контакте с бетоном или карбонатными пленками такие воды называют растворение карбонатных составляющих. Агрессивное действие этих вод выражается в растворении карбоната кальция и извести по уравнениям:
CaCO3+CO2+H2O↔Ca(HCO3)2
Ca(OH)2+2CO2↔Ca(HCO3)2
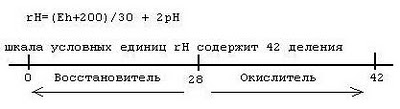
Стабильность воды оценивают по методу Ланжелье, который основан на том, что данному значению рН соответствует определенное количество свободной угольной кислоты, находящейся в равновесии с другими ее формами. Величина рН, соответствующая равновесию, называется "рН равновесного насыщения воды карбонатом кальция" и обозначается pHs вычисляют по формуле
pHs=pK2-pПРCaCO3-lg[Ca2+]-lgЩо+2,5√I+7,6,
где pK2 – отрицательный логарифм константы 2-й ступени диссоциации угольной кислоты; pПРCaCO3 – отрицательный логарифм произведения растворимости; [Ca2+] – концентрация ионов Ca2+ , мг/л; Що – общая щелочность, мг-экв/л; I – ионная сила.
Стабилизация воды, содержащей агрессивную угольную кислоту, производится веществами, вызывающими повышение щелочности воды. В качестве реагентов применяются известь, гидроксид и карбонат натрия. Реакции, протекающие при этом, описываются уравнениями:
NaOH+CO2=NaHCO3 ; Ca(OH)2+2CO2=Ca(HCO3)2
Na2CO3+CO2+H2O=2NaHCO3
Агрессивную воду можно сделать стабильной также путем фильтрования ее через слой известняка, мрамора, природного и полуобожженного доломита ("магномассы"). При фильтровании воды через слой магномассы дополнительно проходит реакция взаимодействия оксида магния с угольной кислотой:
MgO+2CO2+H2O=Mg(HCO3)2
Обработка нестабильных вод направлена на снижение щелочности и заключается в обработке их кислотами (соляной, серной) или в насыщении диоксидом углерода (рекарбонизация). Так, например,
NaHCO3+HCl=NaCl+H2O+CO2
На некоторых очистных сооружениях используются мраморно-песчаные фильтры, которые позволяют получить не только осветленную, но и стабильную воду.
7. Какие процессы определяют скорость ионного обмена, зависит ли скорость от концентрации примесей в воде?
Скорость обмена зависит от размена иона, величины его заряда и способности к гидратации. Она увеличивается с повышением заряда иона и уменьшением степени гидратации. Рабочая обменная емкость катионов по иону Na+ примерно в два раза меньше, чем по ионам Ca2+ или Mg2+. Аниониты имеют большую избирательность к сульфат-иону по сравнению с хлорид-ионом. Рабочая обменная емкость по сульфат-иону на 40 – 50% выше, чем по хлорид-иону. На рабочую обменную емкость влияет скорость фильтрации через ионитовый фильтр. При значительной скорости фильтрования воды рабочая обменная емкость заметно уменьшается. Эта зависимость рабочей обменной емкости от скорости фильтрования является общей для всех видов ионитов. Обычно рабочая обменная емкость составляет около 60% от полной, но в зависимости от режима фильтрования может изменяться. Высота слоя, при которой происходит снижение жесткости исходной воды до заданной величины, называется высотой защитного слоя ионита. На рабочую обменную емкость ионитов влияет и их фракционный состав. Чем меньше размер зерен, тем выше скорость обмена ионов. Размер частиц основной рабочей фракции большинства марок ионитов составляет 0,5мм.
Рабочая обменная емкость ионита зависит от солесодержания. Так, например, рабочая обменная емкость катионита КУ-2 при увеличении солесодержания от 1 до 15 мг-экв/л снижается примерно на 15%.
8. Как проверить в полевых условиях, содержит ли вода органические соединения неизвестного происхождения?
Основную часть органических загрязнений воды составляют белки, жиры, углеводы и продукты их разложения.
Загрязнения воды органическими веществами, которые могут быть источником питания и энергии для микроорганизмов, оценивают непосредственно – по количеству кислорода, который поглощают микроорганизмы в процессе биохимического окисления этих веществ. Такой характеристикой есть БПК – биохимическая потребность в кислороде.
В набранную для пробы воду нужно добавить на кончике ножа перманганат калия, и проследить за реакцией. Если вода станет светлее, то в ней присутствовали примеси органического происхождения.
9. В чем разница карбонатной и временной жесткости воды? Какую жесткость имеют кислые воды? Как снижают карбонатную жесткость и устраняют временную?
Жесткость воды, обусловленная наличием ионов Ca2+ и Mg2+, принимается за общую. В воде эти ионы могут быть связаны с различными анионами (HCO3-, SO42-, Cl-, CO32- и др.).Соответственно этому жесткость воды, обусловленную наличием гидрокарбонатов и карбонатов кальция и магния, называют карбонатной жесткостью.
Карбонат кальция имеет чрезвычайно малую растворимость, равную 14,45 мг/л в дистиллированной воде при 250С. Гидрокарбонат магния при кипячении тоже переходит в труднорастворимые карбонат или основной карбонат магния (MgОН)2СО3. Таким образом, при кипячении жесткость воды, вызванная присутствием гидрокарбонатов кальция и магния, как бы устраняется. Поэтому такая жесткость называется устранимой или временной.
Следует различать понятия карбонатная и устранимая жесткость. При переходе HCO3- в CO32- и при выпадении карбонатов кальция и магния в воде остается некоторое количество ионов Ca2+, Mg2+, CO32-, соответствующее произведению растворимости карбоната кальция и основного карбоната магния. В присутствии посторонних ионов растворимость этих соединений повышается. Разность между карбонатной и устранимой жесткостью, обусловленной карбонатами кальция и магния, характеризует величину остаточной жесткости.
10. Различаются ли классификации сточных вод и примесей сточных вод?
Сточные воды делятся на бытовые, производственные и ливневые. Они отличаются друг от друга своим происхождением, составом, биологической активностью и в связи с этим – способами очистки.
Бытовые сточные воды образуются в результате практической деятельности и жизнедеятельности людей. При этом изменяются физические и химические свойства воды, а также ее бактериальная загрязненность. Химический состав бытовых вод в отличие от производственных сточных вод не подвержен значительным качественным изменениям.
В сточных водах содержатся примеси минерального и органического происхождения. Минеральные соединения в бытовых сточных водах представлены солями аммония, фосфатами, хлоридами, гидрокарбонатами и другими соединениями, образующимися в результате жизнедеятельности человека и разложения органических веществ. Бытовые сточные воды имеют обычно слабощелочную реакцию среды (рН 7,2 – 7,8). Минеральные и органические примеси в воде могут в зависимости от степени дисперсности находиться во взвешенном, коллоидном и растворенном состояниях. Соотношение между содержанием минеральных и органических соединений.
11. В каких единицах выражают кислотность воды? Какие характеристики окислителей принимаются во внимание?
Ионы водорода, обусловливающие кислотность воды, образуются при диссоциации свободных (сильных или слабых) кислот, некоторых кислотных солей (например, гидросульфата натрия), а также вследствие гидролиза солей, образованных слабыми основаниями и сильными кислотами. При неполной диссоциации кислоты или частичном гидролизе соли концентрация свободных ионов Н+, находящихся в растворе, часто не соответствует концентрации водородных ионов, вступающих в реакцию нейтрализации с сильным основанием. Концентрация реально присутствующих ионов Н+ в растворе при данных условиях характеризуется активной кислотностью. Активная кислотность устанавливается при колориметрическом и потенциометрическом определении рН.
Кислотность природных вод обычно обусловлена наличием свободной угольной кислоты, а для некоторых видов вод – также гуминовыми и другими слабыми органическими кислотами. При наличии этих кислот рН воды обычно не бывает <4,5. Кислые рудничные воды, содержащие сульфаты железа, марганца, вследствие гидролиза этих солей могут иметь более низкое значение рН.
При аналитическом определении кислотности воды различают общую и свободную кислотности. Свободная кислотность – это та часть общей кислотности, которая вызывает снижение рН раствора до 4,5 и ниже. Свободная кислотность выражается количеством титрованного раствора сильного основания (мг-экв/л), израсходованного при нейтрализации до достижения рН 4,5.
Похожие работы
... 4 5. » 80 » 125 5 6. » 125 » 250 7 7. » 250 » 450 10 9. » 400 » 800 14 Глава 3. Электрофизический способ очистки и обеззараживания питьевой воды 3.1 Очистка воды с помощью нанотехнологий Качество питьевой воды имеет огромное значение для здоровья людей. Все чаще водопроводная вода по своему составу напоминает химическую и бактериологическую смесь, опасную для нашего здоровья. ...
... «минерализация природных вод» и на основе аргентометрического и титриметрического методов химического анализа провести количественное определение анионов Cl-, SO42-, НCO3-, CO32- и на основе полученных экспериментальных данных сделать вывод о степени минерализации вод рек Раковка и Комаровка. Глава I. Вода на Земле, ее происхождение и состав I.1. ...
... илом. При этом происходит образование комплексов ионов с белком активного ила, следствием чего является, с одной стороны, накопление соединений металлов в осадках, а с другой - снижение качества очистки сточных вод, так как сорбированные металлы концентрируются в активном иле и с возвратным илом неоднократно попадают в аэротенк, где значительная часть подаваемого кислорода воздуха затрачивается не ...
... . 5.ПРОЦЕССЫ БИОЛОГИЧЕСКОЙ ОЧИСТКИ Сооружениям биологической очистки отводится главенствующая роль в общем комплексе сооружений канализационной очистной станции. В результате процессов биологической очистки сточная вода может быть очищена от многих органических и некоторых неорганических примесей. Процесс очистки осуществляет сложное сообщество микроорганизмов - бактерий, простейших, ряда ...
0 комментариев