Цепные разветвлённые реакции
Реакция Cl2 + H 2 = HCl . Первая стадия - фотохимическое инициирование.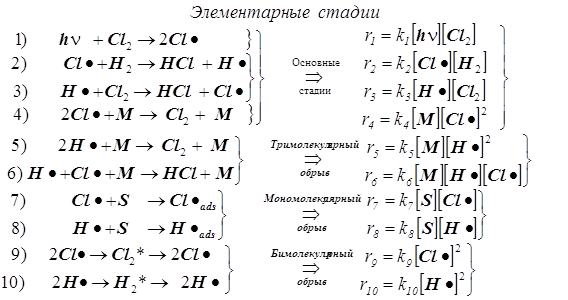
1) Стадия 1 –зарождение цепи.
2) Стадии (2, 3) - продолжение цепи, и вместе они образуют звено цепи.
Суммируя правые и левые части обоих уравнений 2 и 3, находим, что суммарное превращение, протекающее в звене цепи, является основной реакцией...
3) Стадия 4 предполагается основной элементарной реакцией обрыва в силу того, что с её помощью объясняется экспериментально наблюдаемый факт, по которому скорость реакции заметно уменьшается в присутствие примесей, но...
4) ...полный набор стадий обрыва включает в себя и другие элементарные реакции: тримолекулярные (4, 5, 6), мономолекулярные (7, 8), бимолекулярные (9, 10).
5) За суммарную скорость всей реакции ответственны стадии (1, 2, 3, 4).
6) Прочие стадии малосущественны, т.к. на результирующей скорости суммарной реакции обрыв мономолекулярный и бимолекулярный заметно не сказываются.
7) При выводе скорости r всего процесса используем два уравнения для квазистационарных концент раций свободных валентностей® радикальных частиц® атомов H• и Cl•:
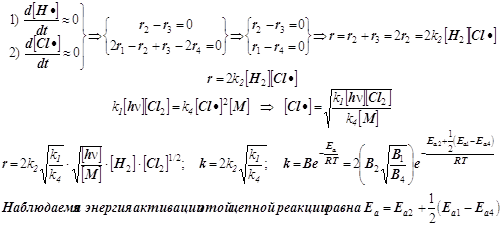
Этот сравнительно простой пример приводит к понятию эффективной энергии активации.
Она является результирующей характеристикой совокупности нескольких стадий сложной реакции. В условиях проведения реального эксперимента наблюдаемые эмпирические акти-вационные параметры очень часто приходится использовать на первых этапах кинетических исследований, пока детали сложного многостадийного механизма превращения остаются ещё невыясненными...
8) Средняя длина цепи определяется как отношение скоростей образования продукта к скорости инициирования (в нашем случае фотохимического) цепи, т.е.: n=r/r1 .
Важно! Обратиться к анализу энергий активации (см. книгу под ред.Краснова, стр. 607).
Энергии активации отдельных стадий примерно равны:
- при взаимодействии двух радикалов - нулю.
- при диссоциации молекул хлора - примерно половине энергии связи 238/2 кДж/моль.
- при взаимодействии атома хлора с молекулой водорода примерно 25 кДж/моль.
Получается энергия активации всей реакции, примерно равная 119/2 + 25 = 85 кДж/моль.
Рассмотрим классический пример – газофазную реакцию: H2+1/2O 2= H2O
Истинный механизм этой реакции состоит из многих стадий (до 30). Существуют различные подходы к его описанию. Выделим лишь некоторые наиболее характерные стадии, и введём очень упрощённую модельную схему, пригодную для классификации основных элементарных превращений, и с их помощью выделим главные особенности и выявим возможные режимы протекания всего процесса. Они возникают из-за конкуренции стадий разветвления и обрыва. Приводимый ниже механизм реализуется при невысоких давлениях (несколько десятков тор) (см. М.Н. Варгафтик, «Химическая кинетика» кафедральное пособие МИТХТ под ред. акад. Я.К. Сыркина, 1970, стр. 89, а также учебник «Физическая химия» под ред. К.С. Краснова, стр. 608). Основные стадии представим в нижеследующей таблице.
| Упрощённый механизм разветвлённой цепной реакции H2+O2= H2O | Баланс активных центров на отдельных стадиях | Скорости элементарных стадий | |||||||
| № | Элементарные реакции | Исх. | Кон. | Скорость | Природа стадии | ||||
| 1 | H2 | + O2 | 2 HO | | r1=k1[H2][O2] | Зарождение | |||
| 2 | HO | + H 2 | H2O | + H | | | r2=k2[H 2][HO] | Продолжение | |
| 3 | H | + O 2 | HO | + O | | ( ) | r3=k3[O2][H] | Разветвление | |
| 4 | O | + H2 | HO | + H | ( ) | | r4=k4[H2][O] | ||
| 5 | H | + O2 + M | HO2 | + M | | () | r5=k5[M][O2][H] | квадрат. | Обрыв |
| 6 | H | + M | 1/2 H2 | + M | | r6=k6[M][H] | линейн. | ||
Стадия 4 считается разветвлением (см. Панченков – Лебедев, стр.261, табл.27), поскольку здесь происходит пространственное разделение двух свободных валентностей; из единого центра возникают два пространственно независимых. Элементарные акты линейного обрыва (стадия 5) происходят на стенке. (На стадии 5, а далее и 6 более строго следовало бы частицы M заменить удельной поверхностью стенки S). Акты квадратичного обрыва происходят в объёме, а на стенке обрыв уже мономолекулярный (стадии 5 и 6).
Теория пределов взрыва приведена у Панченкова и Лебедева, а также у Лейдлера...
В реакционной газовой смеси (в пламени) содержится до 18% атомарного водорода. Для расчёта режимов образования и расходования этих наиболее активных частиц вводится упрощение, называемое методом полустационарных концентраций Н.Н.Семёнова, который состоит в том, что квазистационарное приближение вводится только для менее активных частиц. Концентрация наиболее активных частиц в принципе не может быть стационарной. На этой основе удаётся принципиально упростить схему её расчёта.
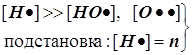
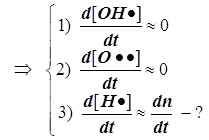
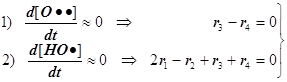
![]()
![]()
![]()
![]()
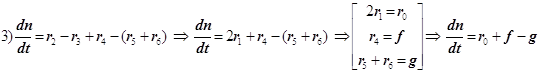 (9.1)
(9.1)
1) Цепной разветвлённый процесс есть результат суперпозиции стадий четырёх типов: зарождения, продолжения, разветвления и обрыва. На стадии продолжения число активных центров остаётся неизменным. Поэтому желательно в уравнении 3) от неё избавиться, и сосредоточиться на трёх основных стадиях, конкуренция которых формирует специфику именно разветвлённого процесса.
2) Поскольку за разветвление ответственны наиболее активные частицы - атомарный водород, то цель преобразований состоит в том, чтобы именно его концентрацию ввести всюду в явном виде. Равенство ![]() позволяет записать:
позволяет записать: 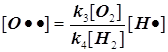 . Благодаря уравнению 2) из главного в нашей задаче уравнения 3) :
. Благодаря уравнению 2) из главного в нашей задаче уравнения 3) :
а) исключаем скорость ![]() , и б) заменяем скорость
, и б) заменяем скорость ![]() скоростью
скоростью ![]() , и получаем формулу (9.2).
, и получаем формулу (9.2).
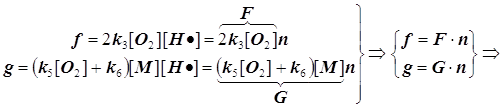
![]() (9.2)
(9.2)
Режимы разветвлённой цепной реакции
Конкуренция разветвления и обрыва
f -скорость разветвления цепи и F - фактор разветвления,
g -скорость обрыва цепи и G - фактор обрыва:
Режимы образования и гашения активных центров n:
![]()
![]()
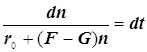
![]()
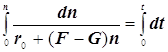
![]()
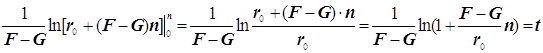
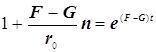
![]()
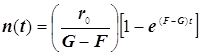 (9.3)
(9.3)
Полученное выражение предсказывает два предельных режима изменения концентрации активных центров, (см. рис.): а)-при доминирующем обрыве цепи система стационарно насыщается активными центрами; б)-при доминирующем разветвлении активные центры способны неограниченно накапливаться.
Эти предельные режимы цепной разветвлённой реакции (рис. ) следующие:
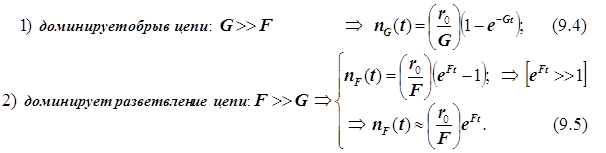
В результате конкуренции разветвления и обрыва возникает специфический механизм цепной разветвлённой реакции, зависящий от многих факторов. В книге Лейдлера (стр.194) рассматриваются взрывные пределы этой реакции. Цитируем: “Реакция водорода с кислородом протекает со скоростями, удобными для измерения между 450 и 600о С; выше этого интервала все смеси взрываются. Если стехиометрическую смесь (H2;O2) держать при (T; p)=(550 оС; 2 тор), то протекает гомогенная реакция. С постепенным повышением давления скорость реакции увеличивается. При некотором критическом давлении, величиною в несколько миллиметров (его точное значение зависит от размеров и формы реакционного сосуда), смесь взрывается. Если смесь выдерживать при p =200 тор, то вновь протекает спокойная стационарная реакция, но, если давление понизить, то при p =100 тор смесь взорвётся. Таким образом, при этой температуре имеется некоторый интервал давлений, внутри которого наблюдается взрыв, а выше и ниже его реакция протекает со стационарной скоростью. Выше 600 оС смесь взрывается при всех давлениях, а ниже 400 оС не взрывается совсем. Два взрывных предела называют первым и вторым или верхним и нижним.
Существует также и третий предел при ещё более высоких давлениях. Иногда этот третий предел является просто термическим пределом; и в этих случаях скорости реакций становятся настолько высокими, что условие изотермичности не сохраняется. Такие взрывы, которые происходят за счёт повышения температуры реакционной системы, называют термическими (тепловыми) . Существуют доводы и в пользу того, что взрыв при третьем пределе в системе (H2;O2) не является термическим, а происходит за счёт внезапного повышения концентрации активных центров-свободных радикалов...”.
Представим исходные состояния реакционной смеси в виде диаграммы в координатах температура – давление (T-p). Координатная плоскость оказывается разделённой на две области Z -образной кривой (-aebdc-) (рис.).
|
t
| |||||||||||||
|
t
| |||||||||||||
Слева от кривой (-aebdc-) лежит область, охватывающая состояния газовой смеси, при которых не развивается цепное разветвление, и реакция протекает в стационарном режиме.
Справа от кривой (-aebdc-) координатная плоскость отображает уже те состояния реакционной среды, при которых реакция протекает в режиме цепного разветвления, и развивается воспламенение. Рассмотрим изотермическую реакционную смесь (T=const) при переменном давлении. Фигуративная точка M перемещается вдоль вертикали, пересекая при этом три ветви кривой (-aebdc-).
Ветвь, на которой лежат точки dc, называется 1-м пределом цепного воспламенения.
Ниже этого предела давление в системе настолько мало, что активные частицы успевают совершить свободный пробег практически до стенки сосуда, не встречаясь в объёме с другими частицами. Это область, где доминирует линейный обрыв цепи (стадия 6).
Выше 1-го предела давление достаточно велико и концентрация активных частиц достаточна для протекания стадий разветвления и поддержания цепного режима. Эффективно протекает воспламенение до следующей ветви (dbe).
Ветвь dbe называется 2-м пределом цепного воспламенения. Выше неё цепное воспламенение не развивается, активные центры успевают погаситься уже при встрече в объёме, в газовой фазе. В этой области доминирует квадратичный обрыв. Так ведёт себя система при давлениях вплоть до ветви. Ветвь, на которой лежат точки ea, называется 3-м пределом цепного воспламенения. В области над нею элементарные акты, ведущие к образованию продукта, становятся столь частыми, что выделяющаяся энергия не успевает отводиться из области реакции и здесь же, в объёме, поступает на размножение активных центров. Это область теплового взрыва.
В точке d заканчивается полуостров воспламенения. Всюду левее неё доминирует обрыв цепи, и цепное воспламенение не имеет места.
В точке e заканчивается полуостров квадратичного обрыва цепи.
Всюду правее кривой - воспламенение.
Увеличение в смеси концентрации (парциального давления) окисляющегося реагента (в нашем случае - водорода) приводит к смещению всей кривой воспламенения в область меньших температур. Роль стадий обрыва очень существенна. Линейный обрыв протекает на стенке сосуда, и скорость этой стадии существенно меняется в зависимости и от материала, и от формы реактора, в котором протекает разветвлённый цепной процесс. Очевидно, условия для линейного обрыва на стенке сосуда наиболее благоприятны, если сосуд имеет вытянутую форму, например, цилиндрическую или извилистую. Напротив, сферическая форма сосуда наиболее благоприятна для столкновения реагирующих частиц в объёме, но размеры сферы при этом должны быть достаточно большими, чтобы частицы не успевали покидать реакционный объём прежде, чем произойдёт соударение. Так возникает критические геометрические характеристики реактора.
Уместно сообщить, что в виде разветвлённого цепного процесса могут развиваться не только химические, но и ядерные реакции, и их основные признаки и закономерности оказываются вполне аналогичными, разве реагирующие частицы иные - ядерные...
В практике и теории ядерного взрыва они характеризуются критическим диаметром ядерной взрывчатки, изготовленной в форме сферы и её критической массой.
Пределы цепного взрыва по температуре и давлению. Полуостров цепного воспламенения (1-й и 2-й пределы цепного взрыва). Тепловой взрыв (3-й предел взрыва)
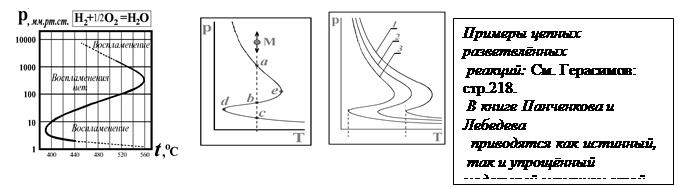
 | |||
| |||
Интерпретация пределов цепного воспламенения различна в разных источниках. Один из вариантов рассматривается в реакции горения фосфина в кислороде. Это одна из самых первых химических реакций, ставших экспериментальной основой для построения теории горения и взрыва (теория цепных разветвлённых реакций). У этой реакции слева от Z-образной кривой реакция вовсе не идёт, а справа идёт цепное воспламенение. Этот пример приводится в книге Н.Н.Семёнова, и на него ссылается Ерёмин. Второй случай связан с горением водорода в кислороде и образованием знаменитой гремучей смеси. Это пример обсуждается у Ерёмина и у Лейдлера, но используемые термины различаются. У Лейдлера: слева стационарная реакция (горение), а справа - взрыв. Итак, по Лейдлеру: 1)Слева от Z-образной кривой - режим горения. 2)Справа от Z-образной кривой – режим цепного взрыва.3)Выше линии ae-область теплового взрыва. Третий предел - предел теплового взрыва был открыт Хиншельвудом. |
Похожие работы
... по реагенту A 2) Реагент A адсорбируется слабее продукта, а продукт M адсорбируется очень сильно: Продукт M тормозит реакцию. 4.3) Приведём несколько различных вариантов протекания гетерогенного катализа в реакциях разложения соединений на металлических катализаторах. (см. А.В. Раковский, Курс физической химии, стр.510-511): 4.3.1. Слабая адсорбция. Молекулы покрывают лишь малую часть ...
... 2Na2O2 + 2CO2 = 2Na2CO3 + O2 . Эта реакция лежит в основе современных изолирующих противогазов (ИП), которые используют в условиях недостатка кислорода в воздухе, применение боевых отравляющих веществ. Изолирующие противогазы находятся на вооружении экипажей современных военно-морских кораблей и подводных лодок, именно эти противогазы обеспечивают выход экипажа из затопленного танка. Гидроксид ...
... ввёл термин «экология», в дальнейшем получивший массовое распространение и давший название одной из глобальных проблем современности. Некоторые предпосылки появления понятия глобальных проблем можно найти и в особом течении – экологической философии, развившейся в русле западноевропейской философской традиции. Например, французским естествоиспытателем Жоржем Луи Леклерком Бюффоном (Buffon) (1707– ...
... в отдельных случаях приводят к откровенному вмешательству во внутренние дела государств. При подобных обстоятельствах «миротворчество» может стать новой формой милитаризма ХХІ века [5, 338]. 2. Войны ограниченные и войны тотальные История мирового сообщества после второй мировой войны сопровождается большим количеством вооруженных конфликтов различного социального характера, масштаба и ...

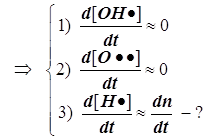
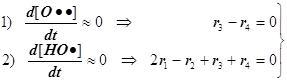
0 комментариев