Навигация
1. Неорганические вещества.
а. Элементы и соединения с ковалентной связью. Примеры: J2, OsOt, GeClt.
б. Соединения с ионной связью, такие, как галогениды и нитраты.
2. Органические соединения.
а. Нейтральные координационные комплексы типа MeR». Это преимущественно хелатные комплексы. Примерами являются дитизонаты, 8-оксихиноляты, ннтрозонафтолаты и др.
б. Комплексные соединения, состоящие из ионной пары, или, в более общем смысле, ионные ассоциаты. Металл может находиться в катионной или анионной части молекулы.
1) Катнонная часть.
Пример: комплексная соль бихинолина одновалентной меди Анионная часть.
Пример: хлорантимонат родамина Б; перренат тетрафеннларсоння I4As+ можно экстрагировать как органическими растворителями, не содержащими кислорода, так и кислородсодержащими растворителями – Однако всегда следует использовать растворители первой группы, так как они экстрагируют ограниченный ряд неорганических веществ. Кислородсодержащие растворители требуются для извлечения ионных неорганических соединений. Благодаря основному характеру кислородного атома молекулы этих растворителей могут координировать с ионом металла или соединением, замещая при этом молекулы воды, с образованием оксониевых комплексных соединений, которые растворимы в органическом растворителе. Может показаться, что приведенная выше классификация экстрагируемых веществ не точна, поскольку неорганические ионные соединения, состоящие из ионных пар, экстрагируются не сами по себе, а в той или иной степени нуждаются во взаимодействии с растворителем; таким образом, фактически экстрагируются органические соединения. Однако полезно провести грань между неорганическими и органическими ионными соединениями, ибо взаимодействие последних с органическим растворителем не происходит или по крайней мере осуществляется значительно слабее, чем с неорганическими соединениями.
Большинство нейтральных хелатных комплексов металлов достаточно хорошо растворимо в органических растворителях, не содержащих кислорода, благодаря чему этот тип комплексных соединений предпочтителен в экстракции. Однако некоторые хелаты более растворимы в кислородсодержащих растворителях. В органических растворителях растворимость хелатных комплексов изменяется в широких пределах. Например, растворимость днтизоната свинца в четыреххлористом углероде при комнатной температуре составляет всего лишь 5–10 М, в то время как растворимость купферрата алюминия в хлороформе равна 1,4 М.
Органические соединения, образованные ионной парой, могут быть растворимы как в бескислородных, так и в кислородсодержащих растворителях. Растворимость может сильно изменяться при переходе от одного растворителя к другому. Так, например, хлорантимонат родамина Б растворим в хлороформе, бензоле, толуоле, амиловом спирте н изопропиловом эфире, но практически нерастворим в четыреххлористом углероде и этиловом эфире. Хлорид бихинолина меди растворим в высших спиртах, но не в хлороформе. Перренат и перманганат тетрафениларсония растворяются в хлороформе. Железороданид трифенилметиларсония растворимы в дихлорбензоле.
Функциональную зависимость экстрагируемости металла от концентрации реагента в растворе, кислотности раствора и концентрации металла обычно можно количественно описать относительно просто, если экстрагируемое вещество является нейтральным хелатом металла.
Экстракционное поведение некоторых из органических систем ионных ассоциатов также можно описать просто. В таких системах растворитель играет физическую роль: он не реагирует с металлом или реагентом. Избыток требуемого органического реагента обычно настолько мал, что при описании равновесий не возникает осложнений благодаря высоким и переменным концентрациям. С другой стороны, ионные неорганические соединения при экстракционном равновесии представляют собой очень сложные системы. Кислородсодержащий растворитель взаимодействует с металлом и даже с реагентом. Как правило, необходима высокая концентрация реагента, например соляной кислоты или азотнокислой соли, и при оценке, их влияния на равновесие как в водной фазе, так и в фазе органического растворителя возникают трудности. Может иметь место ассоциация ионных или полимеризация молекулярных компонентов. Кроме того, осложнения вносятся вследствие возможных изменений в составе фаз при изменении концентрации электролита.
Выражения для экстрагируемых металлов в виде хелатных комплексов органических реагентов можно вывести довольно легко. Разработана общая количественная теория экстракции органическим растворителем для идеальных и неидеальных систем.
а. Неорганические вещества
Из водного раствора подходящими органическими растворителями можно экстрагировать многие неорганические вещества. Некоторые из способов, применяемых для их извлечения, обеспечивают очень хорошее отделение следов элементов. В этом разделе будут рассмотрены некоторые общие вопросы экстракции неорганических веществ; представляющие интерес детали методик можно найти в главах по отдельным элементам.
Экстрагируемость свободных галоидов многими органическими растворителями настолько хорошо известна, что здесь нет необходимости подробно останавливаться на этом. Менее известно, что в некоторых органических растворителях имеет заметную растворимость металлическая ртуть. В гексане ее растворимость составляет 7 мг/л при температуре 65°, в бензоле при комнатной температуре – 1,5–2 мг/л, в то время как в воде растворимость ртути около 0,025 мг/л при 20 и 0,6 мг/л при 100°. Это свойство ртути до сих пор в аналитических целях не использовалось.
Окиси; кислородные кислоты. Экстракционное извлечение Os04 и Ru04 из кислых растворов с помощью четыреххлористого углерода представляет наилучший способ отделения осмия и рутения от других металлов платиновой группы, так же как и других элементов. Нетрудно понять, почему ковалентные соединения этого типа следует экстрагировать бескислородными растворителями.
Различные неорганические кислоты в той или иной степени растворимы в органических растворителях. Простые и комплексные кислородные кислоты с разной степенью эффективности могут экстрагироваться кислородсодержащими растворителями. Например, борная, фосфорная, фосфорно-железная, фосфорномолибденовая и хромовая кислоты экстрагируются диэтиловым эфиром и аналогичными растворителями. Некоторые из этих экстракций имеют аналитическое значение.
Для экстракционного метода необычно извлечение щелочных солей кислородных кислот органическими растворителями, однако до некоторой степени оно имеет место в случае экстракции перренатов щелочных металлов нитрометаном. Перренаты полностью ионизованы в этом растворителе. По-видимому, экстракция марганца, рения и теллура в семивалентных состояниях из 4 М раствора едкого натрия пиридином также связана с экстракцией щелочных солей.
Хлориды. Мышьяк и германий можно экстрагировать из концентрированных растворов соляной кислоты четыреххлористым углеродом, хлороформом, бензолом и другими растворителями, не содержащими кислорода. Несомненно, экстрагируемые соединения представляют собой хлориды. Хлорид теллура экстрагируется не полностью.
Значительно большее число элементов можно экстрагировать из растворов соляной кислоты соответствующей концентрации кислородсодержащими растворителями. Особенно полно изучена экстракция диэтиловым и диизопропиловым эфирами. Экстрагируемые соединения представляют собой главным образом хлорид-ные комплексы. В табл. 9 приведены данные об экстрагнруемости различных металлов этиловым эфиром при равных концентрациях соляной кислоты. Обычно экстрагируемость уменьшается при концентрации НС1 выше 6 М. Иногда этиловый эфир с успехом можно заменить изопропиловым. Наряду с тем, что изопропиловый эфир менее растворим в соляной кислоте и менее летуч, он позволяет более полно экстрагировать металлы; кроме того, может оказаться менее необходимым установление оптимальной кислотности экстрагируемого раствора.
Процесс экстракции эфиром железа из раствора соляной кислоты был предметом всестороннего изучения, однако до сих пор до конца не выяснен и иллюстрирует те трудности в объяснении механизма экстракции, которые возникают в случаях, когда водный и органический растворители заметно взаимно растворимы, а концентрация электролита высока и непостоянна. Экстракция эфиром не очень пригодна для выделения следов железа, но иногда применима для удаления больших количеств его и поэтому здесь будет кратко рассмотрена. При экстракции железа этиловым эфиром оптимальная концентрация соляной кислоты в водной фазе составляет 6 М, изопропиловым эфиром – 8 М и дихлордиэтиловым эфиром – 9 Л! или выше. По-видимому, экстрагируемые комплексные соединения представляют собой главным образом сольватированную HFeCl4.
Кетоны экстрагируют железохлористоводородную кислоту более эффективно, чем простые или сложные эфиры. Этилацетат служит хорошим экстрагентом для золотохлористоводородной кислоты.
Изучалась экстракция молибдена из растворов соляной кислоты простыми и сложными эфирами и кетонами. Вероятно, экстрагируемым соединением является МоО2С12. При концентрации соляной кислоты 6,5 М происходит максимальное извлечение молибдена этиловым эфиром; когда растворителем является дихлорэтиловый эфир, извлечение увеличивается непрерывно с возрастанием концентрации соляной кислоты. Сходство этих явлений с явлениями, наблюдаемыми при экстракции железа и галлия, указывает на то, что аналогично изменяется коэффициент распределения. Этиловый эфир обладает лучшими экстракционными свойствами, чем нзо-пропиловый эфир, но кетоны и сложные эфиры эффективнее по сравнению с простыми эфирами. Наилучший экстрагент – трибутилфосфат. Скандий экстрагируется трибутилфосфатом из концентрированных растворов соляной кислоты. Уран можно извлечь трибутилфосфатом из соляной кислоты с разбавлением примерно 1:1 и отделить от тория и циркония, промывая экстракт солянокислым раствором. Чтобы улучшить физические свойства трибутилфосфата, его можно смешать с таким растворителем, как гексон.
Ниобий экстрагируется из концентрированной соляной кислоты диизопропилкетоном.
Исследовано извлечение индия из бромидных растворов метилизобутилкетоном. В случае макроконцентраций индия коэффициент распределения уменьшается по мере увеличения концентрации индия в растворе. Однако при экстракции этиловым эфиром экстрагируемость индия повышается с увеличением его макроконцентрации. Эти явления отчасти объясняются образованием полимеров.
Иодиды. Об экстрагируемое металлов этиловым эфиром из 6,9 М раствора иодиетоводородной кислоты при соотношении объемов эфирной и водной фаз, равном 4:1, получены следующие данные: Sb, Hg, Cd, Au, Sn экстрагируются полностью; Bi 34%; Zn 10,6%: Mo 6,5%; Те 5,5%; In 7,8%; Fe, Ni, Co, Mn, Ti, Zr, Pb, Al, Ga, Th, Be, U, V, Pt, Pd, Os, Ru, 1г не экстрагируются.
В области концентраций иодиетоводородной кислоты примерно от 0,5 до 2,5 М можно количественно экстрагировать индий; при экстракции таллий сопутствует индию.
Иодид олова также экстрагируется бензолом из раствора серной кислоты при высоких концентрациях иодида.
Фториды. Относительно экстракции металлов этиловым эфиром из растворов плавиковой кислоты имеется немного данных: Sn извлекаются полностью; As 62%; Mo 10%; Se 3%; Sb 0,4%; другие металлы не экстрагируются. Эти цифры даны для соотношения объемов эфирной и водной фаз 4:1.
Для выделения ниобия и тантала важное значение имеет экстракция фторидных комплексов этих элементов различными несмешивающимися органическими растворителями.
Роданиды. Экстрагируемость комплексных роданидов железа эфиром и кобальта – амиловым спиртом была обнаружена по окраске этих соединений и давно применяется в аналитической практике. Экстракцию роданида молибдена эфирами и другими органическими растворителями давно уже используют для определения этого элемента, и до сих пор она остается наилучшим методом. Однако лишь в последние годы были проведены систематические исследования процессов экстракции роданидов. Показано ценное значение эфирно-роданидной экстракции для отделения скандия, особенно от редких земель. Изучена экстракция многих металлов этиловым эфиром в. Полученные данные слишком обширны, чтобы их можно было здесь рассмотреть полностью, но некоторые из них, представляющие особый интерес для аналитика, следует отметить. Особенно легко экстрагируются цинк и олово. При равных объемах водной и органической фаз из раствора, 1 М по роданиду аммония и 0,5 М по соляной кислоте, экстрагируется до 96 96 цинка и до 99,3% олова. Извлечение олова достигает более 99,9% при 7 М концентрации роданида аммония, тогда как экстракция цинка при 3 М концентрации роданида возрастает до максимального значения – 97,4% и падает до 92% при 7 М. Экстрагируемость кобальта увеличивается от 3,6% из 1 М роданида аммония до максимума – 75% из 7 М роданида аммония. Железо лучше всего экстрагируется при низких концентрациях роданида, галлий – при высоких. Максимальное извлечение урана достигается при 1 М концентрации роданида аммония. К другим экстрагируемым металлам относятся бериллии, алюминий, скандий, индий, титан, ванадий и, конечно, молибден. Весьма слабо экстрагируются медь, кадмий, ртуть, мышьяк, сурьма, висмут, хром, никель и палладий. Известно, что экстрагируемость кобальта и скандия остается постоянной в широкой области концентраций металлов.
Исследован состав экстрагируемых соединений при низкой кислотности, где осложнения, связанные с соэкстракцией роданистоводородной кислоты, сведены к минимуму. При низких концентрациях роданида экстрагируются простые роданиды Zn2, Sc2, Ga3, In3, U022 и FeS. При более высоких концентрациях роданида некоторые из металлов экстрагируются в виде комплексных роданидов. Из эфирной фазы удалось выделить соединения oZn4- 4 Н20 и 2Co4- 4 Н20. Бериллий и алюминий при концентрациях роданида вплоть до 7 М экстрагируются в виде простых роданидов. Уменьшение экстрагнруемости урана с увеличением концентрации роданида объясняется образованием менее экстрагируемых комплексных роданидов урана.
б. Металлоорганические соединения
Большинство органических соединений, используемых при разделении металлов, образует хелатные комплексы, в которых один или несколько кислотных атомов водорода хелатирующего реагента замещены металлом. Отделение одного металла от другого путем экстракции несложно, если один из них образует с реагентом незаряженный комплекс, а другой – комплексный ион. Например, четкое разделение никеля и кобальта может быть достигнуто экстрагированием комплексного соединения никеля с диметилглиоксимом Ni2 хлороформом; при этих условиях кобальт образует комплексные ионы и остается в водной фазе. Однако большинство разделений металлов основано не на различиях в форме образующегося комплекса, а на различиях в степени образования молекулярных комплексных соединений. Иначе, экстракционные процессы обычно являются процессами фракционного разделения.
Похожие работы
... пластмасс различного назначения. Приводимый ниже материал предназначен для студентов химического отделения, специализирующихся по органической химии и химии и физике высокомолекулярных соединений, а также может быть полезен аспирантам, инженерам и научным работникам. 2.1 Метод изучения релаксации напряжения Явление релаксации - это процесс перехода из неравновесного в равновесное состояние ...
... лечебного учреждения выделяются зоны: лечебных корпусов для инфекционных и неинфекционных больных, педиатрических, психосоматических, кожно-венерологических, радиологических корпусов, родильных домов и акушерских отделений, садово-парковая, поликлиники, патологоанатомического корпуса, хозяйственная и инженерных сооружений. Патологоанатомический корпус с ритуальной зоной максимально изолируется ...
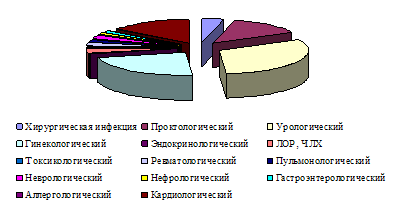
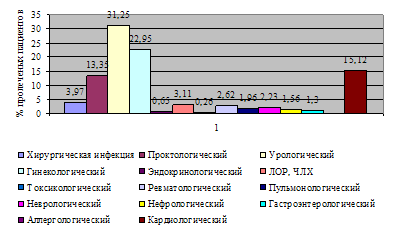
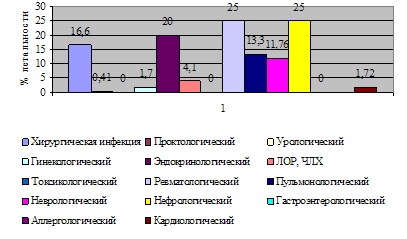
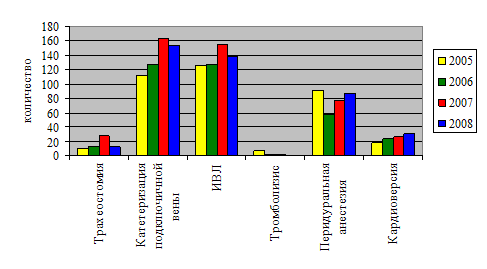
... и лечебных мероприятий, необходимых для поддержания жизненно важных функций пациента. Чтобы представить характер работы персонала отделения анестезиологии-реанимации №2, необходимо знать контингент пациентов. Отделение реанимации является отделением смешанного профиля – хирургического и терапевтического. Хирургический профиль составляют пациенты с урологической, гинекологической и ...
... процесс разделения нестабильных веществ можно проводить в холодильной камере. Выделенное соединение подвергают структурному химическому исследованию, а затем изучают его фармакологическое действие. Получение лекарственных веществ методом культуры тканей высших растений В нашей стране заготавливаются десятки тысяч тонн ЛРС. Однако потребность в БАВ, содержащихся в растениях, с каждым годом ...
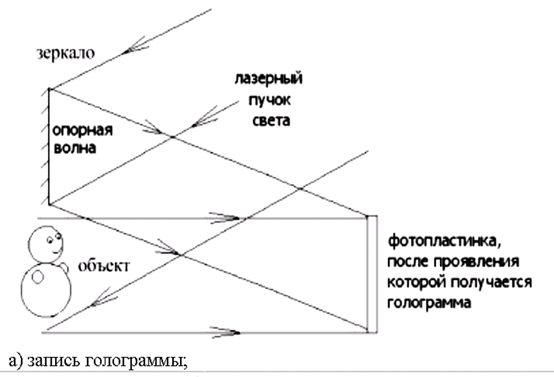
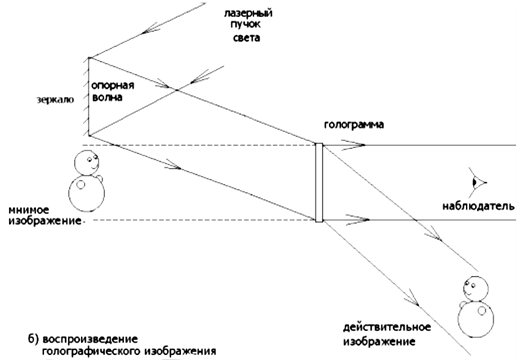

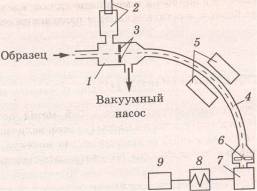

0 комментариев