Навигация
1. Распределение лиганда
Если экстрагируется нейтральный лиганд или сопряженная ему кислота, в то время как комплекс металла не экстрагируется, то об образовании комплекса можно судить по изменению распределения лиганда в зависимости от концентрации иона металла (или лиганда).
Доусон и Мак-Грей уже в 1900 г. изучили образование аммиачных комплексов меди(II), исследуя распределение аммиака между водным раствором и органическими растворителями. Позднее этот же метод был использован для исследования комплексов гидразина, пиридина, анилина, ненасыщенных углеводородов и комплексов (С2Н50)2РООН.
2. Распределение комплексов металлов
Экстрагируемость ионов металлов и комплексов металлов различными растворителями определяется многими условиями. Если лиганд заряжен и в процессе последовательного комплексообразования образуется электронейтральный комплекс, то этот комплекс может извлекаться органическим растворителем с низкой диэлектрической постоянной. Иногда этот незаряженный комплекс является последним в серии последовательно образующихся комплексов, но отмечены случаи, когда имеет место даль-
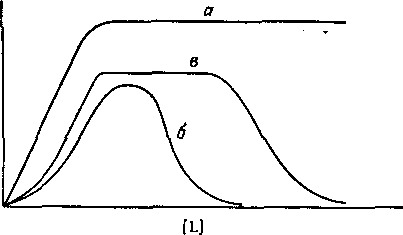
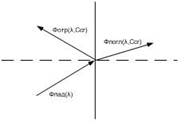
Рис. 1. Зависимость коэффициента распределения q экстрагируемого соединения от концентрации свободного лиганда.
а — образуется координационно насыщенный электроне игральны и комплекс;
6 -- а системе образуется анионный комплекс; в — образуется очень устойчивый электроне игральный комплекс с последующим образованием анионного комплекса.
нейшее присоединение лигандов с последующим образованием комплексных анионов.
В большинстве случаев анионные комплексы не экстрагируются, так что вид кривой распределения комплекса от концентрации лиганда будет разным в зависимости от того, образуется ли в системе анионный комплекс или нет. Коэффициент распределения представляет собой отношение общей концентрации металлсодержащих частиц в обеих фазах:
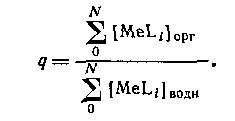
Если MeLm является единственным комплексом, присутствующим в значительных количествах в органической фазе, то
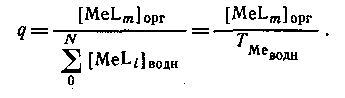
Следовательно, если m = N, то q([L]) представляет собой монотонную функцию, в то время как при N>m эта функция имеет максимум. Если устойчивость нейтрального комплекса достаточно велика, то функция q от [L] имеет отчетливо выраженное плато. Учитывая, что константа распределения соединения MeLmопределяется уравнением
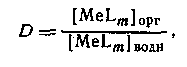
концентрацию MeLm в водной фазе можно определить, вводя константу устойчивости:
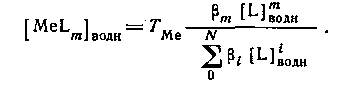
Следовательно,
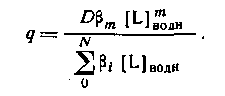
Из уравнения следует, что для расчета N неизвестных констант устойчивости необходимо по крайней мере N+1 экспериментов по распределению. Если кривая распределения имеет длинный горизонтальный отрезок, то значение D непосредственно определяется значением qmax.
D = qmax
Константы устойчивости наиболее просто определяются в том случае, когда функция q от [L] имеет максимум, так как в этом случае образование катионных и анионных комплексов можно рассматривать отдельно.
Этот принцип впервые был использован Морзе при изучении галогенидных комплексов ртути(П); фундаментальные проблемы определения и расчета констант устойчивости были рассмотрены Ридбергом, Дирсеном и Ирвингом.
Если при изучении данной системы комплексов используются различные органические растворители, то, как следует из уравнения, должны быть получены одни и те же константы устойчивости. Если разность между константами устойчивости превышает ошибку эксперимента, то это свидетельствует о взаимодействии между экстрагируемым комплексом и молекулами растворителя. Такое взаимодействие приводит к изменению значения q. В соответствии с рис. 2 отношение qCHCl3/qC6H6 при экстракции ацетилацетоната тория (IV) остается постоянным при одинаковых концентрациях свободного лиганда, но отношение qC6H6 /qC4H9COCH3 существенно меняется. Такое поведение было количественно объяснено образованием смешанного комплекса тория с ацетилацетоном и метилизобутилкетоном.
При использовании органических растворителей с низкой диэлектрической проницаемостью предположение, что в органической фазе присутствует только нейтральный комплекс, является очень хорошим приближением. Это отнюдь не значит, что в органической фазе находятся комплексы только одного типа. Отрицательный заряд (или заряды) анионного комплекса может компенсироваться присоединением протона. Хорошо известно, что целый ряд галогенидов металлов можно извлечь в протонированной форме НМеХ4. Описание экстракции становятся гораздо более сложным, если используются органические растворители с достаточно высокой диэлектрической проницаемостью. Эти системы могут найти очень важные практические приложения, но для оценки констант устойчивости комплексов в водных растворах они не очень удобны.
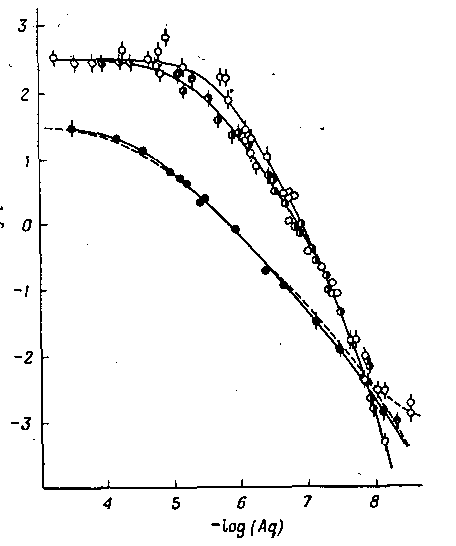
Рис. 2. Распределение Th(IV) между водной и органической фазами в зависимости от концентрации ацетилацетонат-иона при использовании различных растворителей: изобутилмегилкетон; бензол; хлороформ.
В последние годы было тщательно исследовано большое число экстракционных систем. Особенно эффективными органическими растворителями являются алкилфосфорные эфиры, которые часто применяют для экстракции металлов.
3. Синергизм
Этот термин вначале был использован для описания явления возрастания экстракции металлов в системе, содержащей два разных лиганда, при этом один из лигандов представлял собой кислоту и нейтрализовал заряд иона металла, а другой нейтральную донорноактивную молекулу. Вначале казалось, что это явление ограничено очень небольшим числом металлов и систем лигандов, но последующие работы показали, что оно чрезвычайно распространено. Хотя при обсуждении синергетической экстракции необходимо учитывать большое число факторов, однако работы Ирвинга, Хили, Ньюмана, Ли, Таубе и других авторов ясно показали, что решающим является образование смешанного комплекса. Образование смешанного комплекса может повысить долю металла, связанного в комплекс, и в результате привести к повышению экстрагируемости комплекса металла. Характерное поведение металла при синергетической экстракции показано на примере системы кобальт(II) —теноилтрифторацтон—пиридин; аналогичным образом ведет себя кобальт в системах, содержащих вместо пиридина другие, подобные пиридину основания. Синергизм в этом случае объясняется тем, что две молекулы пиридина или другого основания координируются в экваториальные положения октаэдрической молекулы. Другой тип синергизма был обнаружен Ирвингом, который использовал два типа оснований.
4. Конкурирующие реакции
Экстракция как метод исследования очень удобна для изучения конкурирующих реакций. Хотя в принципе, по-видимому, можно исследовать конкурирующие реакции двух металлов с одним лигандом, но до сих пор экстракционными методами изучали только конкурирующие реакции двух разных лигандов с одним металлом. Конник и МакВей определили константы устойчивости большого числа комплексов циркония (1У), исследовав мешающее влияние неорганических ионов на экстракцию бензолом теноилтрифторацетоната циркония(1У). Аналогичные исследования были выполнены с сульфатными комплексами нептуния(1У) Салливаном и Хиндманом. Многие исследователи изучили гидролитические реакции, рассмотрев влияние гидроксоионов на экстракцию различных хелатов металлов.
Недавно Стары рассмотрел возможность применения конкурирующих реакций для определения экстракционным методом констант устойчивости комплексов большого числа металлов.
Список литературы:
1. Бек Н. Химия равновесия реакций комплексообразования. М.Мир. 1973.
2. Белеванцев В.Н., Пещевицкий Б.Н. Исследование сложных равновесий в растворе. Новосибирск. Наука, 1978.
3. Россотти Ф,, Россотти X. Определение констант устойчивости и других констант равновесия в растворах. М. Мир. 1965.
4. Новоселова А.В. Методы исследования гетерогенных равновесий. М., Высшая школа. 1980.
Похожие работы
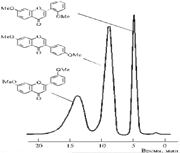
... подобного рода находят применение также другие галоидные комплексы, особенно фториды. Катионообменные смолы использовали для совместного выделения следов ряда элементов. Предложен ионообменный способ выделения меди, кадмия, никеля, цинка и марганца из настоя растительных материалов и отделения их от фосфата. Раствор пропускают через колонку диаметром 2,5 мм со смолой амберлит ir-100 и отмывают ...
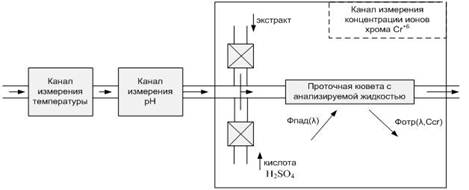
ления тяжелых металлов в природных водах Экстракционно-фотометрический метод определения хрома[16] На протекание естественных процессов в воде большое влияние оказывает содержание в ней тяжелых металлов. Были проведены исследования, целью которых являлась количественная оценка загрязнения реки Кальмиус тяжелыми металлами. Результаты данного исследования показали, что одним из тяжелых металлов ...
... . Комбинированные методы дают дополняющую друг друга информацию, позволяющую произвести правильную идентификации веществ, которые не могут быть опознаны с помощью какого- либо одного метода.[11-12] Глава 3. Примеры применения хроматографии в анализе объектов окружающей среды Анализ состояния водной среды с помощью метода газовой хроматографии[13-15] Метод газовой хроматографии для анализа ...
... . Материал подвергают действию нейтронного излучения, происходят ядерные реакции и образуются радиоактивные изотопы элементов. Далее пробу пробу переводят в раствор и разделяют элементы химическими методами. После чего измеряют интенсивность радиоактивного излучения каждого элемента пробы, параллельно анализируют эталонную пробу. Сравнивают интенсивность радиоактивного излучения отдельных фракций ...

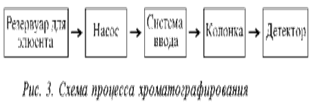


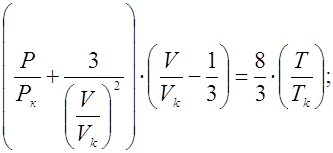
0 комментариев